第二章 烃 第二节 烯烃 炔烃 第2课时 炔烃 学案(含解析)
文档属性
| 名称 | 第二章 烃 第二节 烯烃 炔烃 第2课时 炔烃 学案(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 976.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-15 23:13:12 | ||
图片预览



文档简介
第2课时 炔烃
【课程标准要求】
1.认识炔烃的组成和结构特点。
2.能够列举乙炔的主要物理性质。
3.能描述和分析乙炔的重要反应,能书写相应的化学方程式。
一、乙炔
1.组成和结构
乙炔分子为直线形结构,键角为180°,碳原子采取sp杂化,C、H间均形成单键(σ键),C、C间以三键(1个σ键和2个π键)相连。
2.物理性质
颜色 状态 气味 密度 溶解性
无色 气体 无味 比空气略小 微溶于水,易溶于有机溶剂
3.化学性质
【微自测】
1.下列叙述中,正确的打“√”,错误的打“×”。
(1)乙炔分子中只存在极性键( )
(2)乙炔的最简式是CHCH( )
(3)乙炔分子中的σ键与π键个数比为1∶2( )
(4)乙烯中混有的乙炔可用溴水除去( )
(5)乙烯、乙炔常温下可以与H2、HCl发生加成反应( )
答案 (1)× (2)× (3)× (4)× (5)×
二、炔烃
1.定义:分子里含有碳碳三键的一类脂肪烃。
2.官能团:名称为碳碳三键,结构简式为—C≡C—。
3.通式:炔烃只有一个碳碳三键时,其通式为CnH2n-2(n≥2)。
4.物理性质
熔、沸点随碳原子数的增加而递增,其中碳原子数小于等于4的炔烃是气态烃,最简单的炔烃是乙炔。
【微自测】
2.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性KMnO4溶液褪色
答案 A
解析 1 mol丙炔最多能与2 mol Cl2发生加成反应,故A项正确;乙炔、丙炔、2-丁炔等分子中的所有碳原子都在同一直线上,但1-丁炔等分子中的碳原子不在同一直线上,故B项错误;炔烃易发生加成反应,但不易发生取代反应,故C项错误;炔烃既能使溴水褪色,又能使酸性KMnO4溶液褪色,故D项错误。
一、乙炔的实验室制法
【活动探究】
实验室常用下图所示装置制取乙炔:
1.用化学方程式写出实验室制取乙炔的反应原理。
提示 CaC2+2H2O―→Ca(OH)2+C2H2↑。
2.为什么用饱和食盐水代替水?
提示 碳化钙与水的反应剧烈,为了减慢反应速率,得到平稳的乙炔气流,可用饱和食盐水代替水。
3.装置②的作用是什么?
提示 除去H2S、PH3等杂质气体,防止杂质气体干扰乙炔性质的检验。
4.实验室制取乙炔时,如何收集?能否用排空气法收集乙炔?
提示 使用排水法收集乙炔气体。不能用排空气法。乙炔的相对分子质量为26,空气的平均相对分子质量为29,二者密度相差不大,难以收集到纯净的乙炔。
【核心归纳】
实验室制取乙炔的注意事项
(1)实验装置在使用前要先检查装置气密性。
(2)盛电石的试剂瓶要及时密封并放于干燥处,防止电石吸水而失效。
(3)电石与水反应剧烈,为得到平稳的乙炔气流,可用饱和氯化钠溶液代替水,并用分液漏斗控制滴加饱和氯化钠溶液的速率,让饱和氯化钠溶液慢慢地滴入。
(4)因反应剧烈且产生气泡,为防止产生的泡沫涌入导管,应在导管口塞入少许棉花(图示装置中未画出)。
(5)制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因是:①碳化钙吸水性强,遇水反应剧烈,不能随用、随停;②反应过程中放出大量的热,易使启普发生器炸裂;③生成的Ca(OH)2呈糊状易堵塞球形漏斗。
(6)由于电石中含有可以与水发生反应的杂质(如CaS、Ca3P2等),使制得的乙炔中往往含有H2S、PH3等杂质,将混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去。
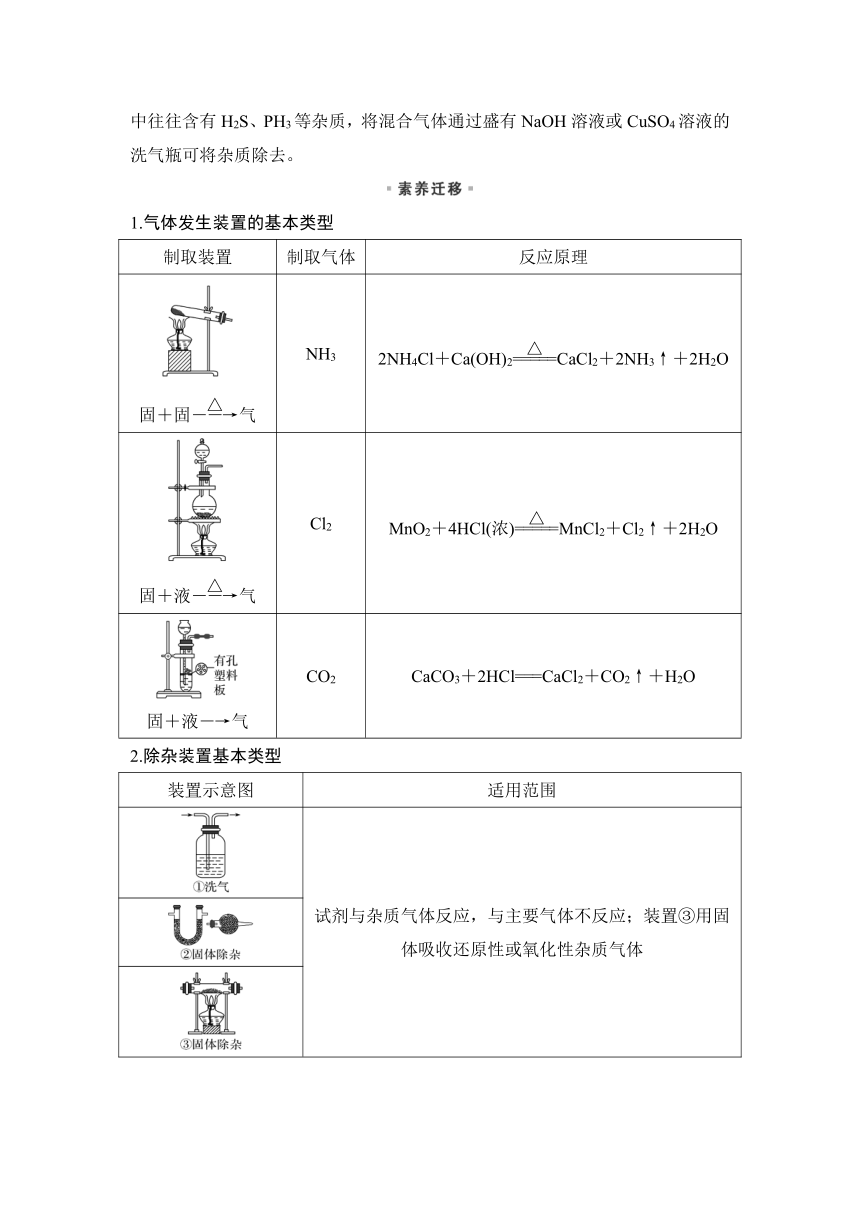
1.气体发生装置的基本类型
制取装置 制取气体 反应原理
固+固气 NH3 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
固+液气 Cl2 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
固+液―→气 CO2 CaCO3+2HCl===CaCl2+CO2↑+H2O
2.除杂装置基本类型
装置示意图 适用范围
试剂与杂质气体反应,与主要气体不反应;装置③用固体吸收还原性或氧化性杂质气体
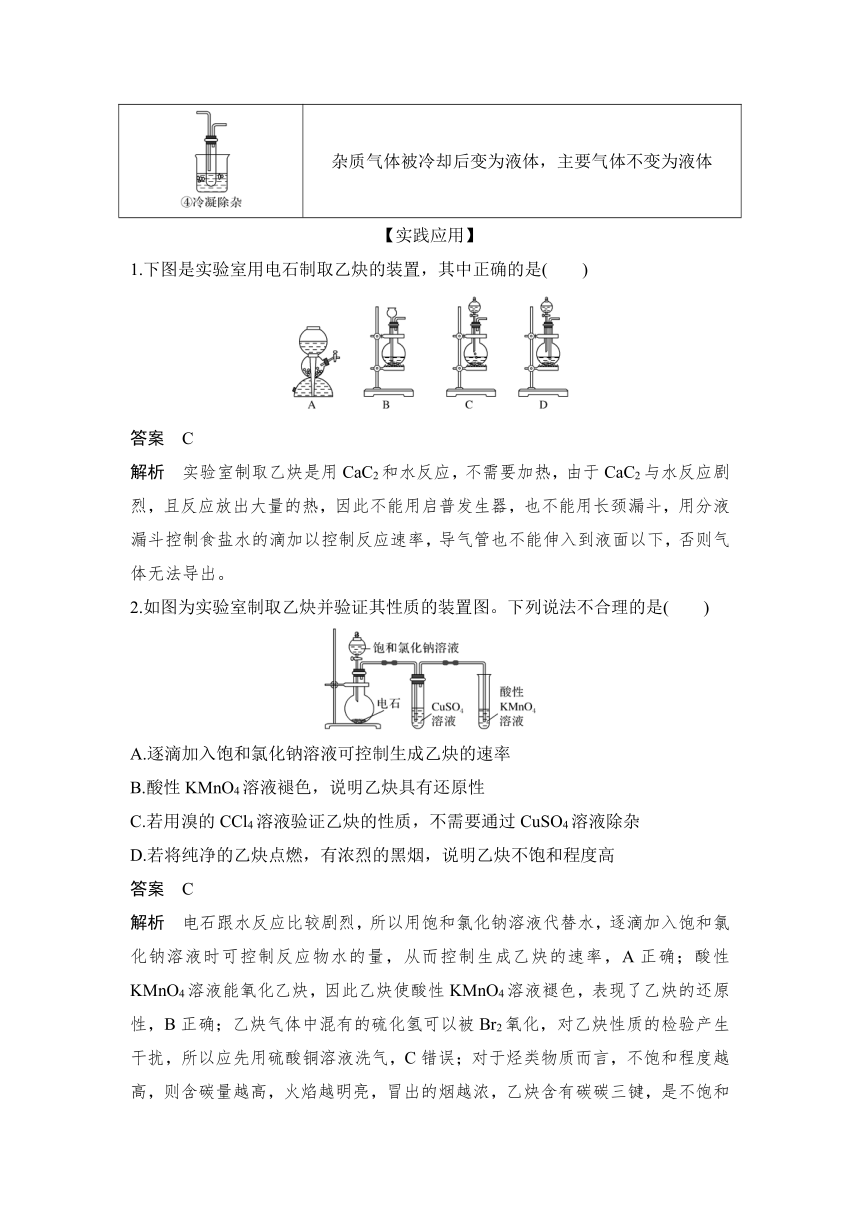
杂质气体被冷却后变为液体,主要气体不变为液体
【实践应用】
1.下图是实验室用电石制取乙炔的装置,其中正确的是( )
答案 C
解析 实验室制取乙炔是用CaC2和水反应,不需要加热,由于CaC2与水反应剧烈,且反应放出大量的热,因此不能用启普发生器,也不能用长颈漏斗,用分液漏斗控制食盐水的滴加以控制反应速率,导气管也不能伸入到液面以下,否则气体无法导出。
2.如图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是( )
A.逐滴加入饱和氯化钠溶液可控制生成乙炔的速率
B.酸性KMnO4溶液褪色,说明乙炔具有还原性
C.若用溴的CCl4溶液验证乙炔的性质,不需要通过CuSO4溶液除杂
D.若将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
答案 C
解析 电石跟水反应比较剧烈,所以用饱和氯化钠溶液代替水,逐滴加入饱和氯化钠溶液时可控制反应物水的量,从而控制生成乙炔的速率,A正确;酸性KMnO4溶液能氧化乙炔,因此乙炔使酸性KMnO4溶液褪色,表现了乙炔的还原性,B正确;乙炔气体中混有的硫化氢可以被Br2氧化,对乙炔性质的检验产生干扰,所以应先用硫酸铜溶液洗气,C错误;对于烃类物质而言,不饱和程度越高,则含碳量越高,火焰越明亮,冒出的烟越浓,乙炔含有碳碳三键,是不饱和程度较高的烃类物质,D正确。
3.实验室制取的乙炔气体中常混有少量H2S、CO2和水蒸气,为了得到干燥纯净的乙炔气体,下列最简便的实验方案是( )
A.通过NaOH溶液后,再通过浓硫酸,最后通过石灰水
B.通过CuSO4溶液后,再通过石灰水
C.通过五氧化二磷后,再通过无水CaCl2
D.通过足量的碱石灰
答案 D
解析 A、B两项操作均不能得到纯净干燥的乙炔;C项操作不能除去H2S、CO2。
二、炔烃的结构与化学性质
【活动探究】
已知使用活性较低的林德拉催化剂[Pd/(PbO、CaCO3)],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化成烷烃。另外将净化后的乙炔气体分别通入溴的四氯化碳溶液和酸性KMnO4溶液,现象如下:
1.分析指出丙炔中碳原子的杂化类型和共价键类型是怎样的?
提示 ,4个C—H σ键,2个C—C σ键,2个π键。
2.将净化后的乙炔气体分别通入溴的四氯化碳溶液和酸性KMnO4溶液,有何现象?
提示 溶液均褪色。
3.若点燃乙炔气体,有何现象?为什么?
提示 点燃乙炔气体有明亮的火焰并有浓烟产生。因为乙炔的含碳量高,燃烧不充分产生碳单质。
4.请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
提示 CH≡CCH2CH3+2H2CH3CH2CH2CH3,反应中碳原子之间形成的π键断裂,形成4个C—H σ键。
5.请写出戊炔所有属于炔烃的同分异构体的结构简式,并用系统命名法命名。
提示 (1)CH≡C(CH2)2CH3 1-戊炔
CH3C≡C—CH2CH3 2-戊炔
3-甲基-1-丁炔
6.某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式,并命名。
提示 4-甲基-1-戊炔
4-甲基-2-戊炔。
【核心归纳】
1.炔烃的结构与性质
(1)结构:分子中的碳原子一定存在sp杂化,共价键一定存在σ键和π键,以“—C≡C—”为中心的4原子共线结构。
(2)炔烃化学性质
①氧化反应
②加成反应:与X2、HX、H2O、H2等发生加成反应
③加聚反应:nR1—C≡C—R2
2.炔烃的命名方法
(1)选主链:将含碳碳三键的最长碳链作为主链,并按主链中所含碳原子数称为“某炔”。
(2)编序号:从距离三键最近的一端给主链上的碳原子依次编号,使三键碳原子的编号最小。
(3)写名称:先用大写数字“二、三……”在炔烃的名称前表示三键的个数;然后在“某炔”前面用阿拉伯数字表示出三键的位置(用三键碳原子的最小编号表示),最后在前面写出支链的名称、个数和位置。
烷烃、烯烃、炔烃的结构和化学性质的比较
烷烃 烯烃 炔烃
通式 CnH2n+2(n≥1) CnH2n(n≥2) CnH2n-2 (n≥2)
代表物 CH4 CH2===CH2 CH≡CH
结构特点 全部单键;饱和链烃 含碳碳双键;不饱和链烃 含碳碳三键;不饱和链烃
化学性质 取代反应 光照卤代 - -
加成反应 - 能与H2、X2、HX、H2O、HCN等发生加成反应
氧化反应 燃烧火焰较明亮 燃烧火焰明亮,伴有黑烟 燃烧火焰很明亮,伴有浓烈的黑烟
不与酸性KMnO4溶液反应 能使酸性KMnO4溶液褪色
加聚反应 - 能发生
鉴别 溴水和酸性KMnO4溶液均不褪色 溴水和酸性KMnO4溶液均褪色
【实践应用】
4.下列说法中正确的是( )
A.1-丁炔分子中四个碳原子位于同一条直线上
B.乙炔分子中碳碳间的三个共价键性质完全相同
C.分子组成符合CnH2n-2通式的链烃,一定是炔烃
D.乙炔及其同系物中,乙炔的含碳量最大
答案 D
解析 1-丁炔中与不饱和碳原子直接相连的原子应在同一直线上,但饱和碳原子为sp3杂化,连接的原子一定不在同一条直线上,A错;碳碳三键中有一个σ键和两个π键,三个共价键性质不完全相同,B错;符合CnH2n-2通式的链烃还可以是二烯烃,C错;乙炔同系物CnH2n-2中碳的质量分数为×100%=×100%,n增大时,14-增大,w(C)减小,故n=2时w(C)最大。
5.乙烷、乙烯、乙炔共同具有的性质是( )
A.易溶于有机溶剂,且密度比水小
B.能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内
D.都能发生聚合反应生成高分子化合物
答案 A
解析 乙烷分子中各原子不能处于同一平面上;乙烷不能发生聚合反应;乙烷不能使溴水和酸性KMnO4溶液褪色。
6.某烃甲与氢气反应后的产物乙为(CH3)2CHCH2CH3,则相关说法不合理的是( )
A.产物乙的系统命名为2-甲基丁烷
B.烃甲可能是2-甲基-1,3-丁二烯
C.0.1 mol产物乙完全燃烧可消耗17.92 L O2
D.烃甲与乙炔可能是同系物
答案 C
解析 烃甲可能为烯烃、二烯烃、炔烃,如2-甲基-1-丁烯、2-甲基-1,3-丁二烯、3-甲基-1-丁炔,B、D正确;0.1 mol产物乙完全燃烧可消耗0.8 mol O2,标准状况下为17.92 L,选项未说明状态,C错误。
核心体系建构
1.在常温下,对于化学式满足CnH2n-2(n≥2,且n为整数)的某气态链烃,下列说法不正确的是( )
A.肯定是不饱和烃
B.肯定能使酸性KMnO4溶液褪色
C.可能是炔烃
D.一定是乙炔的同系物
答案 D
解析 化学式满足CnH2n-2(n≥2,且n为整数)的某气态链烃可能是含有两个碳碳双键的烯烃,所以不一定是炔烃或乙炔的同系物。
2.下列关于乙炔制取的说法不正确的是( )
A.反应后溶液呈碱性
B.此反应是放热反应
C.为了除去杂质气体,可用硫酸铜溶液吸收
D.实验室制得的纯净的乙炔有特殊臭味
答案 D
解析 电石(主要成分CaC2)与水反应得到乙炔和氢氧化钙,溶液呈碱性,故A正确;电石与水反应放出大量的热,属于放热反应,故B正确;杂质气体有H2S或PH3,可用硫酸铜除掉,故C正确;有特殊臭味的乙炔含有H2S或PH3杂质气体,故D错误。
3.下列有机物的系统命名法正确的一组是( )
答案 C
解析 A项,应该是4-甲基-2-戊炔,错误;B项,该有机物的名称为3-甲基-1-戊烯,错误;C项,根据有机物的命名原则,该有机物为2-甲基-2,4-己二烯,正确;D项,该有机物的名称为2,2,4-三甲基戊烷,错误。
4.下列各选项能说明分子式为C4H6的某烃是HC≡C—CH2—CH3,而不是CH2===CH—CH===CH2的是( )
A.燃烧有浓烟
B.能使酸性KMnO4溶液褪色
C.能与溴发生1,2-加成反应
D.与足量溴反应,生成物中只有2个碳原子上有溴原子
答案 D
解析 无论HC≡C—CH2—CH3还是CH2===CH—CH===CH2,A、B、C项所述事实均能发生,而与足量溴加成后,前者产物为,后者产物为,故D正确。
5.实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定电石样品中CaC2的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。
(1)A瓶中的液体可以从酸性KMnO4溶液和CuSO4溶液中选择,应该选择________,它的作用是____________________________________________________________。
(2)写出实验室制取乙炔的化学方程式:____________________________
____________________________________________________________。
(3)装置Ⅰ的主要缺点是_______________________________________;
装置Ⅱ的主要缺点是_________________________________________;
若选用装置Ⅱ来完成实验,则应采取的措施是_________________
____________________________________________________________。
(4)若称取m g电石,反应完全后,测得B处溴水增重n g,则CaC2的纯度为________。
答案 (1)CuSO4溶液 除去乙炔气体中混有的H2S和PH3等杂质气体
(2)CaC2+2H2O―→Ca(OH)2+C2H2↑
(3)少量乙炔会从长颈漏斗中逸出,引起实验误差,且不易控制水的添加量 反应产生的泡沫会堵塞导管 在导管口处塞上一团棉花
(4)×100%
解析 (1)酸性高锰酸钾溶液具有强氧化性,能氧化乙炔,因此选择硫酸铜溶液除去乙炔中混有的H2S和PH3气体。(2)实验室制取乙炔的化学方程式为CaC2+2H2O―→Ca(OH)2+C2H2↑。(3)根据装置Ⅰ的结构可知主要缺点是少量乙炔会从长颈漏斗中逸出,引起实验误差,且不易控制水的添加量。装置Ⅱ的主要缺点是反应产生的泡沫会堵塞导管;根据以上分析可知若选用装置Ⅱ来完成实验,则应采取的措施是给导管口处塞上一团棉花。(4)若称取m g电石,反应完全后,测得B处溴水增重n g,则根据方程式C2H2+2Br2―→CHBr2CHBr2可知乙炔的物质的量是 mol,所以CaC2的纯度为×100%=×100%。
一、选择题(本题包含12个小题,每小题只有一个选项符合题意)
1.下列关于乙炔的说法不正确的是( )
A.燃烧时有浓烈的黑烟
B.可通过酸性高锰酸钾溶液来区别烯烃和炔烃
C.为了减缓电石和水的反应速率,可用饱和食盐水来代替水
D.收集乙炔可用排水法
答案 B
解析 乙炔中含碳量较高,燃烧时会伴有浓烈的黑烟,A正确。烯烃和炔烃都可以使酸性高锰酸钾溶液褪色,无法区别,B错误。用饱和食盐水可以降低电石和水的反应速率,C正确。乙炔微溶于水,可以用排水法收集,D正确。
2.下列关于乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是( )
A.能燃烧生成二氧化碳和水
B.能与溴水发生加成反应
C.能与酸性高锰酸钾溶液发生氧化反应
D.能与氯化氢反应生成氯乙烯
答案 D
解析 乙烯、乙烷、乙炔都能燃烧生成二氧化碳和水,乙烯和乙炔都能与溴水发生加成反应,都能与酸性高锰酸钾溶液发生氧化反应,使酸性高锰酸钾溶液褪色,故A、B、C都不是乙炔独特的性质。与HCl反应生成氯乙烯是乙炔的性质,而不是乙烯和乙烷的性质。
3.块状固体电石遇水会剧烈反应生成乙炔气体。实验室若用此法制取乙炔,选择的装置最好是图中的( )
答案 B
解析 实验室用块状电石与水在常温下反应,发生装置应选择固液常温型装置;由于反应比较剧烈而需严格控制加水的速率,只能选择B装置中的分液漏斗控制水的滴加速率。
4.某学习小组用电(CaC2)与饱和食盐水制取C2H2(含少量H2S、PH3),并验证C2H2的部分化学性质,所用装置如图。下列说法正确的是( )
A.使用饱和食盐水代替水是为了加快制取C2H2的速率
B.去掉装置B,不影响装置C、D中C2H2化学性质的探究
C.取装置C中褪色后的溶液,测定其pH值,与反应前所测pH对比,pH增大,可判断C2H2和Br2发生了加成反应
D.用燃着的木条靠近E玻璃管尖嘴处,未见有明亮火焰,说明C2H2没有可燃性
答案 C
解析 A.饱和食盐水滴到电石上,水被消耗,NaCl析出,附着在电石表面,阻碍电石和水的接触,可以减慢制取C2H2的速率,故A错误;B.装置B的主要作用是除去生成的H2S、PH3,因为H2S、PH3都有还原性,能被溴水和酸性高锰酸钾溶液氧化,从而使溴水和酸性高锰酸钾溶液褪色,所以去掉装置B,会影响装置C、D中C2H2化学性质的探究,故B错误;C.若乙炔和溴发生了加成反应,生成了卤代烃,消耗了溴,溶液的pH会增大;若乙炔和溴发生了取代反应,则除了生成卤代烃外,还生成HBr,则溶液的pH会减小,故C正确;D.用燃着的木条靠近E玻璃管尖嘴处,未见有明亮火焰,可能乙炔完全被前面的试剂消耗,没有乙炔逸出,不能说明C2H2没有可燃性,故D错误;故选C。
5.下列物质中,不可能是炔烃的加成产物的是( )
A.乙烷 B.2,3-二甲基戊烷
C.异戊烷 D.异丁烷
答案 D
解析 A项,乙烷可由乙炔加成得到;B项,2,3-二甲基戊烷可由CH3—CH(CH3)—CH(CH3)—C≡CH与氢气加成得到;C项,若炔烃为(CH3)2CHC≡CH可与氢气加成生成;D项,异丁烷相邻的任意两个碳原子上都不符合有2个氢原子,不能由不饱和炔烃经加成反应生成。
6.某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子中的氢原子又可被3 mol Cl2完全取代,则此气态烃可能是( )
A.CH3C≡CCH3 B.CH2===CH2
C.CH≡CCH3 D.CH2===CHCH3
答案 C
解析 根据题意,该烃与HCl、氯气的物质的量之比是0.5∶1∶3=1∶2∶6,即1 mol该烃与2 mol HCl完全加成,则该烃中含有2个碳碳双键或1个碳碳三键;最终被氯气取代后的产物中有8个氯原子,即对应的烷烃中有8个氢原子,所以该烃的饱和状态为丙烷,则该烃为丙炔,答案选C。
7.某烃和溴水反应后的产物为2,2,3,3-四溴丁烷,则该烃的同分异构体为( )
A.1-丁炔 B.2-丁炔
C.1-丁烯 D.2-丁烯
答案 A
解析 2,2,3,3-四溴丁烷的结构简式为CH3C(Br)2C(Br)2CH3,由某烃与溴加成得到,故该烃为2-丁炔,结构简式为CH3C≡CCH3。1-丁炔与2-丁炔互为同分异构体,A正确;该烃就是2-丁炔,是同一种物质,B错误;1-丁烯与2-丁炔的分子式不同,不互为同分异构体,C错误;2-丁烯与2-丁炔的分子式不同,不互为同分异构体,D错误。
8.某炔烃与氢气发生加成反应后得到,则该炔烃的结构有( )
A.1种 B.2种
C.3种 D.4种
答案 B
解析 将2-甲基戊烷中各C原子编号:,其中2号C上只含有1个H原子,无法形成碳碳三键,只有3、4号C间和4、5号C间可以形成碳碳三键,故符合题述的炔烃有2种,B项正确。
9.含有一个三键的炔烃,氢化后的产物结构简式如图,此炔烃可能的结构简式有( )
A.1种 B.2种
C.3种 D.4种
答案 B
解析 根据炔烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均有至少2个氢原子的碳原子间是对应炔存在—C≡C—的位置。如图3个位置可以还原为—C≡C—:,其中1、2号位置与3、4号两位置相同,故该炔烃共有2种。
10.一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中不正确的是( )
A.该有机物的分子式为C5H4
B.该分子中所有碳原子在同一平面内
C.1 mol该有机物最多可与2 mol Br2发生加成反应
D.与其互为同分异构体,且只含碳碳三键的链烃不止一种
答案 B
解析 键线式中交点数即为碳原子数,然后确定每个碳原子所结合的氢原子数,该有机物分子式为C5H4,A正确;中间碳原子形成四条单键,为四面体形结构,故该分子中所有碳原子不可能在同一平面内,B错误;该烃含有两个碳碳双键,故1 mol该有机物最多能与2 mol Br2发生加成反应,C正确;该烃的链状同分异构体(碳架结构)可能为C≡C—C≡C—C、C≡C—C—C≡C,D正确。
11.已知Mg2C3的结构与CaC2的结构相似。由此可断定Mg2C3与水反应的产物是( )
A.Mg(OH)2和CH≡CH
B.Mg(OH)2和CH4
C.Mg(OH)2和CH3C≡CH
D.Mg(OH)2和CH3CH===CH2
答案 C
解析 CaC2与水反应:CaC2+2H2O―→Ca(OH)2+CH≡CH↑,可拆成:CaC2+2H—OH―→Ca(OH)2+CH≡CH↑,Mg2C3的结构与CaC2的结构相似,与水反应:Mg2C3+4H—OH―→2Mg(OH)2+C3H4↑,C3H4的结构简式为CH3C≡CH。
12.已知:,如果要合成,所用的起始原料可以是( )
①2-甲基-1,3-丁二烯和2-丁炔
②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔
④2,3-二甲基-1,3-丁二烯和丙炔
A.①④ B.②③
C.①③ D.②④
答案 A
解析 由信息:断键后可得到。的断键方式有:,。若按①断键可得到CH3C≡CH(丙炔)和(2,3-二甲基-1,3-丁二烯);若按②断键可得到(2-甲基-1,3-丁二烯)和CH3—C≡C—CH3(2-丁炔)。
二、非选择题(本题共2小题)
13.以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶。请写出如图方框中(1)~(5)的结构简式,并写出①~⑦各步反应的化学方程式。
答案 (1)CH2===CH—Cl (2)CH2===CH—CN
(3)CH2===CH—C≡CH (4)
(5)
①CH≡CH+HClCH2===CHCl
②nCH2===CHCl
③CH≡CH+HCN―→CH2===CHCN
④nCH2===CH—CN
⑤2CH≡CH―→CH2===CH—C≡CH
⑥CH2===CH—C≡CH+HCl―→
⑦
解析 ①为CH≡CH与HCl的加成反应;②为CH2===CHCl的加聚反应;③为乙炔与HCN的加成反应;④为丙烯腈的加聚反应;⑤为两个乙炔分子的相互加成;⑥为乙烯基乙炔与HCl的加成反应;⑦为CH2===CCl—CH===CH2的加聚反应。
14.用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组装一套制备、净化乙炔的装置,并可通过测定标准状况下产生乙炔的体积,从而计算电石的纯度。
(1)进行实验时,所制气体从左向右流动,仪器的正确连接顺序是________(填接口字母)。
(2)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用________。
(3)若在标准状况下溴水与乙炔完全反应生成CHBr2CHBr2,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为________。
(4)若没有除H2S的装置,测定结果将会________(填“偏高”“偏低”或“不变”),理由是________________________________________
_____________________________________________(用化学方程式表示)。
答案 (1)AHGEFDCB (2)饱和食盐水
(3)% (4)偏高 H2S+Br2===S↓+2HBr
解析 由题意知,电石与足量水反应生成乙炔,其中混有的H2S可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积。若没有除H2S装置,则排出水的体积偏大,计算结果偏高。电石纯度计算过程:
CaC2 ~ C2H2
1 mol 1 mol
x mol+ mol
解得x=(+0.001) mol,
w(CaC2)=×100%=%。
【课程标准要求】
1.认识炔烃的组成和结构特点。
2.能够列举乙炔的主要物理性质。
3.能描述和分析乙炔的重要反应,能书写相应的化学方程式。
一、乙炔
1.组成和结构
乙炔分子为直线形结构,键角为180°,碳原子采取sp杂化,C、H间均形成单键(σ键),C、C间以三键(1个σ键和2个π键)相连。
2.物理性质
颜色 状态 气味 密度 溶解性
无色 气体 无味 比空气略小 微溶于水,易溶于有机溶剂
3.化学性质
【微自测】
1.下列叙述中,正确的打“√”,错误的打“×”。
(1)乙炔分子中只存在极性键( )
(2)乙炔的最简式是CHCH( )
(3)乙炔分子中的σ键与π键个数比为1∶2( )
(4)乙烯中混有的乙炔可用溴水除去( )
(5)乙烯、乙炔常温下可以与H2、HCl发生加成反应( )
答案 (1)× (2)× (3)× (4)× (5)×
二、炔烃
1.定义:分子里含有碳碳三键的一类脂肪烃。
2.官能团:名称为碳碳三键,结构简式为—C≡C—。
3.通式:炔烃只有一个碳碳三键时,其通式为CnH2n-2(n≥2)。
4.物理性质
熔、沸点随碳原子数的增加而递增,其中碳原子数小于等于4的炔烃是气态烃,最简单的炔烃是乙炔。
【微自测】
2.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性KMnO4溶液褪色
答案 A
解析 1 mol丙炔最多能与2 mol Cl2发生加成反应,故A项正确;乙炔、丙炔、2-丁炔等分子中的所有碳原子都在同一直线上,但1-丁炔等分子中的碳原子不在同一直线上,故B项错误;炔烃易发生加成反应,但不易发生取代反应,故C项错误;炔烃既能使溴水褪色,又能使酸性KMnO4溶液褪色,故D项错误。
一、乙炔的实验室制法
【活动探究】
实验室常用下图所示装置制取乙炔:
1.用化学方程式写出实验室制取乙炔的反应原理。
提示 CaC2+2H2O―→Ca(OH)2+C2H2↑。
2.为什么用饱和食盐水代替水?
提示 碳化钙与水的反应剧烈,为了减慢反应速率,得到平稳的乙炔气流,可用饱和食盐水代替水。
3.装置②的作用是什么?
提示 除去H2S、PH3等杂质气体,防止杂质气体干扰乙炔性质的检验。
4.实验室制取乙炔时,如何收集?能否用排空气法收集乙炔?
提示 使用排水法收集乙炔气体。不能用排空气法。乙炔的相对分子质量为26,空气的平均相对分子质量为29,二者密度相差不大,难以收集到纯净的乙炔。
【核心归纳】
实验室制取乙炔的注意事项
(1)实验装置在使用前要先检查装置气密性。
(2)盛电石的试剂瓶要及时密封并放于干燥处,防止电石吸水而失效。
(3)电石与水反应剧烈,为得到平稳的乙炔气流,可用饱和氯化钠溶液代替水,并用分液漏斗控制滴加饱和氯化钠溶液的速率,让饱和氯化钠溶液慢慢地滴入。
(4)因反应剧烈且产生气泡,为防止产生的泡沫涌入导管,应在导管口塞入少许棉花(图示装置中未画出)。
(5)制取乙炔不能用启普发生器或具有启普发生器原理的实验装置,原因是:①碳化钙吸水性强,遇水反应剧烈,不能随用、随停;②反应过程中放出大量的热,易使启普发生器炸裂;③生成的Ca(OH)2呈糊状易堵塞球形漏斗。
(6)由于电石中含有可以与水发生反应的杂质(如CaS、Ca3P2等),使制得的乙炔中往往含有H2S、PH3等杂质,将混合气体通过盛有NaOH溶液或CuSO4溶液的洗气瓶可将杂质除去。
1.气体发生装置的基本类型
制取装置 制取气体 反应原理
固+固气 NH3 2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O
固+液气 Cl2 MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
固+液―→气 CO2 CaCO3+2HCl===CaCl2+CO2↑+H2O
2.除杂装置基本类型
装置示意图 适用范围
试剂与杂质气体反应,与主要气体不反应;装置③用固体吸收还原性或氧化性杂质气体
杂质气体被冷却后变为液体,主要气体不变为液体
【实践应用】
1.下图是实验室用电石制取乙炔的装置,其中正确的是( )
答案 C
解析 实验室制取乙炔是用CaC2和水反应,不需要加热,由于CaC2与水反应剧烈,且反应放出大量的热,因此不能用启普发生器,也不能用长颈漏斗,用分液漏斗控制食盐水的滴加以控制反应速率,导气管也不能伸入到液面以下,否则气体无法导出。
2.如图为实验室制取乙炔并验证其性质的装置图。下列说法不合理的是( )
A.逐滴加入饱和氯化钠溶液可控制生成乙炔的速率
B.酸性KMnO4溶液褪色,说明乙炔具有还原性
C.若用溴的CCl4溶液验证乙炔的性质,不需要通过CuSO4溶液除杂
D.若将纯净的乙炔点燃,有浓烈的黑烟,说明乙炔不饱和程度高
答案 C
解析 电石跟水反应比较剧烈,所以用饱和氯化钠溶液代替水,逐滴加入饱和氯化钠溶液时可控制反应物水的量,从而控制生成乙炔的速率,A正确;酸性KMnO4溶液能氧化乙炔,因此乙炔使酸性KMnO4溶液褪色,表现了乙炔的还原性,B正确;乙炔气体中混有的硫化氢可以被Br2氧化,对乙炔性质的检验产生干扰,所以应先用硫酸铜溶液洗气,C错误;对于烃类物质而言,不饱和程度越高,则含碳量越高,火焰越明亮,冒出的烟越浓,乙炔含有碳碳三键,是不饱和程度较高的烃类物质,D正确。
3.实验室制取的乙炔气体中常混有少量H2S、CO2和水蒸气,为了得到干燥纯净的乙炔气体,下列最简便的实验方案是( )
A.通过NaOH溶液后,再通过浓硫酸,最后通过石灰水
B.通过CuSO4溶液后,再通过石灰水
C.通过五氧化二磷后,再通过无水CaCl2
D.通过足量的碱石灰
答案 D
解析 A、B两项操作均不能得到纯净干燥的乙炔;C项操作不能除去H2S、CO2。
二、炔烃的结构与化学性质
【活动探究】
已知使用活性较低的林德拉催化剂[Pd/(PbO、CaCO3)],可使炔烃的氢化停留在生成烯烃的阶段,而不再进一步氢化成烷烃。另外将净化后的乙炔气体分别通入溴的四氯化碳溶液和酸性KMnO4溶液,现象如下:
1.分析指出丙炔中碳原子的杂化类型和共价键类型是怎样的?
提示 ,4个C—H σ键,2个C—C σ键,2个π键。
2.将净化后的乙炔气体分别通入溴的四氯化碳溶液和酸性KMnO4溶液,有何现象?
提示 溶液均褪色。
3.若点燃乙炔气体,有何现象?为什么?
提示 点燃乙炔气体有明亮的火焰并有浓烟产生。因为乙炔的含碳量高,燃烧不充分产生碳单质。
4.请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
提示 CH≡CCH2CH3+2H2CH3CH2CH2CH3,反应中碳原子之间形成的π键断裂,形成4个C—H σ键。
5.请写出戊炔所有属于炔烃的同分异构体的结构简式,并用系统命名法命名。
提示 (1)CH≡C(CH2)2CH3 1-戊炔
CH3C≡C—CH2CH3 2-戊炔
3-甲基-1-丁炔
6.某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔烃可能的结构简式,并命名。
提示 4-甲基-1-戊炔
4-甲基-2-戊炔。
【核心归纳】
1.炔烃的结构与性质
(1)结构:分子中的碳原子一定存在sp杂化,共价键一定存在σ键和π键,以“—C≡C—”为中心的4原子共线结构。
(2)炔烃化学性质
①氧化反应
②加成反应:与X2、HX、H2O、H2等发生加成反应
③加聚反应:nR1—C≡C—R2
2.炔烃的命名方法
(1)选主链:将含碳碳三键的最长碳链作为主链,并按主链中所含碳原子数称为“某炔”。
(2)编序号:从距离三键最近的一端给主链上的碳原子依次编号,使三键碳原子的编号最小。
(3)写名称:先用大写数字“二、三……”在炔烃的名称前表示三键的个数;然后在“某炔”前面用阿拉伯数字表示出三键的位置(用三键碳原子的最小编号表示),最后在前面写出支链的名称、个数和位置。
烷烃、烯烃、炔烃的结构和化学性质的比较
烷烃 烯烃 炔烃
通式 CnH2n+2(n≥1) CnH2n(n≥2) CnH2n-2 (n≥2)
代表物 CH4 CH2===CH2 CH≡CH
结构特点 全部单键;饱和链烃 含碳碳双键;不饱和链烃 含碳碳三键;不饱和链烃
化学性质 取代反应 光照卤代 - -
加成反应 - 能与H2、X2、HX、H2O、HCN等发生加成反应
氧化反应 燃烧火焰较明亮 燃烧火焰明亮,伴有黑烟 燃烧火焰很明亮,伴有浓烈的黑烟
不与酸性KMnO4溶液反应 能使酸性KMnO4溶液褪色
加聚反应 - 能发生
鉴别 溴水和酸性KMnO4溶液均不褪色 溴水和酸性KMnO4溶液均褪色
【实践应用】
4.下列说法中正确的是( )
A.1-丁炔分子中四个碳原子位于同一条直线上
B.乙炔分子中碳碳间的三个共价键性质完全相同
C.分子组成符合CnH2n-2通式的链烃,一定是炔烃
D.乙炔及其同系物中,乙炔的含碳量最大
答案 D
解析 1-丁炔中与不饱和碳原子直接相连的原子应在同一直线上,但饱和碳原子为sp3杂化,连接的原子一定不在同一条直线上,A错;碳碳三键中有一个σ键和两个π键,三个共价键性质不完全相同,B错;符合CnH2n-2通式的链烃还可以是二烯烃,C错;乙炔同系物CnH2n-2中碳的质量分数为×100%=×100%,n增大时,14-增大,w(C)减小,故n=2时w(C)最大。
5.乙烷、乙烯、乙炔共同具有的性质是( )
A.易溶于有机溶剂,且密度比水小
B.能够使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内
D.都能发生聚合反应生成高分子化合物
答案 A
解析 乙烷分子中各原子不能处于同一平面上;乙烷不能发生聚合反应;乙烷不能使溴水和酸性KMnO4溶液褪色。
6.某烃甲与氢气反应后的产物乙为(CH3)2CHCH2CH3,则相关说法不合理的是( )
A.产物乙的系统命名为2-甲基丁烷
B.烃甲可能是2-甲基-1,3-丁二烯
C.0.1 mol产物乙完全燃烧可消耗17.92 L O2
D.烃甲与乙炔可能是同系物
答案 C
解析 烃甲可能为烯烃、二烯烃、炔烃,如2-甲基-1-丁烯、2-甲基-1,3-丁二烯、3-甲基-1-丁炔,B、D正确;0.1 mol产物乙完全燃烧可消耗0.8 mol O2,标准状况下为17.92 L,选项未说明状态,C错误。
核心体系建构
1.在常温下,对于化学式满足CnH2n-2(n≥2,且n为整数)的某气态链烃,下列说法不正确的是( )
A.肯定是不饱和烃
B.肯定能使酸性KMnO4溶液褪色
C.可能是炔烃
D.一定是乙炔的同系物
答案 D
解析 化学式满足CnH2n-2(n≥2,且n为整数)的某气态链烃可能是含有两个碳碳双键的烯烃,所以不一定是炔烃或乙炔的同系物。
2.下列关于乙炔制取的说法不正确的是( )
A.反应后溶液呈碱性
B.此反应是放热反应
C.为了除去杂质气体,可用硫酸铜溶液吸收
D.实验室制得的纯净的乙炔有特殊臭味
答案 D
解析 电石(主要成分CaC2)与水反应得到乙炔和氢氧化钙,溶液呈碱性,故A正确;电石与水反应放出大量的热,属于放热反应,故B正确;杂质气体有H2S或PH3,可用硫酸铜除掉,故C正确;有特殊臭味的乙炔含有H2S或PH3杂质气体,故D错误。
3.下列有机物的系统命名法正确的一组是( )
答案 C
解析 A项,应该是4-甲基-2-戊炔,错误;B项,该有机物的名称为3-甲基-1-戊烯,错误;C项,根据有机物的命名原则,该有机物为2-甲基-2,4-己二烯,正确;D项,该有机物的名称为2,2,4-三甲基戊烷,错误。
4.下列各选项能说明分子式为C4H6的某烃是HC≡C—CH2—CH3,而不是CH2===CH—CH===CH2的是( )
A.燃烧有浓烟
B.能使酸性KMnO4溶液褪色
C.能与溴发生1,2-加成反应
D.与足量溴反应,生成物中只有2个碳原子上有溴原子
答案 D
解析 无论HC≡C—CH2—CH3还是CH2===CH—CH===CH2,A、B、C项所述事实均能发生,而与足量溴加成后,前者产物为,后者产物为,故D正确。
5.实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定电石样品中CaC2的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。
(1)A瓶中的液体可以从酸性KMnO4溶液和CuSO4溶液中选择,应该选择________,它的作用是____________________________________________________________。
(2)写出实验室制取乙炔的化学方程式:____________________________
____________________________________________________________。
(3)装置Ⅰ的主要缺点是_______________________________________;
装置Ⅱ的主要缺点是_________________________________________;
若选用装置Ⅱ来完成实验,则应采取的措施是_________________
____________________________________________________________。
(4)若称取m g电石,反应完全后,测得B处溴水增重n g,则CaC2的纯度为________。
答案 (1)CuSO4溶液 除去乙炔气体中混有的H2S和PH3等杂质气体
(2)CaC2+2H2O―→Ca(OH)2+C2H2↑
(3)少量乙炔会从长颈漏斗中逸出,引起实验误差,且不易控制水的添加量 反应产生的泡沫会堵塞导管 在导管口处塞上一团棉花
(4)×100%
解析 (1)酸性高锰酸钾溶液具有强氧化性,能氧化乙炔,因此选择硫酸铜溶液除去乙炔中混有的H2S和PH3气体。(2)实验室制取乙炔的化学方程式为CaC2+2H2O―→Ca(OH)2+C2H2↑。(3)根据装置Ⅰ的结构可知主要缺点是少量乙炔会从长颈漏斗中逸出,引起实验误差,且不易控制水的添加量。装置Ⅱ的主要缺点是反应产生的泡沫会堵塞导管;根据以上分析可知若选用装置Ⅱ来完成实验,则应采取的措施是给导管口处塞上一团棉花。(4)若称取m g电石,反应完全后,测得B处溴水增重n g,则根据方程式C2H2+2Br2―→CHBr2CHBr2可知乙炔的物质的量是 mol,所以CaC2的纯度为×100%=×100%。
一、选择题(本题包含12个小题,每小题只有一个选项符合题意)
1.下列关于乙炔的说法不正确的是( )
A.燃烧时有浓烈的黑烟
B.可通过酸性高锰酸钾溶液来区别烯烃和炔烃
C.为了减缓电石和水的反应速率,可用饱和食盐水来代替水
D.收集乙炔可用排水法
答案 B
解析 乙炔中含碳量较高,燃烧时会伴有浓烈的黑烟,A正确。烯烃和炔烃都可以使酸性高锰酸钾溶液褪色,无法区别,B错误。用饱和食盐水可以降低电石和水的反应速率,C正确。乙炔微溶于水,可以用排水法收集,D正确。
2.下列关于乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是( )
A.能燃烧生成二氧化碳和水
B.能与溴水发生加成反应
C.能与酸性高锰酸钾溶液发生氧化反应
D.能与氯化氢反应生成氯乙烯
答案 D
解析 乙烯、乙烷、乙炔都能燃烧生成二氧化碳和水,乙烯和乙炔都能与溴水发生加成反应,都能与酸性高锰酸钾溶液发生氧化反应,使酸性高锰酸钾溶液褪色,故A、B、C都不是乙炔独特的性质。与HCl反应生成氯乙烯是乙炔的性质,而不是乙烯和乙烷的性质。
3.块状固体电石遇水会剧烈反应生成乙炔气体。实验室若用此法制取乙炔,选择的装置最好是图中的( )
答案 B
解析 实验室用块状电石与水在常温下反应,发生装置应选择固液常温型装置;由于反应比较剧烈而需严格控制加水的速率,只能选择B装置中的分液漏斗控制水的滴加速率。
4.某学习小组用电(CaC2)与饱和食盐水制取C2H2(含少量H2S、PH3),并验证C2H2的部分化学性质,所用装置如图。下列说法正确的是( )
A.使用饱和食盐水代替水是为了加快制取C2H2的速率
B.去掉装置B,不影响装置C、D中C2H2化学性质的探究
C.取装置C中褪色后的溶液,测定其pH值,与反应前所测pH对比,pH增大,可判断C2H2和Br2发生了加成反应
D.用燃着的木条靠近E玻璃管尖嘴处,未见有明亮火焰,说明C2H2没有可燃性
答案 C
解析 A.饱和食盐水滴到电石上,水被消耗,NaCl析出,附着在电石表面,阻碍电石和水的接触,可以减慢制取C2H2的速率,故A错误;B.装置B的主要作用是除去生成的H2S、PH3,因为H2S、PH3都有还原性,能被溴水和酸性高锰酸钾溶液氧化,从而使溴水和酸性高锰酸钾溶液褪色,所以去掉装置B,会影响装置C、D中C2H2化学性质的探究,故B错误;C.若乙炔和溴发生了加成反应,生成了卤代烃,消耗了溴,溶液的pH会增大;若乙炔和溴发生了取代反应,则除了生成卤代烃外,还生成HBr,则溶液的pH会减小,故C正确;D.用燃着的木条靠近E玻璃管尖嘴处,未见有明亮火焰,可能乙炔完全被前面的试剂消耗,没有乙炔逸出,不能说明C2H2没有可燃性,故D错误;故选C。
5.下列物质中,不可能是炔烃的加成产物的是( )
A.乙烷 B.2,3-二甲基戊烷
C.异戊烷 D.异丁烷
答案 D
解析 A项,乙烷可由乙炔加成得到;B项,2,3-二甲基戊烷可由CH3—CH(CH3)—CH(CH3)—C≡CH与氢气加成得到;C项,若炔烃为(CH3)2CHC≡CH可与氢气加成生成;D项,异丁烷相邻的任意两个碳原子上都不符合有2个氢原子,不能由不饱和炔烃经加成反应生成。
6.某气态烃0.5 mol能与1 mol HCl完全加成,加成后产物分子中的氢原子又可被3 mol Cl2完全取代,则此气态烃可能是( )
A.CH3C≡CCH3 B.CH2===CH2
C.CH≡CCH3 D.CH2===CHCH3
答案 C
解析 根据题意,该烃与HCl、氯气的物质的量之比是0.5∶1∶3=1∶2∶6,即1 mol该烃与2 mol HCl完全加成,则该烃中含有2个碳碳双键或1个碳碳三键;最终被氯气取代后的产物中有8个氯原子,即对应的烷烃中有8个氢原子,所以该烃的饱和状态为丙烷,则该烃为丙炔,答案选C。
7.某烃和溴水反应后的产物为2,2,3,3-四溴丁烷,则该烃的同分异构体为( )
A.1-丁炔 B.2-丁炔
C.1-丁烯 D.2-丁烯
答案 A
解析 2,2,3,3-四溴丁烷的结构简式为CH3C(Br)2C(Br)2CH3,由某烃与溴加成得到,故该烃为2-丁炔,结构简式为CH3C≡CCH3。1-丁炔与2-丁炔互为同分异构体,A正确;该烃就是2-丁炔,是同一种物质,B错误;1-丁烯与2-丁炔的分子式不同,不互为同分异构体,C错误;2-丁烯与2-丁炔的分子式不同,不互为同分异构体,D错误。
8.某炔烃与氢气发生加成反应后得到,则该炔烃的结构有( )
A.1种 B.2种
C.3种 D.4种
答案 B
解析 将2-甲基戊烷中各C原子编号:,其中2号C上只含有1个H原子,无法形成碳碳三键,只有3、4号C间和4、5号C间可以形成碳碳三键,故符合题述的炔烃有2种,B项正确。
9.含有一个三键的炔烃,氢化后的产物结构简式如图,此炔烃可能的结构简式有( )
A.1种 B.2种
C.3种 D.4种
答案 B
解析 根据炔烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均有至少2个氢原子的碳原子间是对应炔存在—C≡C—的位置。如图3个位置可以还原为—C≡C—:,其中1、2号位置与3、4号两位置相同,故该炔烃共有2种。
10.一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中不正确的是( )
A.该有机物的分子式为C5H4
B.该分子中所有碳原子在同一平面内
C.1 mol该有机物最多可与2 mol Br2发生加成反应
D.与其互为同分异构体,且只含碳碳三键的链烃不止一种
答案 B
解析 键线式中交点数即为碳原子数,然后确定每个碳原子所结合的氢原子数,该有机物分子式为C5H4,A正确;中间碳原子形成四条单键,为四面体形结构,故该分子中所有碳原子不可能在同一平面内,B错误;该烃含有两个碳碳双键,故1 mol该有机物最多能与2 mol Br2发生加成反应,C正确;该烃的链状同分异构体(碳架结构)可能为C≡C—C≡C—C、C≡C—C—C≡C,D正确。
11.已知Mg2C3的结构与CaC2的结构相似。由此可断定Mg2C3与水反应的产物是( )
A.Mg(OH)2和CH≡CH
B.Mg(OH)2和CH4
C.Mg(OH)2和CH3C≡CH
D.Mg(OH)2和CH3CH===CH2
答案 C
解析 CaC2与水反应:CaC2+2H2O―→Ca(OH)2+CH≡CH↑,可拆成:CaC2+2H—OH―→Ca(OH)2+CH≡CH↑,Mg2C3的结构与CaC2的结构相似,与水反应:Mg2C3+4H—OH―→2Mg(OH)2+C3H4↑,C3H4的结构简式为CH3C≡CH。
12.已知:,如果要合成,所用的起始原料可以是( )
①2-甲基-1,3-丁二烯和2-丁炔
②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔
④2,3-二甲基-1,3-丁二烯和丙炔
A.①④ B.②③
C.①③ D.②④
答案 A
解析 由信息:断键后可得到。的断键方式有:,。若按①断键可得到CH3C≡CH(丙炔)和(2,3-二甲基-1,3-丁二烯);若按②断键可得到(2-甲基-1,3-丁二烯)和CH3—C≡C—CH3(2-丁炔)。
二、非选择题(本题共2小题)
13.以乙炔为主要原料可以合成聚氯乙烯、聚丙烯腈和氯丁橡胶。请写出如图方框中(1)~(5)的结构简式,并写出①~⑦各步反应的化学方程式。
答案 (1)CH2===CH—Cl (2)CH2===CH—CN
(3)CH2===CH—C≡CH (4)
(5)
①CH≡CH+HClCH2===CHCl
②nCH2===CHCl
③CH≡CH+HCN―→CH2===CHCN
④nCH2===CH—CN
⑤2CH≡CH―→CH2===CH—C≡CH
⑥CH2===CH—C≡CH+HCl―→
⑦
解析 ①为CH≡CH与HCl的加成反应;②为CH2===CHCl的加聚反应;③为乙炔与HCN的加成反应;④为丙烯腈的加聚反应;⑤为两个乙炔分子的相互加成;⑥为乙烯基乙炔与HCl的加成反应;⑦为CH2===CCl—CH===CH2的加聚反应。
14.用电石制备的乙炔气体中常混有少量H2S气体。请用图中仪器和药品组装一套制备、净化乙炔的装置,并可通过测定标准状况下产生乙炔的体积,从而计算电石的纯度。
(1)进行实验时,所制气体从左向右流动,仪器的正确连接顺序是________(填接口字母)。
(2)为了使实验中气流平稳,甲中分液漏斗里的液体X通常用________。
(3)若在标准状况下溴水与乙炔完全反应生成CHBr2CHBr2,已知称取电石m g,测得量筒内液体体积V mL,则电石纯度可表示为________。
(4)若没有除H2S的装置,测定结果将会________(填“偏高”“偏低”或“不变”),理由是________________________________________
_____________________________________________(用化学方程式表示)。
答案 (1)AHGEFDCB (2)饱和食盐水
(3)% (4)偏高 H2S+Br2===S↓+2HBr
解析 由题意知,电石与足量水反应生成乙炔,其中混有的H2S可用NaOH溶液吸收,乙炔气体被溴水吸收后余下的部分通过排水法测量其体积。若没有除H2S装置,则排出水的体积偏大,计算结果偏高。电石纯度计算过程:
CaC2 ~ C2H2
1 mol 1 mol
x mol+ mol
解得x=(+0.001) mol,
w(CaC2)=×100%=%。
