第六单元 常用的金属和盐巩固—2021-2022学年九年级化学沪教版(上海)第二学期 (word版有答案)
文档属性
| 名称 | 第六单元 常用的金属和盐巩固—2021-2022学年九年级化学沪教版(上海)第二学期 (word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 143.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-16 09:22:28 | ||
图片预览


文档简介
第6章常用的金属和盐巩固2021-2022学年九年级化学沪教版(上海)
一、单选题
1.下列措施中,不能防止金属制品锈蚀的是
A.在表面刷漆
B.改用不锈钢
C.在表面镀铬
D.用湿布擦拭
2.下列金属中,金属活动性最强的是( )
A.钾 B.铁 C.铜 D.金
3.为验证Zn、Cu、Ag三种金属的活动性顺序,下列试剂可以选用的是( )
A.ZnSO4溶液 B.稀盐酸 C.AgNO3溶液 D.CuSO4溶液
4.下列化学方程式所表示的化学反应能发生的是 ( )
A.Cu+H2SO4=CuSO4+H2↑ B.Fe+ Zn( NO3)2=Fe(NO3)2+Zn↓
C.CuCl2+2NaOH=Cu(OH)2↓+2NaCl D.Na2CO3+2KNO3=K2CO3+ 2NaNO3
5.下列属于置换反应的是
A.
B.
C.NaOH+HCl=NaCl+H2O
D.2Al+6HCl=2AlCl3+3H2↑
6.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
7.已知金属锰在金属活动性顺序中位于铝和锌之间.下列化学反应不能发生的是( )
A.Mn+2HCl=MnCl2+H2↑ B.Mg+MnSO4=MgSO4+Mn
C.Fe+MnSO4=FeSO4+Mn D.Mn+CuSO4=MnSO4+Cu
8.某固体粉末可能由氢氧化钠、氢氧化钙、碳酸钠和碳酸钙中的一种或几种组成,进行如下实验:①取少量固体加入足量的水,搅拌,有不溶物;②过滤,向滤液中加入盐酸,有气泡产生。下列对固体粉末成分的判断中,不正确的是
A.一定在碳酸钠 B.可能有氢氧化钠
C.一定有碳酸钙 D.可能有氢氧化钙
9.X、R表示两种金属,在溶液中发生反应:X+3RNO3=3R+X(NO3)3。下列说法不正确的是
A.该反应是置换反应
B.若X是Al,R是Ag,则反应后溶液质量减少
C.X可能是Fe,R可能是Cu
D.X的金属活动性比R强
10.下列各组物质间能发生化学反应的是
A.银和稀盐酸 B.铁和硫酸锌溶液
C.硝酸钾溶液和食盐水 D.硫酸和氯化钡溶液
11.为达到以下实验目的,所设计的实验方案不合理的是
A.分离出含有少量NaCl的KNO3,高温下配制KNO3饱和溶液,趁热过滤
B.除去NaCl溶液中的Na2SO4,滴加适量BaCl2溶液,充分反应后,过滤
C.鉴别某种溶液是FeCl3溶液,取样,观察溶液颜色,滴加AgNO3溶液
D.鉴别NaCl、Na2CO3两种溶液,取样,分别滴加酚酞溶液
二、简答题
12.下列是初中化学常见仪器与实验。
(1)A图中仪器的名称是_______。
(2)取用块状大理石用到的是_______(填字母)图中仪器。
(3)D图为检验氧气是否收集满的操作,请将明显的错误加以改正_______。
(4)E图中能够说明Cu和Ag活动性顺序的现象是_______。
13.钢铁被称为工业的骨骼,而中国早在春秋时期已发明铸铁技术。写出工业上炼铁的化学方程式__________________________________。
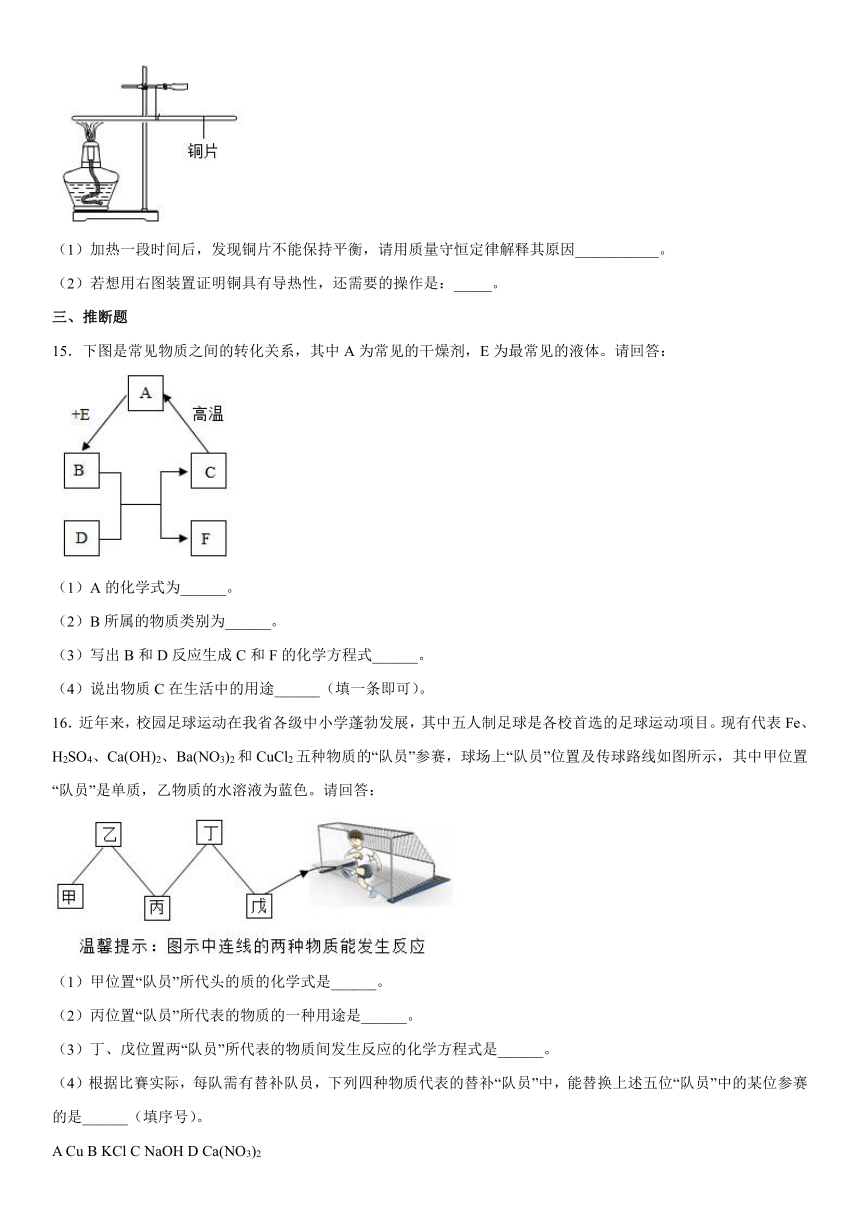
14.如图所示,用细线系住宽1cm的铜片使之平衡,然后在铜片一端用酒精灯加热。
(1)加热一段时间后,发现铜片不能保持平衡,请用质量守恒定律解释其原因___________。
(2)若想用右图装置证明铜具有导热性,还需要的操作是:_____。
三、推断题
15.下图是常见物质之间的转化关系,其中A为常见的干燥剂,E为最常见的液体。请回答:
(1)A的化学式为______。
(2)B所属的物质类别为______。
(3)写出B和D反应生成C和F的化学方程式______。
(4)说出物质C在生活中的用途______(填一条即可)。
16.近年来,校园足球运动在我省各级中小学蓬勃发展,其中五人制足球是各校首选的足球运动项目。现有代表Fe、H2SO4、Ca(OH)2、Ba(NO3)2和CuCl2五种物质的“队员”参赛,球场上“队员”位置及传球路线如图所示,其中甲位置“队员”是单质,乙物质的水溶液为蓝色。请回答:
(1)甲位置“队员”所代头的质的化学式是______。
(2)丙位置“队员”所代表的物质的一种用途是______。
(3)丁、戊位置两“队员”所代表的物质间发生反应的化学方程式是______。
(4)根据比賽实际,每队需有替补队员,下列四种物质代表的替补“队员”中,能替换上述五位“队员”中的某位参赛的是______(填序号)。
A Cu B KCl C NaOH D Ca(NO3)2
17.甲乙丙丁四种物质的转化关系如图所示,回答下列问题。
(1)若甲、丁为单质,则此类反应一定属于____(填一种基本反应类型)。
(2)若丁为水,写出一个符合条件的化学方程式:_____。
(3)若丁为蓝色沉淀,则甲可能为_____(填一种物质的化学式)
四、实验题
18.完成下列实验问题
(1)实验1:滴加液体的仪器是______。白色点滴板孔穴4中溶液变为红色,说明柠檬汁显______性。使用白色点滴板进行实验的优点是______(答一点)。
(2)实验2:水电解反应的化学方程式为______。
(3)实验3:托盘天平向右倾斜。整个实验过程中气球的作用是______。
(4)有关上述三个实验,以下说法正确的是______。(填序号)
①实验1草木灰(K2CO3)是一种钾肥
②实验2加入食盐可增强水的导电性
③实验3天平向右倾斜是因为锥形瓶内未充分冷却
④实验2中b端收集的是氢气
⑤实验3锥形瓶内事先放少量细沙的作用是吸收白烟和热量
19.按下图装置进行实验,倾斜锥形瓶使稀盐酸与固体接触发生反应,瓶内气压的变化如坐标图所示。
(1)该实验中发生反应的化学方程式为__________。
(2)通过该实验得出“化学反应的速率与反应物的接触面积有关”,依据是__________。
五、计算题
20.工业用焦炭还原100kg含Fe2O380%的赤铁矿,理论上可炼得铁的质量为多少?(请写出解题步骤)
21.某工厂利用废铁屑和废硫酸反应制取硫酸亚铁,现有废硫酸9.8t(H2SO4的质量分数为10%),与足量的废铁屑反应,理论上可生成FeSO4的质量是多少?(H2SO4—98,FeSO4—152)
22.某碳酸钠样品中混有少量氯化钠,根据如图所示信息计算该样品中碳酸钠的质量分数。(计算结果精确到0.1%)(反应的化学方程式:CaCl2+Na2CO3===CaCO3↓+2NaCl)
试卷第1页,共3页
参考答案:
1.D
2.A
3.D
4.C
5.D
6.B
7.C
8.C
9.C
10.D
11.A
12. 蒸发皿 C 应将带火星的木条放在集气瓶口 铜片的表面覆盖一层银白色物质,溶液颜色由无色变为蓝色
13.2
14. 在加热过程中,因为铜与氧气发生反应,所以反应后固体质量增加,本实验现象与质量守恒定律不矛盾 测试右端的铜片温度是否有升高
15. CaO 碱 补钙(合理即可)
16. Fe 改良酸性土壤等 C
17. 置换反应 CuSO4(合理均可)
18. 胶头滴管 酸性 节约药品等 平衡装置内外压强、缓冲作用 ①③
19. 相同时间内,粉末状碳酸钙与稀盐酸反应生成的二氧化碳气体更多
20.解:设理论上可炼得铁的质量为x
答:理论上可炼得铁的质量为56kg。
21.解:设理论上可生成FeSO4的质量为x
x=1.52t
答:理论上可生成FeSO4的质量是1.52t。
22.设该样品中碳酸钠的质量为x。
CaCl2+Na2CO3===CaCO3↓+2NaCl
106 100
x 5.0 g
= x=5.3 g
样品中碳酸钠的质量分数为×100%=70.7%
答:该样品中碳酸钠的质量分数为70.7%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列措施中,不能防止金属制品锈蚀的是
A.在表面刷漆
B.改用不锈钢
C.在表面镀铬
D.用湿布擦拭
2.下列金属中,金属活动性最强的是( )
A.钾 B.铁 C.铜 D.金
3.为验证Zn、Cu、Ag三种金属的活动性顺序,下列试剂可以选用的是( )
A.ZnSO4溶液 B.稀盐酸 C.AgNO3溶液 D.CuSO4溶液
4.下列化学方程式所表示的化学反应能发生的是 ( )
A.Cu+H2SO4=CuSO4+H2↑ B.Fe+ Zn( NO3)2=Fe(NO3)2+Zn↓
C.CuCl2+2NaOH=Cu(OH)2↓+2NaCl D.Na2CO3+2KNO3=K2CO3+ 2NaNO3
5.下列属于置换反应的是
A.
B.
C.NaOH+HCl=NaCl+H2O
D.2Al+6HCl=2AlCl3+3H2↑
6.下列关于金属材料的说法中,不正确的是( )
A.常温下,铝能与空气中的氧气反应,在其表面生成致密的氧化铝薄膜
B.铁在干燥的空气中容易生锈
C.硬铝(铝合金)的硬度大于纯铝
D.金属资源的回收利用既保护了环境,又节约了金属资源
7.已知金属锰在金属活动性顺序中位于铝和锌之间.下列化学反应不能发生的是( )
A.Mn+2HCl=MnCl2+H2↑ B.Mg+MnSO4=MgSO4+Mn
C.Fe+MnSO4=FeSO4+Mn D.Mn+CuSO4=MnSO4+Cu
8.某固体粉末可能由氢氧化钠、氢氧化钙、碳酸钠和碳酸钙中的一种或几种组成,进行如下实验:①取少量固体加入足量的水,搅拌,有不溶物;②过滤,向滤液中加入盐酸,有气泡产生。下列对固体粉末成分的判断中,不正确的是
A.一定在碳酸钠 B.可能有氢氧化钠
C.一定有碳酸钙 D.可能有氢氧化钙
9.X、R表示两种金属,在溶液中发生反应:X+3RNO3=3R+X(NO3)3。下列说法不正确的是
A.该反应是置换反应
B.若X是Al,R是Ag,则反应后溶液质量减少
C.X可能是Fe,R可能是Cu
D.X的金属活动性比R强
10.下列各组物质间能发生化学反应的是
A.银和稀盐酸 B.铁和硫酸锌溶液
C.硝酸钾溶液和食盐水 D.硫酸和氯化钡溶液
11.为达到以下实验目的,所设计的实验方案不合理的是
A.分离出含有少量NaCl的KNO3,高温下配制KNO3饱和溶液,趁热过滤
B.除去NaCl溶液中的Na2SO4,滴加适量BaCl2溶液,充分反应后,过滤
C.鉴别某种溶液是FeCl3溶液,取样,观察溶液颜色,滴加AgNO3溶液
D.鉴别NaCl、Na2CO3两种溶液,取样,分别滴加酚酞溶液
二、简答题
12.下列是初中化学常见仪器与实验。
(1)A图中仪器的名称是_______。
(2)取用块状大理石用到的是_______(填字母)图中仪器。
(3)D图为检验氧气是否收集满的操作,请将明显的错误加以改正_______。
(4)E图中能够说明Cu和Ag活动性顺序的现象是_______。
13.钢铁被称为工业的骨骼,而中国早在春秋时期已发明铸铁技术。写出工业上炼铁的化学方程式__________________________________。
14.如图所示,用细线系住宽1cm的铜片使之平衡,然后在铜片一端用酒精灯加热。
(1)加热一段时间后,发现铜片不能保持平衡,请用质量守恒定律解释其原因___________。
(2)若想用右图装置证明铜具有导热性,还需要的操作是:_____。
三、推断题
15.下图是常见物质之间的转化关系,其中A为常见的干燥剂,E为最常见的液体。请回答:
(1)A的化学式为______。
(2)B所属的物质类别为______。
(3)写出B和D反应生成C和F的化学方程式______。
(4)说出物质C在生活中的用途______(填一条即可)。
16.近年来,校园足球运动在我省各级中小学蓬勃发展,其中五人制足球是各校首选的足球运动项目。现有代表Fe、H2SO4、Ca(OH)2、Ba(NO3)2和CuCl2五种物质的“队员”参赛,球场上“队员”位置及传球路线如图所示,其中甲位置“队员”是单质,乙物质的水溶液为蓝色。请回答:
(1)甲位置“队员”所代头的质的化学式是______。
(2)丙位置“队员”所代表的物质的一种用途是______。
(3)丁、戊位置两“队员”所代表的物质间发生反应的化学方程式是______。
(4)根据比賽实际,每队需有替补队员,下列四种物质代表的替补“队员”中,能替换上述五位“队员”中的某位参赛的是______(填序号)。
A Cu B KCl C NaOH D Ca(NO3)2
17.甲乙丙丁四种物质的转化关系如图所示,回答下列问题。
(1)若甲、丁为单质,则此类反应一定属于____(填一种基本反应类型)。
(2)若丁为水,写出一个符合条件的化学方程式:_____。
(3)若丁为蓝色沉淀,则甲可能为_____(填一种物质的化学式)
四、实验题
18.完成下列实验问题
(1)实验1:滴加液体的仪器是______。白色点滴板孔穴4中溶液变为红色,说明柠檬汁显______性。使用白色点滴板进行实验的优点是______(答一点)。
(2)实验2:水电解反应的化学方程式为______。
(3)实验3:托盘天平向右倾斜。整个实验过程中气球的作用是______。
(4)有关上述三个实验,以下说法正确的是______。(填序号)
①实验1草木灰(K2CO3)是一种钾肥
②实验2加入食盐可增强水的导电性
③实验3天平向右倾斜是因为锥形瓶内未充分冷却
④实验2中b端收集的是氢气
⑤实验3锥形瓶内事先放少量细沙的作用是吸收白烟和热量
19.按下图装置进行实验,倾斜锥形瓶使稀盐酸与固体接触发生反应,瓶内气压的变化如坐标图所示。
(1)该实验中发生反应的化学方程式为__________。
(2)通过该实验得出“化学反应的速率与反应物的接触面积有关”,依据是__________。
五、计算题
20.工业用焦炭还原100kg含Fe2O380%的赤铁矿,理论上可炼得铁的质量为多少?(请写出解题步骤)
21.某工厂利用废铁屑和废硫酸反应制取硫酸亚铁,现有废硫酸9.8t(H2SO4的质量分数为10%),与足量的废铁屑反应,理论上可生成FeSO4的质量是多少?(H2SO4—98,FeSO4—152)
22.某碳酸钠样品中混有少量氯化钠,根据如图所示信息计算该样品中碳酸钠的质量分数。(计算结果精确到0.1%)(反应的化学方程式:CaCl2+Na2CO3===CaCO3↓+2NaCl)
试卷第1页,共3页
参考答案:
1.D
2.A
3.D
4.C
5.D
6.B
7.C
8.C
9.C
10.D
11.A
12. 蒸发皿 C 应将带火星的木条放在集气瓶口 铜片的表面覆盖一层银白色物质,溶液颜色由无色变为蓝色
13.2
14. 在加热过程中,因为铜与氧气发生反应,所以反应后固体质量增加,本实验现象与质量守恒定律不矛盾 测试右端的铜片温度是否有升高
15. CaO 碱 补钙(合理即可)
16. Fe 改良酸性土壤等 C
17. 置换反应 CuSO4(合理均可)
18. 胶头滴管 酸性 节约药品等 平衡装置内外压强、缓冲作用 ①③
19. 相同时间内,粉末状碳酸钙与稀盐酸反应生成的二氧化碳气体更多
20.解:设理论上可炼得铁的质量为x
答:理论上可炼得铁的质量为56kg。
21.解:设理论上可生成FeSO4的质量为x
x=1.52t
答:理论上可生成FeSO4的质量是1.52t。
22.设该样品中碳酸钠的质量为x。
CaCl2+Na2CO3===CaCO3↓+2NaCl
106 100
x 5.0 g
= x=5.3 g
样品中碳酸钠的质量分数为×100%=70.7%
答:该样品中碳酸钠的质量分数为70.7%。
答案第1页,共2页
答案第1页,共2页
