第四单元盐、化肥同步练习-2021-2022学年九年级化学人教版(五四学制)全一册(word版有答案)
文档属性
| 名称 | 第四单元盐、化肥同步练习-2021-2022学年九年级化学人教版(五四学制)全一册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 121.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-16 20:03:56 | ||
图片预览


文档简介
第四单元盐、化肥同步练习2021-2022学年九年级化学人教版(五四学制)全一册
一、单选题
1.侯德榜是我国制碱工业的先驱。侯氏制碱法中的“碱”是指纯碱,其化学式为
A.Na2CO3 B.NaHCO3 C.NaOH D.NaCl
2.某花圃所种的花卉缺乏氮和钾元素,如果只施用一种化肥,则应施用的是
A.CO(NH2)2 B.K2SO4 C.Ca(H2PO4)2 D.KNO3
3.下列有关X、Y所表示的概念之间存在如图所示交叉关系的是
选项 A B C D
概念 X 金属 纯净物 盐 化合反应
Y 单质 混合物 碳酸盐 氧化反应
A.A B.B C.C D.D
4.化肥对提高农作物的产量有重要作用。下列有关化肥的说法不正确的是
A.提倡农家肥与化肥综合使用
B.草木灰是一种农家肥,其主要成分中含有钾元素
C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿
D.常用作氮肥的化合物有尿素、碳酸氢铵等
5.下列各组常见的固体物质中,用水不能区分的是
A.NaOH和NH4NO3
B.CuSO4和Na2SO4
C.Na2CO3和CaCO3
D.NaCl和KCl
6.人体内几种液体的正常pH范围如下,下列说法错误的是
体液 血浆 胃液 胆汁 胰液
pH 7.35~7.45 0.9~1.5 7.1~7.3 7.5~8.0
A.血浆呈碱性 B.胃液和胆汁呈酸性
C.胰液比血浆的碱性强 D.胃酸过多的人应少饮碳酸饮料
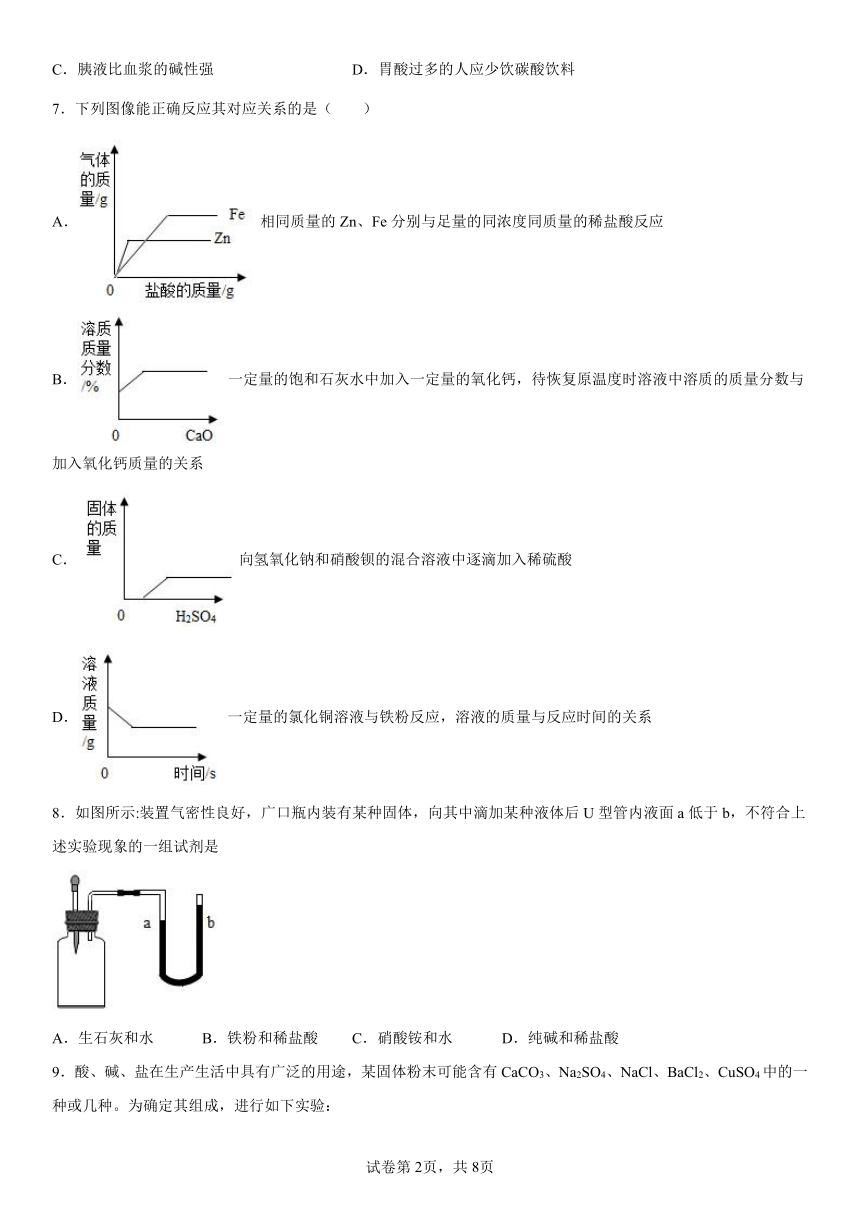
7.下列图像能正确反应其对应关系的是( )
A.相同质量的Zn、Fe分别与足量的同浓度同质量的稀盐酸反应
B.一定量的饱和石灰水中加入一定量的氧化钙,待恢复原温度时溶液中溶质的质量分数与加入氧化钙质量的关系
C.向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸
D.一定量的氯化铜溶液与铁粉反应,溶液的质量与反应时间的关系
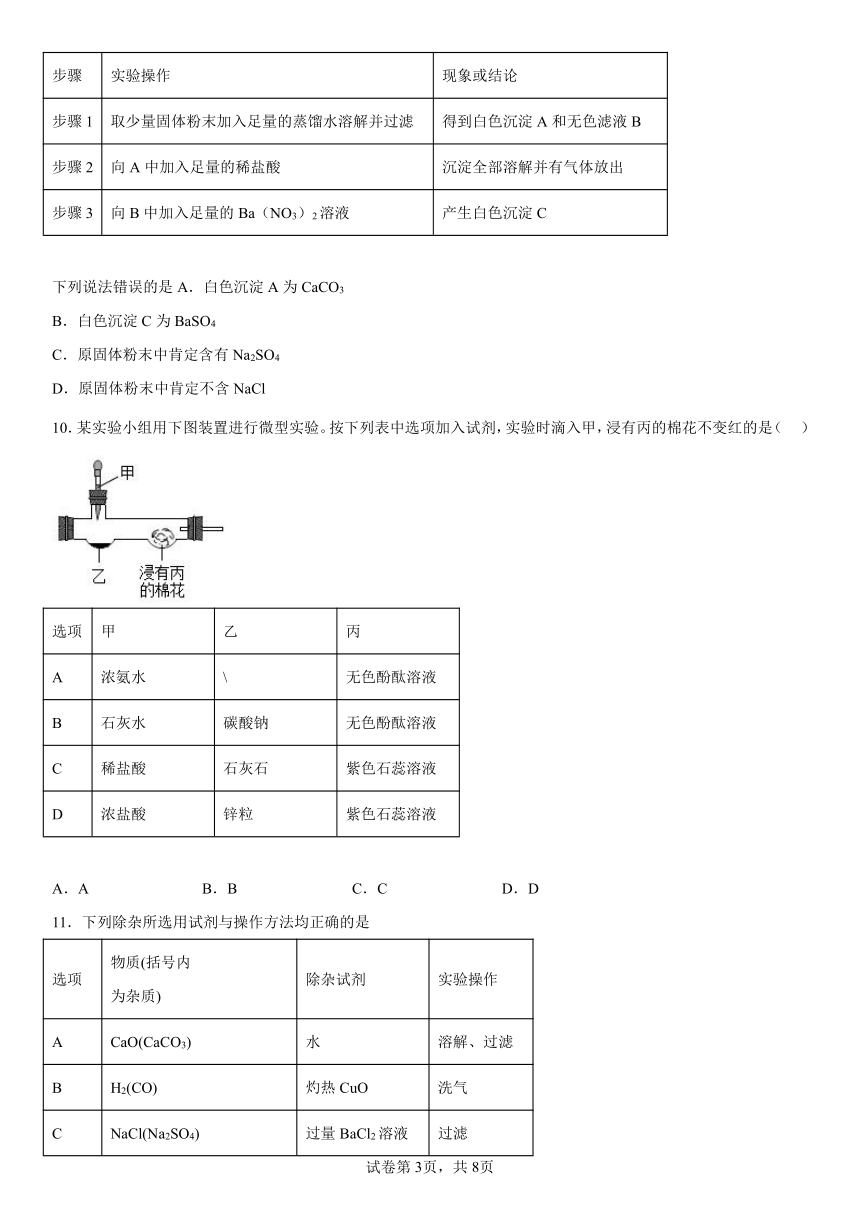
8.如图所示:装置气密性良好,广口瓶内装有某种固体,向其中滴加某种液体后U型管内液面a低于b,不符合上述实验现象的一组试剂是
A.生石灰和水 B.铁粉和稀盐酸 C.硝酸铵和水 D.纯碱和稀盐酸
9.酸、碱、盐在生产生活中具有广泛的用途,某固体粉末可能含有CaCO3、Na2SO4、NaCl、BaCl2、CuSO4中的一种或几种。为确定其组成,进行如下实验:
步骤 实验操作 现象或结论
步骤1 取少量固体粉末加入足量的蒸馏水溶解并过滤 得到白色沉淀A和无色滤液B
步骤2 向A中加入足量的稀盐酸 沉淀全部溶解并有气体放出
步骤3 向B中加入足量的Ba(NO3)2溶液 产生白色沉淀C
下列说法错误的是A.白色沉淀A为CaCO3
B.白色沉淀C为BaSO4
C.原固体粉末中肯定含有Na2SO4
D.原固体粉末中肯定不含NaCl
10.某实验小组用下图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 \ 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 锌粒 紫色石蕊溶液
A.A B.B C.C D.D
11.下列除杂所选用试剂与操作方法均正确的是
选项 物质(括号内 为杂质) 除杂试剂 实验操作
A CaO(CaCO3) 水 溶解、过滤
B H2(CO) 灼热CuO 洗气
C NaCl(Na2SO4) 过量BaCl2溶液 过滤
D NaCl(Na2CO3) 足量稀盐酸 蒸发结晶
A.A B.B C.C D.D
二、简答题
12.过滤后的滤液若出现浑浊,原因可能是什么?浑浊滤液如何处理?
13.粗盐水中含有MgCl2、CaCl2、Na2SO4杂质,某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:加入Na2CO3溶液的目的是:_____,以上方案还需完善,请说明原因并加以补充:_____,最后进行蒸发结晶时使用玻璃棒的作用是:_____。
14.小明同学学习了氢氧化钙和氢氧化钠的化学性质后知道:氢氧化钙和氢氧化钠都能与二氧化碳反应;二氧化碳通入澄清石灰水中能产生明显的现象。于是小明同学提出了一个问题_______________________________
小明同学联想到在“固体碘溶解在酒精中”的实验
时,酒精作为溶剂能溶解固体碘。酒精能否溶解氢氧化钠和碳酸钠呢?小明查阅资料并通过实验获知,氢氧化钠不与酒精发生化学反应,但能溶解在酒精中形成无色透明的溶液,氢氧化钠的酒精溶液与氢氧化钠的水溶液化学性质相似,碳酸钠不与酒精反应也不溶于酒精。至此,小明同学对自己提出的问题有了清晰的解决方案。
(1)小明同学的解决方案是__________________________________。
(2)写出解决方案中涉及的化学方程式_______________________________。
三、推断题
15.现有三种固体:铁粉、铜粉、Cu(OH)2。五种溶液:CuSO4,NaOH,FeSO4,,Na2SO4,稀硫酸。它们之间存在如下关系:
(1)A溶液+C溶液→固体甲+D溶液。
(2)固体乙+B溶液→E溶液+H2↑。
(3)固体甲+B溶液→C溶液+H2O。
试写出上述三个反应的化学方程式。
(1)_______;
(2)_______;
(3)_______。
16.A、B、C、D、E、F之间存在如图的转化关系(部分物质及反应条件已略去)、已知A是一种气体肥料;D含有人体中含量最高的金属元素,其相对分子质量为100.则C的用途为_____;E→F的化学方程式为____;图示转化关系中未涉及的基本反应类型为_____。
17.现有A~F六瓶失去标签的溶液,分别为澄清石灰水、硫酸铁溶液、碳酸钠溶液、稀盐酸、溶质质量分数为10%的氢氧化钠溶液和10%的氢氧化钾溶液。
已知硫酸钠、硫酸钾溶液呈中性。某同学进行实验如下:
(1)从外观上观察,F呈黄色,则F为_______________。
(2)从剩余的五瓶溶液中各取少量溶液两两混合,可以观察到:A+D→白色沉淀,C+D→无色气体,其余无明显现象。则这五种溶液两两混合可发生_______________个反应,C为____________,A与D反应的化学方程式为_____________________。
(3)取未鉴别出的B、E溶液各20g于两个烧杯中,分别滴加两滴酚酞溶液,再分别加入10%的稀硫酸17.5g(如图所示),并不断搅拌。观察到B溶液由红色变为无色,E溶液仍为红色。则E为__________________溶液(填化学式)。
(4)将六瓶溶液贴上标签。
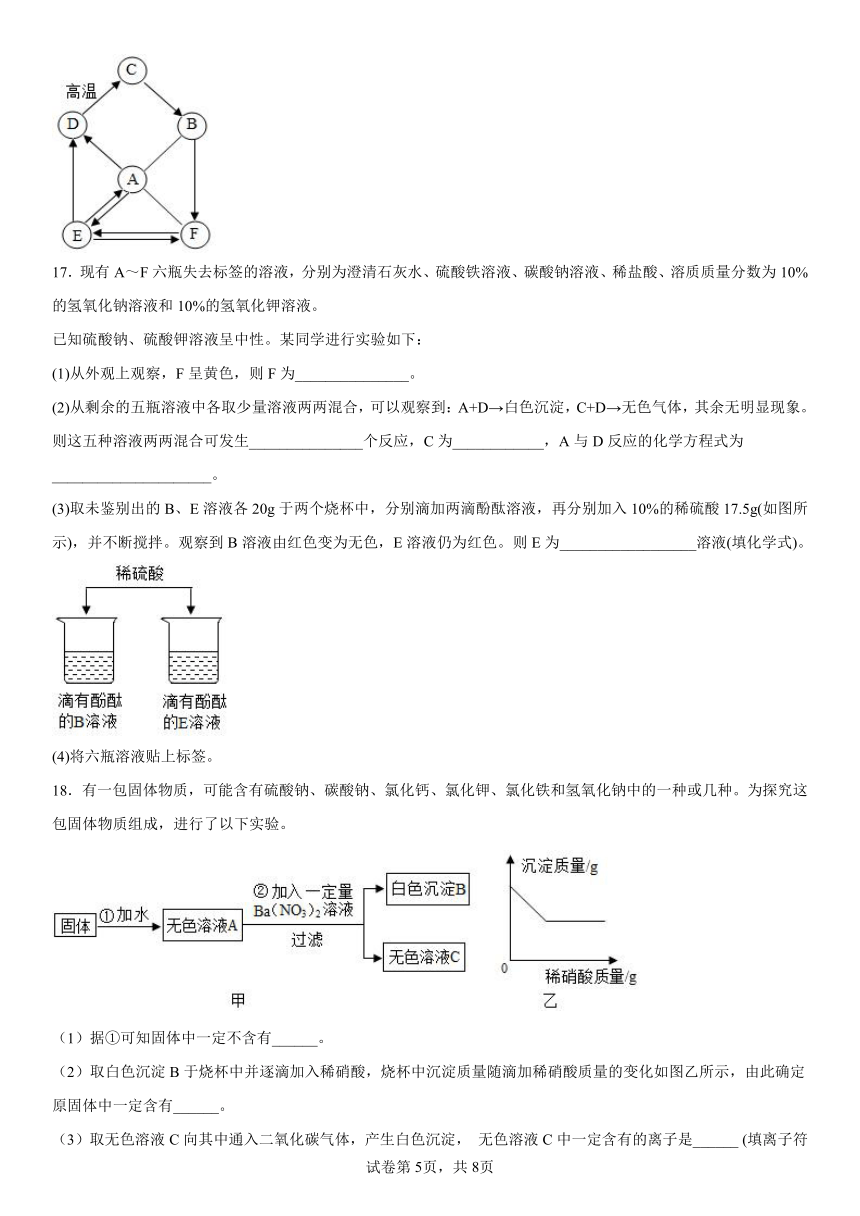
18.有一包固体物质,可能含有硫酸钠、碳酸钠、氯化钙、氯化钾、氯化铁和氢氧化钠中的一种或几种。为探究这包固体物质组成,进行了以下实验。
(1)据①可知固体中一定不含有______。
(2)取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中沉淀质量随滴加稀硝酸质量的变化如图乙所示,由此确定原固体中一定含有______。
(3)取无色溶液C向其中通入二氧化碳气体,产生白色沉淀, 无色溶液C中一定含有的离子是______ (填离子符号)。
(4)为确定原固体中可能含有的物质是否存在的实验方案是______ (写明操作、现象和结论)。
四、实验题
19.用如图所示操作进行酸碱中和反应的实验,回答问题。
(1)A是稀释浓硫酸的操作,物质甲应为_____。
(2)向E中加入一定量的稀硫酸后,得到无色溶液,说明氢氧化钠溶液与稀硫酸发生反应,该反应的化学方程式为_______ ,基本反应类型为_________。若上述现象不能说明恰好完全反应,理由是______。
20.某兴趣小组同学对CO和CO2两种常见气体进行如图探究活动。
探究I.实验室制取CO2时,大理石的形状对反应速率的影响。
实验1:取等纯度、等质量的块状和粉末状大理石,分别加入足量等浓度的稀盐酸,实验过程中生成气体的体积随时间变化的情况如图1所示。
(1)分析图中_____(选填序号)点,可得出“块状大理石与稀盐酸的反应速率较慢”的结论。
A ac B ab C be D bd
(2)e点表达的含义是_____。
探究Ⅱ,验证CO和CO2的化学性质
实验2:小组同学按照图2所示装置进行实验,实验前,K1、K2均关闭;实验开始后,打开K2,当装置C中溶液变浑浊时,立即关闭K2,打开K1,观察到装置B中溶液始终无明显变化。
(1)实验过程中观察到装置A中_____,证明CO有还原性。
(2)“装置C中溶液变浑浊”的原因是_____(用化学方程式表示);取少量反应后装置B中的溶液于试管中,加入足量稀盐酸,观察到_____。据此,小组同学得出“CO2能与碱溶液反应”的结论。
(3)装置B、C都能有效防止一氧化碳污染空气,其中装置B中可观察到气球涨大,装置C中与之相关的现象是_____。
探究Ⅲ.探究装置B中反应物是否有剩余
实验3:小红取实验2结束后装置B中的溶液少许,先向其中加入足量的BaCl2溶液,然后滴入酚酞溶液,根据观察到的现象得出“装置B中的氢氧化钠有剩余”的结论。
加入足量BaCl2溶液的作用是_____。
五、计算题
21.某化学兴趣活动小组用采集的石灰岩样品进行相关实验。将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同的稀盐酸反应,测定释放出二氧化碳的质量与反应时间的关系如图所示。
(1)由图中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越 ,其反应速率越 。
(2)求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)。
22.泡腾片配料表如下:
成分 柠檬酸 碳酸氢钠 维生素C 乳糖 色素香精
每片含量(4 g/片) 未知 未知 0.2 g 未知 极少量
泡腾片放入温开水中,浮于水面上,产生大量气泡,所得溶液喝起来酸甜可口。已知:柠檬酸的化学式为C6H8O7,相对分子质量为192;泡腾片溶于水时,碳酸氢钠刚好与柠檬酸完全反应,生成Na3C6H5O7。
(1)泡腾片在水中产生气体的化学式为_____。泡腾片中柠檬酸与碳酸氢钠的质量比为_____。
(2)称取5.00 g泡腾片放入200.00 g温开水中,待泡腾片完全溶解,不再产生气体后,测得溶液质量为203.68 g.通过计算确定泡腾片中柠檬酸的质量分数_____。
23.现有家庭食用碱样品12 g(主要成分Na2CO3,其他成分不与酸反应),向其中加入某未知浓度的盐酸,生成气体的质量与加入盐酸的质量关系如图。请计算:
(1)共生成气体二氧化碳的质量是________g。
(2)盐酸的溶质的质量分数是多少? (要求写出计算过程,结果精确到0.1)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.D
4.C
5.D
6.B
7.D
8.C
9.D
10.B
11.D
12.原因可能是滤纸破损或液面高于滤纸边缘。浑浊滤液应重新过滤。
13. 除去氯化钙和过量的氯化钡 溶液中含有过量的氢氧化钠和碳酸钠 向滤液中加入过量稀盐酸;使液体均匀受热,防止液体飞溅。
14. 二氧化碳和氢氧化钠反应能否产生明显现象 将二氧化碳气体通入到氢氧化钠的酒精溶液中 2NaOH + CO2 === Na2CO3↓ + H2O
15.
16. 作干燥剂 置换反应
17. 硫酸铁溶液 5 稀盐酸 NaOH
18. 氯化铁(或FeCl3) 碳酸钠和硫酸钠(或:Na2CO3和Na2SO4) 取适量无色溶液C于试管中,加入硝酸银溶液,再加入过量的稀硝酸,仍然有白色沉淀,证明有氯化钾。
19. 浓硫酸 复分解反应 无色酚酞溶液遇到酸或中性液体均为无色
20. B 两种形状的大理石和稀盐酸完全反应 黑色固体变红色 Ca(OH)2+CO2═CaCO3↓+H2O 产生气泡 液体压入长颈漏斗 除去碳酸钠,防止影响对氢氧化钠的检验
21.(1) 大 快 (或 小 慢) (2)75%
22.(1)CO2;16:21(2)38.4%
23.(1)4.4;(2)7.3%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.侯德榜是我国制碱工业的先驱。侯氏制碱法中的“碱”是指纯碱,其化学式为
A.Na2CO3 B.NaHCO3 C.NaOH D.NaCl
2.某花圃所种的花卉缺乏氮和钾元素,如果只施用一种化肥,则应施用的是
A.CO(NH2)2 B.K2SO4 C.Ca(H2PO4)2 D.KNO3
3.下列有关X、Y所表示的概念之间存在如图所示交叉关系的是
选项 A B C D
概念 X 金属 纯净物 盐 化合反应
Y 单质 混合物 碳酸盐 氧化反应
A.A B.B C.C D.D
4.化肥对提高农作物的产量有重要作用。下列有关化肥的说法不正确的是
A.提倡农家肥与化肥综合使用
B.草木灰是一种农家肥,其主要成分中含有钾元素
C.磷肥的主要作用是促进植物茎、叶生长茂盛,叶色浓绿
D.常用作氮肥的化合物有尿素、碳酸氢铵等
5.下列各组常见的固体物质中,用水不能区分的是
A.NaOH和NH4NO3
B.CuSO4和Na2SO4
C.Na2CO3和CaCO3
D.NaCl和KCl
6.人体内几种液体的正常pH范围如下,下列说法错误的是
体液 血浆 胃液 胆汁 胰液
pH 7.35~7.45 0.9~1.5 7.1~7.3 7.5~8.0
A.血浆呈碱性 B.胃液和胆汁呈酸性
C.胰液比血浆的碱性强 D.胃酸过多的人应少饮碳酸饮料
7.下列图像能正确反应其对应关系的是( )
A.相同质量的Zn、Fe分别与足量的同浓度同质量的稀盐酸反应
B.一定量的饱和石灰水中加入一定量的氧化钙,待恢复原温度时溶液中溶质的质量分数与加入氧化钙质量的关系
C.向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸
D.一定量的氯化铜溶液与铁粉反应,溶液的质量与反应时间的关系
8.如图所示:装置气密性良好,广口瓶内装有某种固体,向其中滴加某种液体后U型管内液面a低于b,不符合上述实验现象的一组试剂是
A.生石灰和水 B.铁粉和稀盐酸 C.硝酸铵和水 D.纯碱和稀盐酸
9.酸、碱、盐在生产生活中具有广泛的用途,某固体粉末可能含有CaCO3、Na2SO4、NaCl、BaCl2、CuSO4中的一种或几种。为确定其组成,进行如下实验:
步骤 实验操作 现象或结论
步骤1 取少量固体粉末加入足量的蒸馏水溶解并过滤 得到白色沉淀A和无色滤液B
步骤2 向A中加入足量的稀盐酸 沉淀全部溶解并有气体放出
步骤3 向B中加入足量的Ba(NO3)2溶液 产生白色沉淀C
下列说法错误的是A.白色沉淀A为CaCO3
B.白色沉淀C为BaSO4
C.原固体粉末中肯定含有Na2SO4
D.原固体粉末中肯定不含NaCl
10.某实验小组用下图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 \ 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 锌粒 紫色石蕊溶液
A.A B.B C.C D.D
11.下列除杂所选用试剂与操作方法均正确的是
选项 物质(括号内 为杂质) 除杂试剂 实验操作
A CaO(CaCO3) 水 溶解、过滤
B H2(CO) 灼热CuO 洗气
C NaCl(Na2SO4) 过量BaCl2溶液 过滤
D NaCl(Na2CO3) 足量稀盐酸 蒸发结晶
A.A B.B C.C D.D
二、简答题
12.过滤后的滤液若出现浑浊,原因可能是什么?浑浊滤液如何处理?
13.粗盐水中含有MgCl2、CaCl2、Na2SO4杂质,某同学设计了除去三种可溶性杂质的实验方案:先将固体溶解,然后向其中依次加入过量的BaCl2、NaOH、Na2CO3溶液,充分反应后过滤,蒸发结晶。请回答:加入Na2CO3溶液的目的是:_____,以上方案还需完善,请说明原因并加以补充:_____,最后进行蒸发结晶时使用玻璃棒的作用是:_____。
14.小明同学学习了氢氧化钙和氢氧化钠的化学性质后知道:氢氧化钙和氢氧化钠都能与二氧化碳反应;二氧化碳通入澄清石灰水中能产生明显的现象。于是小明同学提出了一个问题_______________________________
小明同学联想到在“固体碘溶解在酒精中”的实验
时,酒精作为溶剂能溶解固体碘。酒精能否溶解氢氧化钠和碳酸钠呢?小明查阅资料并通过实验获知,氢氧化钠不与酒精发生化学反应,但能溶解在酒精中形成无色透明的溶液,氢氧化钠的酒精溶液与氢氧化钠的水溶液化学性质相似,碳酸钠不与酒精反应也不溶于酒精。至此,小明同学对自己提出的问题有了清晰的解决方案。
(1)小明同学的解决方案是__________________________________。
(2)写出解决方案中涉及的化学方程式_______________________________。
三、推断题
15.现有三种固体:铁粉、铜粉、Cu(OH)2。五种溶液:CuSO4,NaOH,FeSO4,,Na2SO4,稀硫酸。它们之间存在如下关系:
(1)A溶液+C溶液→固体甲+D溶液。
(2)固体乙+B溶液→E溶液+H2↑。
(3)固体甲+B溶液→C溶液+H2O。
试写出上述三个反应的化学方程式。
(1)_______;
(2)_______;
(3)_______。
16.A、B、C、D、E、F之间存在如图的转化关系(部分物质及反应条件已略去)、已知A是一种气体肥料;D含有人体中含量最高的金属元素,其相对分子质量为100.则C的用途为_____;E→F的化学方程式为____;图示转化关系中未涉及的基本反应类型为_____。
17.现有A~F六瓶失去标签的溶液,分别为澄清石灰水、硫酸铁溶液、碳酸钠溶液、稀盐酸、溶质质量分数为10%的氢氧化钠溶液和10%的氢氧化钾溶液。
已知硫酸钠、硫酸钾溶液呈中性。某同学进行实验如下:
(1)从外观上观察,F呈黄色,则F为_______________。
(2)从剩余的五瓶溶液中各取少量溶液两两混合,可以观察到:A+D→白色沉淀,C+D→无色气体,其余无明显现象。则这五种溶液两两混合可发生_______________个反应,C为____________,A与D反应的化学方程式为_____________________。
(3)取未鉴别出的B、E溶液各20g于两个烧杯中,分别滴加两滴酚酞溶液,再分别加入10%的稀硫酸17.5g(如图所示),并不断搅拌。观察到B溶液由红色变为无色,E溶液仍为红色。则E为__________________溶液(填化学式)。
(4)将六瓶溶液贴上标签。
18.有一包固体物质,可能含有硫酸钠、碳酸钠、氯化钙、氯化钾、氯化铁和氢氧化钠中的一种或几种。为探究这包固体物质组成,进行了以下实验。
(1)据①可知固体中一定不含有______。
(2)取白色沉淀B于烧杯中并逐滴加入稀硝酸,烧杯中沉淀质量随滴加稀硝酸质量的变化如图乙所示,由此确定原固体中一定含有______。
(3)取无色溶液C向其中通入二氧化碳气体,产生白色沉淀, 无色溶液C中一定含有的离子是______ (填离子符号)。
(4)为确定原固体中可能含有的物质是否存在的实验方案是______ (写明操作、现象和结论)。
四、实验题
19.用如图所示操作进行酸碱中和反应的实验,回答问题。
(1)A是稀释浓硫酸的操作,物质甲应为_____。
(2)向E中加入一定量的稀硫酸后,得到无色溶液,说明氢氧化钠溶液与稀硫酸发生反应,该反应的化学方程式为_______ ,基本反应类型为_________。若上述现象不能说明恰好完全反应,理由是______。
20.某兴趣小组同学对CO和CO2两种常见气体进行如图探究活动。
探究I.实验室制取CO2时,大理石的形状对反应速率的影响。
实验1:取等纯度、等质量的块状和粉末状大理石,分别加入足量等浓度的稀盐酸,实验过程中生成气体的体积随时间变化的情况如图1所示。
(1)分析图中_____(选填序号)点,可得出“块状大理石与稀盐酸的反应速率较慢”的结论。
A ac B ab C be D bd
(2)e点表达的含义是_____。
探究Ⅱ,验证CO和CO2的化学性质
实验2:小组同学按照图2所示装置进行实验,实验前,K1、K2均关闭;实验开始后,打开K2,当装置C中溶液变浑浊时,立即关闭K2,打开K1,观察到装置B中溶液始终无明显变化。
(1)实验过程中观察到装置A中_____,证明CO有还原性。
(2)“装置C中溶液变浑浊”的原因是_____(用化学方程式表示);取少量反应后装置B中的溶液于试管中,加入足量稀盐酸,观察到_____。据此,小组同学得出“CO2能与碱溶液反应”的结论。
(3)装置B、C都能有效防止一氧化碳污染空气,其中装置B中可观察到气球涨大,装置C中与之相关的现象是_____。
探究Ⅲ.探究装置B中反应物是否有剩余
实验3:小红取实验2结束后装置B中的溶液少许,先向其中加入足量的BaCl2溶液,然后滴入酚酞溶液,根据观察到的现象得出“装置B中的氢氧化钠有剩余”的结论。
加入足量BaCl2溶液的作用是_____。
五、计算题
21.某化学兴趣活动小组用采集的石灰岩样品进行相关实验。将采集到的样品用水冲洗后晾干,称取20.00g样品平均分成两份,分别与足量相同的稀盐酸反应,测定释放出二氧化碳的质量与反应时间的关系如图所示。
(1)由图中曲线可以看出,固体物质与液体物质反应,当其他条件相同时,接触面积越 ,其反应速率越 。
(2)求样品中碳酸钙的质量分数(假设样品中其他杂质不参加反应,不考虑水、氯化氢逸出)。
22.泡腾片配料表如下:
成分 柠檬酸 碳酸氢钠 维生素C 乳糖 色素香精
每片含量(4 g/片) 未知 未知 0.2 g 未知 极少量
泡腾片放入温开水中,浮于水面上,产生大量气泡,所得溶液喝起来酸甜可口。已知:柠檬酸的化学式为C6H8O7,相对分子质量为192;泡腾片溶于水时,碳酸氢钠刚好与柠檬酸完全反应,生成Na3C6H5O7。
(1)泡腾片在水中产生气体的化学式为_____。泡腾片中柠檬酸与碳酸氢钠的质量比为_____。
(2)称取5.00 g泡腾片放入200.00 g温开水中,待泡腾片完全溶解,不再产生气体后,测得溶液质量为203.68 g.通过计算确定泡腾片中柠檬酸的质量分数_____。
23.现有家庭食用碱样品12 g(主要成分Na2CO3,其他成分不与酸反应),向其中加入某未知浓度的盐酸,生成气体的质量与加入盐酸的质量关系如图。请计算:
(1)共生成气体二氧化碳的质量是________g。
(2)盐酸的溶质的质量分数是多少? (要求写出计算过程,结果精确到0.1)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.D
4.C
5.D
6.B
7.D
8.C
9.D
10.B
11.D
12.原因可能是滤纸破损或液面高于滤纸边缘。浑浊滤液应重新过滤。
13. 除去氯化钙和过量的氯化钡 溶液中含有过量的氢氧化钠和碳酸钠 向滤液中加入过量稀盐酸;使液体均匀受热,防止液体飞溅。
14. 二氧化碳和氢氧化钠反应能否产生明显现象 将二氧化碳气体通入到氢氧化钠的酒精溶液中 2NaOH + CO2 === Na2CO3↓ + H2O
15.
16. 作干燥剂 置换反应
17. 硫酸铁溶液 5 稀盐酸 NaOH
18. 氯化铁(或FeCl3) 碳酸钠和硫酸钠(或:Na2CO3和Na2SO4) 取适量无色溶液C于试管中,加入硝酸银溶液,再加入过量的稀硝酸,仍然有白色沉淀,证明有氯化钾。
19. 浓硫酸 复分解反应 无色酚酞溶液遇到酸或中性液体均为无色
20. B 两种形状的大理石和稀盐酸完全反应 黑色固体变红色 Ca(OH)2+CO2═CaCO3↓+H2O 产生气泡 液体压入长颈漏斗 除去碳酸钠,防止影响对氢氧化钠的检验
21.(1) 大 快 (或 小 慢) (2)75%
22.(1)CO2;16:21(2)38.4%
23.(1)4.4;(2)7.3%
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
