安徽省六安市名校2021-2022学年高一下学期2月开学考试化学试题(Word版含答案)
文档属性
| 名称 | 安徽省六安市名校2021-2022学年高一下学期2月开学考试化学试题(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-17 08:50:23 | ||
图片预览


文档简介
六安市名校2021-2022学年高一下学期2月开学考试
化学试卷
满分:100分 时间:75分钟
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Cl:35.5 Al:27 Fe:56 Cu:64 S:32
一、选择题(每小题3分,共51分)
1. 下列有关试剂的保存或配制说法正确的是
A. 少量金属钠可以保存在水中 B. 漂白粉长期放置于敞口烧杯中
C. 配制硫酸亚铁溶液时,要加入少量铜粉 D. 新制氯水放在棕色试剂瓶中
2. 化学与生产、生活、环境密切相关。下列说法错误的是
A. 节日里五彩缤纷的烟花利用了焰色反应的原理
B. 制造“后母戊鼎”的青铜和举世轰动的“超级钢”均属于合金
C. “新冠抗疫”中,用于消毒的84消毒液有效成分为NaClO
D. CO2、SO2大量排放都会导致酸雨的形成
3. 我国“玉兔”号月球车用作为热源材料。关于的叙述正确的是
A. 质量数是94 B. 质子数是145
C. 中子数为239 D. 核外电子数94
4. 氯的核电荷数为17,35Cl是氯的一种核素,下列说法正确的是( )
A. 35Cl2气体摩尔质量为 70g
B. mol的1H35Cl分子所含中子数约为6.02 ×1023
C. 3.5g 35Cl2气体的体积约为1.12L
D. Na35Cl中Cl—的结构示意图:
5. 下表中物质的分类组合,完全正确的是( )
编号 A B C D
强电解质 KNO3 H2SO4 BaSO4 NaCl
弱电解质 NH3·H2O CaCO3 HC1O C2H5OH
非电解质 CO2 Al H2O CH3COOH
A A B. B C. C D. D
6. 某盐的混合物溶液中含有Na+、Mg2+、、四种离子,其中三种浓度分别为0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L ,则为
A. 0.1mol/L B. 0.2mol/L C. 0.3mol/L D. 0.4mol/L
7. 下列各组离子能在水溶液中大量共存的是( )
A. Na+、Mg2+、Cl-、OH- B. H+、Ca2+、NO、CO
C Cu2+、Na+、SO、NO D. Na+、HCO、OH-、Ca2+
8. 下列离子方程式与所述事实相符且正确的是
A. Ca(HCO3)2溶液中加入少量NaOH溶液:
B. 向含有0.4molFeI2的溶液中通入0.3molCl2充分反应:
C. Ca(OH)2溶液中通入足量的
D. 磁性氧化铁溶于稀硝酸:
9. 某溶液中含有较大量的Cl-、、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。下列实验操作的操作顺序中,正确的是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A. ①②④②③ B. ④②③②① C. ①②③②④ D. ④②①②③
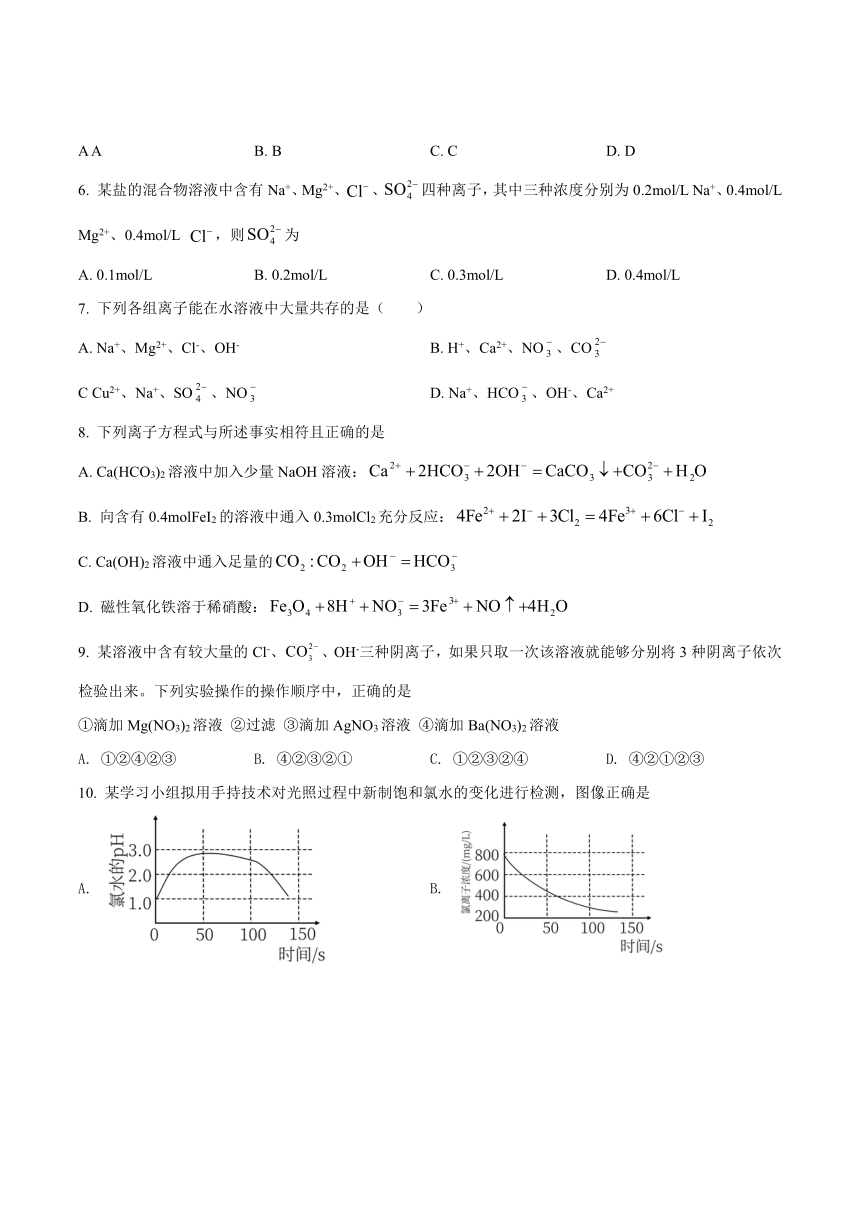
10. 某学习小组拟用手持技术对光照过程中新制饱和氯水的变化进行检测,图像正确是
A. B.
C. D.
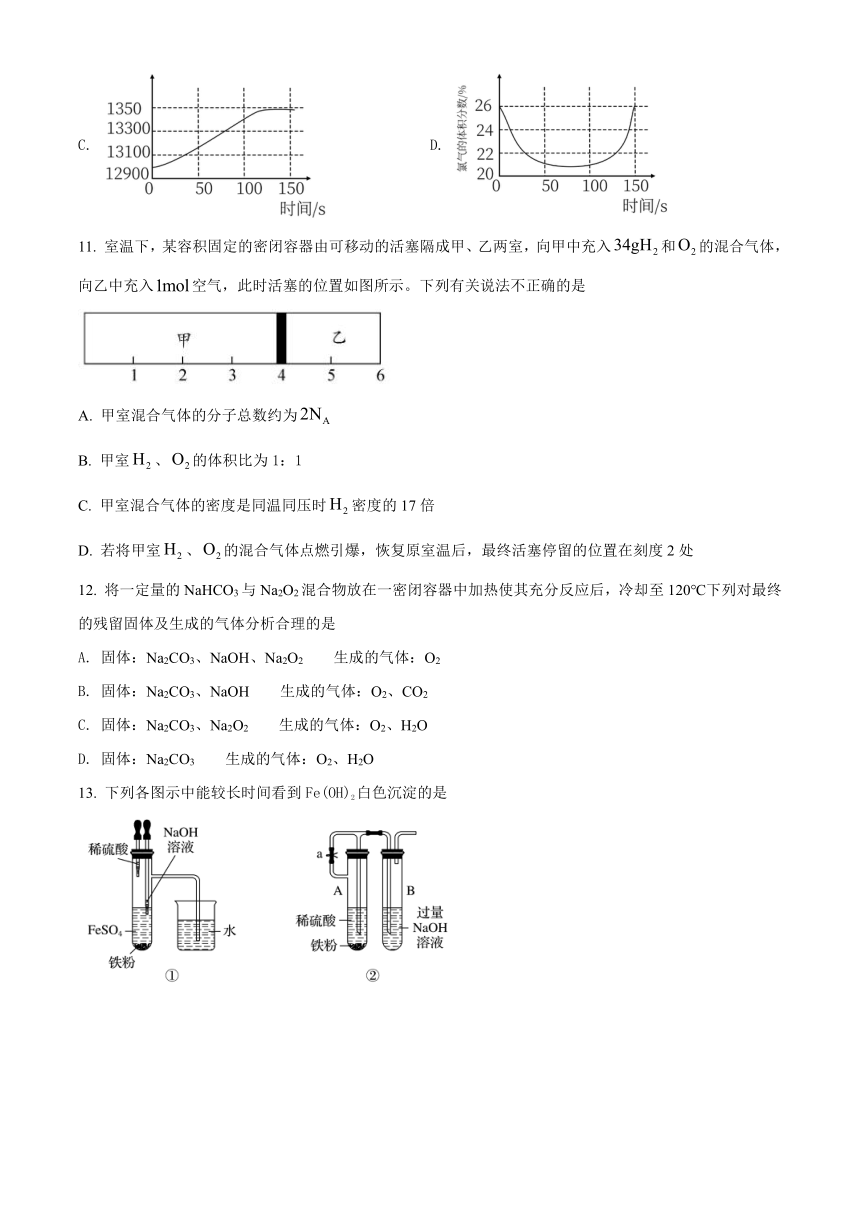
11. 室温下,某容积固定的密闭容器由可移动的活塞隔成甲、乙两室,向甲中充入和的混合气体,向乙中充入空气,此时活塞的位置如图所示。下列有关说法不正确的是
A. 甲室混合气体的分子总数约为
B. 甲室、的体积比为1:1
C. 甲室混合气体的密度是同温同压时密度的17倍
D. 若将甲室、的混合气体点燃引爆,恢复原室温后,最终活塞停留的位置在刻度2处
12. 将一定量的NaHCO3与Na2O2混合物放在一密闭容器中加热使其充分反应后,冷却至120℃下列对最终的残留固体及生成的气体分析合理的是
A. 固体:Na2CO3、NaOH、Na2O2 生成的气体:O2
B. 固体:Na2CO3、NaOH 生成的气体:O2、CO2
C. 固体:Na2CO3、Na2O2 生成的气体:O2、H2O
D. 固体:Na2CO3 生成的气体:O2、H2O
13. 下列各图示中能较长时间看到Fe(OH)2白色沉淀的是
A. ①②③ B. ①②④ C. ①②③④ D. ②③④
14. 硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收,其转化如下图所示(不溶于水)。下列说法中,不正确的是
A. 过程①中,生成的反应为
B. 过程②中,作氧化剂
C. 过程③中,各元素化合价均未改变
D. 回收S的总反应为
15. NA为阿伏加德罗常数的数值,下列说法中正确的有个
①0.5molO3与11.2LO2所含的分子数一定相等
②通常状况下,NA 个CO2分子占有的体积为22.4L
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3 NA
⑤标准状况下,4.48 L重水(D2O)中含有的中子数为2NA
⑥标准状况下,22.4 L SO3含有的分子数为NA
⑦在常温常压下,1 mol O2含有的原子数为2NA
⑧物质的量浓度为0.5 mol·L-1 MgCl2溶液中,含有Cl-个数为NA
⑨在1 mol乙烷(C2H6)与乙烯(C2H4)的混合气体中,氢原子数为5NA
A. 3 B. 4 C. 5 D. 6
16. 已知还原性顺序:I >Fe2+>Br 。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列说法正确的是
A. a=6
B. 线段Ⅲ代表Fe2+的变化情况
C. 线段Ⅱ表示Br-的变化情况
D. 原溶液中n(FeI2):n(FeBr2)=3:1
17. 从矿物学资料查得一定条件下,自然界存在硫酸铜和硫化亚铁发生如下反应:。下列说法正确的是
A. 只作还原剂,只作还原产物
B. 发生反应时有4.2mol电子转移
C. 参与反应,产物中有3mol SO是氧化产物
D. 参与反应,则被氧化的物质的量为1mol
二、填空题(共49分)
18. 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是___________。
(2)⑦的最高价氧化物的水化物的分子式为___________。
(3)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
A. 最高正化合价为+6
B. 气态氢化物比H2S稳定
C. 最高价氧化物对应水化物的酸性比硫酸弱
D. 单质在常温下可与氢气化合
(4)已知Cs元素位于元素周期表中第六周期第ⅠA族,请回答下列问题:
①铯的原子序数为___________。
②预测铯单质的还原性比钠单质的还原性___________(填“弱”或“强”)。
③下列推断正确的是___________(填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(5)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b与a可能存在的所有的关系___________。
19. 中国疾控中心指出,消毒是疫情防控的重要措施。含氯消毒剂是一种高效、安全的杀菌消毒剂。
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-的物质的量分数(a)随pH变化的关系如图所示。
由图分析,用氯气处理饮用水时,pH=6与pH=7.5两种情况下,pH=___________时杀菌效果强。
(2)84消毒液是一种家庭常用消毒剂,但不能用于钢制器具的消毒,原因是________;在使用时也不能与洁厕灵(主要成分为盐酸)混合使用,混合时会产生黄绿色的有毒气体,其反应的离子方程式为_______。
(3)ClO2是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为∶,X的化学式为_________,每生成1molClO2,反应中转移电子___________mol。
20. 硫酸亚铁晶体(FeSO4·7H2O)在医药上用作补血剂。某课外小组设计实验测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
请回答下列问题:
(1)向步骤①的滤液中滴加KSCN溶液后变为红色,检验滤液中还存在Fe2+的方法为_______(说明试剂、现象)。
(2)步骤②加入过量H2O2的目的是_______。涉及的反应离子方程式:_______。
(3)步骤③中反应的离子方程式为_______。
(4)步骤④中一系列处理的操作步骤包括过滤、_______干燥、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为_______g。
21. 为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
已知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
a.点燃酒精灯,加热b.熄灭酒精灯c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊e.关闭K1和K2f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3;假设二:只有Na2O;假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 操作和现象 结论
1 将硬质玻璃管中的固体产物溶于水后过滤; 假设一成立
2 往步骤1所得滤液中_________________________________;现象:____________________________________。
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 m2 m3
66.7g 69.0g 721g
六安市名校2021-2022学年高一下学期2月开学考试
化学试卷
满分:100分 时间:75分钟
一、选择题(每小题3分,共51分)
1-----5.D DDBA 6----10 CCCDC
11 C 12AD 13.B 14.C 15.A
16.A 17. BD
二、填空题(共49分)
18.
(1)第三周期第IVA族
(2)H2SiO3 (3)BD
(4) ①. 55 ②. 强 ③. B
(5)b=a+1或b=a+11
19.
(1)6 (2) ①. NaClO具有氧化性 ②. ClO-+Cl-+2H+=Cl2↑+H2O
(3) ①. CO2 ②. 1
20.
(1)取一定量滤液,滴加少量KMnO4酸性溶液,溶液紫色褪去
(2) ①. 将Fe2+全部氧化为Fe3+ ②.
(3)
(4) ①. 洗涤 ②. 冷却至室温
(5)0.07a
21.
①. 饱和碳酸氢钠溶液 ②. d、a、b、f 、e、c ③. 钠的焰色反应为黄色,钠与二氧化碳反应有碳单质生成 ④. 加入足量BaCl2溶液(或足量CaCl2溶液)后滴入酚酞试液(或测pH) ⑤. 有白色沉淀产生,酚酞不变红(pH=7) ⑥. 12Na+11CO2=6Na2CO3+C+4CO
化学试卷
满分:100分 时间:75分钟
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Mg:24 Cl:35.5 Al:27 Fe:56 Cu:64 S:32
一、选择题(每小题3分,共51分)
1. 下列有关试剂的保存或配制说法正确的是
A. 少量金属钠可以保存在水中 B. 漂白粉长期放置于敞口烧杯中
C. 配制硫酸亚铁溶液时,要加入少量铜粉 D. 新制氯水放在棕色试剂瓶中
2. 化学与生产、生活、环境密切相关。下列说法错误的是
A. 节日里五彩缤纷的烟花利用了焰色反应的原理
B. 制造“后母戊鼎”的青铜和举世轰动的“超级钢”均属于合金
C. “新冠抗疫”中,用于消毒的84消毒液有效成分为NaClO
D. CO2、SO2大量排放都会导致酸雨的形成
3. 我国“玉兔”号月球车用作为热源材料。关于的叙述正确的是
A. 质量数是94 B. 质子数是145
C. 中子数为239 D. 核外电子数94
4. 氯的核电荷数为17,35Cl是氯的一种核素,下列说法正确的是( )
A. 35Cl2气体摩尔质量为 70g
B. mol的1H35Cl分子所含中子数约为6.02 ×1023
C. 3.5g 35Cl2气体的体积约为1.12L
D. Na35Cl中Cl—的结构示意图:
5. 下表中物质的分类组合,完全正确的是( )
编号 A B C D
强电解质 KNO3 H2SO4 BaSO4 NaCl
弱电解质 NH3·H2O CaCO3 HC1O C2H5OH
非电解质 CO2 Al H2O CH3COOH
A A B. B C. C D. D
6. 某盐的混合物溶液中含有Na+、Mg2+、、四种离子,其中三种浓度分别为0.2mol/L Na+、0.4mol/L Mg2+、0.4mol/L ,则为
A. 0.1mol/L B. 0.2mol/L C. 0.3mol/L D. 0.4mol/L
7. 下列各组离子能在水溶液中大量共存的是( )
A. Na+、Mg2+、Cl-、OH- B. H+、Ca2+、NO、CO
C Cu2+、Na+、SO、NO D. Na+、HCO、OH-、Ca2+
8. 下列离子方程式与所述事实相符且正确的是
A. Ca(HCO3)2溶液中加入少量NaOH溶液:
B. 向含有0.4molFeI2的溶液中通入0.3molCl2充分反应:
C. Ca(OH)2溶液中通入足量的
D. 磁性氧化铁溶于稀硝酸:
9. 某溶液中含有较大量的Cl-、、OH-三种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来。下列实验操作的操作顺序中,正确的是
①滴加Mg(NO3)2溶液 ②过滤 ③滴加AgNO3溶液 ④滴加Ba(NO3)2溶液
A. ①②④②③ B. ④②③②① C. ①②③②④ D. ④②①②③
10. 某学习小组拟用手持技术对光照过程中新制饱和氯水的变化进行检测,图像正确是
A. B.
C. D.
11. 室温下,某容积固定的密闭容器由可移动的活塞隔成甲、乙两室,向甲中充入和的混合气体,向乙中充入空气,此时活塞的位置如图所示。下列有关说法不正确的是
A. 甲室混合气体的分子总数约为
B. 甲室、的体积比为1:1
C. 甲室混合气体的密度是同温同压时密度的17倍
D. 若将甲室、的混合气体点燃引爆,恢复原室温后,最终活塞停留的位置在刻度2处
12. 将一定量的NaHCO3与Na2O2混合物放在一密闭容器中加热使其充分反应后,冷却至120℃下列对最终的残留固体及生成的气体分析合理的是
A. 固体:Na2CO3、NaOH、Na2O2 生成的气体:O2
B. 固体:Na2CO3、NaOH 生成的气体:O2、CO2
C. 固体:Na2CO3、Na2O2 生成的气体:O2、H2O
D. 固体:Na2CO3 生成的气体:O2、H2O
13. 下列各图示中能较长时间看到Fe(OH)2白色沉淀的是
A. ①②③ B. ①②④ C. ①②③④ D. ②③④
14. 硫化氢的转化是资源利用和环境保护的重要研究课题。将和空气的混合气体通入、和的混合溶液中回收,其转化如下图所示(不溶于水)。下列说法中,不正确的是
A. 过程①中,生成的反应为
B. 过程②中,作氧化剂
C. 过程③中,各元素化合价均未改变
D. 回收S的总反应为
15. NA为阿伏加德罗常数的数值,下列说法中正确的有个
①0.5molO3与11.2LO2所含的分子数一定相等
②通常状况下,NA 个CO2分子占有的体积为22.4L
③常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
④常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3 NA
⑤标准状况下,4.48 L重水(D2O)中含有的中子数为2NA
⑥标准状况下,22.4 L SO3含有的分子数为NA
⑦在常温常压下,1 mol O2含有的原子数为2NA
⑧物质的量浓度为0.5 mol·L-1 MgCl2溶液中,含有Cl-个数为NA
⑨在1 mol乙烷(C2H6)与乙烯(C2H4)的混合气体中,氢原子数为5NA
A. 3 B. 4 C. 5 D. 6
16. 已知还原性顺序:I >Fe2+>Br 。向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列说法正确的是
A. a=6
B. 线段Ⅲ代表Fe2+的变化情况
C. 线段Ⅱ表示Br-的变化情况
D. 原溶液中n(FeI2):n(FeBr2)=3:1
17. 从矿物学资料查得一定条件下,自然界存在硫酸铜和硫化亚铁发生如下反应:。下列说法正确的是
A. 只作还原剂,只作还原产物
B. 发生反应时有4.2mol电子转移
C. 参与反应,产物中有3mol SO是氧化产物
D. 参与反应,则被氧化的物质的量为1mol
二、填空题(共49分)
18. 如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答问题:
(1)地壳中含量居于第二位的元素在周期表中的位置是___________。
(2)⑦的最高价氧化物的水化物的分子式为___________。
(3)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___________(填字母)。
A. 最高正化合价为+6
B. 气态氢化物比H2S稳定
C. 最高价氧化物对应水化物的酸性比硫酸弱
D. 单质在常温下可与氢气化合
(4)已知Cs元素位于元素周期表中第六周期第ⅠA族,请回答下列问题:
①铯的原子序数为___________。
②预测铯单质的还原性比钠单质的还原性___________(填“弱”或“强”)。
③下列推断正确的是___________(填字母)。
A.与铯处于同一主族的元素都是金属元素
B.铯单质发生反应时,铯原子易失去电子
C.碳酸铯是一种可溶性碱
D.铯离子的氧化性强于钾离子
(5)已知X为第IIA族元素(第一到第四周期),其原子序数为a,Y与X位于同一周期,且为第ⅢA族元素,写出Y的原子序数b与a可能存在的所有的关系___________。
19. 中国疾控中心指出,消毒是疫情防控的重要措施。含氯消毒剂是一种高效、安全的杀菌消毒剂。
(1)已知HClO的杀菌能力比ClO-强。25℃时将氯气溶于水形成氯气-氯水体系,该体系中Cl2(aq)、HClO和ClO-的物质的量分数(a)随pH变化的关系如图所示。
由图分析,用氯气处理饮用水时,pH=6与pH=7.5两种情况下,pH=___________时杀菌效果强。
(2)84消毒液是一种家庭常用消毒剂,但不能用于钢制器具的消毒,原因是________;在使用时也不能与洁厕灵(主要成分为盐酸)混合使用,混合时会产生黄绿色的有毒气体,其反应的离子方程式为_______。
(3)ClO2是国际上公认的高效、安全的杀菌消毒剂。工业制备ClO2的反应原理为∶,X的化学式为_________,每生成1molClO2,反应中转移电子___________mol。
20. 硫酸亚铁晶体(FeSO4·7H2O)在医药上用作补血剂。某课外小组设计实验测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
请回答下列问题:
(1)向步骤①的滤液中滴加KSCN溶液后变为红色,检验滤液中还存在Fe2+的方法为_______(说明试剂、现象)。
(2)步骤②加入过量H2O2的目的是_______。涉及的反应离子方程式:_______。
(3)步骤③中反应的离子方程式为_______。
(4)步骤④中一系列处理的操作步骤包括过滤、_______干燥、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为_______g。
21. 为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
已知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为mlg,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3g。
a.点燃酒精灯,加热b.熄灭酒精灯c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊e.关闭K1和K2f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3;假设二:只有Na2O;假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 操作和现象 结论
1 将硬质玻璃管中的固体产物溶于水后过滤; 假设一成立
2 往步骤1所得滤液中_________________________________;现象:____________________________________。
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 m2 m3
66.7g 69.0g 721g
六安市名校2021-2022学年高一下学期2月开学考试
化学试卷
满分:100分 时间:75分钟
一、选择题(每小题3分,共51分)
1-----5.D DDBA 6----10 CCCDC
11 C 12AD 13.B 14.C 15.A
16.A 17. BD
二、填空题(共49分)
18.
(1)第三周期第IVA族
(2)H2SiO3 (3)BD
(4) ①. 55 ②. 强 ③. B
(5)b=a+1或b=a+11
19.
(1)6 (2) ①. NaClO具有氧化性 ②. ClO-+Cl-+2H+=Cl2↑+H2O
(3) ①. CO2 ②. 1
20.
(1)取一定量滤液,滴加少量KMnO4酸性溶液,溶液紫色褪去
(2) ①. 将Fe2+全部氧化为Fe3+ ②.
(3)
(4) ①. 洗涤 ②. 冷却至室温
(5)0.07a
21.
①. 饱和碳酸氢钠溶液 ②. d、a、b、f 、e、c ③. 钠的焰色反应为黄色,钠与二氧化碳反应有碳单质生成 ④. 加入足量BaCl2溶液(或足量CaCl2溶液)后滴入酚酞试液(或测pH) ⑤. 有白色沉淀产生,酚酞不变红(pH=7) ⑥. 12Na+11CO2=6Na2CO3+C+4CO
同课章节目录
