第四单元盐、化肥基础练习-2021-2022学年九年级化学人教版(五四学制)全一册(word版有答案)
文档属性
| 名称 | 第四单元盐、化肥基础练习-2021-2022学年九年级化学人教版(五四学制)全一册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 152.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-17 10:03:24 | ||
图片预览



文档简介
第四单元盐、化肥基础练习2021-2022学年九年级化学人教版(五四学制)全一册
一、单选题
1.下列物质呈酸性的是
A.柠檬水 B.肥皂水 C.石灰水 D.浓氨水
2.给农作物施用下列一种化肥就能增加两种需要量较大的营养元素,这种化肥是
A.NH4HCO3 B.K2SO4 C.Ca3(PO4)2 D.KNO3
3.“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有
A.1种 B.2种 C.3种 D.4种
4.已知某无色溶液中大量共存的物质有KNO3、NaOH、X、BaCl2,其中X可能是
A.CuSO4
B.K2CO3
C.NaNO3
D.MgCl2
5.向10mLpH为12的溶液中加入试剂,溶液的pH肯定增大的是
A.加水 B.氢氧化钠颗粒
C.pH为4的溶液 D.稀硫酸
6.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
7.“庄稼一枝花,全靠肥当家”。下列关于农作物和化肥的说法正确的是( )
A.(NH4)2SO4属于复合肥料
B.农作物所必需的营养元素只有氮、磷和钾三种
C.磷肥能使作物根系发达,耐寒耐旱
D.铵态氮肥与熟石灰混合施用可以明显提高肥效
8.盐酸先生闯迷宫(见图),请你帮他选择行进路线(不发生化学反应)。( )
A.A B.B C.C D.D
9.物质的性质与用途密切相关。 下列做法不合理的是
A.工业上用稀盐酸除铁锈
B.农业上用熟石灰改良酸性土壤
C.碳酸钠用于玻璃、 造纸、 洗涤剂的生产
D.水壶中的水垢(主要成分是碳酸钙和氢氧化镁) 用水清洗
10.下列溶液分别能跟硫酸铜、盐酸、碳酸钠溶液反应,并产生不同现象的是( )
A.Ca(OH)2 B.AgNO3 C.H2SO4 D.NaOH
11.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的 pH 随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液中,含有的溶质是NaCl和NaOH
B.由a点到b点的pH变化过程证明酸和碱发生了中和反应
C.向图中c点所示溶液中滴加无色酚酞,溶液不变色
D.该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中
12.下列物质在溶液中组内两两之间都能互相发生化学反应的是
A.硫酸铜 氯化钙 硝酸钠 B.硫酸 碳酸钾 氢氧化钡
C.氯化钙 碳酸钠 氢氧化钾 D.盐酸 硝酸钾 氢氧化锌
二、简答题
13.制作松花蛋所用的配料主要有纯碱、生石灰、食盐、水等物质,制作时需要将它们混合并充分搅拌。回答下列问题:
(1)写出制作过程中能发生反应的两个化学方程式。
(2)制作松花蛋的工人有的说“纯碱溶液显碱性”;有的说“纯碱溶液显中性”。请你利用pH试纸测定纯碱溶液的pH,简述测定方法。
14.浓硫酸、生石灰、固体氢氧化钠溶于水时常伴随有能量的变化。
(1)将水倒进浓硫酸时会看到硫酸液滴向四周飞溅,请解释其原因。__________
(2)用化学化学方程式表示生石灰做气体干燥剂的原理。__________
(3)固体氢氧化钠溶于水后敞口放置在空气中一段时间,写出检验溶液中溶质成分的试剂。__________
15.复分解反应是化合物之间最基本的反应类型,我们常利用复分解反应原理除杂。如表是部分物质的溶解性表:
SO Cl- OH-
K+ 溶 溶 溶
Ba2+ 不 溶 溶
Mg2+ 溶 溶 不
(1)BaCl2溶液与KOH溶液能发生复分解反应吗?________(填“能”或“不能”),原因是________;
(2)从上述溶解性表中选择物质,写出两种盐溶液反应的一个化学方程式:__________________;
(3)利用复分解反应除去KCl溶液中混有的MgCl2,有关反应的化学方程式是____________。
三、推断题
16.有A,B,C,D四种化合物,A是硝酸盐,B是酸,C是碱,D是含+3价元素的氯化物,发生以下反应:
(1)A,B的溶液混合后,出现不溶于稀硝酸的白色沉淀。
(2)B,C的溶液完全反应后,得到氯化钠溶液。
(3)C,D的溶液混合后,出现红褐色沉淀。试推断A,B,C,D的化学式。
A._____;B._____;C._____;D._____。
17.有一包固体样品可能由氢氧化钠、碳酸钠、硝酸镁、硝酸钾、氯化铁中的一种或几种物质组成,为确定其组成,进行如下实验:(微溶物视为沉淀)。
步骤I:将少量样品放于烧杯中,加入足量水,充分搅拌,得到无色溶液A。
步骤Ⅱ:取步骤I所得少量溶液A,滴入几滴酚酞,溶液变红色。再滴入过量稀盐酸,产生气泡,红色逐渐褪去,得到无色溶液。
(1)分析上述实验过程,关于样品的组成,一定含有的物质是___________(写化学式):无法确认是否存在是_______________。(写名称)
(2)步骤Ⅲ:设计实验进一步确定混合物组成,再取少量A溶液,进行如下实验操作:____________。
18.化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如下表(微溶物视为可溶物):
实验 A+B A+C A+D B+C
现象 产生气体 产生沉淀 产生沉淀 产生沉淀
(1)写出溶液B、C中溶质的化学式: B是______,C是______。
(2)写出溶液A与D反应的化学方程式______。
19.某工厂排出的废水中可 能含有AgNO3、Ba(NO3)2、FeCl2、Cu(NO3)2、Na2SO4中的几种物质。某化学兴趣小组做如下实验,探究工厂废水中含有的物质并设计实验方案处理废水。
【查阅资料】①白色的Fe(OH)2沉淀在潮湿空气中迅速转化为红褐色Fe(OH)3;②Ba是金属活动性比Fe强。
(1)取少量废水,加入过量稀盐酸,产生白色沉淀,沉淀化学式为______;过滤,将滤液分成两份,一份加入稀硫酸,产生白色沉淀,反应化学方程式为___________;另一份加入过量氢氧化钠溶液,产生蓝色沉淀。该过程中与OH-反应的离子有______(写离子符号)。
(2)依据工厂排出废水中含有的物质,该化学兴趣小组设计了一个处理该废水的实验方案,流程如下:
废水中含有的物质为_____(写化学式),溶液C中的溶质为________(写化学式)。此流程中涉及________种基本反应类型。
四、实验题
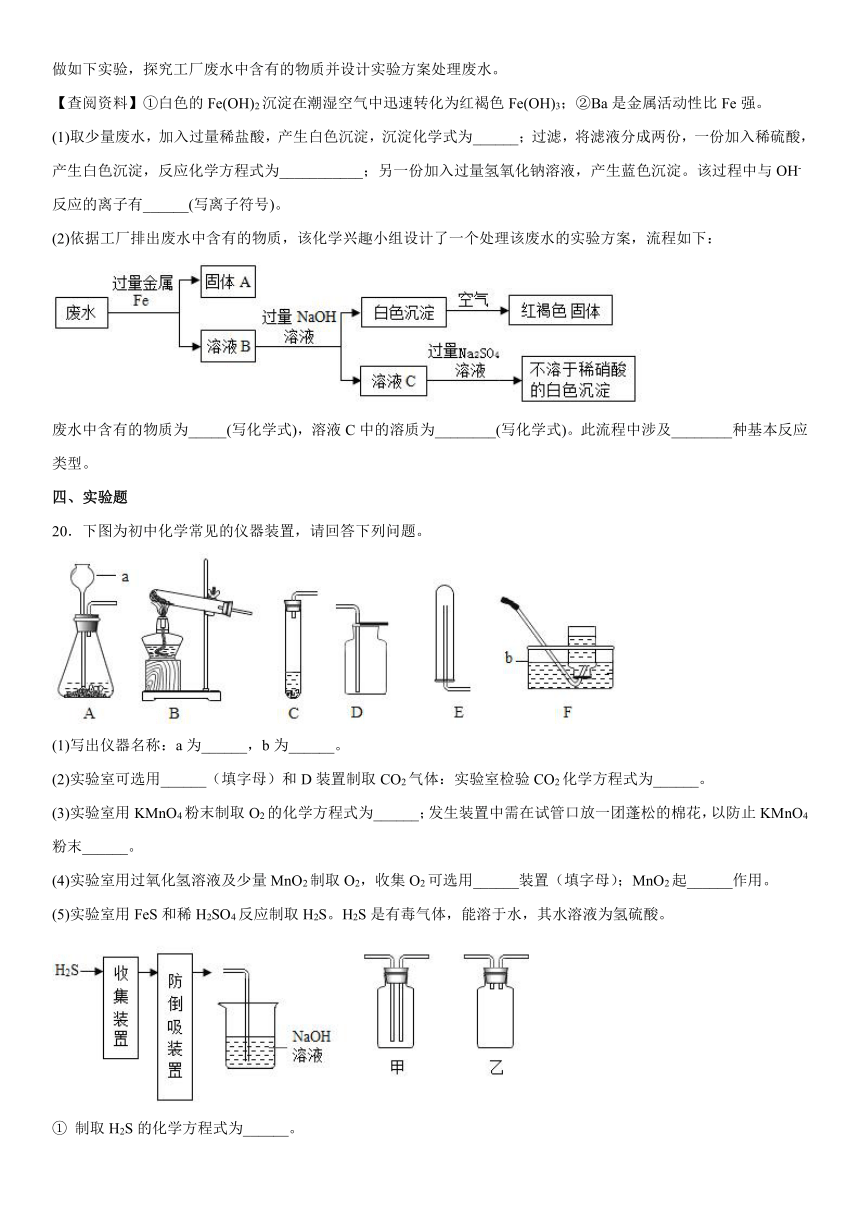
20.下图为初中化学常见的仪器装置,请回答下列问题。
(1)写出仪器名称:a为______,b为______。
(2)实验室可选用______(填字母)和D装置制取CO2气体:实验室检验CO2化学方程式为______。
(3)实验室用KMnO4粉末制取O2的化学方程式为______;发生装置中需在试管口放一团蓬松的棉花,以防止KMnO4粉末______。
(4)实验室用过氧化氢溶液及少量MnO2制取O2,收集O2可选用______装置(填字母);MnO2起______作用。
(5)实验室用FeS和稀H2SO4反应制取H2S。H2S是有毒气体,能溶于水,其水溶液为氢硫酸。
① 制取H2S的化学方程式为______。
② 图中“防倒吸装置”应选择______。(填“甲”或“乙”)
③ NaOH溶液的作用是______。化学方程式为______。
21.某化学兴趣小组利用“化学喷泉”设计了如下实验:20 ℃时,用 250 mL 圆底烧瓶收集一瓶纯净的 CO2,按下图组装装置。用注射器缓缓注入 3 mL NaOH 溶液,轻轻振荡烧瓶,打开止水夹,玻璃导管尖嘴处很快产生“喷泉”,与此同时,C、E 装置中发生连锁反应。回答下列问题:
(1)图中仪器 X 的名称是_______。
(2)注入 NaOH 溶液后,烧瓶内发生反应的化学方程式是________。
(3)“连锁反应”后,C 试管中溶液的颜色变化为_________;E 试管中的现象为_____,反应的化学方程式为________。
(4)实验结束后,同学们发现圆底烧瓶中溶液呈红色,由此认为烧瓶中一定还有 NaOH剩余,你认为是否正确?______,说明原因:_________。
五、计算题
22.某碳酸钠样品中混有少量氯化钠,根据下图所示信息,计算该样品中碳酸钠的质量分数(计算结果精确到0.1%)。
23.现有一定质量的碳酸钠和氯化钠的混合物,取11.6g该混合物样品,加入盛有118.4g氯化钙溶液的烧杯中,恰好完全反应,反应后烧杯内溶液的质量为120g。计算:
(1)生成碳酸钙的质量;
(2)原混合物中碳酸钠与氯化钠的质量比为(填最简比)
(3)反应后所得溶液中溶质的质量分数(结果精确至0.1%)。
24.为测定某CaCl2溶液的溶质质量分数,化学兴趣小组同学进行了如下实验,请计算:
(1)反应生成沉淀的质量为 g。
(2)该CaCl2溶液的溶质质量分数。
试卷第1页,共3页
参考答案:
1.A
2.D
3.B
4.C
5.B
6.B
7.C
8.B
9.D
10.A
11.B
12.B
13.(7分)
(1)CaO + H2O ==Ca(OH)2(2分)
Na2CO3 +Ca(OH)2==CaCO3↓+ 2NaOH (2分)
(2)答:在白瓷板(或玻璃片)上放一小片pH试纸(1分),(用玻璃棒或胶头滴管)将纯碱溶液滴到试纸上(1分),把试纸显示的颜色与标准比色卡比较,即可得出纯碱溶液的pH(1分)。
14. 水的密度较小,浮在浓硫酸上面,浓硫酸溶解时放出的热使水沸腾 CaCl2和酚酞溶液(合理即可)
15. 不能 没有沉淀、气体或水生成 BaCl2+MgSO4===BaSO4↓+MgCl2 MgCl2+2KOH===Mg(OH)2↓+2KCl
16. AgNO3 HCl NaOH FeCl3
17. Na2CO3 硝酸钾 在A中加入过量的可溶性钡盐或钙盐,振荡,静置,在上层清液中滴入几滴酚酞(或石蕊)试液,若上层淸液变红(或变蓝)则有氢氧化钠,无此现象则无氢氧化钠
18. H2SO4 BaCl2
19. AgCl H2SO4+Ba(NO3)2=BaSO4↓+2HNO3 Cu2+、H+ AgNO3、Ba(NO3)2和Cu(NO3)2 NaNO3、NaOH和Ba(NO3)2 略
20.(1) 长颈漏斗 水槽
(2) A C
(3) 进入导管
(4) D F 催化
(5) 乙 吸收尾气
21. 锥形瓶 红色变浅或褪去 出现蓝色絮状沉淀 不正确 生成碳酸钠的水溶液也呈碱性,也可使酚酞变红
22.70.7%
23.解:生成碳酸钙的质量
设混合物中碳酸钠质量为 x,生成氯化钠质量为 y
混合物中碳酸钠与氯化钠的质量比为:
反应后溶液溶质的质量分数为:
答:(1)生成碳酸钙的10g;
(2)原混合物中碳酸钠与氯化钠的质量比为53:5
(3)反应后所得溶液中溶质的质量分数为10.6%
24.(1)5(2)11. 1%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质呈酸性的是
A.柠檬水 B.肥皂水 C.石灰水 D.浓氨水
2.给农作物施用下列一种化肥就能增加两种需要量较大的营养元素,这种化肥是
A.NH4HCO3 B.K2SO4 C.Ca3(PO4)2 D.KNO3
3.“苛性钠、烧碱、纯碱、火碱”四种俗称中所代表的物质只有
A.1种 B.2种 C.3种 D.4种
4.已知某无色溶液中大量共存的物质有KNO3、NaOH、X、BaCl2,其中X可能是
A.CuSO4
B.K2CO3
C.NaNO3
D.MgCl2
5.向10mLpH为12的溶液中加入试剂,溶液的pH肯定增大的是
A.加水 B.氢氧化钠颗粒
C.pH为4的溶液 D.稀硫酸
6.饮食过量,胃酸会大量分泌,以致消化不良。为缓减该症状,下列药剂不适宜的是
A.氢氧化铝 B.氯化钠 C.碳酸镁 D.碳酸氢钠
7.“庄稼一枝花,全靠肥当家”。下列关于农作物和化肥的说法正确的是( )
A.(NH4)2SO4属于复合肥料
B.农作物所必需的营养元素只有氮、磷和钾三种
C.磷肥能使作物根系发达,耐寒耐旱
D.铵态氮肥与熟石灰混合施用可以明显提高肥效
8.盐酸先生闯迷宫(见图),请你帮他选择行进路线(不发生化学反应)。( )
A.A B.B C.C D.D
9.物质的性质与用途密切相关。 下列做法不合理的是
A.工业上用稀盐酸除铁锈
B.农业上用熟石灰改良酸性土壤
C.碳酸钠用于玻璃、 造纸、 洗涤剂的生产
D.水壶中的水垢(主要成分是碳酸钙和氢氧化镁) 用水清洗
10.下列溶液分别能跟硫酸铜、盐酸、碳酸钠溶液反应,并产生不同现象的是( )
A.Ca(OH)2 B.AgNO3 C.H2SO4 D.NaOH
11.某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的 pH 随滴加液体体积变化的曲线如图所示。下列说法正确的是( )
A.图中a点所示溶液中,含有的溶质是NaCl和NaOH
B.由a点到b点的pH变化过程证明酸和碱发生了中和反应
C.向图中c点所示溶液中滴加无色酚酞,溶液不变色
D.该实验是将盐酸逐滴滴入到盛有氢氧化钠溶液的烧杯中
12.下列物质在溶液中组内两两之间都能互相发生化学反应的是
A.硫酸铜 氯化钙 硝酸钠 B.硫酸 碳酸钾 氢氧化钡
C.氯化钙 碳酸钠 氢氧化钾 D.盐酸 硝酸钾 氢氧化锌
二、简答题
13.制作松花蛋所用的配料主要有纯碱、生石灰、食盐、水等物质,制作时需要将它们混合并充分搅拌。回答下列问题:
(1)写出制作过程中能发生反应的两个化学方程式。
(2)制作松花蛋的工人有的说“纯碱溶液显碱性”;有的说“纯碱溶液显中性”。请你利用pH试纸测定纯碱溶液的pH,简述测定方法。
14.浓硫酸、生石灰、固体氢氧化钠溶于水时常伴随有能量的变化。
(1)将水倒进浓硫酸时会看到硫酸液滴向四周飞溅,请解释其原因。__________
(2)用化学化学方程式表示生石灰做气体干燥剂的原理。__________
(3)固体氢氧化钠溶于水后敞口放置在空气中一段时间,写出检验溶液中溶质成分的试剂。__________
15.复分解反应是化合物之间最基本的反应类型,我们常利用复分解反应原理除杂。如表是部分物质的溶解性表:
SO Cl- OH-
K+ 溶 溶 溶
Ba2+ 不 溶 溶
Mg2+ 溶 溶 不
(1)BaCl2溶液与KOH溶液能发生复分解反应吗?________(填“能”或“不能”),原因是________;
(2)从上述溶解性表中选择物质,写出两种盐溶液反应的一个化学方程式:__________________;
(3)利用复分解反应除去KCl溶液中混有的MgCl2,有关反应的化学方程式是____________。
三、推断题
16.有A,B,C,D四种化合物,A是硝酸盐,B是酸,C是碱,D是含+3价元素的氯化物,发生以下反应:
(1)A,B的溶液混合后,出现不溶于稀硝酸的白色沉淀。
(2)B,C的溶液完全反应后,得到氯化钠溶液。
(3)C,D的溶液混合后,出现红褐色沉淀。试推断A,B,C,D的化学式。
A._____;B._____;C._____;D._____。
17.有一包固体样品可能由氢氧化钠、碳酸钠、硝酸镁、硝酸钾、氯化铁中的一种或几种物质组成,为确定其组成,进行如下实验:(微溶物视为沉淀)。
步骤I:将少量样品放于烧杯中,加入足量水,充分搅拌,得到无色溶液A。
步骤Ⅱ:取步骤I所得少量溶液A,滴入几滴酚酞,溶液变红色。再滴入过量稀盐酸,产生气泡,红色逐渐褪去,得到无色溶液。
(1)分析上述实验过程,关于样品的组成,一定含有的物质是___________(写化学式):无法确认是否存在是_______________。(写名称)
(2)步骤Ⅲ:设计实验进一步确定混合物组成,再取少量A溶液,进行如下实验操作:____________。
18.化学实验室有失去标签的稀硫酸、氢氧化钠、氢氧化钙、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如下表(微溶物视为可溶物):
实验 A+B A+C A+D B+C
现象 产生气体 产生沉淀 产生沉淀 产生沉淀
(1)写出溶液B、C中溶质的化学式: B是______,C是______。
(2)写出溶液A与D反应的化学方程式______。
19.某工厂排出的废水中可 能含有AgNO3、Ba(NO3)2、FeCl2、Cu(NO3)2、Na2SO4中的几种物质。某化学兴趣小组做如下实验,探究工厂废水中含有的物质并设计实验方案处理废水。
【查阅资料】①白色的Fe(OH)2沉淀在潮湿空气中迅速转化为红褐色Fe(OH)3;②Ba是金属活动性比Fe强。
(1)取少量废水,加入过量稀盐酸,产生白色沉淀,沉淀化学式为______;过滤,将滤液分成两份,一份加入稀硫酸,产生白色沉淀,反应化学方程式为___________;另一份加入过量氢氧化钠溶液,产生蓝色沉淀。该过程中与OH-反应的离子有______(写离子符号)。
(2)依据工厂排出废水中含有的物质,该化学兴趣小组设计了一个处理该废水的实验方案,流程如下:
废水中含有的物质为_____(写化学式),溶液C中的溶质为________(写化学式)。此流程中涉及________种基本反应类型。
四、实验题
20.下图为初中化学常见的仪器装置,请回答下列问题。
(1)写出仪器名称:a为______,b为______。
(2)实验室可选用______(填字母)和D装置制取CO2气体:实验室检验CO2化学方程式为______。
(3)实验室用KMnO4粉末制取O2的化学方程式为______;发生装置中需在试管口放一团蓬松的棉花,以防止KMnO4粉末______。
(4)实验室用过氧化氢溶液及少量MnO2制取O2,收集O2可选用______装置(填字母);MnO2起______作用。
(5)实验室用FeS和稀H2SO4反应制取H2S。H2S是有毒气体,能溶于水,其水溶液为氢硫酸。
① 制取H2S的化学方程式为______。
② 图中“防倒吸装置”应选择______。(填“甲”或“乙”)
③ NaOH溶液的作用是______。化学方程式为______。
21.某化学兴趣小组利用“化学喷泉”设计了如下实验:20 ℃时,用 250 mL 圆底烧瓶收集一瓶纯净的 CO2,按下图组装装置。用注射器缓缓注入 3 mL NaOH 溶液,轻轻振荡烧瓶,打开止水夹,玻璃导管尖嘴处很快产生“喷泉”,与此同时,C、E 装置中发生连锁反应。回答下列问题:
(1)图中仪器 X 的名称是_______。
(2)注入 NaOH 溶液后,烧瓶内发生反应的化学方程式是________。
(3)“连锁反应”后,C 试管中溶液的颜色变化为_________;E 试管中的现象为_____,反应的化学方程式为________。
(4)实验结束后,同学们发现圆底烧瓶中溶液呈红色,由此认为烧瓶中一定还有 NaOH剩余,你认为是否正确?______,说明原因:_________。
五、计算题
22.某碳酸钠样品中混有少量氯化钠,根据下图所示信息,计算该样品中碳酸钠的质量分数(计算结果精确到0.1%)。
23.现有一定质量的碳酸钠和氯化钠的混合物,取11.6g该混合物样品,加入盛有118.4g氯化钙溶液的烧杯中,恰好完全反应,反应后烧杯内溶液的质量为120g。计算:
(1)生成碳酸钙的质量;
(2)原混合物中碳酸钠与氯化钠的质量比为(填最简比)
(3)反应后所得溶液中溶质的质量分数(结果精确至0.1%)。
24.为测定某CaCl2溶液的溶质质量分数,化学兴趣小组同学进行了如下实验,请计算:
(1)反应生成沉淀的质量为 g。
(2)该CaCl2溶液的溶质质量分数。
试卷第1页,共3页
参考答案:
1.A
2.D
3.B
4.C
5.B
6.B
7.C
8.B
9.D
10.A
11.B
12.B
13.(7分)
(1)CaO + H2O ==Ca(OH)2(2分)
Na2CO3 +Ca(OH)2==CaCO3↓+ 2NaOH (2分)
(2)答:在白瓷板(或玻璃片)上放一小片pH试纸(1分),(用玻璃棒或胶头滴管)将纯碱溶液滴到试纸上(1分),把试纸显示的颜色与标准比色卡比较,即可得出纯碱溶液的pH(1分)。
14. 水的密度较小,浮在浓硫酸上面,浓硫酸溶解时放出的热使水沸腾 CaCl2和酚酞溶液(合理即可)
15. 不能 没有沉淀、气体或水生成 BaCl2+MgSO4===BaSO4↓+MgCl2 MgCl2+2KOH===Mg(OH)2↓+2KCl
16. AgNO3 HCl NaOH FeCl3
17. Na2CO3 硝酸钾 在A中加入过量的可溶性钡盐或钙盐,振荡,静置,在上层清液中滴入几滴酚酞(或石蕊)试液,若上层淸液变红(或变蓝)则有氢氧化钠,无此现象则无氢氧化钠
18. H2SO4 BaCl2
19. AgCl H2SO4+Ba(NO3)2=BaSO4↓+2HNO3 Cu2+、H+ AgNO3、Ba(NO3)2和Cu(NO3)2 NaNO3、NaOH和Ba(NO3)2 略
20.(1) 长颈漏斗 水槽
(2) A C
(3) 进入导管
(4) D F 催化
(5) 乙 吸收尾气
21. 锥形瓶 红色变浅或褪去 出现蓝色絮状沉淀 不正确 生成碳酸钠的水溶液也呈碱性,也可使酚酞变红
22.70.7%
23.解:生成碳酸钙的质量
设混合物中碳酸钠质量为 x,生成氯化钠质量为 y
混合物中碳酸钠与氯化钠的质量比为:
反应后溶液溶质的质量分数为:
答:(1)生成碳酸钙的10g;
(2)原混合物中碳酸钠与氯化钠的质量比为53:5
(3)反应后所得溶液中溶质的质量分数为10.6%
24.(1)5(2)11. 1%
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一单元 金属和金属材料
- 课题1 金属材料
- 课题2 金属的化学性质
- 课题3 金属资源的利用和保护
- 实验活动1 金属的物理性质和某些化学性质
- 第二单元 溶液
- 课题1 溶液的形成
- 课题2 溶解度
- 课题3 溶液的浓度
- 实验活动2 一定溶质质量分数的氯化钠溶液的配制
- 第三单元 酸和碱
- 课题1 常见的酸和碱
- 课题2 酸和碱的中和反应
- 实验活动3 酸、碱的化学性质
- 实验活动4 溶液酸碱性的检验
- 第四单元 盐 化肥
- 课题1 生活中常见的盐
- 课题2 化学肥料
- 实验活动5 粗盐中难溶性杂志的去除
- 第五单元 化学与生活
- 课题1 人类重要的营养物质
- 课题2 化学元素与人体健康
- 课题3 有机合成材料
- 旧版目录
- 课题3 溶质的质量分数
- 课题2 酸和碱之间会发生什么反应
