第八章常见的酸、碱、盐单元巩固-2021-2022学年九年级化学科粤版(2012)下册(word版 含答案)
文档属性
| 名称 | 第八章常见的酸、碱、盐单元巩固-2021-2022学年九年级化学科粤版(2012)下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 204.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-17 10:54:13 | ||
图片预览




文档简介
第八章常见的酸、碱、盐 单元巩固2021-2022学年九年级化学科粤版(2012)下册
一、单选题
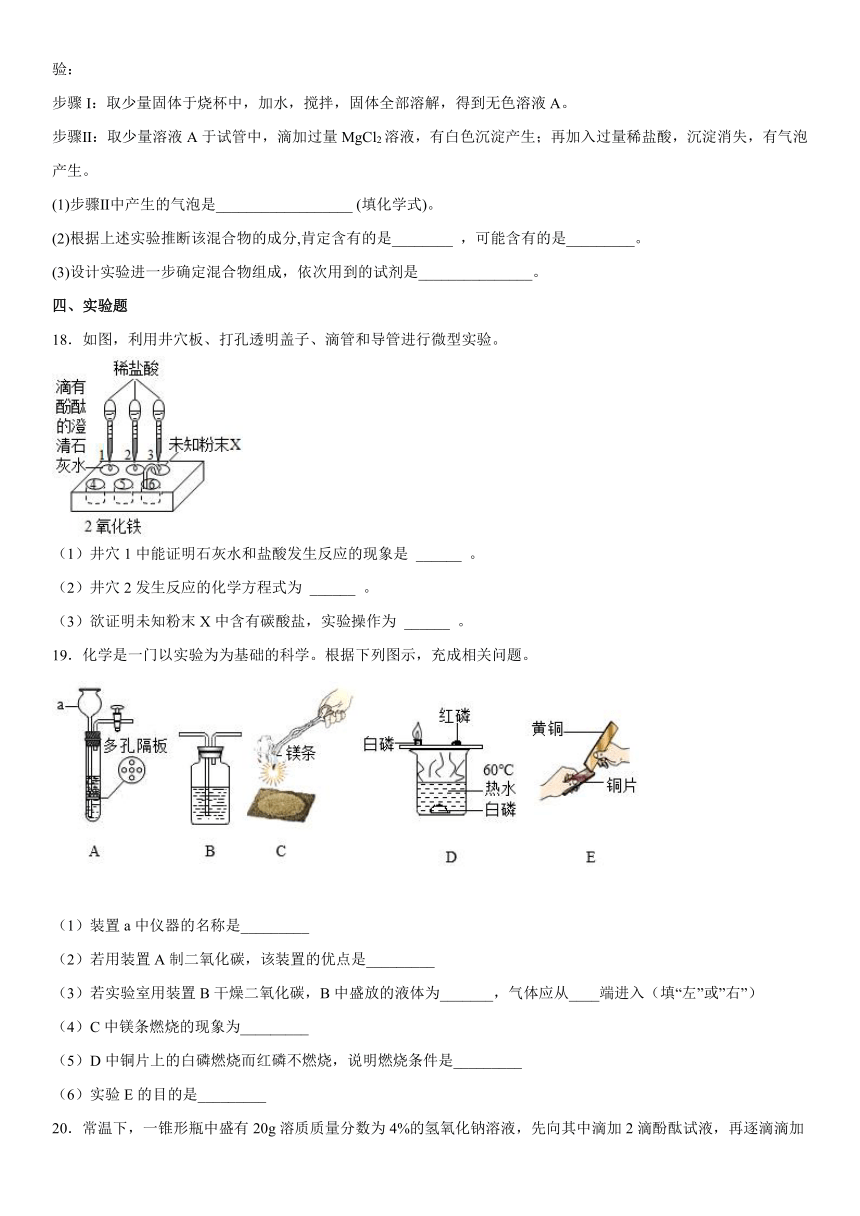
1.新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是( )
A.柠檬汁 B.苹果汁
C.西瓜汁 D.玉米汁
2.新鲜魔芋在去皮时出现的白色汁液内含有一种碱性物质——皂角甙,皮肤沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是
A.料酒 B.食醋 C.纯碱溶液 D.食盐水
3.下列物质露置于空气中,因发生化学变化而使质量增加的是
A.浓硫酸 B.烧碱溶液 C.浓盐酸 D.双氧水溶液
4.下列各项所采取的方法正确的是
A.用闻气味的方法鉴别水、氨水和酒精 B.用带火星的木条鉴别氮气、空气、氧气
C.用点燃的方法除去CO2中混有的CO D.除去食盐中的蔗糖:加水溶解,然后过滤
5.下列实验操作不正确的是
A.用托盘天平称取2.3克氯化钠 B.用10mL的量筒量取8mL的水
C.用50mL的烧杯盛放大约15mL的水 D.用石蕊测定某溶液的pH值
6.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水
B.有沉淀生成
C.有气体生成
D.有盐生成
7.下图是某反应前后的微观示意图,“”和“”表示两种不同元素的原子。下列有关说法正确的是
A.该反应没有单质生成
B.该反应属于复分解反应
C.该反应中,原子个数发生了改变
D.参加反应的两种分子(和)的个数比为1:1
8.我国制碱工业的先驱——侯德榜先生,1921年留美回国后,潜心研究制碱技术,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法),为纯碱和氮肥工业技术的发展做出了杰出贡献。下列物质中能与纯碱发生反应的是
A.NaOH B.NaHCO3 C.H2SO4 D.K2SO4
9.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是
A.HNO3和FeCl3 B.NaOH和HCl
C.BaCl2和Na2SO4 D.KOH和CuSO4
10.室温时,将氢氧化钠溶液与盐酸用滴加方式反应时,溶液的pH随滴入溶液体积变化如右下图所示。下列有关说法不正确的是
A.该图像表示的是将氢氧化钠溶液滴入盐酸中
B.氢氧化钠溶液和盐酸恰好完全反应时。溶液的pH等于7
C.当滴入溶液的体积为5mL时,所得溶液中的溶质只有NaCl
D.滴入溶液体积为15mL时,再加几滴紫色石蕊试液溶液呈蓝色
11.化肥对提高农作物的产量具有重要作用。某同学设计了如图实验对几种化肥进行简易鉴别:
取少量固体分别进行实验,如表方案中不合理的是( )
选项 实验① 实验②
A 观察固体颜色 与熟石灰粉末混合研磨
B 观察固体颜色 加入Ba(NO3)2溶液中
C 加入足量水中 加入AgNO3溶液中
D 加入足量水中 加入Ba(OH)2溶液中
A.A B.B C.C D.D
12.能在同一溶液中大量共存,且溶液为无色透明的一组物质是
A.FeCl2、CuSO4、NaCl B.BaCl2、K2SO4、NaOH
C.CaCl2、K2SO3、AgNO3 D.Na2SO4、KNO3、NH4Cl
二、简答题
13.请用化学方程式解释下列问题。
(1)正常雨水的pH约为5.6;_______
(2)将氧化铜粉末置于试管中加热、通入氨气,生成铜、水和一种气体单质。______
14.化学实验是进行科学探究的重要手段。请填写下列空格:用图B所示的装置探究酸碱中和反应。将稀盐酸滴入氢氧化钠溶液(滴有酚酞溶液)中至过量,观察到的现象是_______________。从微观角度分析,中和反应的实质是___________________________。
请另外写出一个符合上述反应实质的化学方程式_______________________。
15.某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2)。该小组同学进行如下探究。
探究一:该气体的成分。
【猜想与假设】小华说:该气体可能是CO2、O2、CO、H2、N2。
小明说:不可能含有N2,因为_________________________。
小芳说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO_____________________________。
该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
【进行实验】
实验编号 实验操作 实验现象
① 将气体通入澄清的石灰水中 澄清石灰水变浑浊
② 将带火星的木条伸入该气体中 带火星的木条没有复燃
【得出结论】(1)由实验①可知,该气体中肯定含有_________,写出该反应的化学方程式________________。
(2)由实验②____________(填“能”或“不能”)确定该气体中不含氧气,理由是______________________。
探究二:维C泡腾片溶液的酸碱性。
向维C泡腾片溶液中滴加石蕊试液,溶液变红,说明溶液显_________性。
三、推断题
16.A、B、C、D、E都是初中化学常见的物质。B、D、E均为氧化物,常温下B为固态,D为液态,E为气态;A、B、C中均含有同一种金属元素。它们之间的转化关系如图所示(部分生成物略去)。
写出下列物质的名称:
A_______
E________
17.某固体混合物可能含有CuSO4、CaCO3、Na2CO3、KOH的一 种或两种,为了确定该混合物的成分,进行如下实验:
步骤I:取少量固体于烧杯中,加水,搅拌,固体全部溶解,得到无色溶液A。
步骤Ⅱ:取少量溶液A于试管中,滴加过量MgCl2溶液,有白色沉淀产生;再加入过量稀盐酸,沉淀消失,有气泡产生。
(1)步骤Ⅱ中产生的气泡是__________________ (填化学式)。
(2)根据上述实验推断该混合物的成分,肯定含有的是________ ,可能含有的是_________。
(3)设计实验进一步确定混合物组成,依次用到的试剂是_______________。
四、实验题
18.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
19.化学是一门以实验为为基础的科学。根据下列图示,充成相关问题。
(1)装置a中仪器的名称是_________
(2)若用装置A制二氧化碳,该装置的优点是_________
(3)若实验室用装置B干燥二氧化碳,B中盛放的液体为_______,气体应从____端进入(填“左”或”右”)
(4)C中镁条燃烧的现象为_________
(5)D中铜片上的白磷燃烧而红磷不燃烧,说明燃烧条件是_________
(6)实验E的目的是_________
20.常温下,一锥形瓶中盛有20g溶质质量分数为4%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加溶质质量分数为6.3%的稀硝酸,用pH传感器测得溶液的pH与加入稀硝酸的关系曲线如图。请回答问题:
(1)本实验反应的化学方程式是____。
(2)pH=7时,锥形瓶中的溶液呈____色,此时溶液的溶质质量分数是____(结果精确到0.01%)。
(3)图中a点对应的溶液中溶质的化学式是____。
(4)若改用溶质质量分数为12.6%的稀硝酸进行本实验,pH传感器测得的曲线可能经过____(填“甲”“乙”或“丙”)点。
五、计算题
21.取100g一定质量分数的Ba(OH)2溶液于烧杯中,逐渐加入质量分数为20%的H2SO4溶液.实验过程中,溶液的pH与加入H2SO4溶液的质量关系如图所示。请计算Ba(OH)2溶液中溶质的质量分数。( 反应的方程式为:Ba(OH)2 + H2SO4 = BaSO4↓+ 2H2O)
22.洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分的含量进行探究。他向一个锥形瓶中加入100 g该品牌的洁厕灵,再加入120 g溶质质量分数为7% 的NaHCO3溶液,二者恰好完全反应。(洁厕灵有效成分是HCl,洁厕灵中其他成分均不与NaHCO3反应。)
请计算:该品牌洁厕灵中HCl的质量分数是多少?
23.某造纸厂排放含NaOH的废水200吨,恰好需要含溶质4.9吨的硫酸溶液中和处理,求该废水中NaOH的溶质质量分数。
24.在牙膏和一些药品中,常用颗粒直径极小的轻质碳酸钙粉末(轻钙)作填充剂或摩擦剂。制取轻质碳酸钙粉末可用下列方法:
(1)操作1的名称是______;操作1中发生的反应方程式______;该反应的基本反应类型是______。
(2)用含碳酸钙40t的石灰石,理论上能制得二氧化碳的质量是多少?
试卷第1页,共3页
参考答案:
1.D
2.B
3.B
4.A
5.D
6.D
7.A
8.C
9.B
10.C
11.C
12.D
13. H2O+CO2═H2CO3 CuO+2NH33Cu+3H2O+N2
14. 溶液由红色逐渐变为无色 H+与OH-结合生成H2O H2SO4+2KOH===K2SO4+2H2O(合理即可)
15. 根据质量守恒定律(或化学反应前后元素种类不变),反应物中不含氮元素 有毒 二氧化碳 Ca(OH)2+CO2=CaCO3↓+H2O 不能 若生成氧气和二氧化碳的混合物,当氧气含量过少时,带火星的木条也不能复燃 酸
16. 碳酸钙 二氧化碳
17. CO2 碳酸钠 氢氧化钾 过量氯化钡(氯化钙/硝酸钡/硝酸钙)溶液,酚酞溶液
18. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
19. 长颈漏斗 可以控制反应的发生和停止 浓硫酸 左 发出耀眼的白光,放出大量的热,生成一种白色固体 需要达到可燃物着火点 比较合金的硬度和组成它的纯金属硬度的大小
20. NaOH+HNO3=NaNO3+H2O 无 4.25% HNO3、NaNO3 甲
21.6.48%
22.解:设HCl的质量分数是x
答:该品牌洁厕灵中HCl的质量分数是3.65%。
23.解:设该废水中NaOH的溶质质量分数为x
x=2%
答:该废水中NaOH的溶质质量分数为2%。
24.(1)溶解;CaO+H2O=Ca(OH)2;化合反应
(2)17.6t
解:设用含碳酸钙40t的石灰石,理论上能制得二氧化碳的质量为x,则有
答:用含碳酸钙40t的石灰石,理论上能制得二氧化碳的质量是17.6t。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.新鲜果汁是常见的饮料,下列四种饮料呈弱碱性的是( )
A.柠檬汁 B.苹果汁
C.西瓜汁 D.玉米汁
2.新鲜魔芋在去皮时出现的白色汁液内含有一种碱性物质——皂角甙,皮肤沾上它会奇痒难忍。下列厨房中的物质止痒效果最好的是
A.料酒 B.食醋 C.纯碱溶液 D.食盐水
3.下列物质露置于空气中,因发生化学变化而使质量增加的是
A.浓硫酸 B.烧碱溶液 C.浓盐酸 D.双氧水溶液
4.下列各项所采取的方法正确的是
A.用闻气味的方法鉴别水、氨水和酒精 B.用带火星的木条鉴别氮气、空气、氧气
C.用点燃的方法除去CO2中混有的CO D.除去食盐中的蔗糖:加水溶解,然后过滤
5.下列实验操作不正确的是
A.用托盘天平称取2.3克氯化钠 B.用10mL的量筒量取8mL的水
C.用50mL的烧杯盛放大约15mL的水 D.用石蕊测定某溶液的pH值
6.有关中和反应的说法一定正确的是( )
A.反应物均须溶于水
B.有沉淀生成
C.有气体生成
D.有盐生成
7.下图是某反应前后的微观示意图,“”和“”表示两种不同元素的原子。下列有关说法正确的是
A.该反应没有单质生成
B.该反应属于复分解反应
C.该反应中,原子个数发生了改变
D.参加反应的两种分子(和)的个数比为1:1
8.我国制碱工业的先驱——侯德榜先生,1921年留美回国后,潜心研究制碱技术,发明了将制碱与制氨结合起来的联合制碱法(又称侯氏制碱法),为纯碱和氮肥工业技术的发展做出了杰出贡献。下列物质中能与纯碱发生反应的是
A.NaOH B.NaHCO3 C.H2SO4 D.K2SO4
9.将下列各组物质放入足量的水中,充分搅拌后,得到无色溶液的是
A.HNO3和FeCl3 B.NaOH和HCl
C.BaCl2和Na2SO4 D.KOH和CuSO4
10.室温时,将氢氧化钠溶液与盐酸用滴加方式反应时,溶液的pH随滴入溶液体积变化如右下图所示。下列有关说法不正确的是
A.该图像表示的是将氢氧化钠溶液滴入盐酸中
B.氢氧化钠溶液和盐酸恰好完全反应时。溶液的pH等于7
C.当滴入溶液的体积为5mL时,所得溶液中的溶质只有NaCl
D.滴入溶液体积为15mL时,再加几滴紫色石蕊试液溶液呈蓝色
11.化肥对提高农作物的产量具有重要作用。某同学设计了如图实验对几种化肥进行简易鉴别:
取少量固体分别进行实验,如表方案中不合理的是( )
选项 实验① 实验②
A 观察固体颜色 与熟石灰粉末混合研磨
B 观察固体颜色 加入Ba(NO3)2溶液中
C 加入足量水中 加入AgNO3溶液中
D 加入足量水中 加入Ba(OH)2溶液中
A.A B.B C.C D.D
12.能在同一溶液中大量共存,且溶液为无色透明的一组物质是
A.FeCl2、CuSO4、NaCl B.BaCl2、K2SO4、NaOH
C.CaCl2、K2SO3、AgNO3 D.Na2SO4、KNO3、NH4Cl
二、简答题
13.请用化学方程式解释下列问题。
(1)正常雨水的pH约为5.6;_______
(2)将氧化铜粉末置于试管中加热、通入氨气,生成铜、水和一种气体单质。______
14.化学实验是进行科学探究的重要手段。请填写下列空格:用图B所示的装置探究酸碱中和反应。将稀盐酸滴入氢氧化钠溶液(滴有酚酞溶液)中至过量,观察到的现象是_______________。从微观角度分析,中和反应的实质是___________________________。
请另外写出一个符合上述反应实质的化学方程式_______________________。
15.某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2)。该小组同学进行如下探究。
探究一:该气体的成分。
【猜想与假设】小华说:该气体可能是CO2、O2、CO、H2、N2。
小明说:不可能含有N2,因为_________________________。
小芳说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO_____________________________。
该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
【进行实验】
实验编号 实验操作 实验现象
① 将气体通入澄清的石灰水中 澄清石灰水变浑浊
② 将带火星的木条伸入该气体中 带火星的木条没有复燃
【得出结论】(1)由实验①可知,该气体中肯定含有_________,写出该反应的化学方程式________________。
(2)由实验②____________(填“能”或“不能”)确定该气体中不含氧气,理由是______________________。
探究二:维C泡腾片溶液的酸碱性。
向维C泡腾片溶液中滴加石蕊试液,溶液变红,说明溶液显_________性。
三、推断题
16.A、B、C、D、E都是初中化学常见的物质。B、D、E均为氧化物,常温下B为固态,D为液态,E为气态;A、B、C中均含有同一种金属元素。它们之间的转化关系如图所示(部分生成物略去)。
写出下列物质的名称:
A_______
E________
17.某固体混合物可能含有CuSO4、CaCO3、Na2CO3、KOH的一 种或两种,为了确定该混合物的成分,进行如下实验:
步骤I:取少量固体于烧杯中,加水,搅拌,固体全部溶解,得到无色溶液A。
步骤Ⅱ:取少量溶液A于试管中,滴加过量MgCl2溶液,有白色沉淀产生;再加入过量稀盐酸,沉淀消失,有气泡产生。
(1)步骤Ⅱ中产生的气泡是__________________ (填化学式)。
(2)根据上述实验推断该混合物的成分,肯定含有的是________ ,可能含有的是_________。
(3)设计实验进一步确定混合物组成,依次用到的试剂是_______________。
四、实验题
18.如图,利用井穴板、打孔透明盖子、滴管和导管进行微型实验。
(1)井穴1中能证明石灰水和盐酸发生反应的现象是 ______ 。
(2)井穴2发生反应的化学方程式为 ______ 。
(3)欲证明未知粉末X中含有碳酸盐,实验操作为 ______ 。
19.化学是一门以实验为为基础的科学。根据下列图示,充成相关问题。
(1)装置a中仪器的名称是_________
(2)若用装置A制二氧化碳,该装置的优点是_________
(3)若实验室用装置B干燥二氧化碳,B中盛放的液体为_______,气体应从____端进入(填“左”或”右”)
(4)C中镁条燃烧的现象为_________
(5)D中铜片上的白磷燃烧而红磷不燃烧,说明燃烧条件是_________
(6)实验E的目的是_________
20.常温下,一锥形瓶中盛有20g溶质质量分数为4%的氢氧化钠溶液,先向其中滴加2滴酚酞试液,再逐滴滴加溶质质量分数为6.3%的稀硝酸,用pH传感器测得溶液的pH与加入稀硝酸的关系曲线如图。请回答问题:
(1)本实验反应的化学方程式是____。
(2)pH=7时,锥形瓶中的溶液呈____色,此时溶液的溶质质量分数是____(结果精确到0.01%)。
(3)图中a点对应的溶液中溶质的化学式是____。
(4)若改用溶质质量分数为12.6%的稀硝酸进行本实验,pH传感器测得的曲线可能经过____(填“甲”“乙”或“丙”)点。
五、计算题
21.取100g一定质量分数的Ba(OH)2溶液于烧杯中,逐渐加入质量分数为20%的H2SO4溶液.实验过程中,溶液的pH与加入H2SO4溶液的质量关系如图所示。请计算Ba(OH)2溶液中溶质的质量分数。( 反应的方程式为:Ba(OH)2 + H2SO4 = BaSO4↓+ 2H2O)
22.洁厕灵是常用的陶瓷清洗液,某同学对某品牌洁厕灵的有效成分的含量进行探究。他向一个锥形瓶中加入100 g该品牌的洁厕灵,再加入120 g溶质质量分数为7% 的NaHCO3溶液,二者恰好完全反应。(洁厕灵有效成分是HCl,洁厕灵中其他成分均不与NaHCO3反应。)
请计算:该品牌洁厕灵中HCl的质量分数是多少?
23.某造纸厂排放含NaOH的废水200吨,恰好需要含溶质4.9吨的硫酸溶液中和处理,求该废水中NaOH的溶质质量分数。
24.在牙膏和一些药品中,常用颗粒直径极小的轻质碳酸钙粉末(轻钙)作填充剂或摩擦剂。制取轻质碳酸钙粉末可用下列方法:
(1)操作1的名称是______;操作1中发生的反应方程式______;该反应的基本反应类型是______。
(2)用含碳酸钙40t的石灰石,理论上能制得二氧化碳的质量是多少?
试卷第1页,共3页
参考答案:
1.D
2.B
3.B
4.A
5.D
6.D
7.A
8.C
9.B
10.C
11.C
12.D
13. H2O+CO2═H2CO3 CuO+2NH33Cu+3H2O+N2
14. 溶液由红色逐渐变为无色 H+与OH-结合生成H2O H2SO4+2KOH===K2SO4+2H2O(合理即可)
15. 根据质量守恒定律(或化学反应前后元素种类不变),反应物中不含氮元素 有毒 二氧化碳 Ca(OH)2+CO2=CaCO3↓+H2O 不能 若生成氧气和二氧化碳的混合物,当氧气含量过少时,带火星的木条也不能复燃 酸
16. 碳酸钙 二氧化碳
17. CO2 碳酸钠 氢氧化钾 过量氯化钡(氯化钙/硝酸钡/硝酸钙)溶液,酚酞溶液
18. 红色溶液变成无色 6HCl+Fe2O3=2FeCl3 +3H2O 在孔穴6中加入澄清石灰水,将稀盐酸挤入孔穴3
19. 长颈漏斗 可以控制反应的发生和停止 浓硫酸 左 发出耀眼的白光,放出大量的热,生成一种白色固体 需要达到可燃物着火点 比较合金的硬度和组成它的纯金属硬度的大小
20. NaOH+HNO3=NaNO3+H2O 无 4.25% HNO3、NaNO3 甲
21.6.48%
22.解:设HCl的质量分数是x
答:该品牌洁厕灵中HCl的质量分数是3.65%。
23.解:设该废水中NaOH的溶质质量分数为x
x=2%
答:该废水中NaOH的溶质质量分数为2%。
24.(1)溶解;CaO+H2O=Ca(OH)2;化合反应
(2)17.6t
解:设用含碳酸钙40t的石灰石,理论上能制得二氧化碳的质量为x,则有
答:用含碳酸钙40t的石灰石,理论上能制得二氧化碳的质量是17.6t。
答案第1页,共2页
答案第1页,共2页
