9.1.2金属矿物及其冶炼同步练习-2021-2022学年九年级化学鲁教版下册
文档属性
| 名称 | 9.1.2金属矿物及其冶炼同步练习-2021-2022学年九年级化学鲁教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 466.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-17 10:59:33 | ||
图片预览

文档简介
《9.1.2 金属矿物及其冶炼》同步练习
一、基础训练
1.早在春秋战国时期,我国就开始生产和使用铁器。下列有关铁的冶炼的说法正确的是( )
A. 高炉炼出的铁是纯铁
B. 高炉炼铁用碳作还原剂还原铁矿石
C. 高炉炼铁的原料是焦炭、铁矿石、石灰石、空气等
D. 炼铁的过程是把铁矿石转化成纯净的氧化铁
2.【2020·重庆】“中国高铁,世界第一”。高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是C+2NiO=====2Ni+CO2↑,下列说法错误的是( )
A. 反应中NiO发生还原反应
B. 气体产物中可能有CO
C. 该不锈钢中还含有铁和碳
D. 该不锈钢合金的硬度小于纯铁
3.下列有关一氧化碳还原氧化铁实验的有关说法正确的是( )
A. 实验时,应先点燃酒精喷灯,后通一氧化碳
B. 实验结束时,应先停止通入一氧化碳,后熄灭酒精喷灯
C. 用赤铁矿炼铁的主要反应原理是3CO+Fe2O3 ===== 2Fe+3CO2
D. 高炉炼铁得到的是纯铁
4.下列金属在自然界中主要以单质形式存在的是( )
A. 镁 B. 铝 C. 金 D. 铁
5.地球上的金属资源广泛地存在于________和________中,除金、银等少数很不活泼的金属以________形式存在外,其余都以________形式存在。
6.(1)工业炼铝常选用铝土矿,其主要成分为________。工业采用电解法冶炼铝,反应的化学方程式为____________________________。
(2)填写下表中矿石的主要成分。
矿石名称 赤铁矿 磁铁矿 菱铁矿 黄铁矿
主要成分 ________ ________ ________ ________
你认为最适宜炼铁的矿石是____________________,理由是_________________________________________________________。
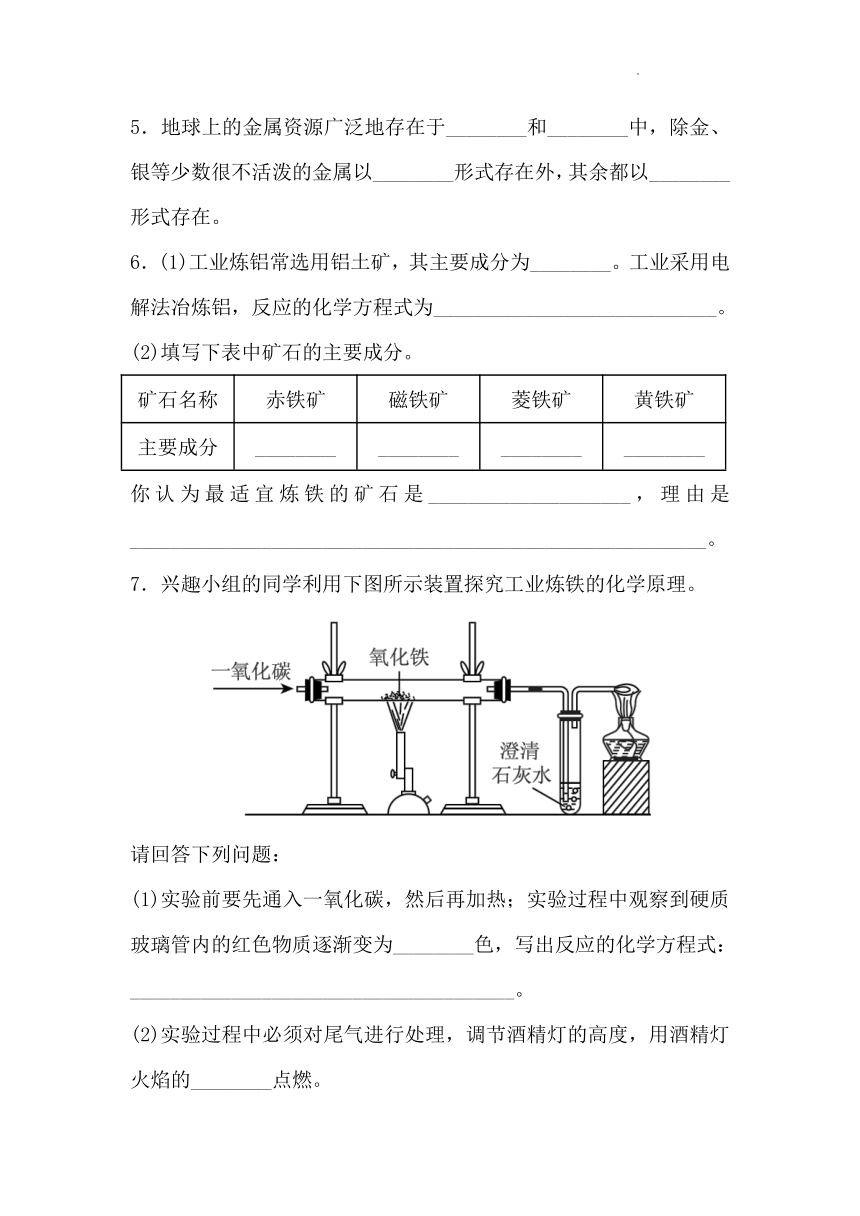
7.兴趣小组的同学利用下图所示装置探究工业炼铁的化学原理。
请回答下列问题:
(1)实验前要先通入一氧化碳,然后再加热;实验过程中观察到硬质玻璃管内的红色物质逐渐变为________色,写出反应的化学方程式:______________________________________。
(2)实验过程中必须对尾气进行处理,调节酒精灯的高度,用酒精灯火焰的________点燃。
(3)通过上述实验探究,同学们总结一氧化碳的化学性质有__________________。
8.【2020·凉山】某钢铁厂每天需消耗5 000 t含三氧化二铁76%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是_____________。
9.某钢铁厂采用赤铁矿(主要成分为 Fe2O3)炼铁,反应原理为 Fe2O3+3CO =====2Fe+3CO2。若该厂日产含铁 1.4×104 t 的生铁,至少需要含 Fe2O3 80%的赤铁矿的质量是多少?(要求写出计算过程)
10.《千里江山图》是北宋王希孟创作的绢本设色画,其颜料选用各色天然矿石,描绘了祖国的锦绣河山。一些矿石的主要成分及颜色如下表。
矿石 蓝铜矿 孔雀石 雌黄 赭石
主要成分 Cu3(OH)2(CO3)2 Cu2(OH)2CO3 As2S3 Fe2O3
颜色 蓝色 绿色 黄色 红色
(1)四种矿石主要成分中,属于氧化物的是________。
(2)蓝铜矿和孔雀石的主要成分在组成上具有的相同点是__________________________________________。
二、提升训练
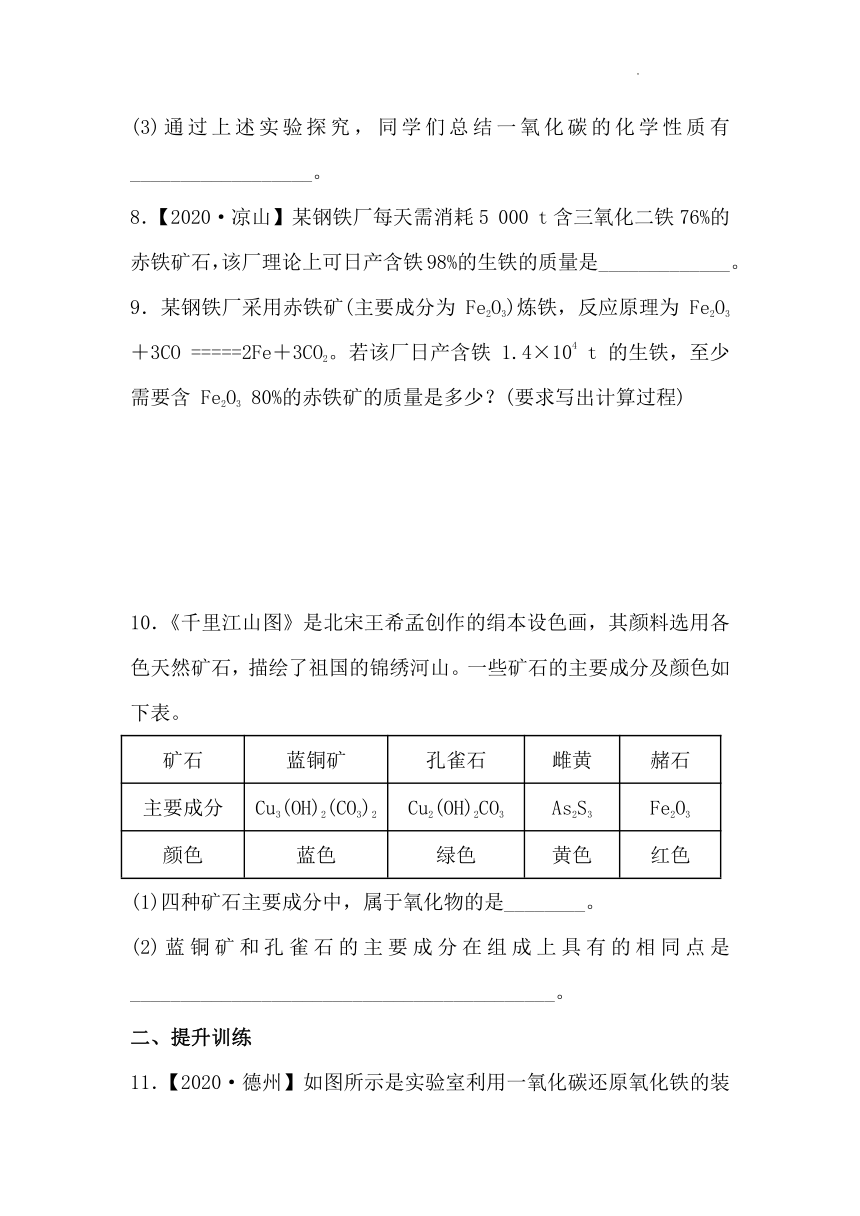
11.【2020·德州】如图所示是实验室利用一氧化碳还原氧化铁的装置图。关于该实验,下列说法错误的是( )
A. 实验时可观察到玻璃管中红棕色粉末逐渐变黑
B. 反应后玻璃管中固体物质的质量较反应前增加
C. 试管中澄清石灰水变浑浊,说明有二氧化碳生成
D. 为了防止污染空气,该实验应增加尾气处理装置
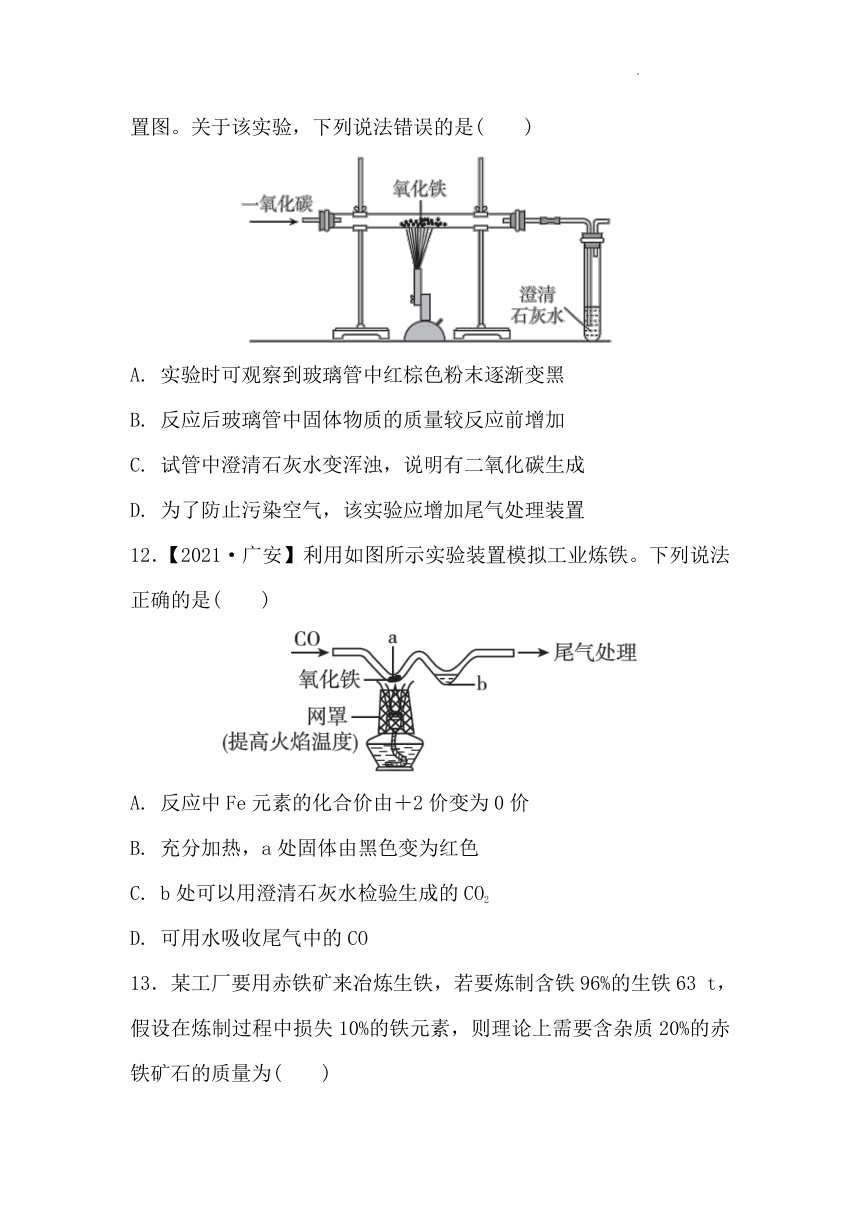
12.【2021·广安】利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
A. 反应中Fe元素的化合价由+2价变为0价
B. 充分加热,a处固体由黑色变为红色
C. b处可以用澄清石灰水检验生成的CO2
D. 可用水吸收尾气中的CO
13.某工厂要用赤铁矿来冶炼生铁,若要炼制含铁96%的生铁63 t,假设在炼制过程中损失10%的铁元素,则理论上需要含杂质20%的赤铁矿石的质量为( )
A. 120 t B. 108 t C. 96 t D. 84 t
14.还原某铁的氧化物2.16 g,可以得到1.68 g铁。则这种铁的氧化物的化学式为( )
A. FeO B. Fe2O3 C. Fe3O4 D. FeCO3
15.【2020·潍坊】利用甲酸(HCOOH)与浓硫酸制备CO,并用如图所示实验装置验证CO的有关性质。已知:HCOOH=========CO↑+H2O下列说法不正确的是( )
A. 操作时,先点燃乙处酒精灯,再滴加HCOOH
B. 装置丙的作用是防止倒吸
C. 装置丁既可检验CO2,又可收集CO
D. 随着反应进行,浓硫酸浓度降低,产生CO气体速率减小
16.某化学兴趣小组利用下图所示装置进行实验,探究工业炼铁的化学原理,试按要求填空:
(1)硬质玻璃管中观察到的现象是______________________,写出一氧化碳和氧化铁反应的化学方程式:__________________________。
(2)实验中首先通入一氧化碳的目的是________________________。
(3)装置中导管末端加一盏点燃的酒精灯的目的是__________________________________。
17.如图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO4)
(1)用高炉冶铁的主要反应原理是_________________________(用化学方程式表示)。
(2)分析流程图,三脱装置中发生反应的基本反应类型是________________。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中___________(填一种仪器的名称)的作用。
(4)铁与镍相比,铁的金属活动性________(填“>”“=”或“<”)镍,判断依据是_________________________(用化学方程式表示)。
(5)通过以上信息,得出白铜的成分是____________,其硬度比纯铜________(填“大”或“小”)。
18.某钢铁厂每天消耗4 000 t含Fe2O3 80%的赤铁矿石,该钢铁厂理论上可日产含Fe 98%的生铁质量是多少?(用两种方法计算)
19.【2020·日照】如图表示各物质之间相互转化的关系。A和F是含有两种相同元素的固体,A为红棕色,F为黑色。C和E是含有两种相同元素的气体。B和D是固体单质,D能与稀盐酸反应。请回答:
(1)A和B反应生成D和E的化学方程式是____________________________________。
(2)C在空气中燃烧时,火焰呈________。
(3)在实验室里,做D在氧气中燃烧实验时,盛有氧气的集气瓶中要预先放入一些水,目的是_____________________________________,该反应的化学方程式是_______________________________。
20.人类制得并利用金属有着悠久的历史:
图1
(1)利用孔雀石冶炼铜的主要反应:①Cu2(OH)2CO3 ====== 2CuO+H2O+CO2↑,该反应的类型是______(填“化合”“分解”或“复分解”)反应;
②2CuO+C =====2Cu+CO2↑,该反应前后铜元素化合价发生的变化是________________________。
(2)高炉炼铁的主要反应过程如下:
图2
请写出对应的化学方程式:
①___________________________________________;
②__________________________________________;
③__________________________________________。
(3)冶炼金属铝的主要反应为2Al2O3====4Al+3O2↑,该反应的条件是________________。
参考答案
一、基础训练
1.C 2.D 3.C 4.C
5.地壳;海洋;单质;化合物
6.(1)Al2O3;2Al2O3=====4Al+3O2↑
(2)Fe2O3;Fe3O4;FeCO3;FeS2
磁铁矿和赤铁矿;这两种铁矿石含铁量高,含硫等有害元素少,便于冶炼,污染少
7.(1)黑;Fe2O3+3CO===== 2Fe+3CO2
(2)外焰
(3)还原性、可燃性
8.2 714.3 t
9.解:设需要含Fe2O3 80%的赤铁矿的质量是x。
Fe2O3+3CO===== 2Fe+3CO2
160 112
80%·x 1.4×104 t
= x=2.5×104 t
答:需要含Fe2O3 80%的赤铁矿的质量是2.5×104 t。
10.(1)Fe2O3
(2)都是由Cu、O、C、H四种元素组成的
二、提升训练
11.B 12.C 13.A 14.A 15.A
16.(1)红棕色粉末变为黑色;Fe2O3+3CO=====2Fe+3CO2
(2)排尽装置内的空气,防止加热时发生爆炸
(3)处理尾气,防止污染环境
17.(1)3CO+Fe2O3===== 2Fe+3CO2(或4CO+Fe3O4=====3Fe+4CO2)
(2)化合反应
(3)玻璃棒
(4)>;Fe+NiSO4===Ni+FeSO4
(5)铜、镍;大
18.方法一:解:设可日产含Fe 98%的生铁质量为x。
4 000 t×80%××100%=x×98%
解得:x≈2 285.7 t
答:可日产含Fe 98%的生铁2 285.7 t。
方法二:解:设可日产含Fe 98%的生铁质量为x。
3CO+Fe2O3=====2Fe+3CO2
160 112
4 000 t×80% x×98%
= 解得x≈2 285.7 t
答:可日产含Fe 98%的生铁2 285.7 t。
19.(1)3C+2Fe2O3===== 4Fe+3CO2↑
(2)淡蓝色
(3)防止高温生成物溅落下来炸裂集气瓶;3Fe+2O2=====Fe3O4
20.(1)分解;由+2价→0价
(2)①C+O2=====CO2
②CO2+C=====2CO
③Fe2O3+3CO=====2Fe+3CO2
(3)通电
一、基础训练
1.早在春秋战国时期,我国就开始生产和使用铁器。下列有关铁的冶炼的说法正确的是( )
A. 高炉炼出的铁是纯铁
B. 高炉炼铁用碳作还原剂还原铁矿石
C. 高炉炼铁的原料是焦炭、铁矿石、石灰石、空气等
D. 炼铁的过程是把铁矿石转化成纯净的氧化铁
2.【2020·重庆】“中国高铁,世界第一”。高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是C+2NiO=====2Ni+CO2↑,下列说法错误的是( )
A. 反应中NiO发生还原反应
B. 气体产物中可能有CO
C. 该不锈钢中还含有铁和碳
D. 该不锈钢合金的硬度小于纯铁
3.下列有关一氧化碳还原氧化铁实验的有关说法正确的是( )
A. 实验时,应先点燃酒精喷灯,后通一氧化碳
B. 实验结束时,应先停止通入一氧化碳,后熄灭酒精喷灯
C. 用赤铁矿炼铁的主要反应原理是3CO+Fe2O3 ===== 2Fe+3CO2
D. 高炉炼铁得到的是纯铁
4.下列金属在自然界中主要以单质形式存在的是( )
A. 镁 B. 铝 C. 金 D. 铁
5.地球上的金属资源广泛地存在于________和________中,除金、银等少数很不活泼的金属以________形式存在外,其余都以________形式存在。
6.(1)工业炼铝常选用铝土矿,其主要成分为________。工业采用电解法冶炼铝,反应的化学方程式为____________________________。
(2)填写下表中矿石的主要成分。
矿石名称 赤铁矿 磁铁矿 菱铁矿 黄铁矿
主要成分 ________ ________ ________ ________
你认为最适宜炼铁的矿石是____________________,理由是_________________________________________________________。
7.兴趣小组的同学利用下图所示装置探究工业炼铁的化学原理。
请回答下列问题:
(1)实验前要先通入一氧化碳,然后再加热;实验过程中观察到硬质玻璃管内的红色物质逐渐变为________色,写出反应的化学方程式:______________________________________。
(2)实验过程中必须对尾气进行处理,调节酒精灯的高度,用酒精灯火焰的________点燃。
(3)通过上述实验探究,同学们总结一氧化碳的化学性质有__________________。
8.【2020·凉山】某钢铁厂每天需消耗5 000 t含三氧化二铁76%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是_____________。
9.某钢铁厂采用赤铁矿(主要成分为 Fe2O3)炼铁,反应原理为 Fe2O3+3CO =====2Fe+3CO2。若该厂日产含铁 1.4×104 t 的生铁,至少需要含 Fe2O3 80%的赤铁矿的质量是多少?(要求写出计算过程)
10.《千里江山图》是北宋王希孟创作的绢本设色画,其颜料选用各色天然矿石,描绘了祖国的锦绣河山。一些矿石的主要成分及颜色如下表。
矿石 蓝铜矿 孔雀石 雌黄 赭石
主要成分 Cu3(OH)2(CO3)2 Cu2(OH)2CO3 As2S3 Fe2O3
颜色 蓝色 绿色 黄色 红色
(1)四种矿石主要成分中,属于氧化物的是________。
(2)蓝铜矿和孔雀石的主要成分在组成上具有的相同点是__________________________________________。
二、提升训练
11.【2020·德州】如图所示是实验室利用一氧化碳还原氧化铁的装置图。关于该实验,下列说法错误的是( )
A. 实验时可观察到玻璃管中红棕色粉末逐渐变黑
B. 反应后玻璃管中固体物质的质量较反应前增加
C. 试管中澄清石灰水变浑浊,说明有二氧化碳生成
D. 为了防止污染空气,该实验应增加尾气处理装置
12.【2021·广安】利用如图所示实验装置模拟工业炼铁。下列说法正确的是( )
A. 反应中Fe元素的化合价由+2价变为0价
B. 充分加热,a处固体由黑色变为红色
C. b处可以用澄清石灰水检验生成的CO2
D. 可用水吸收尾气中的CO
13.某工厂要用赤铁矿来冶炼生铁,若要炼制含铁96%的生铁63 t,假设在炼制过程中损失10%的铁元素,则理论上需要含杂质20%的赤铁矿石的质量为( )
A. 120 t B. 108 t C. 96 t D. 84 t
14.还原某铁的氧化物2.16 g,可以得到1.68 g铁。则这种铁的氧化物的化学式为( )
A. FeO B. Fe2O3 C. Fe3O4 D. FeCO3
15.【2020·潍坊】利用甲酸(HCOOH)与浓硫酸制备CO,并用如图所示实验装置验证CO的有关性质。已知:HCOOH=========CO↑+H2O下列说法不正确的是( )
A. 操作时,先点燃乙处酒精灯,再滴加HCOOH
B. 装置丙的作用是防止倒吸
C. 装置丁既可检验CO2,又可收集CO
D. 随着反应进行,浓硫酸浓度降低,产生CO气体速率减小
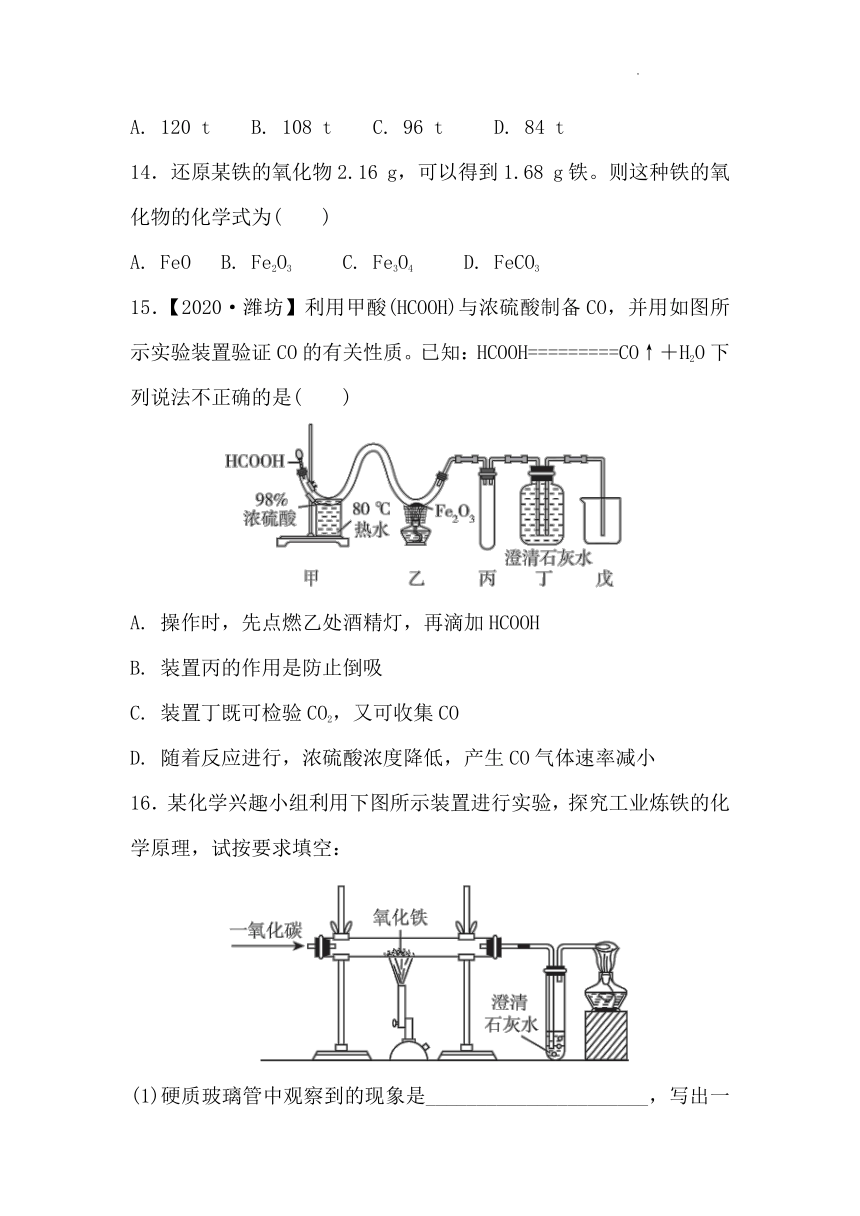
16.某化学兴趣小组利用下图所示装置进行实验,探究工业炼铁的化学原理,试按要求填空:
(1)硬质玻璃管中观察到的现象是______________________,写出一氧化碳和氧化铁反应的化学方程式:__________________________。
(2)实验中首先通入一氧化碳的目的是________________________。
(3)装置中导管末端加一盏点燃的酒精灯的目的是__________________________________。
17.如图为高炉冶铁、炼钢并用生产的钢来探究白铜成分的流程图。(已知硫酸镍的化学式为NiSO4)
(1)用高炉冶铁的主要反应原理是_________________________(用化学方程式表示)。
(2)分析流程图,三脱装置中发生反应的基本反应类型是________________。
(3)向精炼炉中吹入氩气使钢水循环流动,各成分均匀混合,相当于化学实验中___________(填一种仪器的名称)的作用。
(4)铁与镍相比,铁的金属活动性________(填“>”“=”或“<”)镍,判断依据是_________________________(用化学方程式表示)。
(5)通过以上信息,得出白铜的成分是____________,其硬度比纯铜________(填“大”或“小”)。
18.某钢铁厂每天消耗4 000 t含Fe2O3 80%的赤铁矿石,该钢铁厂理论上可日产含Fe 98%的生铁质量是多少?(用两种方法计算)
19.【2020·日照】如图表示各物质之间相互转化的关系。A和F是含有两种相同元素的固体,A为红棕色,F为黑色。C和E是含有两种相同元素的气体。B和D是固体单质,D能与稀盐酸反应。请回答:
(1)A和B反应生成D和E的化学方程式是____________________________________。
(2)C在空气中燃烧时,火焰呈________。
(3)在实验室里,做D在氧气中燃烧实验时,盛有氧气的集气瓶中要预先放入一些水,目的是_____________________________________,该反应的化学方程式是_______________________________。
20.人类制得并利用金属有着悠久的历史:
图1
(1)利用孔雀石冶炼铜的主要反应:①Cu2(OH)2CO3 ====== 2CuO+H2O+CO2↑,该反应的类型是______(填“化合”“分解”或“复分解”)反应;
②2CuO+C =====2Cu+CO2↑,该反应前后铜元素化合价发生的变化是________________________。
(2)高炉炼铁的主要反应过程如下:
图2
请写出对应的化学方程式:
①___________________________________________;
②__________________________________________;
③__________________________________________。
(3)冶炼金属铝的主要反应为2Al2O3====4Al+3O2↑,该反应的条件是________________。
参考答案
一、基础训练
1.C 2.D 3.C 4.C
5.地壳;海洋;单质;化合物
6.(1)Al2O3;2Al2O3=====4Al+3O2↑
(2)Fe2O3;Fe3O4;FeCO3;FeS2
磁铁矿和赤铁矿;这两种铁矿石含铁量高,含硫等有害元素少,便于冶炼,污染少
7.(1)黑;Fe2O3+3CO===== 2Fe+3CO2
(2)外焰
(3)还原性、可燃性
8.2 714.3 t
9.解:设需要含Fe2O3 80%的赤铁矿的质量是x。
Fe2O3+3CO===== 2Fe+3CO2
160 112
80%·x 1.4×104 t
= x=2.5×104 t
答:需要含Fe2O3 80%的赤铁矿的质量是2.5×104 t。
10.(1)Fe2O3
(2)都是由Cu、O、C、H四种元素组成的
二、提升训练
11.B 12.C 13.A 14.A 15.A
16.(1)红棕色粉末变为黑色;Fe2O3+3CO=====2Fe+3CO2
(2)排尽装置内的空气,防止加热时发生爆炸
(3)处理尾气,防止污染环境
17.(1)3CO+Fe2O3===== 2Fe+3CO2(或4CO+Fe3O4=====3Fe+4CO2)
(2)化合反应
(3)玻璃棒
(4)>;Fe+NiSO4===Ni+FeSO4
(5)铜、镍;大
18.方法一:解:设可日产含Fe 98%的生铁质量为x。
4 000 t×80%××100%=x×98%
解得:x≈2 285.7 t
答:可日产含Fe 98%的生铁2 285.7 t。
方法二:解:设可日产含Fe 98%的生铁质量为x。
3CO+Fe2O3=====2Fe+3CO2
160 112
4 000 t×80% x×98%
= 解得x≈2 285.7 t
答:可日产含Fe 98%的生铁2 285.7 t。
19.(1)3C+2Fe2O3===== 4Fe+3CO2↑
(2)淡蓝色
(3)防止高温生成物溅落下来炸裂集气瓶;3Fe+2O2=====Fe3O4
20.(1)分解;由+2价→0价
(2)①C+O2=====CO2
②CO2+C=====2CO
③Fe2O3+3CO=====2Fe+3CO2
(3)通电
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
