第6章常用的金属和盐章节练习-2021-2022学年九年级化学沪教版(上海)第二学期 (word版 含答案))
文档属性
| 名称 | 第6章常用的金属和盐章节练习-2021-2022学年九年级化学沪教版(上海)第二学期 (word版 含答案)) |  | |
| 格式 | docx | ||
| 文件大小 | 170.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-17 14:40:36 | ||
图片预览



文档简介
第6章常用的金属和盐章节练习2021-2022学年九年级化学沪教版(上海)下册
一、单选题
1.邵阳市某地盛产石膏矿,石膏矿的主要成分是CaSO4,CaSO4属于( )
A.单质
B.氧化物
C.盐
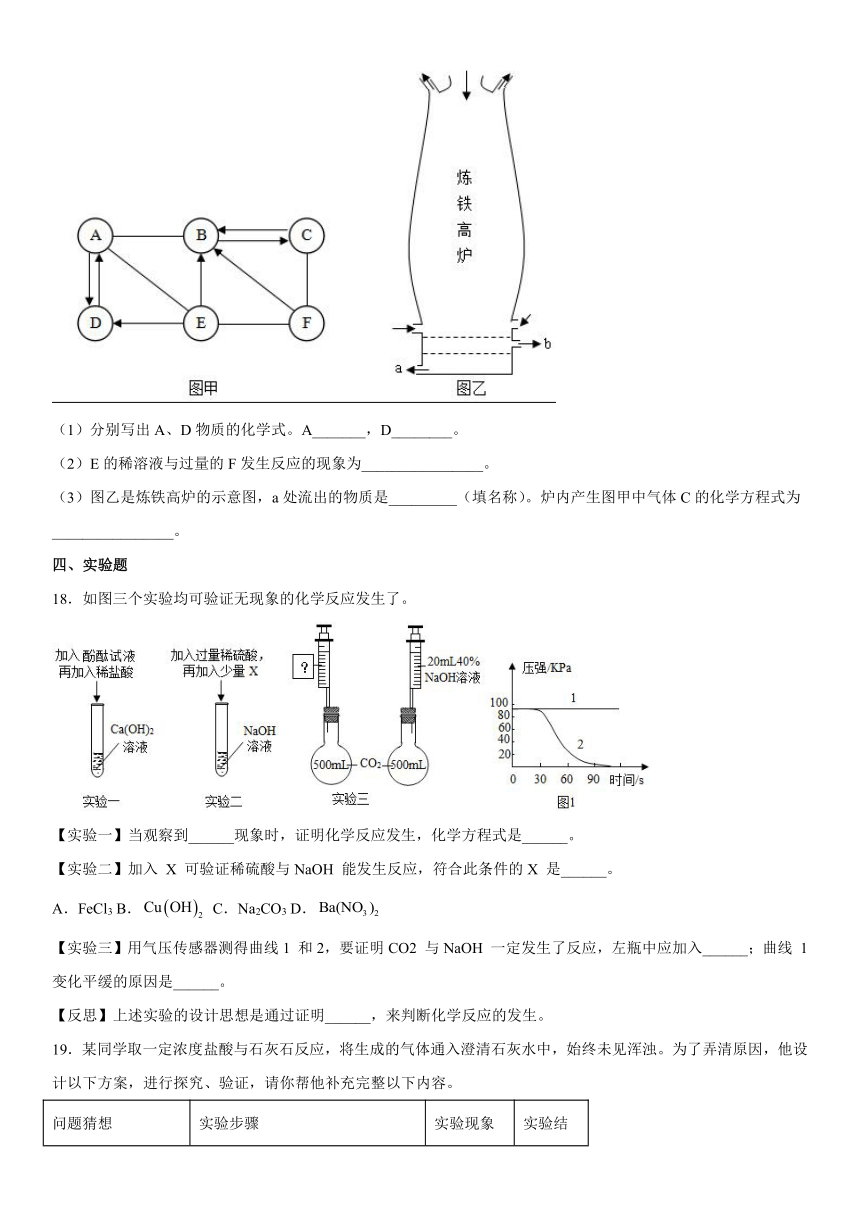
D.混合物
2.化学与生活息息相关,下列做法不科学的是( )
A.甲醛大量用于海鲜的防腐 B.明矾、活性炭用于净水
C.将易拉罐投入可回收垃圾箱 D.青少年常喝牛奶补充钙元素
3.下列物质间能够发生反应,但没有出现明显现象的是
A.将稀盐酸滴入盛石灰石的试管中
B.将CO2通入NaOH溶液中
C.将碳酸钠溶液滴入澄清石灰水中
D.将稀硫酸滴入NaCl溶液中
4.下列各组常见的固体物质中,用水不能区分的是
A.NaOH和NH4NO3
B.CuSO4和Na2SO4
C.Na2CO3和CaCO3
D.NaCl和KCl
5.下列化肥分别与熟石灰混合研磨后。能闻到刺激性气味的是
A.NH4Cl B.KNO3 C.NaNO3 D.Ca3(PO4)2
6.空气中含①N2 ②O2 ③稀有气体 ④水蒸气等成分,其中与钢铁生锈有关的是( )
A.①③ B.②④ C.③④ D.①④
7.下列金属中,金属活动性最强的是
A.铁 B.铝 C.铜 D.银
8.某干燥剂含有CaO、NaOH和CaCl2中的两种物质,为探究其成分,设计了如图所示实验.
则下列说法正确的是( )
A.a、b溶液一定只含两种溶质
B.b溶液中一定有NaOH和Na2CO3
C.白色固体一定不是纯净物
D.干燥剂一定由NaOH和CaCl2组成
9.验证铝、铜、银的金属活动性强弱,小明设计了以下四组实验,下列说法不正确的是
A.通过①②实验,可以证明金属活动性Al>Cu
B.通过①②③实验,可以证明金属活动性Al>Cu>Ag
C.若要用实验④证明金属活动性Al>Cu,X可以为Al,Y为CuSO4溶液
D.若要用实验④证明金属活动性Cu>Ag,X可以为Cu,Y为AgNO3溶液
10.根据金属活动性顺序判断,下列容器与所盛溶液不会发生化学反应的是
A.用铁制容器盛盐酸 B.用铜制容器盛盐酸
C.用铁制容器盛硝酸银溶液 D.用铜制容器盛硝酸银溶液
11.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
12.实验室欲测定一包黄铜样品中锌的质量分数(假设样品中只含铜和锌),取50g黄铜样品粉末于烧杯中,先加入100g稀硫酸,充分反应后得固液混合物149.8g,再继续加入200g相同浓度的稀硫酸,充分反应后过滤,得滤液312.6g,则黄铜样品中锌的质量分数为
A.39% B.74% C.61% D.26%
二、简答题
13.钢铁有工业的骨骼之称。工业上用赤铁矿(主要成分为Fe2O3)炼铁的化学方程式为_____。
14.用稀盐酸中和一定量氢氧化钙溶液时,溶液的pH与加入的稀盐酸质量的关系如图所示。
(1)请写出该反应的化学方程式________。
(2)若向c点溶液中逐滴滴加足量碳酸钠溶液,可观察到什么现象 _______
15.下图为我国发行的人民币硬币,主要材料含有铁、铝、铜等。
(1)工业上用赤铁矿(主要成分Fe2O3)炼铁的化学方程式为 _____ 。
(2)选择铸造硬币的材料,需要考虑的因素是 _____ (填序号)。
A 金属的硬度 B 金属的导电性 C 金属的耐腐蚀性
三、推断题
16.现有一包固体粉末,可能含有FeCl3、Na2SO4、NaOH、CaCO3、NH4HCO3、Na2CO3中的一种或几种.现做如下实验:
(1)取少量固体加热,无氨味,则原固体中一定不含_____.
(2)另取少量固体溶于水,得到无色澄清溶液,则原固体中一定不含_____.
(3)取(2)中溶液适量,滴加过量BaC12溶液,出现白色沉淀,过滤得固体A和滤液B.固体A能全部溶于稀硝酸并产生气泡.则原固体中一定含有_____,一定不含_____.
(4)向滤液B中通入CO2,产生白色沉淀,由此判断原固体中还含有NaOH.生成白色沉淀总反应的化学方程式_____.
17.图甲中A、B、C、D、E、F为初中化学常见的六种物质。其中B、C、F都是氧化物E、A、D是酸、碱、盐,炉具清洁剂中含有A,E的浓溶液可做干燥剂,F是赤铁矿的主要成分(图中用“—”表示两种物质间能发生反应,用“→”或“”表示两种物质间能单向或双向转化,部分反应物和生成物及反应条件已略去,图中部分反应需在溶液中进行,物质是溶液的只考虑溶质)。
(1)分别写出A、D物质的化学式。A_______,D________。
(2)E的稀溶液与过量的F发生反应的现象为________________。
(3)图乙是炼铁高炉的示意图,a处流出的物质是_________(填名称)。炉内产生图甲中气体C的化学方程式为________________。
四、实验题
18.如图三个实验均可验证无现象的化学反应发生了。
【实验一】当观察到______现象时,证明化学反应发生,化学方程式是______。
【实验二】加入 X 可验证稀硫酸与NaOH 能发生反应,符合此条件的X 是______。
A.FeCl3 B. C.Na2CO3 D.
【实验三】用气压传感器测得曲线1 和2,要证明CO2 与NaOH 一定发生了反应,左瓶中应加入______;曲线 1 变化平缓的原因是______。
【反思】上述实验的设计思想是通过证明______,来判断化学反应的发生。
19.某同学取一定浓度盐酸与石灰石反应,将生成的气体通入澄清石灰水中,始终未见浑浊。为了弄清原因,他设计以下方案,进行探究、验证,请你帮他补充完整以下内容。
问题猜想 实验步骤 实验现象 实验结论
原因一:石灰水已完全变质 取少量未通入CO2的澄清石灰水于试管中,向试管中滴加__试剂。 溶液_____色 猜想的结论正确
原因二:产生的CO2中带有HCl气体 将盐酸与石灰石反应生成的气体通入___试剂中。 有___沉淀产生
20.利用下图所示装置进行实验。
(1)A中电子秤示数变化的原因是______。
(2)B中观察到的现象为______。
(3)C中反应的化学方程式为______。
(4)以上实验能验证质量守恒定律的是______(填序号)。
五、计算题
21.纯碱(主要成分为碳酸钠)中常含有少量氯化钠。化学兴趣小组的同学为了测定实验室中某盐酸的溶质质量分数,称取了某品牌纯碱样品12g进行了以下实验:将样品置于烧杯中,取50g此稀盐酸分五次加入其中,测得的有关数据如下表所示。
第一次 第二次 第三次 第四次 第五次
加入稀盐酸质量/ 10 10 10 10 10
烧杯中剩余物的质量/ 20.9 29.8 47.6 57.6
试计算:
(1)表中a的值为______。
(2)实验中产生二氧化碳的总质量为______。
(3)所用稀盐酸中溶质的质量分数。(写出计算过程,计算结果保留一位小数)
22.长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。某研究性学习小组为测定水垢中碳酸钙的质量分数,将100.0g稀盐酸加人到10.0g水垢中。恰好完全反应后,容器内剩余物质的质量为106.7g。请回答:
(1)生成CO2气体的质量为________g。
(2)求测得水垢中碳酸钙的质量分数。
23.为测定某CuSO4溶液中溶质的质量分数,取150gCuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50gCuSO4溶液完全反应时,所得沉淀的质量为______________g。
(2)CuSO4溶液中溶质的质量分数。
24.工业纯碱中含少量氯化钠。兴趣小组采用如图装置测定工业纯碱样品中碳酸钠的质量分数。称取12g样品与足量的稀盐酸充分反应,生成的二氧化碳通入乙装置,实验测得乙装置增加的质量为 4.4g。
(1)计算样品中碳酸钠的质量。
(2)实验分析:该方法测得的碳酸钠的质量分数偏______,原因是______。
试卷第1页,共3页
参考答案:
1.C
2.A
3.B
4.D
5.A
6.B
7.B
8.B
9.B
10.B
11.B
12.D
13.3CO+Fe2O33CO2+2Fe
14. 先有气泡产生,后产生白色沉淀。
15. 3CO + Fe2O3 3CO2 + 2Fe AC
16. NH4HCO3 FeCl3、CaCO3 Na2CO3 Na2SO4 BaCl2 + CO2+2NaOH=BaCO3 ↓ +2NaCl+ H2O
17. NaOH Na2SO4 红棕色固体逐渐减少,溶液由无色变为黄色 生铁
18. 溶液由红色变为无色 A 20mL水 CO2 在水中的溶解度较小且与水反应的量小 反应物已转化为其他物质
19. 无色酚酞 不变 硝酸银溶液 白色
20. 浓硫酸具有吸水性,会吸收空气中的水分 产生气泡,溶液由无色变为浅绿色 C
21.(1)38.7;(2)4.4g
(3)根据反应生成二氧化碳的质量,可求出稀盐酸中溶质的质量,根据溶质质量分数的计算公式计算稀盐酸中溶质的质量分数。
设参加反应的HCl的总质量为x。
x=7.3g
稀盐酸中溶质的质量分数为(其他解法合理即可)
答:所用稀盐酸中溶质的质量分数为。
22.(1)3.3;
(2)解:设水垢中碳酸钙的质量分数为x
x=75%。
答:水垢中碳酸钙的质量分数为75%。
23.(1)9.8g (2)32%
24.(1)解:设样品中碳酸钠的质量为x
答:样品中碳酸钠的质量为10.6g。
(2)大;乙装置中氢氧化钠会吸收来自于甲装置中挥发出的氯化氢气体
答案第1页,共2页
答案第1页,共2页
一、单选题
1.邵阳市某地盛产石膏矿,石膏矿的主要成分是CaSO4,CaSO4属于( )
A.单质
B.氧化物
C.盐
D.混合物
2.化学与生活息息相关,下列做法不科学的是( )
A.甲醛大量用于海鲜的防腐 B.明矾、活性炭用于净水
C.将易拉罐投入可回收垃圾箱 D.青少年常喝牛奶补充钙元素
3.下列物质间能够发生反应,但没有出现明显现象的是
A.将稀盐酸滴入盛石灰石的试管中
B.将CO2通入NaOH溶液中
C.将碳酸钠溶液滴入澄清石灰水中
D.将稀硫酸滴入NaCl溶液中
4.下列各组常见的固体物质中,用水不能区分的是
A.NaOH和NH4NO3
B.CuSO4和Na2SO4
C.Na2CO3和CaCO3
D.NaCl和KCl
5.下列化肥分别与熟石灰混合研磨后。能闻到刺激性气味的是
A.NH4Cl B.KNO3 C.NaNO3 D.Ca3(PO4)2
6.空气中含①N2 ②O2 ③稀有气体 ④水蒸气等成分,其中与钢铁生锈有关的是( )
A.①③ B.②④ C.③④ D.①④
7.下列金属中,金属活动性最强的是
A.铁 B.铝 C.铜 D.银
8.某干燥剂含有CaO、NaOH和CaCl2中的两种物质,为探究其成分,设计了如图所示实验.
则下列说法正确的是( )
A.a、b溶液一定只含两种溶质
B.b溶液中一定有NaOH和Na2CO3
C.白色固体一定不是纯净物
D.干燥剂一定由NaOH和CaCl2组成
9.验证铝、铜、银的金属活动性强弱,小明设计了以下四组实验,下列说法不正确的是
A.通过①②实验,可以证明金属活动性Al>Cu
B.通过①②③实验,可以证明金属活动性Al>Cu>Ag
C.若要用实验④证明金属活动性Al>Cu,X可以为Al,Y为CuSO4溶液
D.若要用实验④证明金属活动性Cu>Ag,X可以为Cu,Y为AgNO3溶液
10.根据金属活动性顺序判断,下列容器与所盛溶液不会发生化学反应的是
A.用铁制容器盛盐酸 B.用铜制容器盛盐酸
C.用铁制容器盛硝酸银溶液 D.用铜制容器盛硝酸银溶液
11.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
12.实验室欲测定一包黄铜样品中锌的质量分数(假设样品中只含铜和锌),取50g黄铜样品粉末于烧杯中,先加入100g稀硫酸,充分反应后得固液混合物149.8g,再继续加入200g相同浓度的稀硫酸,充分反应后过滤,得滤液312.6g,则黄铜样品中锌的质量分数为
A.39% B.74% C.61% D.26%
二、简答题
13.钢铁有工业的骨骼之称。工业上用赤铁矿(主要成分为Fe2O3)炼铁的化学方程式为_____。
14.用稀盐酸中和一定量氢氧化钙溶液时,溶液的pH与加入的稀盐酸质量的关系如图所示。
(1)请写出该反应的化学方程式________。
(2)若向c点溶液中逐滴滴加足量碳酸钠溶液,可观察到什么现象 _______
15.下图为我国发行的人民币硬币,主要材料含有铁、铝、铜等。
(1)工业上用赤铁矿(主要成分Fe2O3)炼铁的化学方程式为 _____ 。
(2)选择铸造硬币的材料,需要考虑的因素是 _____ (填序号)。
A 金属的硬度 B 金属的导电性 C 金属的耐腐蚀性
三、推断题
16.现有一包固体粉末,可能含有FeCl3、Na2SO4、NaOH、CaCO3、NH4HCO3、Na2CO3中的一种或几种.现做如下实验:
(1)取少量固体加热,无氨味,则原固体中一定不含_____.
(2)另取少量固体溶于水,得到无色澄清溶液,则原固体中一定不含_____.
(3)取(2)中溶液适量,滴加过量BaC12溶液,出现白色沉淀,过滤得固体A和滤液B.固体A能全部溶于稀硝酸并产生气泡.则原固体中一定含有_____,一定不含_____.
(4)向滤液B中通入CO2,产生白色沉淀,由此判断原固体中还含有NaOH.生成白色沉淀总反应的化学方程式_____.
17.图甲中A、B、C、D、E、F为初中化学常见的六种物质。其中B、C、F都是氧化物E、A、D是酸、碱、盐,炉具清洁剂中含有A,E的浓溶液可做干燥剂,F是赤铁矿的主要成分(图中用“—”表示两种物质间能发生反应,用“→”或“”表示两种物质间能单向或双向转化,部分反应物和生成物及反应条件已略去,图中部分反应需在溶液中进行,物质是溶液的只考虑溶质)。
(1)分别写出A、D物质的化学式。A_______,D________。
(2)E的稀溶液与过量的F发生反应的现象为________________。
(3)图乙是炼铁高炉的示意图,a处流出的物质是_________(填名称)。炉内产生图甲中气体C的化学方程式为________________。
四、实验题
18.如图三个实验均可验证无现象的化学反应发生了。
【实验一】当观察到______现象时,证明化学反应发生,化学方程式是______。
【实验二】加入 X 可验证稀硫酸与NaOH 能发生反应,符合此条件的X 是______。
A.FeCl3 B. C.Na2CO3 D.
【实验三】用气压传感器测得曲线1 和2,要证明CO2 与NaOH 一定发生了反应,左瓶中应加入______;曲线 1 变化平缓的原因是______。
【反思】上述实验的设计思想是通过证明______,来判断化学反应的发生。
19.某同学取一定浓度盐酸与石灰石反应,将生成的气体通入澄清石灰水中,始终未见浑浊。为了弄清原因,他设计以下方案,进行探究、验证,请你帮他补充完整以下内容。
问题猜想 实验步骤 实验现象 实验结论
原因一:石灰水已完全变质 取少量未通入CO2的澄清石灰水于试管中,向试管中滴加__试剂。 溶液_____色 猜想的结论正确
原因二:产生的CO2中带有HCl气体 将盐酸与石灰石反应生成的气体通入___试剂中。 有___沉淀产生
20.利用下图所示装置进行实验。
(1)A中电子秤示数变化的原因是______。
(2)B中观察到的现象为______。
(3)C中反应的化学方程式为______。
(4)以上实验能验证质量守恒定律的是______(填序号)。
五、计算题
21.纯碱(主要成分为碳酸钠)中常含有少量氯化钠。化学兴趣小组的同学为了测定实验室中某盐酸的溶质质量分数,称取了某品牌纯碱样品12g进行了以下实验:将样品置于烧杯中,取50g此稀盐酸分五次加入其中,测得的有关数据如下表所示。
第一次 第二次 第三次 第四次 第五次
加入稀盐酸质量/ 10 10 10 10 10
烧杯中剩余物的质量/ 20.9 29.8 47.6 57.6
试计算:
(1)表中a的值为______。
(2)实验中产生二氧化碳的总质量为______。
(3)所用稀盐酸中溶质的质量分数。(写出计算过程,计算结果保留一位小数)
22.长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。某研究性学习小组为测定水垢中碳酸钙的质量分数,将100.0g稀盐酸加人到10.0g水垢中。恰好完全反应后,容器内剩余物质的质量为106.7g。请回答:
(1)生成CO2气体的质量为________g。
(2)求测得水垢中碳酸钙的质量分数。
23.为测定某CuSO4溶液中溶质的质量分数,取150gCuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50gCuSO4溶液完全反应时,所得沉淀的质量为______________g。
(2)CuSO4溶液中溶质的质量分数。
24.工业纯碱中含少量氯化钠。兴趣小组采用如图装置测定工业纯碱样品中碳酸钠的质量分数。称取12g样品与足量的稀盐酸充分反应,生成的二氧化碳通入乙装置,实验测得乙装置增加的质量为 4.4g。
(1)计算样品中碳酸钠的质量。
(2)实验分析:该方法测得的碳酸钠的质量分数偏______,原因是______。
试卷第1页,共3页
参考答案:
1.C
2.A
3.B
4.D
5.A
6.B
7.B
8.B
9.B
10.B
11.B
12.D
13.3CO+Fe2O33CO2+2Fe
14. 先有气泡产生,后产生白色沉淀。
15. 3CO + Fe2O3 3CO2 + 2Fe AC
16. NH4HCO3 FeCl3、CaCO3 Na2CO3 Na2SO4 BaCl2 + CO2+2NaOH=BaCO3 ↓ +2NaCl+ H2O
17. NaOH Na2SO4 红棕色固体逐渐减少,溶液由无色变为黄色 生铁
18. 溶液由红色变为无色 A 20mL水 CO2 在水中的溶解度较小且与水反应的量小 反应物已转化为其他物质
19. 无色酚酞 不变 硝酸银溶液 白色
20. 浓硫酸具有吸水性,会吸收空气中的水分 产生气泡,溶液由无色变为浅绿色 C
21.(1)38.7;(2)4.4g
(3)根据反应生成二氧化碳的质量,可求出稀盐酸中溶质的质量,根据溶质质量分数的计算公式计算稀盐酸中溶质的质量分数。
设参加反应的HCl的总质量为x。
x=7.3g
稀盐酸中溶质的质量分数为(其他解法合理即可)
答:所用稀盐酸中溶质的质量分数为。
22.(1)3.3;
(2)解:设水垢中碳酸钙的质量分数为x
x=75%。
答:水垢中碳酸钙的质量分数为75%。
23.(1)9.8g (2)32%
24.(1)解:设样品中碳酸钠的质量为x
答:样品中碳酸钠的质量为10.6g。
(2)大;乙装置中氢氧化钠会吸收来自于甲装置中挥发出的氯化氢气体
答案第1页,共2页
答案第1页,共2页
