第12章盐章末复习-2021-2022学年九年级化学京改版(2013)下册(word版有答案)
文档属性
| 名称 | 第12章盐章末复习-2021-2022学年九年级化学京改版(2013)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 228.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-17 14:41:43 | ||
图片预览

文档简介
第12章盐章末复习2021-2022学年九年级化学京改版(2013)下册
一、单选题
1.Na2CO3俗称纯碱,侯德榜为纯碱工业的发展做出了杰出贡献。Na2CO3属于
A.氧化物
B.盐
C.有机物
D.混合物
2.叶子发黄的水稻易倒伏,专家建议施用含钾的复合肥料。下列肥料符合要求的是
A.NH4NO3 B.KNO3 C.NH4H2PO4 D.K2SO4
3.下列有关X、Y所表示的概念之间存在如图所示交叉关系的是
选项 A B C D
概念 X 金属 纯净物 盐 化合反应
Y 单质 混合物 碳酸盐 氧化反应
A.A B.B C.C D.D
4.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
5.下列有关纯碱的说法正确的是
A.纯碱难溶于水
B.纯碱是碱而不是盐
C.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产
D.纯碱中含有少量的小苏打可以用稀盐酸除去
6.下列各组常见的固体物质中,用水不能区分的是
A.NaOH和NH4NO3
B.CuSO4和Na2SO4
C.Na2CO3和CaCO3
D.NaCl和KCl
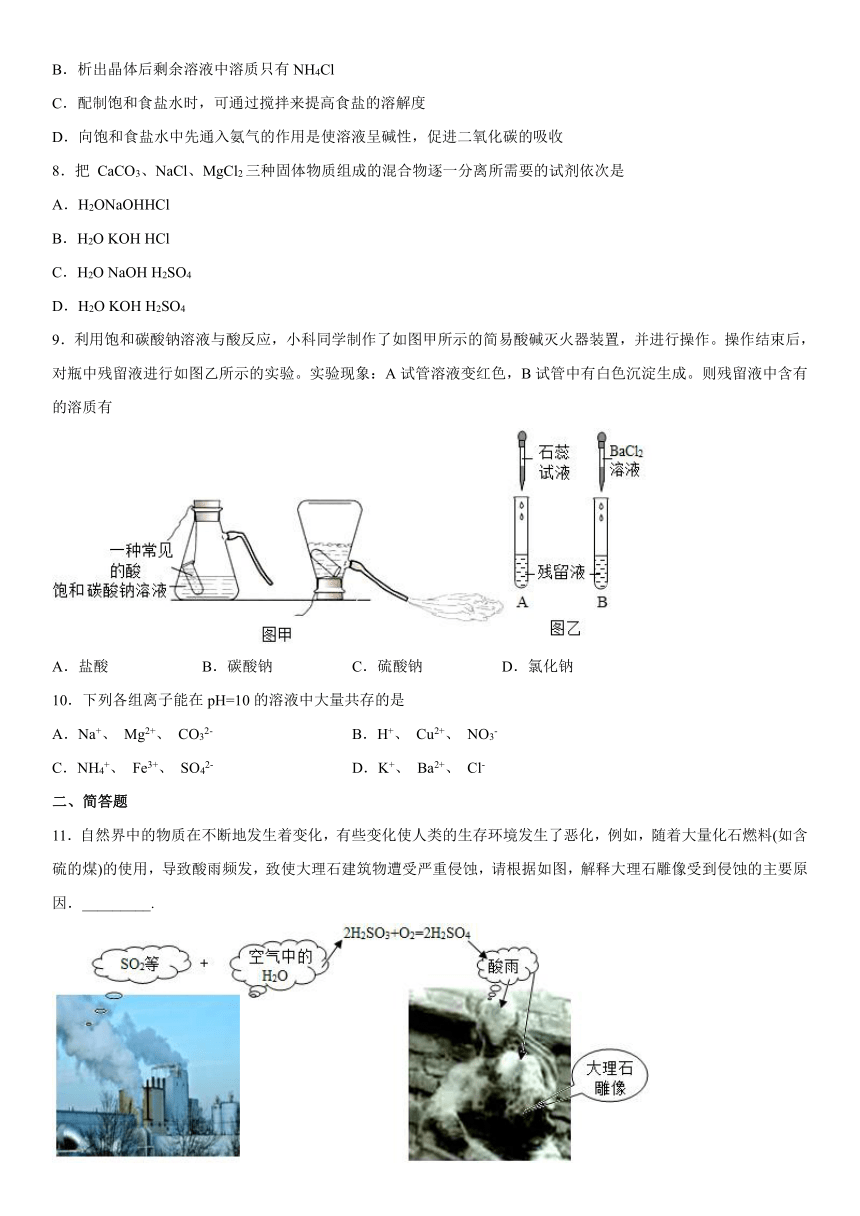
7.“NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl”是著名的“侯氏制碱法”的重要反应。下列有关叙述正确的是
A.NaHCO3是纯碱
B.析出晶体后剩余溶液中溶质只有NH4Cl
C.配制饱和食盐水时,可通过搅拌来提高食盐的溶解度
D.向饱和食盐水中先通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收
8.把 CaCO3、NaCl、MgCl2三种固体物质组成的混合物逐一分离所需要的试剂依次是
A.H2ONaOHHCl
B.H2O KOH HCl
C.H2O NaOH H2SO4
D.H2O KOH H2SO4
9.利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有
A.盐酸 B.碳酸钠 C.硫酸钠 D.氯化钠
10.下列各组离子能在pH=10的溶液中大量共存的是
A.Na+、 Mg2+、 CO32- B.H+、 Cu2+、 NO3-
C.NH4+、 Fe3+、 SO42- D.K+、 Ba2+、 Cl-
二、简答题
11.自然界中的物质在不断地发生着变化,有些变化使人类的生存环境发生了恶化,例如,随着大量化石燃料(如含硫的煤)的使用,导致酸雨频发,致使大理石建筑物遭受严重侵蚀,请根据如图,解释大理石雕像受到侵蚀的主要原因._________.
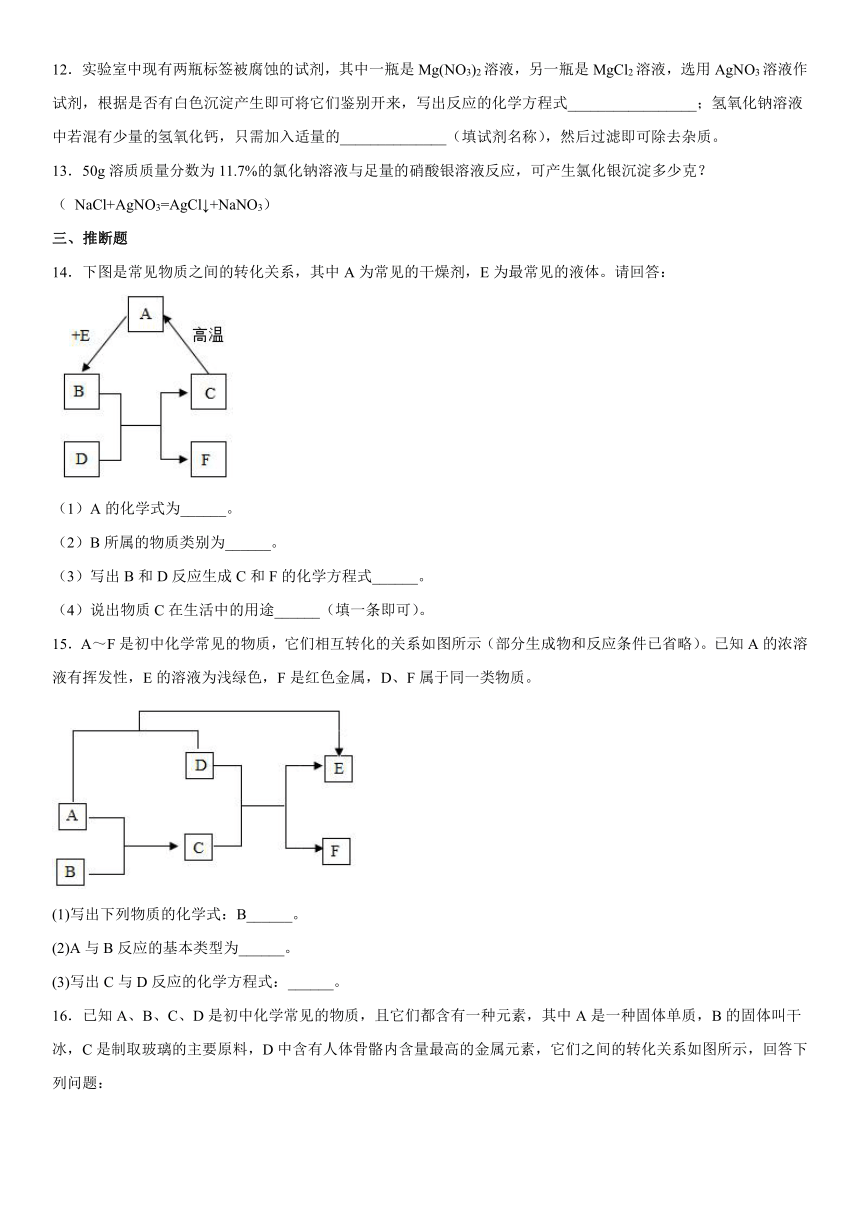
12.实验室中现有两瓶标签被腐蚀的试剂,其中一瓶是Mg(NO3)2溶液,另一瓶是MgCl2溶液,选用AgNO3溶液作试剂,根据是否有白色沉淀产生即可将它们鉴别开来,写出反应的化学方程式_________________;氢氧化钠溶液中若混有少量的氢氧化钙,只需加入适量的______________(填试剂名称),然后过滤即可除去杂质。
13.50g溶质质量分数为11.7%的氯化钠溶液与足量的硝酸银溶液反应,可产生氯化银沉淀多少克?( NaCl+AgNO3=AgCl↓+NaNO3)
三、推断题
14.下图是常见物质之间的转化关系,其中A为常见的干燥剂,E为最常见的液体。请回答:
(1)A的化学式为______。
(2)B所属的物质类别为______。
(3)写出B和D反应生成C和F的化学方程式______。
(4)说出物质C在生活中的用途______(填一条即可)。
15.A~F是初中化学常见的物质,它们相互转化的关系如图所示(部分生成物和反应条件已省略)。已知A的浓溶液有挥发性,E的溶液为浅绿色,F是红色金属,D、F属于同一类物质。
(1)写出下列物质的化学式:B______。
(2)A与B反应的基本类型为______。
(3)写出C与D反应的化学方程式:______。
16.已知A、B、C、D是初中化学常见的物质,且它们都含有一种元素,其中A是一种固体单质,B的固体叫干冰,C是制取玻璃的主要原料,D中含有人体骨骼内含量最高的金属元素,它们之间的转化关系如图所示,回答下列问题:
(1)写出A、D的化学式:A___________;D___________.
(2)将B通入水中,所得溶液的pH_______(填“>7”、“<7”或“=7”)。
(3)写出B转化为C的化学方程式_________________。
17.有一包不纯的NaOH粉末,可能含有Na2SO4、NaCl、CuCl2、NH4Cl、Na2CO3、MgCl2中的一种或几种,为分析含有的杂质,现进行如下实验。
(1)取样溶于水,无固体残留,得无色溶液X。则此粉末中一定不含_________。
(2)取溶液X适量,微热,无氨味。则此粉末中一定不含______
(3)另取溶液X适量,滴加BaCl溶液,有白色沉淀,再加入足量稀HNO,沉淀全部溶解,则此粉末中一定不含__,沉淀溶解的反应方程式为______
(4)为进一步探究该粉末的成分,可另取溶液X适量,滴加过量M溶液,再滴加N溶液,观察现象。M、N分别为______(选填序号)。
a 硝酸钡、硝酸银 b 稀硝酸、硝酸银 c 氯化钡、硝酸银
四、实验题
18.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
19.化学实验室中有失去标签的四瓶无色溶液,稀盐酸、氢氧化钙溶液、碳酸钠溶液、酚酞试液,现将其任意编号为A、B、C、D,然后两两组合进行实验,其中部分现象如下表:
实验 A+B A+C B+C B+D
现象 溶液变红 溶液变红 产生沉淀 产生气体
请回答:
(1) D的化学式是______________;
(2) B与C反应的化学方程式为______________;反应所属的类型是______________。
20.实验设计是化学实验的重要环节,请根据下列实验要求回答相关问题。
(1)实验一中振荡三个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为_____;对比A瓶与_____(填“B”或“C”)瓶的实验现象,可证明二氧化碳能与氢氧化钠发生反应。
(2)实验二观察到C装置中发生的现象是干燥的蓝色石蕊试纸不变色,而湿润的蓝色石蕊试纸变_____色,结论是_____.(用化学方程式表示)。
五、计算题
21.0.9%的氯化钠溶液称作生理盐水。
(1)生理盐水中的溶剂是 。
(2)若氯化钠来配制100g0.9%的生理盐水,需加水 g。
22.一瓶久置的固体氢氧化钠,部分变质为碳酸钠。为测定该瓶固体中氢氧化钠的质量分数,取样品 20 g,加入 80 g 水使其完全溶解,再加入一定溶质质量分数为 20%氢氧化钡溶液,恰好完全反应,过滤,得到白色沉淀 19.7 g。计算:
(1)该样品中氢氧化钠的质量分数;
(2)反应后所得滤液中溶质的质量分数(计算结果精确到 0.1%)。
23.用光卤石为原料提取的氯化钾产品中含有氯化镁杂质,产品等级中氯化钾指标为:
指标名称 优良品 一级品 二级品
氯化钾质量分数(≥) 93.00% 90.00% 87.00%
为确定某氯化钾产品等级进行了以下实验:
步骤一(溶解):取40.0g氯化钾产品溶于水,配制成溶液。
步骤二(沉淀):向步骤一所得溶液中加入过量的质量分数为10%的氢氧化钾溶液112.0g,充分反应后过滤,得2.9g沉淀和一定质量的滤液。
步骤三(回收):向步骤二所得滤液中加入盐酸至溶液呈中性,得到400.0g溶液,将所得溶液蒸发结晶,回收氯化钾固体。
回答下列问题:(提示:KCl溶液呈中性;不考虑实验过程中的损失)
(1)通过计算判断该产品的等级。(写出解题过程)
(2)步骤三所得溶液中氯化钾的质量分数为 。
试卷第1页,共3页
参考答案:
1.B
2.B
3.D
4.D
5.C
6.D
7.D
8.A
9.C
10.D
11.大理石的主要成分是碳酸钙,碳酸钙能和酸雨中的酸性物质反应,侵蚀大理石
12. 2AgNO3+MgCl2=Mg(NO3)2+2AgCl 碳酸钠溶液
13.可产生氯化银沉淀为14.35g.
14. CaO 碱 补钙(合理即可)
15.(1)CuO或Cu(OH)2
(2)复分解反应
(3)
16. C CaCO3 <7 CO2+2NaOH=Na2CO3+H2O
17. CuCl2 MgCl2 NH4Cl Na2SO4 BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑ b
18. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
19. HCl Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 复分解反应
20. Ca(OH)2+CO2==CaCO3↓+H2O C 红色 H2O+CO2==H2CO3
21.(1)水 (2)99.1
22.(1)47%;(2)10.5%
23.(1)二级品;(2)3.725%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.Na2CO3俗称纯碱,侯德榜为纯碱工业的发展做出了杰出贡献。Na2CO3属于
A.氧化物
B.盐
C.有机物
D.混合物
2.叶子发黄的水稻易倒伏,专家建议施用含钾的复合肥料。下列肥料符合要求的是
A.NH4NO3 B.KNO3 C.NH4H2PO4 D.K2SO4
3.下列有关X、Y所表示的概念之间存在如图所示交叉关系的是
选项 A B C D
概念 X 金属 纯净物 盐 化合反应
Y 单质 混合物 碳酸盐 氧化反应
A.A B.B C.C D.D
4.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
5.下列有关纯碱的说法正确的是
A.纯碱难溶于水
B.纯碱是碱而不是盐
C.纯碱既可从内陆盐湖提取,又可用“侯氏联合制碱法”生产
D.纯碱中含有少量的小苏打可以用稀盐酸除去
6.下列各组常见的固体物质中,用水不能区分的是
A.NaOH和NH4NO3
B.CuSO4和Na2SO4
C.Na2CO3和CaCO3
D.NaCl和KCl
7.“NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl”是著名的“侯氏制碱法”的重要反应。下列有关叙述正确的是
A.NaHCO3是纯碱
B.析出晶体后剩余溶液中溶质只有NH4Cl
C.配制饱和食盐水时,可通过搅拌来提高食盐的溶解度
D.向饱和食盐水中先通入氨气的作用是使溶液呈碱性,促进二氧化碳的吸收
8.把 CaCO3、NaCl、MgCl2三种固体物质组成的混合物逐一分离所需要的试剂依次是
A.H2ONaOHHCl
B.H2O KOH HCl
C.H2O NaOH H2SO4
D.H2O KOH H2SO4
9.利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有
A.盐酸 B.碳酸钠 C.硫酸钠 D.氯化钠
10.下列各组离子能在pH=10的溶液中大量共存的是
A.Na+、 Mg2+、 CO32- B.H+、 Cu2+、 NO3-
C.NH4+、 Fe3+、 SO42- D.K+、 Ba2+、 Cl-
二、简答题
11.自然界中的物质在不断地发生着变化,有些变化使人类的生存环境发生了恶化,例如,随着大量化石燃料(如含硫的煤)的使用,导致酸雨频发,致使大理石建筑物遭受严重侵蚀,请根据如图,解释大理石雕像受到侵蚀的主要原因._________.
12.实验室中现有两瓶标签被腐蚀的试剂,其中一瓶是Mg(NO3)2溶液,另一瓶是MgCl2溶液,选用AgNO3溶液作试剂,根据是否有白色沉淀产生即可将它们鉴别开来,写出反应的化学方程式_________________;氢氧化钠溶液中若混有少量的氢氧化钙,只需加入适量的______________(填试剂名称),然后过滤即可除去杂质。
13.50g溶质质量分数为11.7%的氯化钠溶液与足量的硝酸银溶液反应,可产生氯化银沉淀多少克?( NaCl+AgNO3=AgCl↓+NaNO3)
三、推断题
14.下图是常见物质之间的转化关系,其中A为常见的干燥剂,E为最常见的液体。请回答:
(1)A的化学式为______。
(2)B所属的物质类别为______。
(3)写出B和D反应生成C和F的化学方程式______。
(4)说出物质C在生活中的用途______(填一条即可)。
15.A~F是初中化学常见的物质,它们相互转化的关系如图所示(部分生成物和反应条件已省略)。已知A的浓溶液有挥发性,E的溶液为浅绿色,F是红色金属,D、F属于同一类物质。
(1)写出下列物质的化学式:B______。
(2)A与B反应的基本类型为______。
(3)写出C与D反应的化学方程式:______。
16.已知A、B、C、D是初中化学常见的物质,且它们都含有一种元素,其中A是一种固体单质,B的固体叫干冰,C是制取玻璃的主要原料,D中含有人体骨骼内含量最高的金属元素,它们之间的转化关系如图所示,回答下列问题:
(1)写出A、D的化学式:A___________;D___________.
(2)将B通入水中,所得溶液的pH_______(填“>7”、“<7”或“=7”)。
(3)写出B转化为C的化学方程式_________________。
17.有一包不纯的NaOH粉末,可能含有Na2SO4、NaCl、CuCl2、NH4Cl、Na2CO3、MgCl2中的一种或几种,为分析含有的杂质,现进行如下实验。
(1)取样溶于水,无固体残留,得无色溶液X。则此粉末中一定不含_________。
(2)取溶液X适量,微热,无氨味。则此粉末中一定不含______
(3)另取溶液X适量,滴加BaCl溶液,有白色沉淀,再加入足量稀HNO,沉淀全部溶解,则此粉末中一定不含__,沉淀溶解的反应方程式为______
(4)为进一步探究该粉末的成分,可另取溶液X适量,滴加过量M溶液,再滴加N溶液,观察现象。M、N分别为______(选填序号)。
a 硝酸钡、硝酸银 b 稀硝酸、硝酸银 c 氯化钡、硝酸银
四、实验题
18.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
19.化学实验室中有失去标签的四瓶无色溶液,稀盐酸、氢氧化钙溶液、碳酸钠溶液、酚酞试液,现将其任意编号为A、B、C、D,然后两两组合进行实验,其中部分现象如下表:
实验 A+B A+C B+C B+D
现象 溶液变红 溶液变红 产生沉淀 产生气体
请回答:
(1) D的化学式是______________;
(2) B与C反应的化学方程式为______________;反应所属的类型是______________。
20.实验设计是化学实验的重要环节,请根据下列实验要求回答相关问题。
(1)实验一中振荡三个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为_____;对比A瓶与_____(填“B”或“C”)瓶的实验现象,可证明二氧化碳能与氢氧化钠发生反应。
(2)实验二观察到C装置中发生的现象是干燥的蓝色石蕊试纸不变色,而湿润的蓝色石蕊试纸变_____色,结论是_____.(用化学方程式表示)。
五、计算题
21.0.9%的氯化钠溶液称作生理盐水。
(1)生理盐水中的溶剂是 。
(2)若氯化钠来配制100g0.9%的生理盐水,需加水 g。
22.一瓶久置的固体氢氧化钠,部分变质为碳酸钠。为测定该瓶固体中氢氧化钠的质量分数,取样品 20 g,加入 80 g 水使其完全溶解,再加入一定溶质质量分数为 20%氢氧化钡溶液,恰好完全反应,过滤,得到白色沉淀 19.7 g。计算:
(1)该样品中氢氧化钠的质量分数;
(2)反应后所得滤液中溶质的质量分数(计算结果精确到 0.1%)。
23.用光卤石为原料提取的氯化钾产品中含有氯化镁杂质,产品等级中氯化钾指标为:
指标名称 优良品 一级品 二级品
氯化钾质量分数(≥) 93.00% 90.00% 87.00%
为确定某氯化钾产品等级进行了以下实验:
步骤一(溶解):取40.0g氯化钾产品溶于水,配制成溶液。
步骤二(沉淀):向步骤一所得溶液中加入过量的质量分数为10%的氢氧化钾溶液112.0g,充分反应后过滤,得2.9g沉淀和一定质量的滤液。
步骤三(回收):向步骤二所得滤液中加入盐酸至溶液呈中性,得到400.0g溶液,将所得溶液蒸发结晶,回收氯化钾固体。
回答下列问题:(提示:KCl溶液呈中性;不考虑实验过程中的损失)
(1)通过计算判断该产品的等级。(写出解题过程)
(2)步骤三所得溶液中氯化钾的质量分数为 。
试卷第1页,共3页
参考答案:
1.B
2.B
3.D
4.D
5.C
6.D
7.D
8.A
9.C
10.D
11.大理石的主要成分是碳酸钙,碳酸钙能和酸雨中的酸性物质反应,侵蚀大理石
12. 2AgNO3+MgCl2=Mg(NO3)2+2AgCl 碳酸钠溶液
13.可产生氯化银沉淀为14.35g.
14. CaO 碱 补钙(合理即可)
15.(1)CuO或Cu(OH)2
(2)复分解反应
(3)
16. C CaCO3 <7 CO2+2NaOH=Na2CO3+H2O
17. CuCl2 MgCl2 NH4Cl Na2SO4 BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑ b
18. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
19. HCl Ca(OH)2+Na2CO3═CaCO3↓+2NaOH 复分解反应
20. Ca(OH)2+CO2==CaCO3↓+H2O C 红色 H2O+CO2==H2CO3
21.(1)水 (2)99.1
22.(1)47%;(2)10.5%
23.(1)二级品;(2)3.725%
答案第1页,共2页
答案第1页,共2页
