第八章常见的酸、碱、盐单元训练--2021-2022学年九年级化学科粤版(2012)下册(word版含答案)
文档属性
| 名称 | 第八章常见的酸、碱、盐单元训练--2021-2022学年九年级化学科粤版(2012)下册(word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 102.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-17 00:00:00 | ||
图片预览


文档简介
第八章常见的酸、碱、盐 训练2021-2022学年九年级化学科粤版(2012)下册
一、单选题
1.家庭中一些常见物质的pH如下表所示:
物质 食醋 酱油 食盐水 牙膏 肥皂
pH 2~3 4~5 7 8~9 9~10
夏天我们被蚊虫叮咬后,蚊虫会在人的皮肤内分泌蚁酸(一种酸),从而使皮肤肿痛。要减轻痛痒,可在叮咬处涂抹下列物质中的A.食醋 B.酱油 C.肥皂水 D.食盐水
2.下列有关碳及碳的化合物的说法正确的是
A.金刚石、石墨和C60的化学性质相似,物理性质有很大差异,是因为它们由不同的原子构成
B.煤炉上放一盆水就能防止一氧化碳中毒
C.碳酸钙在医疗上可用作补钙剂
D.空气中二氧化碳含量过高可形成酸雨
3.兴趣小组的同学利用下图装置,探究化学反应前后物质的质量是否守恒。应选用的药品是
A.铁粉和稀盐酸液体中
B.硝酸钾晶体和水
C.碳酸钡粉末和稀硫酸
D.铜粉和硝酸银溶液
4.下列物质的用途,一定涉及化学变化的是
A.金具有黄色金属光泽 制作饰品
B.活性炭具有吸附性 作除味剂
C.生石灰吸收空气中的水分 作干燥剂
D.干冰升华吸收大量的热 作制冷剂
5.若利用碱的性质进行下列实验,不能达到相应目的的是
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
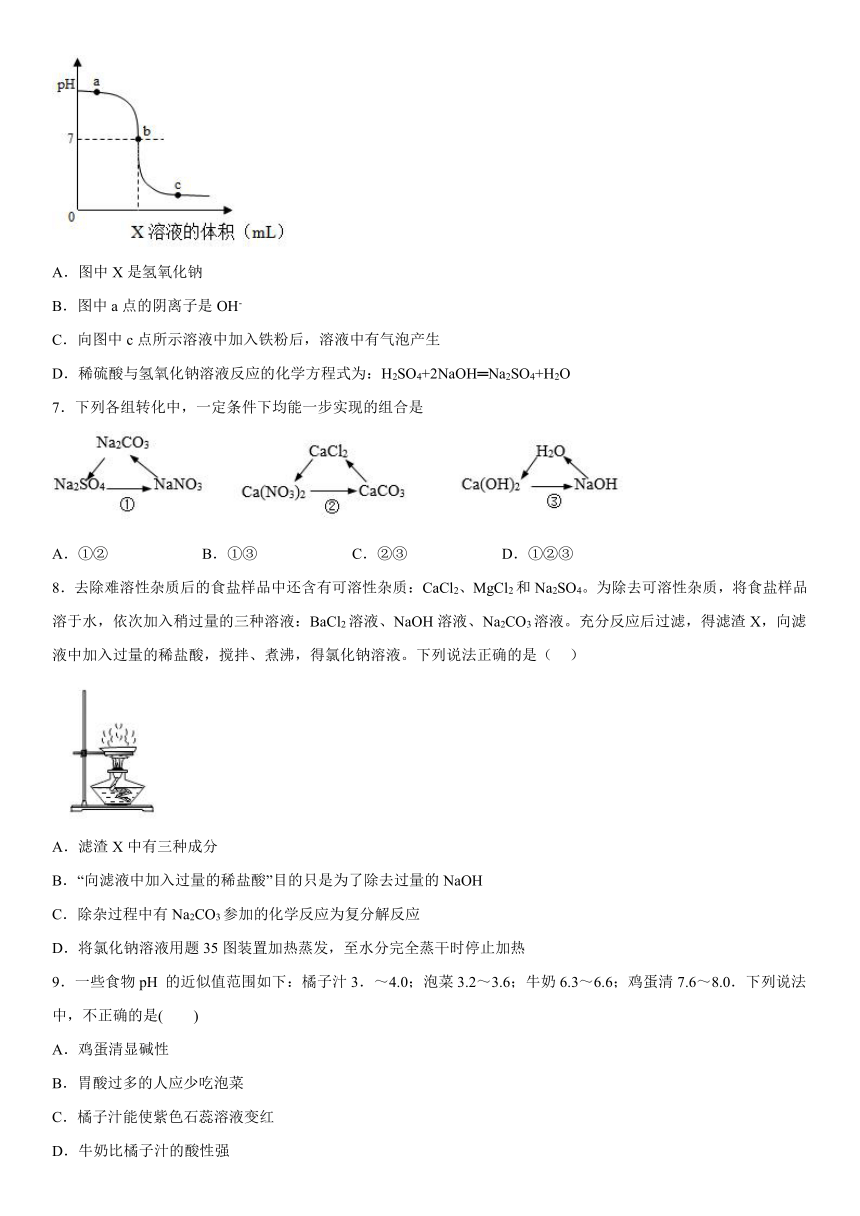
6.如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化曲线。下列有关说法正确的是( )
A.图中X是氢氧化钠
B.图中a点的阴离子是OH-
C.向图中c点所示溶液中加入铁粉后,溶液中有气泡产生
D.稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O
7.下列各组转化中,一定条件下均能一步实现的组合是
A.①② B.①③ C.②③ D.①②③
8.去除难溶性杂质后的食盐样品中还含有可溶性杂质:CaCl2、MgCl2和Na2SO4。为除去可溶性杂质,将食盐样品溶于水,依次加入稍过量的三种溶液:BaCl2溶液、NaOH溶液、Na2CO3溶液。充分反应后过滤,得滤渣X,向滤液中加入过量的稀盐酸,搅拌、煮沸,得氯化钠溶液。下列说法正确的是( )
A.滤渣X中有三种成分
B.“向滤液中加入过量的稀盐酸”目的只是为了除去过量的NaOH
C.除杂过程中有Na2CO3参加的化学反应为复分解反应
D.将氯化钠溶液用题35图装置加热蒸发,至水分完全蒸干时停止加热
9.一些食物pH 的近似值范围如下:橘子汁3.~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0.下列说法中,不正确的是( )
A.鸡蛋清显碱性
B.胃酸过多的人应少吃泡菜
C.橘子汁能使紫色石蕊溶液变红
D.牛奶比橘子汁的酸性强
10.化学肥料和农药对农业的高产丰收具有重要作用。下列有关说法错误的是
A.KNO3 是复合肥料
B.残留农药可通过农作物转移到人体中
C.熟石灰可用于改良酸性土壤
D.化肥能提高粮食产量,施用越多越好
11.某实验小组将Ba(OH)2溶液逐滴滴入硫酸溶液中,溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示。下列说法错误的是( )
A.a点溶液为酸性
B.b点恰好完全反应
C.c点溶液的溶质为硫酸
D.b、c两点沉淀质量相等
二、简答题
12.课后,小明取氢氧化钠溶液,滴加氯化钙溶液后,有白色浑浊出现,为什么?________
13.铁锈的主要成分是________,将一枚生锈的铁钉放入足量的稀盐酸中,你首先观察到的现象是________,过一会儿,你还可以观察到的现象是________请写出有关反应的化学方程式________。
三、推断题
14.A、B、C、D、E、F是初中常见的物质,其中A是可参与光合作用的气体,B是酸溶液,C为黑色粉末,D为钡盐溶液,E俗称纯碱, F为盐溶液,它们之间的转化关系如图所示(“→”表示一种物质可以转化另一种物质,“——”表示两种物质间能发生反应,图中已略去部分物质)。
(1)B物质或B的溶质的化学式为 _____________ 。
(2)D + F反应的化学方程式为 ____________________________ 。
(3)E → A反应的化学方程式 ________________________ 。
(4)写出一个A在生活中的用途: ________________________ 。
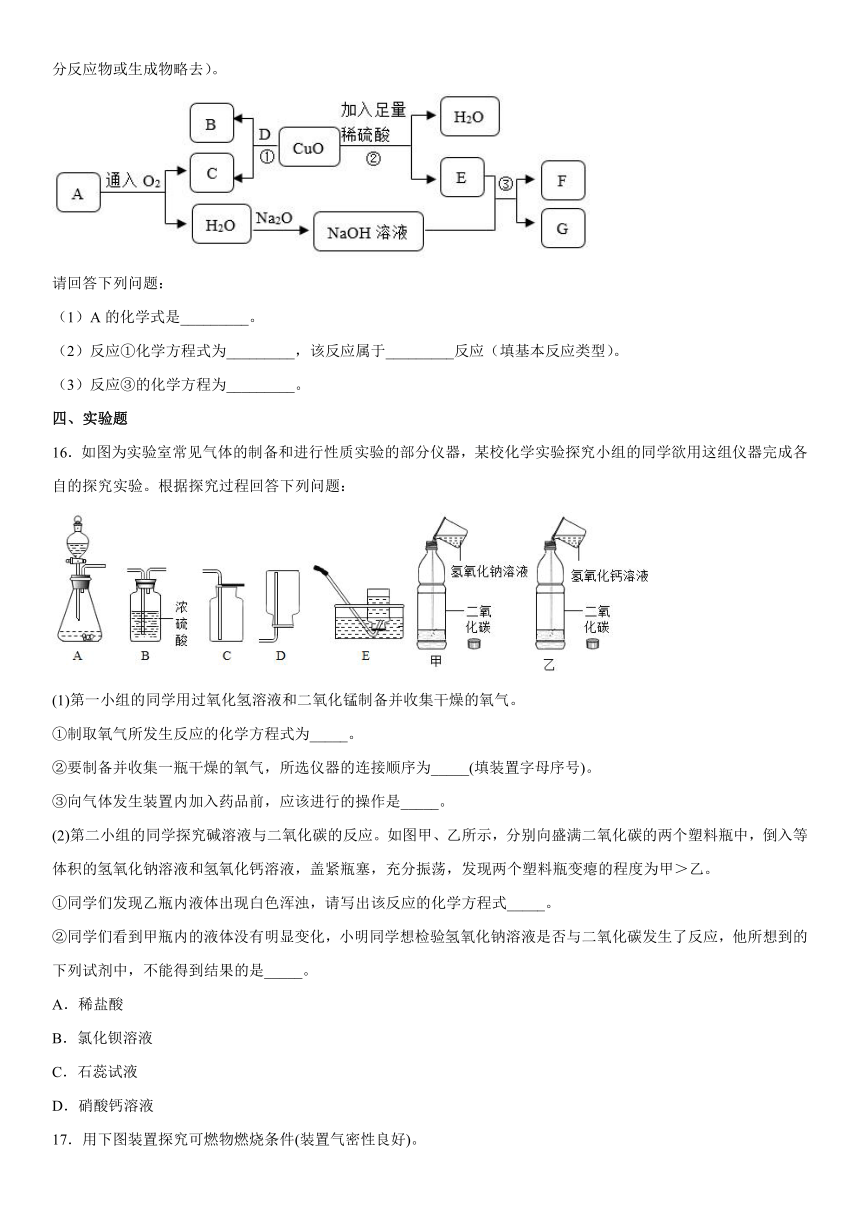
15.A~G为初中常见的七种物质,其中A是天然气的主要成分,D为单质,他们之间的相互关系如下图所示(部分反应物或生成物略去)。
请回答下列问题:
(1)A的化学式是_________。
(2)反应①化学方程式为_________,该反应属于_________反应(填基本反应类型)。
(3)反应③的化学方程为_________。
四、实验题
16.如图为实验室常见气体的制备和进行性质实验的部分仪器,某校化学实验探究小组的同学欲用这组仪器完成各自的探究实验。根据探究过程回答下列问题:
(1)第一小组的同学用过氧化氢溶液和二氧化锰制备并收集干燥的氧气。
①制取氧气所发生反应的化学方程式为_____。
②要制备并收集一瓶干燥的氧气,所选仪器的连接顺序为_____(填装置字母序号)。
③向气体发生装置内加入药品前,应该进行的操作是_____。
(2)第二小组的同学探究碱溶液与二氧化碳的反应。如图甲、乙所示,分别向盛满二氧化碳的两个塑料瓶中,倒入等体积的氢氧化钠溶液和氢氧化钙溶液,盖紧瓶塞,充分振荡,发现两个塑料瓶变瘪的程度为甲>乙。
①同学们发现乙瓶内液体出现白色浑浊,请写出该反应的化学方程式_____。
②同学们看到甲瓶内的液体没有明显变化,小明同学想检验氢氧化钠溶液是否与二氧化碳发生了反应,他所想到的下列试剂中,不能得到结果的是_____。
A.稀盐酸
B.氯化钡溶液
C.石蕊试液
D.硝酸钙溶液
17.用下图装置探究可燃物燃烧条件(装置气密性良好)。
已知:白磷的着火点为40℃。
步骤Ⅰ:点燃蜡烛,立即伸入瓶中并塞进瓶塞。
步骤Ⅱ:一段时间后,待蜡烛熄灭并冷却至室温,打开分液漏斗活塞,向锥形瓶中注入少量水,立即关闭活塞,观察到铝盒中的白磷燃烧。
(1)对比步骤Ⅰ中蜡烛点燃前后的现象,可得出可燃物燃烧的条件是_______。
(2)步骤Ⅱ中白磷燃烧的化学方程式为_______。
(3)分析上述实验,下列说法正确是_______(填序号)。
A 蜡烛燃烧耗尽了瓶内的氧气,所以蜡烛熄灭
B 蜡烛燃烧后瓶内还有少量氧气,但氧气浓度过低导致蜡烛熄灭
C 生石灰的作用是与水反应提供热量,并利用生成物吸收二氧化碳
18.现有一包固体粉末,可能含有Ba(OH)2、K2CO3、Na2SO4、MgCl2中的一种或几种,为确定其组成,进行如下实验:
步骤I:取少量样品于烧杯中,加入足量的水,充分搅拌,过滤得白色沉淀A和无色滤液B
步骤II:取步骤I所得白色沉淀A于试管中,加入足量稀盐酸,固体部分溶解且有气泡产生。
步骤III取步骤I所得无色滤液B于试管中,滴入少量Ba(OH)2溶液,无明显现象。
(1)白色沉淀A中一定存在的物质有________(填化学式);
(2)通过上述实验,可得到的实验结论是_______
(3)若只需一种试剂就能够进一步确定样品的组成,还需进行的实验操作是______
五、计算题
19.工业上常用煅烧石灰石的方法制取生石灰(氧化钙)和二氧化碳,某工厂现有石 灰石 125 吨,完全煅烧相关数据如图所示(杂质不参与反应)求:
(1)生成 CO2 的质量为_____t。
(2)所用石灰石中碳酸钙的质量分数。
20.洁厕灵的有效成分为HCl,李强同学测定某品牌洁厕灵中HCl的质量分数。他将100.0g洁厕灵倒入锥形瓶中,逐次加入等质量相同质量分数的Na2CO3溶液,测出每次完全反应后溶液的总质量,实验数据记录如下表。
第一次 第二次 第三次 第四次 第五次
加入Na2CO3溶液的质量/g 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.9 137.8 M 175.6 195.6
请根据实验数据分析解答下列问题:
(1)表格中M的数值为 。
(2)恰好完全反应时消耗Na2CO3的质量是多少
(3)该洁厕灵中HC1的质量分数是多少?
21.生活中有些胃药含有氢氧化铝|【Al(OH)3】。请回答下列问题:
(1)氢氧化铝在人的胃内起的作用是 。
(2)氢氧化铝中铝、氧、氢三种元素的质量比为 (写最简比);
(3)铝元素的质量分数为 。(结果精确至0.1%)
(4)在 g氢氧化铝中含有4.8g氧元素。
试卷第1页,共3页
参考答案:
1.C
2.C
3.D
4.C
5.C
6.C
7.C
8.C
9.D
10.D
11.C
12.氢氧化钠溶液变质后生成的碳酸钠溶液与氯化钙溶液反应生成碳酸钙白色沉淀
13. 氧化铁 溶液由无色变成黄色 产生气泡 Fe2O3+6HCl=2FeCl3+3H2O,Fe+2HCl=FeCl2+H2↑
14. HCl BaCl2 + AgNO3 =Ba(NO3)2 +2AgCl↓ Na2CO3+2HCl=2NaCl+H2O+CO2↑ 灭火
15. CH4 置换
16. 2H2O22H2O+O2↑ A、B、C 检查装置气密性 Ca(OH)2+CO2═CaCO3↓+H2O C
17. 温度达到着火点 4P+5O22P2O5 BC
18. BaCO3、BaSO4 固体粉末一定含有Ba(OH)2、Na2SO4、K2CO3,可能含有MgCl2 向步骤Ⅱ的上层清液滴加足量的氢氧化钠溶液
19.(1)44;
(2)解:设所用石灰石中碳酸钙的质量分数为x
x=80%
答:所用石灰石中碳酸钙的质量分数为80%。
20.(1)156.7;(2)10.6g;(3)7.3%
21.(1)中和胃酸
(2)9:16:1
(3)铝元素的质量分数为:
(4)含有4.8g氧元素的氢氧化铝的质量为:
答案第1页,共2页
答案第1页,共2页
一、单选题
1.家庭中一些常见物质的pH如下表所示:
物质 食醋 酱油 食盐水 牙膏 肥皂
pH 2~3 4~5 7 8~9 9~10
夏天我们被蚊虫叮咬后,蚊虫会在人的皮肤内分泌蚁酸(一种酸),从而使皮肤肿痛。要减轻痛痒,可在叮咬处涂抹下列物质中的A.食醋 B.酱油 C.肥皂水 D.食盐水
2.下列有关碳及碳的化合物的说法正确的是
A.金刚石、石墨和C60的化学性质相似,物理性质有很大差异,是因为它们由不同的原子构成
B.煤炉上放一盆水就能防止一氧化碳中毒
C.碳酸钙在医疗上可用作补钙剂
D.空气中二氧化碳含量过高可形成酸雨
3.兴趣小组的同学利用下图装置,探究化学反应前后物质的质量是否守恒。应选用的药品是
A.铁粉和稀盐酸液体中
B.硝酸钾晶体和水
C.碳酸钡粉末和稀硫酸
D.铜粉和硝酸银溶液
4.下列物质的用途,一定涉及化学变化的是
A.金具有黄色金属光泽 制作饰品
B.活性炭具有吸附性 作除味剂
C.生石灰吸收空气中的水分 作干燥剂
D.干冰升华吸收大量的热 作制冷剂
5.若利用碱的性质进行下列实验,不能达到相应目的的是
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
6.如图是室温下稀硫酸和氢氧化钠反应过程中的pH变化曲线。下列有关说法正确的是( )
A.图中X是氢氧化钠
B.图中a点的阴离子是OH-
C.向图中c点所示溶液中加入铁粉后,溶液中有气泡产生
D.稀硫酸与氢氧化钠溶液反应的化学方程式为:H2SO4+2NaOH═Na2SO4+H2O
7.下列各组转化中,一定条件下均能一步实现的组合是
A.①② B.①③ C.②③ D.①②③
8.去除难溶性杂质后的食盐样品中还含有可溶性杂质:CaCl2、MgCl2和Na2SO4。为除去可溶性杂质,将食盐样品溶于水,依次加入稍过量的三种溶液:BaCl2溶液、NaOH溶液、Na2CO3溶液。充分反应后过滤,得滤渣X,向滤液中加入过量的稀盐酸,搅拌、煮沸,得氯化钠溶液。下列说法正确的是( )
A.滤渣X中有三种成分
B.“向滤液中加入过量的稀盐酸”目的只是为了除去过量的NaOH
C.除杂过程中有Na2CO3参加的化学反应为复分解反应
D.将氯化钠溶液用题35图装置加热蒸发,至水分完全蒸干时停止加热
9.一些食物pH 的近似值范围如下:橘子汁3.~4.0;泡菜3.2~3.6;牛奶6.3~6.6;鸡蛋清7.6~8.0.下列说法中,不正确的是( )
A.鸡蛋清显碱性
B.胃酸过多的人应少吃泡菜
C.橘子汁能使紫色石蕊溶液变红
D.牛奶比橘子汁的酸性强
10.化学肥料和农药对农业的高产丰收具有重要作用。下列有关说法错误的是
A.KNO3 是复合肥料
B.残留农药可通过农作物转移到人体中
C.熟石灰可用于改良酸性土壤
D.化肥能提高粮食产量,施用越多越好
11.某实验小组将Ba(OH)2溶液逐滴滴入硫酸溶液中,溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示。下列说法错误的是( )
A.a点溶液为酸性
B.b点恰好完全反应
C.c点溶液的溶质为硫酸
D.b、c两点沉淀质量相等
二、简答题
12.课后,小明取氢氧化钠溶液,滴加氯化钙溶液后,有白色浑浊出现,为什么?________
13.铁锈的主要成分是________,将一枚生锈的铁钉放入足量的稀盐酸中,你首先观察到的现象是________,过一会儿,你还可以观察到的现象是________请写出有关反应的化学方程式________。
三、推断题
14.A、B、C、D、E、F是初中常见的物质,其中A是可参与光合作用的气体,B是酸溶液,C为黑色粉末,D为钡盐溶液,E俗称纯碱, F为盐溶液,它们之间的转化关系如图所示(“→”表示一种物质可以转化另一种物质,“——”表示两种物质间能发生反应,图中已略去部分物质)。
(1)B物质或B的溶质的化学式为 _____________ 。
(2)D + F反应的化学方程式为 ____________________________ 。
(3)E → A反应的化学方程式 ________________________ 。
(4)写出一个A在生活中的用途: ________________________ 。
15.A~G为初中常见的七种物质,其中A是天然气的主要成分,D为单质,他们之间的相互关系如下图所示(部分反应物或生成物略去)。
请回答下列问题:
(1)A的化学式是_________。
(2)反应①化学方程式为_________,该反应属于_________反应(填基本反应类型)。
(3)反应③的化学方程为_________。
四、实验题
16.如图为实验室常见气体的制备和进行性质实验的部分仪器,某校化学实验探究小组的同学欲用这组仪器完成各自的探究实验。根据探究过程回答下列问题:
(1)第一小组的同学用过氧化氢溶液和二氧化锰制备并收集干燥的氧气。
①制取氧气所发生反应的化学方程式为_____。
②要制备并收集一瓶干燥的氧气,所选仪器的连接顺序为_____(填装置字母序号)。
③向气体发生装置内加入药品前,应该进行的操作是_____。
(2)第二小组的同学探究碱溶液与二氧化碳的反应。如图甲、乙所示,分别向盛满二氧化碳的两个塑料瓶中,倒入等体积的氢氧化钠溶液和氢氧化钙溶液,盖紧瓶塞,充分振荡,发现两个塑料瓶变瘪的程度为甲>乙。
①同学们发现乙瓶内液体出现白色浑浊,请写出该反应的化学方程式_____。
②同学们看到甲瓶内的液体没有明显变化,小明同学想检验氢氧化钠溶液是否与二氧化碳发生了反应,他所想到的下列试剂中,不能得到结果的是_____。
A.稀盐酸
B.氯化钡溶液
C.石蕊试液
D.硝酸钙溶液
17.用下图装置探究可燃物燃烧条件(装置气密性良好)。
已知:白磷的着火点为40℃。
步骤Ⅰ:点燃蜡烛,立即伸入瓶中并塞进瓶塞。
步骤Ⅱ:一段时间后,待蜡烛熄灭并冷却至室温,打开分液漏斗活塞,向锥形瓶中注入少量水,立即关闭活塞,观察到铝盒中的白磷燃烧。
(1)对比步骤Ⅰ中蜡烛点燃前后的现象,可得出可燃物燃烧的条件是_______。
(2)步骤Ⅱ中白磷燃烧的化学方程式为_______。
(3)分析上述实验,下列说法正确是_______(填序号)。
A 蜡烛燃烧耗尽了瓶内的氧气,所以蜡烛熄灭
B 蜡烛燃烧后瓶内还有少量氧气,但氧气浓度过低导致蜡烛熄灭
C 生石灰的作用是与水反应提供热量,并利用生成物吸收二氧化碳
18.现有一包固体粉末,可能含有Ba(OH)2、K2CO3、Na2SO4、MgCl2中的一种或几种,为确定其组成,进行如下实验:
步骤I:取少量样品于烧杯中,加入足量的水,充分搅拌,过滤得白色沉淀A和无色滤液B
步骤II:取步骤I所得白色沉淀A于试管中,加入足量稀盐酸,固体部分溶解且有气泡产生。
步骤III取步骤I所得无色滤液B于试管中,滴入少量Ba(OH)2溶液,无明显现象。
(1)白色沉淀A中一定存在的物质有________(填化学式);
(2)通过上述实验,可得到的实验结论是_______
(3)若只需一种试剂就能够进一步确定样品的组成,还需进行的实验操作是______
五、计算题
19.工业上常用煅烧石灰石的方法制取生石灰(氧化钙)和二氧化碳,某工厂现有石 灰石 125 吨,完全煅烧相关数据如图所示(杂质不参与反应)求:
(1)生成 CO2 的质量为_____t。
(2)所用石灰石中碳酸钙的质量分数。
20.洁厕灵的有效成分为HCl,李强同学测定某品牌洁厕灵中HCl的质量分数。他将100.0g洁厕灵倒入锥形瓶中,逐次加入等质量相同质量分数的Na2CO3溶液,测出每次完全反应后溶液的总质量,实验数据记录如下表。
第一次 第二次 第三次 第四次 第五次
加入Na2CO3溶液的质量/g 20.0 20.0 20.0 20.0 20.0
反应后溶液的总质量/g 118.9 137.8 M 175.6 195.6
请根据实验数据分析解答下列问题:
(1)表格中M的数值为 。
(2)恰好完全反应时消耗Na2CO3的质量是多少
(3)该洁厕灵中HC1的质量分数是多少?
21.生活中有些胃药含有氢氧化铝|【Al(OH)3】。请回答下列问题:
(1)氢氧化铝在人的胃内起的作用是 。
(2)氢氧化铝中铝、氧、氢三种元素的质量比为 (写最简比);
(3)铝元素的质量分数为 。(结果精确至0.1%)
(4)在 g氢氧化铝中含有4.8g氧元素。
试卷第1页,共3页
参考答案:
1.C
2.C
3.D
4.C
5.C
6.C
7.C
8.C
9.D
10.D
11.C
12.氢氧化钠溶液变质后生成的碳酸钠溶液与氯化钙溶液反应生成碳酸钙白色沉淀
13. 氧化铁 溶液由无色变成黄色 产生气泡 Fe2O3+6HCl=2FeCl3+3H2O,Fe+2HCl=FeCl2+H2↑
14. HCl BaCl2 + AgNO3 =Ba(NO3)2 +2AgCl↓ Na2CO3+2HCl=2NaCl+H2O+CO2↑ 灭火
15. CH4 置换
16. 2H2O22H2O+O2↑ A、B、C 检查装置气密性 Ca(OH)2+CO2═CaCO3↓+H2O C
17. 温度达到着火点 4P+5O22P2O5 BC
18. BaCO3、BaSO4 固体粉末一定含有Ba(OH)2、Na2SO4、K2CO3,可能含有MgCl2 向步骤Ⅱ的上层清液滴加足量的氢氧化钠溶液
19.(1)44;
(2)解:设所用石灰石中碳酸钙的质量分数为x
x=80%
答:所用石灰石中碳酸钙的质量分数为80%。
20.(1)156.7;(2)10.6g;(3)7.3%
21.(1)中和胃酸
(2)9:16:1
(3)铝元素的质量分数为:
(4)含有4.8g氧元素的氢氧化铝的质量为:
答案第1页,共2页
答案第1页,共2页
