第10章金属检测题-2021-2022学年九年级化学京改版(2013)下册(word版有答案)
文档属性
| 名称 | 第10章金属检测题-2021-2022学年九年级化学京改版(2013)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 165.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-17 14:59:07 | ||
图片预览

文档简介
第10章《金属》检测题
一、单选题
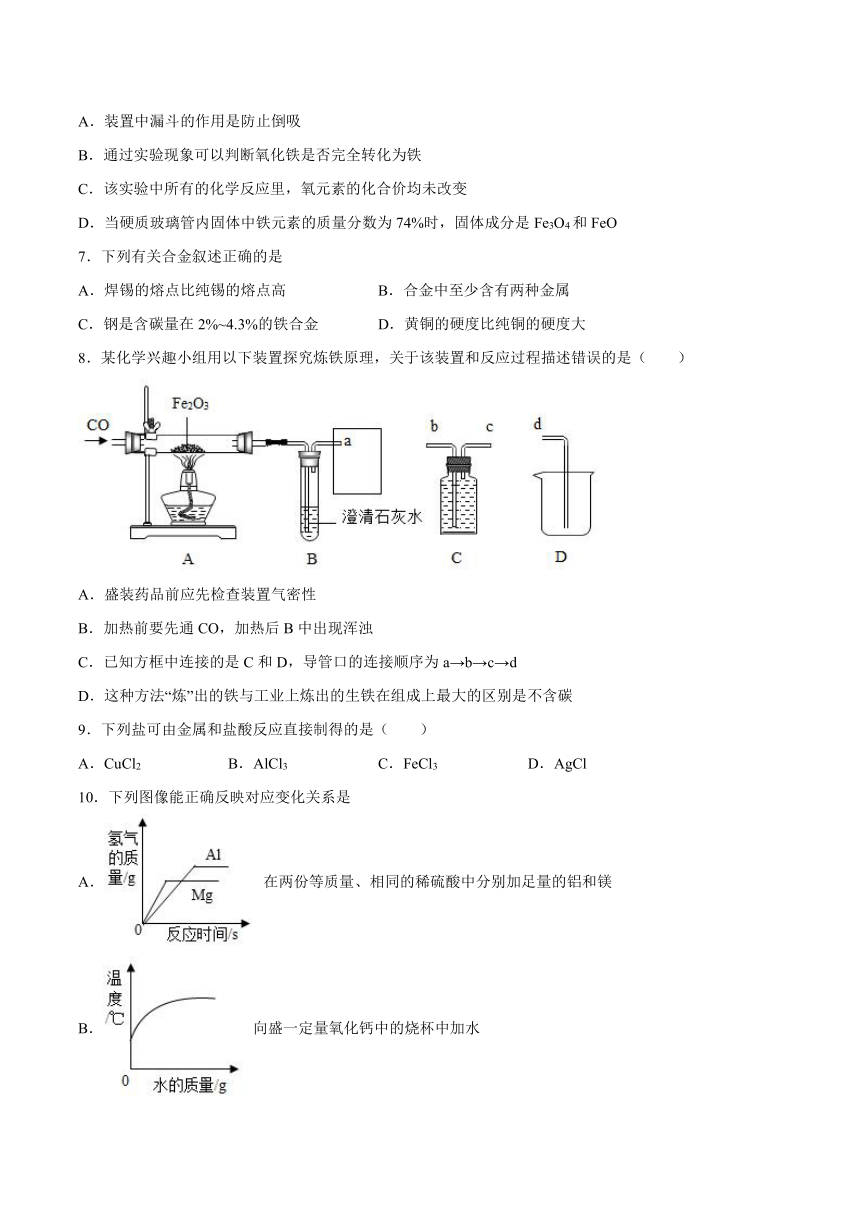
1.2018年3月9日,特朗普正式签署关税令“对进口钢铁和铝分别征收25%的关税”,这一做法严重违反国际贸易规则,严重损害我国利益。下列选项中不属于合金的是
A.钢 B.金刚石 C.焊锡 D.黄铜
2.X、R表示两种金属,在溶液中发生反应:X+3RNO3=3R+X(NO3)3。下列说法不正确的是
A.该反应是置换反应
B.若X是Al,R是Ag,则反应后溶液质量减少
C.X可能是Fe,R可能是Cu
D.X的金属活动性比R强
3.将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液里,搅拌,使其充分反应后过滤,滤纸上留下的金属是( )
A.Ag B.Fe、Ag C.Fe、Zn D.Ag、Zn、Fe
4.现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从强到弱的顺序是
A.甲>乙>丙 B.乙>甲>丙 C.甲>丙>乙 D.无法判断
5.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是
A.MgCl2溶液、Cu、Sn
B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸
D.MgCl2溶液、Sn、CuCl2溶液
6.用一氧化碳还原氧化铁的实验中,Fe2O3转化为铁的具体过程是: 。已知铁的氧化物除Fe2O3外,其余均为黑色。下列说法正确的是
A.装置中漏斗的作用是防止倒吸
B.通过实验现象可以判断氧化铁是否完全转化为铁
C.该实验中所有的化学反应里,氧元素的化合价均未改变
D.当硬质玻璃管内固体中铁元素的质量分数为74%时,固体成分是Fe3O4和FeO
7.下列有关合金叙述正确的是
A.焊锡的熔点比纯锡的熔点高 B.合金中至少含有两种金属
C.钢是含碳量在2%~4.3%的铁合金 D.黄铜的硬度比纯铜的硬度大
8.某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A.盛装药品前应先检查装置气密性
B.加热前要先通CO,加热后B中出现浑浊
C.已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D.这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
9.下列盐可由金属和盐酸反应直接制得的是( )
A.CuCl2 B.AlCl3 C.FeCl3 D.AgCl
10.下列图像能正确反映对应变化关系是
A. 在两份等质量、相同的稀硫酸中分别加足量的铝和镁
B. 向盛一定量氧化钙中的烧杯中加水
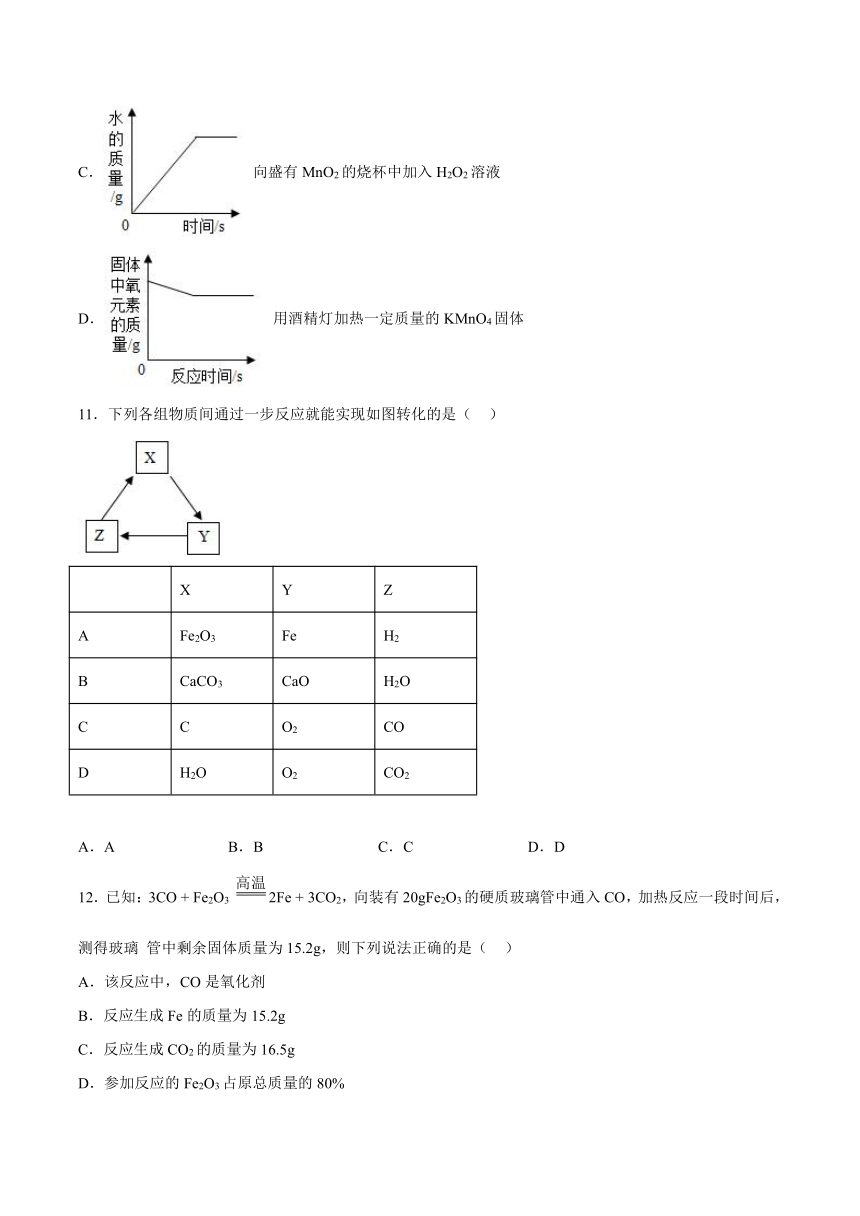
C. 向盛有MnO2的烧杯中加入H2O2溶液
D. 用酒精灯加热一定质量的KMnO4固体
11.下列各组物质间通过一步反应就能实现如图转化的是( )
X Y Z
A Fe2O3 Fe H2
B CaCO3 CaO H2O
C C O2 CO
D H2O O2 CO2
A.A B.B C.C D.D
12.已知:3CO + Fe2O3 2Fe + 3CO2,向装有20gFe2O3的硬质玻璃管中通入CO,加热反应一段时间后,测得玻璃 管中剩余固体质量为15.2g,则下列说法正确的是( )
A.该反应中,CO是氧化剂
B.反应生成Fe的质量为15.2g
C.反应生成CO2的质量为16.5g
D.参加反应的Fe2O3占原总质量的80%
二、简答题
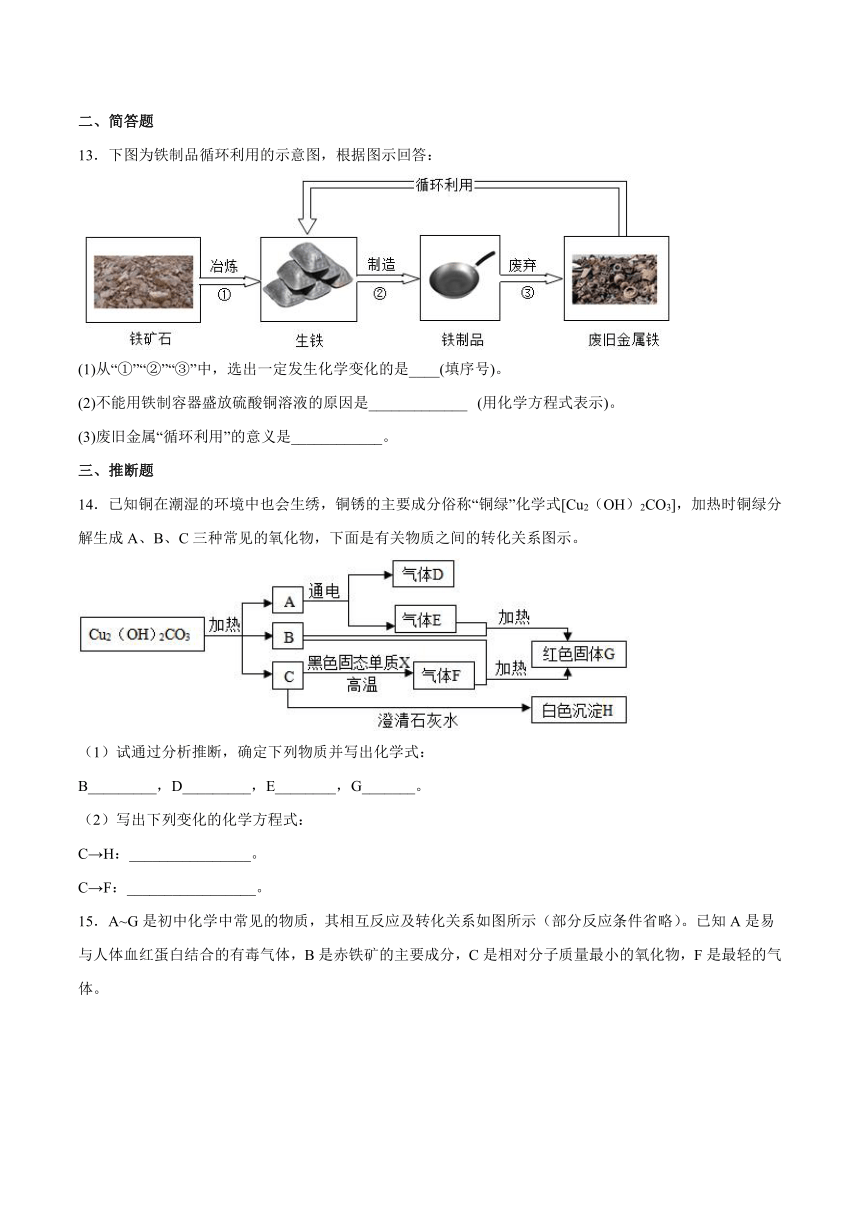
13.下图为铁制品循环利用的示意图,根据图示回答:
(1)从“①”“②”“③”中,选出一定发生化学变化的是____(填序号)。
(2)不能用铁制容器盛放硫酸铜溶液的原因是_____________ (用化学方程式表示)。
(3)废旧金属“循环利用”的意义是____________。
三、推断题
14.已知铜在潮湿的环境中也会生绣,铜锈的主要成分俗称“铜绿”化学式[Cu2(OH)2CO3],加热时铜绿分解生成A、B、C三种常见的氧化物,下面是有关物质之间的转化关系图示。
(1)试通过分析推断,确定下列物质并写出化学式:
B_________,D_________,E________,G_______。
(2)写出下列变化的化学方程式:
C→H:________________。
C→F:_________________。
15.A~G是初中化学中常见的物质,其相互反应及转化关系如图所示(部分反应条件省略)。已知A是易与人体血红蛋白结合的有毒气体,B是赤铁矿的主要成分,C是相对分子质量最小的氧化物,F是最轻的气体。
(1)G的化学式为______。
(2)反应③的实验现象_____。
(3)写出①的化学方程式________。
(4)化学反应②的基本反应类型是_____。
四、实验题
16.为了验证锌、铁、铜的金属活动性强弱,同学们设计了如如图所示实验。
(1)实验A的目的是_________。
(2)实验B能证明金属活动性铁强于铜的实验现象是________。
(3)实验C也能验证铁与铜的金属活动性强弱,则X、Y分别是________。
17.氢气是一种还原性气体。
①装置A 开始反应,锌粒表面的现象为______,该反应的化学方程式为______。充分反应后,可以观察到氧化铜表面的现象为______,说明氢气具有还原性,该反应的化学方程式为______。
②装置 B 的实验操作顺序如下:
I.制氧化铜:打开低压加热器,加热铜丝,发现铜丝表面变黑后停止加热,此时铜丝表面反应的化学方程式为______。
II.制氢气:必须待铜丝冷却至室温,才能倾斜装置使稀硫酸流入锌粒,开始反应,理由是______。
III.反应:应先对产生的气体进行______操作后,再打开低压加热器,加热铜丝,直至铜丝表面黑色物质消失后停止加热,取出铜丝,停止反应。
③请选择一套合适的装置______,并从实验装置和药品的角度阐述你的理由______。
18.小明同学为了研究影响铁生锈的因素,进行了如下实验:在A、B、C、D四只烧瓶中分别放入干燥的细铁丝,浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝(使细铁丝完全浸没在食盐水中)(四只烧瓶中细铁丝的质量均相同),然后装配成如图所示的四套装置,每隔0.5小时测量导管中水面上升的高度,结果如表所示:请回答:
烧瓶 时间(h) 0 0.5 1.0 1.5 2.0 2.5 3.0
A 干燥的细铁丝 0 0 0 0 0 0 0
B 浸过食盐水的细铁丝 0 0.4 1.2 3.4 5.6 7.6 9.8
C 浸过清水的细铁丝 0 0 0 0.3 0.8 2.0 3.5
D 完全浸没在食盐水中的细铁丝 0 0 0 0 0 0 0
(1)以上实验中,铁生锈速率最大的是___________瓶(填烧瓶号,下同)
(2)证明铁生锈需要水参与,应选择的烧瓶是___________。
(3)证明食盐能促进铁生锈,应选择的烧瓶是___________。
(4)为了防止钢铁生锈,人们常采用表面涂刷矿物油或镀上其他金属等覆盖保护膜的方法,这些方法的共同原理是___________。
五、计算题
19.工业上电解氧化铝制取金属铝的化学方程式2Al2O34Al+3O2↑ 电解20t氧化铝最多可生产多少吨铝?(写出必要的计算过程,计算结果精确到0.1t)
20.铁的锈蚀对社会生产造成损害,但也有有利的一面,如某些食品包装袋内常放入还原性铁粉作“双吸剂”0以防止食品腐败。某同学发现了一包破损的还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸),他们取六份样品,分别加稀硫酸反应。测得实验数据如下:
实验次数 1 2 3 4 5 6
取样品质量(g) 31.0 31.0 31.0 31.0 31.0 31.0
取稀硫酸质量(g) 30.0 90.0 120.0 150.0 180.0 210.0
产生气体质量(g) 0 a 0.3 0.5 0.6 0.6
(1)食品袋内放入“双吸剂”是为了吸收_____(填化学式),用铁粉而不用铁块作“双吸剂”的理由是_____。
(2)a的数值为_____。
(3)第4次实验,所得到溶液中溶质的化学式为_____。
(4)计算该样品中单质铁的质量分数(保留至0.1%)。
参考答案:
1.B 2.C 3.B 4.C 5.A 6.D 7.D 8.C 9.B 10.D 11.D 12.D
13. ① Fe+CuSO4===FeSO4+Cu 节约金属资源,树立可持续发展的观念(或保护金属资源或节约能源或减少对环境的污染等)
14. CuO O2 H2 Cu CO2 +Ca(OH)2 ==CaCO3↓+ H2O C + CO2 2CO
15. 剧烈燃烧,火星四射,生成黑色固体 分解反应
16. 验证锌和铁的金属活动性强弱 铁片上有气泡产生,铜片无明显现象 Fe、CuSO4 溶液(或Cu、FeSO4溶液)
17. 产生大量气泡 由黑色变成红色 防止氢气与装置中的空气混合加热发生爆炸 验纯 B 装置简单,操作方便,药品用量少
18.(1)B
(2)AC
(3)BC
(4)隔绝氧气和水
19.设可以生产铝的质量为x,根据电解氧化铝制取铝的化学反应方程式:
解得x≈10.6吨
答:电解20t氧化铝最多可生产10.6吨铝。
20.(1)O2、H2O;增大与氧气、水分的接触面积,加快反应速率;(2)0.1;(3)Fe2(SO4)3、FeSO4;(4)54.2%
一、单选题
1.2018年3月9日,特朗普正式签署关税令“对进口钢铁和铝分别征收25%的关税”,这一做法严重违反国际贸易规则,严重损害我国利益。下列选项中不属于合金的是
A.钢 B.金刚石 C.焊锡 D.黄铜
2.X、R表示两种金属,在溶液中发生反应:X+3RNO3=3R+X(NO3)3。下列说法不正确的是
A.该反应是置换反应
B.若X是Al,R是Ag,则反应后溶液质量减少
C.X可能是Fe,R可能是Cu
D.X的金属活动性比R强
3.将过量的铁粉放入含AgNO3和Zn(NO3)2的混合溶液里,搅拌,使其充分反应后过滤,滤纸上留下的金属是( )
A.Ag B.Fe、Ag C.Fe、Zn D.Ag、Zn、Fe
4.现有甲、乙、丙三种金属,先将三者分别加入到硫酸亚铁溶液中,只有甲可使溶液中析出铁单质。再将三者加入到硝酸银溶液中,只有乙不能使溶液中析出银单质,则三者的金属活动性从强到弱的顺序是
A.甲>乙>丙 B.乙>甲>丙 C.甲>丙>乙 D.无法判断
5.为验证Mg、Cu、Sn的金属活动性顺序,不可选用的一组物质是
A.MgCl2溶液、Cu、Sn
B.Mg、Cu、SnCl2溶液
C.Mg、Sn、Cu、盐酸
D.MgCl2溶液、Sn、CuCl2溶液
6.用一氧化碳还原氧化铁的实验中,Fe2O3转化为铁的具体过程是: 。已知铁的氧化物除Fe2O3外,其余均为黑色。下列说法正确的是
A.装置中漏斗的作用是防止倒吸
B.通过实验现象可以判断氧化铁是否完全转化为铁
C.该实验中所有的化学反应里,氧元素的化合价均未改变
D.当硬质玻璃管内固体中铁元素的质量分数为74%时,固体成分是Fe3O4和FeO
7.下列有关合金叙述正确的是
A.焊锡的熔点比纯锡的熔点高 B.合金中至少含有两种金属
C.钢是含碳量在2%~4.3%的铁合金 D.黄铜的硬度比纯铜的硬度大
8.某化学兴趣小组用以下装置探究炼铁原理,关于该装置和反应过程描述错误的是( )
A.盛装药品前应先检查装置气密性
B.加热前要先通CO,加热后B中出现浑浊
C.已知方框中连接的是C和D,导管口的连接顺序为a→b→c→d
D.这种方法“炼”出的铁与工业上炼出的生铁在组成上最大的区别是不含碳
9.下列盐可由金属和盐酸反应直接制得的是( )
A.CuCl2 B.AlCl3 C.FeCl3 D.AgCl
10.下列图像能正确反映对应变化关系是
A. 在两份等质量、相同的稀硫酸中分别加足量的铝和镁
B. 向盛一定量氧化钙中的烧杯中加水
C. 向盛有MnO2的烧杯中加入H2O2溶液
D. 用酒精灯加热一定质量的KMnO4固体
11.下列各组物质间通过一步反应就能实现如图转化的是( )
X Y Z
A Fe2O3 Fe H2
B CaCO3 CaO H2O
C C O2 CO
D H2O O2 CO2
A.A B.B C.C D.D
12.已知:3CO + Fe2O3 2Fe + 3CO2,向装有20gFe2O3的硬质玻璃管中通入CO,加热反应一段时间后,测得玻璃 管中剩余固体质量为15.2g,则下列说法正确的是( )
A.该反应中,CO是氧化剂
B.反应生成Fe的质量为15.2g
C.反应生成CO2的质量为16.5g
D.参加反应的Fe2O3占原总质量的80%
二、简答题
13.下图为铁制品循环利用的示意图,根据图示回答:
(1)从“①”“②”“③”中,选出一定发生化学变化的是____(填序号)。
(2)不能用铁制容器盛放硫酸铜溶液的原因是_____________ (用化学方程式表示)。
(3)废旧金属“循环利用”的意义是____________。
三、推断题
14.已知铜在潮湿的环境中也会生绣,铜锈的主要成分俗称“铜绿”化学式[Cu2(OH)2CO3],加热时铜绿分解生成A、B、C三种常见的氧化物,下面是有关物质之间的转化关系图示。
(1)试通过分析推断,确定下列物质并写出化学式:
B_________,D_________,E________,G_______。
(2)写出下列变化的化学方程式:
C→H:________________。
C→F:_________________。
15.A~G是初中化学中常见的物质,其相互反应及转化关系如图所示(部分反应条件省略)。已知A是易与人体血红蛋白结合的有毒气体,B是赤铁矿的主要成分,C是相对分子质量最小的氧化物,F是最轻的气体。
(1)G的化学式为______。
(2)反应③的实验现象_____。
(3)写出①的化学方程式________。
(4)化学反应②的基本反应类型是_____。
四、实验题
16.为了验证锌、铁、铜的金属活动性强弱,同学们设计了如如图所示实验。
(1)实验A的目的是_________。
(2)实验B能证明金属活动性铁强于铜的实验现象是________。
(3)实验C也能验证铁与铜的金属活动性强弱,则X、Y分别是________。
17.氢气是一种还原性气体。
①装置A 开始反应,锌粒表面的现象为______,该反应的化学方程式为______。充分反应后,可以观察到氧化铜表面的现象为______,说明氢气具有还原性,该反应的化学方程式为______。
②装置 B 的实验操作顺序如下:
I.制氧化铜:打开低压加热器,加热铜丝,发现铜丝表面变黑后停止加热,此时铜丝表面反应的化学方程式为______。
II.制氢气:必须待铜丝冷却至室温,才能倾斜装置使稀硫酸流入锌粒,开始反应,理由是______。
III.反应:应先对产生的气体进行______操作后,再打开低压加热器,加热铜丝,直至铜丝表面黑色物质消失后停止加热,取出铜丝,停止反应。
③请选择一套合适的装置______,并从实验装置和药品的角度阐述你的理由______。
18.小明同学为了研究影响铁生锈的因素,进行了如下实验:在A、B、C、D四只烧瓶中分别放入干燥的细铁丝,浸过食盐水的细铁丝、浸过清水的细铁丝、食盐水及细铁丝(使细铁丝完全浸没在食盐水中)(四只烧瓶中细铁丝的质量均相同),然后装配成如图所示的四套装置,每隔0.5小时测量导管中水面上升的高度,结果如表所示:请回答:
烧瓶 时间(h) 0 0.5 1.0 1.5 2.0 2.5 3.0
A 干燥的细铁丝 0 0 0 0 0 0 0
B 浸过食盐水的细铁丝 0 0.4 1.2 3.4 5.6 7.6 9.8
C 浸过清水的细铁丝 0 0 0 0.3 0.8 2.0 3.5
D 完全浸没在食盐水中的细铁丝 0 0 0 0 0 0 0
(1)以上实验中,铁生锈速率最大的是___________瓶(填烧瓶号,下同)
(2)证明铁生锈需要水参与,应选择的烧瓶是___________。
(3)证明食盐能促进铁生锈,应选择的烧瓶是___________。
(4)为了防止钢铁生锈,人们常采用表面涂刷矿物油或镀上其他金属等覆盖保护膜的方法,这些方法的共同原理是___________。
五、计算题
19.工业上电解氧化铝制取金属铝的化学方程式2Al2O34Al+3O2↑ 电解20t氧化铝最多可生产多少吨铝?(写出必要的计算过程,计算结果精确到0.1t)
20.铁的锈蚀对社会生产造成损害,但也有有利的一面,如某些食品包装袋内常放入还原性铁粉作“双吸剂”0以防止食品腐败。某同学发现了一包破损的还原性铁粉(含少量杂质,杂质既不溶于水也不溶于酸),他们取六份样品,分别加稀硫酸反应。测得实验数据如下:
实验次数 1 2 3 4 5 6
取样品质量(g) 31.0 31.0 31.0 31.0 31.0 31.0
取稀硫酸质量(g) 30.0 90.0 120.0 150.0 180.0 210.0
产生气体质量(g) 0 a 0.3 0.5 0.6 0.6
(1)食品袋内放入“双吸剂”是为了吸收_____(填化学式),用铁粉而不用铁块作“双吸剂”的理由是_____。
(2)a的数值为_____。
(3)第4次实验,所得到溶液中溶质的化学式为_____。
(4)计算该样品中单质铁的质量分数(保留至0.1%)。
参考答案:
1.B 2.C 3.B 4.C 5.A 6.D 7.D 8.C 9.B 10.D 11.D 12.D
13. ① Fe+CuSO4===FeSO4+Cu 节约金属资源,树立可持续发展的观念(或保护金属资源或节约能源或减少对环境的污染等)
14. CuO O2 H2 Cu CO2 +Ca(OH)2 ==CaCO3↓+ H2O C + CO2 2CO
15. 剧烈燃烧,火星四射,生成黑色固体 分解反应
16. 验证锌和铁的金属活动性强弱 铁片上有气泡产生,铜片无明显现象 Fe、CuSO4 溶液(或Cu、FeSO4溶液)
17. 产生大量气泡 由黑色变成红色 防止氢气与装置中的空气混合加热发生爆炸 验纯 B 装置简单,操作方便,药品用量少
18.(1)B
(2)AC
(3)BC
(4)隔绝氧气和水
19.设可以生产铝的质量为x,根据电解氧化铝制取铝的化学反应方程式:
解得x≈10.6吨
答:电解20t氧化铝最多可生产10.6吨铝。
20.(1)O2、H2O;增大与氧气、水分的接触面积,加快反应速率;(2)0.1;(3)Fe2(SO4)3、FeSO4;(4)54.2%
