第11章酸与碱检测题-2021-2022学年九年级化学京改版(2013)下册(word版有答案)
文档属性
| 名称 | 第11章酸与碱检测题-2021-2022学年九年级化学京改版(2013)下册(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 115.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-17 00:00:00 | ||
图片预览


文档简介
第11章《酸与碱》检测题
一、单选题
1.下列四种物质久置空气中,质量增加且没有新物质生成的是( )
A.氨水 B.烧碱 C.浓硫酸 D.浓盐酸
2.能用于鉴别氢氧化钠溶液和氢氧化钙溶液的物质是
A.HCl B.KNO3 C.Na2CO3 D.FeCl3
3.分别向甲、乙、丙三种无色溶液中滴加紫色石蕊试液,观察到甲溶液变红色,乙溶液变蓝色,丙溶液变紫色。则它们的pH由小到大的排列是( )
A.甲、乙、丙 B.甲、丙、乙 C.乙、甲、丙 D.丙、甲、乙
4.将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下。由此分析下列说法正确的是
A.反应前后阴、阳离子的总数目不变
B.反应前后溶剂质量不变
C.反应后溶液呈中性
D.反应前后元素种类发生了变化
5.根据如图实验判断下列说法错误的是
A.浓盐酸有挥发性 B.分子在不断运动
C.B烧杯溶液的颜色会改变 D.B烧杯内发生了置换反应
6.如下列举了生活中常见的几种液体,其中能使紫色石蕊试液变蓝的溶液是( )
A.石灰乳 B.苏打水 C.白醋 D.食盐水
7.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
8.某些金属氢化物与水反应可生成碱和氢气,如:NaH+H2O═NaOH+H2↑,则CaH2与足量Na2CO3溶液之间发生反应的产物是( )
A.CaCO3、NaOH和H2 B.Ca(OH)2和H2
C.NaOH和Ca(OH)2 D.Ca(OH)2、CaCO3和H2
9.向足量的稀硫酸溶液中加入浑身是锈的铁钉,下列有关量的变化图象不正确的是( )
A. B.
C. D.
10.已知生活中厕所清洁剂的pH=1,厨房的清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高 B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果 D.厕所清洁剂可能使铁制下水道腐蚀
11.白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁酸腐蚀的是
A.铜制塑像 B.镀锌水管 C.大理石栏杆 D.铝合金门窗
二、简答题
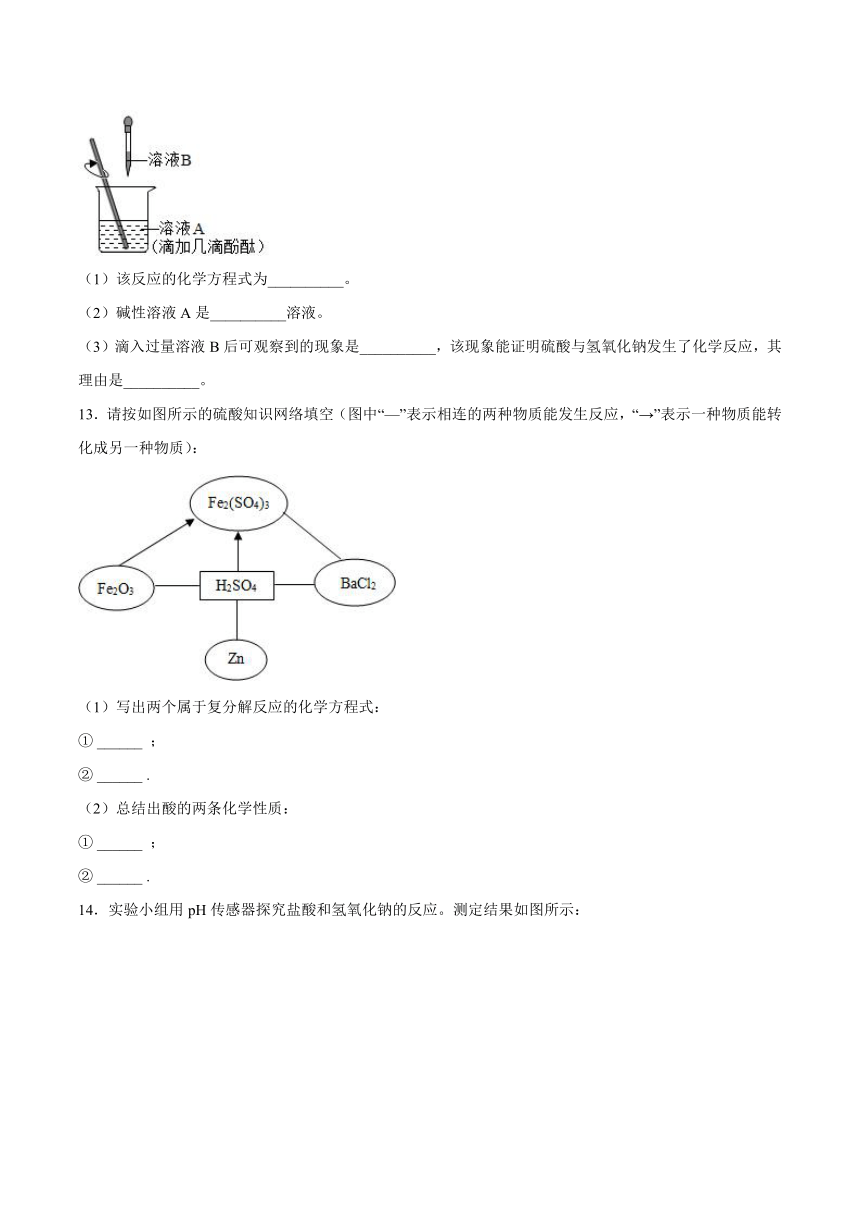
12.为了探究硫酸与氢氧化钠是否发生反应,同学们设计并进行了如图所示的实验。
(1)该反应的化学方程式为__________。
(2)碱性溶液A是__________溶液。
(3)滴入过量溶液B后可观察到的现象是__________,该现象能证明硫酸与氢氧化钠发生了化学反应,其理由是__________。
13.请按如图所示的硫酸知识网络填空(图中“—”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质):
(1)写出两个属于复分解反应的化学方程式:
① ______ ;
② ______ .
(2)总结出酸的两条化学性质:
① ______ ;
② ______ .
14.实验小组用pH传感器探究盐酸和氢氧化钠的反应。测定结果如图所示:
(1)盐酸和氢氧化钠反应的化学方程式为_____。
(2)向烧瓶中缓慢注入稀盐酸,能说明盐酸与氢氧化钠发生化学反应的依据是_____。
(3)60s时,向烧瓶中加入过量碳酸钠溶液,则烧瓶内溶液中的溶质是_____。
三、推断题
15.A~E是初中化学常见的五种物质。A和B属于同类别物质,B、C、D、E分别属于四种不同类别的化合物,B常用于灭火,D是大理石的主要成分。它们相互之间的关系如图所示。“一”表示两种物质之间可以相互反应,“→”表示一种物质可以生成另一种物质。请回答下列问题:
(1)物质A的化学式为______,C的俗称为______。
(2)B和C反应的化学方程式为______。
(3)D和E反应的基本反应类型是______。
16.现有铁和含铁化合物的变化关系图如下
(1)物质 A 是铁锈的主要成分,物质 B 是常见的稀硫酸液反应得到的棕黄色溶液,写出物质A、B、C的化学式:A___________;B___________;C___________;
(2)写出下列指定反应的化学方程式反应②___________; 反应③___________; 反应④___________该反应的现象___________
四、实验题
17.根据下图实验回答问题。
(1)实验室用高锰酸钾制氧气,应选择的发生装置是______(填序号,下同)。
(2)装置C中发生反应的化学方程式为______。
(3)若用装置D验证只有水或只有二氧化碳不能使石蕊试纸变红,则X可能是下列物质中______或______。
A.稀硫酸 B.浓硫酸 C.NaOH溶液 D.NaCl溶液
18.利用下图所示装置进行实验。
(1)A中电子秤示数变化的原因是______。
(2)B中观察到的现象为______。
(3)C中反应的化学方程式为______。
(4)以上实验能验证质量守恒定律的是______(填序号)。
五、计算题
19.在烧杯中加入2.14g久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示。请回答下列问题:
(1)产生氢气 __________ g,刚开始滴加稀硫酸没有氢气放出的原因是 ___________ 。
(2)所滴加的稀硫酸中溶质的质量分数为 ________ 。
(3)铝箔中铝元素的质量为 ________ 。
20.某课外活动小组同学取一定量的铜与氧化铜的粉末固体混合物放入烧杯中,加入50g稀硫酸,恰好完全反应,烧杯中固体的质量随收集变化情况如图所示。计算所用稀硫酸的溶质质量分数。
参考答案:
1.C 2.C 3.B 4.C 5.D 6.B 7.B 8.A 9.C 10.C 11.A
12. 2NaOH+H2SO4=Na2SO4+2H2O 氢氧化钠(含酚酞) 烧杯中溶液由红色变为无色 酚酞在碱性溶液中显红色,在中性和酸性溶液中显无色
13. Fe2O3+ 3H2SO4= Fe2(SO4)3+3H2O H2SO4+BaCl2=BaSO4↓+2HCl 酸和金属氧化物反应生成盐和水 金属和酸反应生成盐和氢气
14. NaOH+ HCl=NaCl + H2O 红色溶液变为无色,pH逐渐减小至等于或小于7 NaCl、Na2CO3
15. H2O 熟石灰(或消石灰;或熟石灰、消石灰) 复分解反应
16. Fe2O3 Fe2(SO4)3 FeSO4 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Fe+H2SO4=FeSO4+H2↑ Fe+CuSO4=FeSO4+Cu 铁表面产生红色物质,蓝色溶液逐渐变为浅绿色
17. A B C
18. 浓硫酸具有吸水性,会吸收空气中的水分 产生气泡,溶液由无色变为浅绿色 C
19. 0.2 稀硫酸与氧化铝反应 10% 92.52%
20.解:剩余固体是铜,即混合物中铜是2g,所取粉末中氧化铜的质量为:10g-2g=8g,
设硫酸的质量为x,
解得x=9.8g,
所用稀硫酸的溶质质量分数=
答:所用稀硫酸的溶质质量分数是19.6%。
一、单选题
1.下列四种物质久置空气中,质量增加且没有新物质生成的是( )
A.氨水 B.烧碱 C.浓硫酸 D.浓盐酸
2.能用于鉴别氢氧化钠溶液和氢氧化钙溶液的物质是
A.HCl B.KNO3 C.Na2CO3 D.FeCl3
3.分别向甲、乙、丙三种无色溶液中滴加紫色石蕊试液,观察到甲溶液变红色,乙溶液变蓝色,丙溶液变紫色。则它们的pH由小到大的排列是( )
A.甲、乙、丙 B.甲、丙、乙 C.乙、甲、丙 D.丙、甲、乙
4.将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如下。由此分析下列说法正确的是
A.反应前后阴、阳离子的总数目不变
B.反应前后溶剂质量不变
C.反应后溶液呈中性
D.反应前后元素种类发生了变化
5.根据如图实验判断下列说法错误的是
A.浓盐酸有挥发性 B.分子在不断运动
C.B烧杯溶液的颜色会改变 D.B烧杯内发生了置换反应
6.如下列举了生活中常见的几种液体,其中能使紫色石蕊试液变蓝的溶液是( )
A.石灰乳 B.苏打水 C.白醋 D.食盐水
7.按如图所示装置,玻璃棒末端固定一团喷有酚酞溶液的脱脂棉Y。先加入物质X,再塞上带玻璃棒的橡胶塞。片刻后,能观察到喷有酚酞溶液的脱脂棉Y变红,则物质X可能是
A.浓盐酸 B.浓氨水
C.浓醋酸 D.浓氢氧化钠溶液
8.某些金属氢化物与水反应可生成碱和氢气,如:NaH+H2O═NaOH+H2↑,则CaH2与足量Na2CO3溶液之间发生反应的产物是( )
A.CaCO3、NaOH和H2 B.Ca(OH)2和H2
C.NaOH和Ca(OH)2 D.Ca(OH)2、CaCO3和H2
9.向足量的稀硫酸溶液中加入浑身是锈的铁钉,下列有关量的变化图象不正确的是( )
A. B.
C. D.
10.已知生活中厕所清洁剂的pH=1,厨房的清洁剂的pH=12。下列关于两者的说法不正确的是
A.厕所清洁剂加水稀释,溶液pH升高 B.厨房清洁剂可能含有NaOH
C.混合使用能提高两者的清洁效果 D.厕所清洁剂可能使铁制下水道腐蚀
11.白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁酸腐蚀的是
A.铜制塑像 B.镀锌水管 C.大理石栏杆 D.铝合金门窗
二、简答题
12.为了探究硫酸与氢氧化钠是否发生反应,同学们设计并进行了如图所示的实验。
(1)该反应的化学方程式为__________。
(2)碱性溶液A是__________溶液。
(3)滴入过量溶液B后可观察到的现象是__________,该现象能证明硫酸与氢氧化钠发生了化学反应,其理由是__________。
13.请按如图所示的硫酸知识网络填空(图中“—”表示相连的两种物质能发生反应,“→”表示一种物质能转化成另一种物质):
(1)写出两个属于复分解反应的化学方程式:
① ______ ;
② ______ .
(2)总结出酸的两条化学性质:
① ______ ;
② ______ .
14.实验小组用pH传感器探究盐酸和氢氧化钠的反应。测定结果如图所示:
(1)盐酸和氢氧化钠反应的化学方程式为_____。
(2)向烧瓶中缓慢注入稀盐酸,能说明盐酸与氢氧化钠发生化学反应的依据是_____。
(3)60s时,向烧瓶中加入过量碳酸钠溶液,则烧瓶内溶液中的溶质是_____。
三、推断题
15.A~E是初中化学常见的五种物质。A和B属于同类别物质,B、C、D、E分别属于四种不同类别的化合物,B常用于灭火,D是大理石的主要成分。它们相互之间的关系如图所示。“一”表示两种物质之间可以相互反应,“→”表示一种物质可以生成另一种物质。请回答下列问题:
(1)物质A的化学式为______,C的俗称为______。
(2)B和C反应的化学方程式为______。
(3)D和E反应的基本反应类型是______。
16.现有铁和含铁化合物的变化关系图如下
(1)物质 A 是铁锈的主要成分,物质 B 是常见的稀硫酸液反应得到的棕黄色溶液,写出物质A、B、C的化学式:A___________;B___________;C___________;
(2)写出下列指定反应的化学方程式反应②___________; 反应③___________; 反应④___________该反应的现象___________
四、实验题
17.根据下图实验回答问题。
(1)实验室用高锰酸钾制氧气,应选择的发生装置是______(填序号,下同)。
(2)装置C中发生反应的化学方程式为______。
(3)若用装置D验证只有水或只有二氧化碳不能使石蕊试纸变红,则X可能是下列物质中______或______。
A.稀硫酸 B.浓硫酸 C.NaOH溶液 D.NaCl溶液
18.利用下图所示装置进行实验。
(1)A中电子秤示数变化的原因是______。
(2)B中观察到的现象为______。
(3)C中反应的化学方程式为______。
(4)以上实验能验证质量守恒定律的是______(填序号)。
五、计算题
19.在烧杯中加入2.14g久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如图所示。请回答下列问题:
(1)产生氢气 __________ g,刚开始滴加稀硫酸没有氢气放出的原因是 ___________ 。
(2)所滴加的稀硫酸中溶质的质量分数为 ________ 。
(3)铝箔中铝元素的质量为 ________ 。
20.某课外活动小组同学取一定量的铜与氧化铜的粉末固体混合物放入烧杯中,加入50g稀硫酸,恰好完全反应,烧杯中固体的质量随收集变化情况如图所示。计算所用稀硫酸的溶质质量分数。
参考答案:
1.C 2.C 3.B 4.C 5.D 6.B 7.B 8.A 9.C 10.C 11.A
12. 2NaOH+H2SO4=Na2SO4+2H2O 氢氧化钠(含酚酞) 烧杯中溶液由红色变为无色 酚酞在碱性溶液中显红色,在中性和酸性溶液中显无色
13. Fe2O3+ 3H2SO4= Fe2(SO4)3+3H2O H2SO4+BaCl2=BaSO4↓+2HCl 酸和金属氧化物反应生成盐和水 金属和酸反应生成盐和氢气
14. NaOH+ HCl=NaCl + H2O 红色溶液变为无色,pH逐渐减小至等于或小于7 NaCl、Na2CO3
15. H2O 熟石灰(或消石灰;或熟石灰、消石灰) 复分解反应
16. Fe2O3 Fe2(SO4)3 FeSO4 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Fe+H2SO4=FeSO4+H2↑ Fe+CuSO4=FeSO4+Cu 铁表面产生红色物质,蓝色溶液逐渐变为浅绿色
17. A B C
18. 浓硫酸具有吸水性,会吸收空气中的水分 产生气泡,溶液由无色变为浅绿色 C
19. 0.2 稀硫酸与氧化铝反应 10% 92.52%
20.解:剩余固体是铜,即混合物中铜是2g,所取粉末中氧化铜的质量为:10g-2g=8g,
设硫酸的质量为x,
解得x=9.8g,
所用稀硫酸的溶质质量分数=
答:所用稀硫酸的溶质质量分数是19.6%。
