高中化学人教版(2019)必修第一册2.3.2 气体摩尔体积 课件(40张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册2.3.2 气体摩尔体积 课件(40张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-17 16:54:16 | ||
图片预览



文档简介
(共42张PPT)
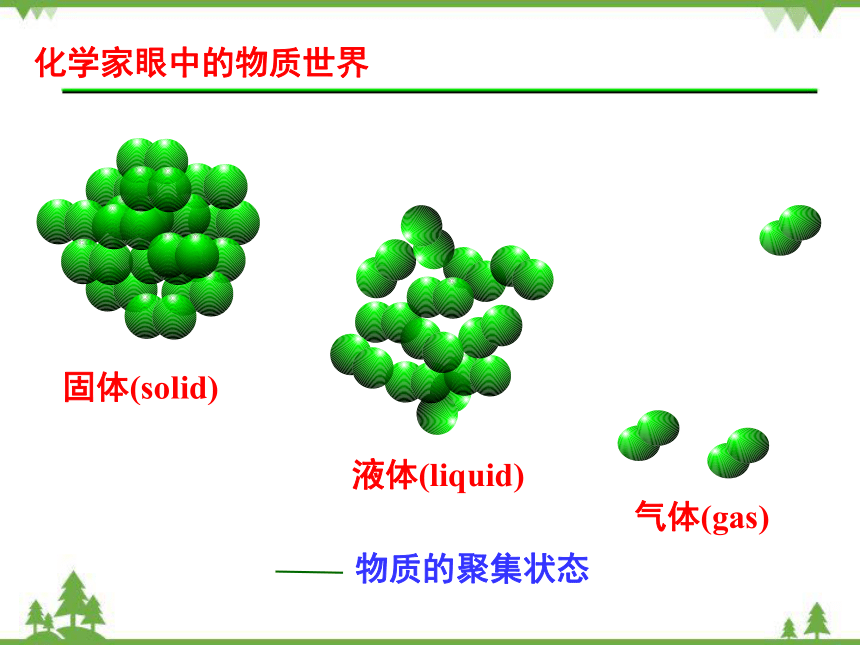
化学家眼中的物质世界
物质的聚集状态
固体(solid)
液体(liquid)
气体(gas)
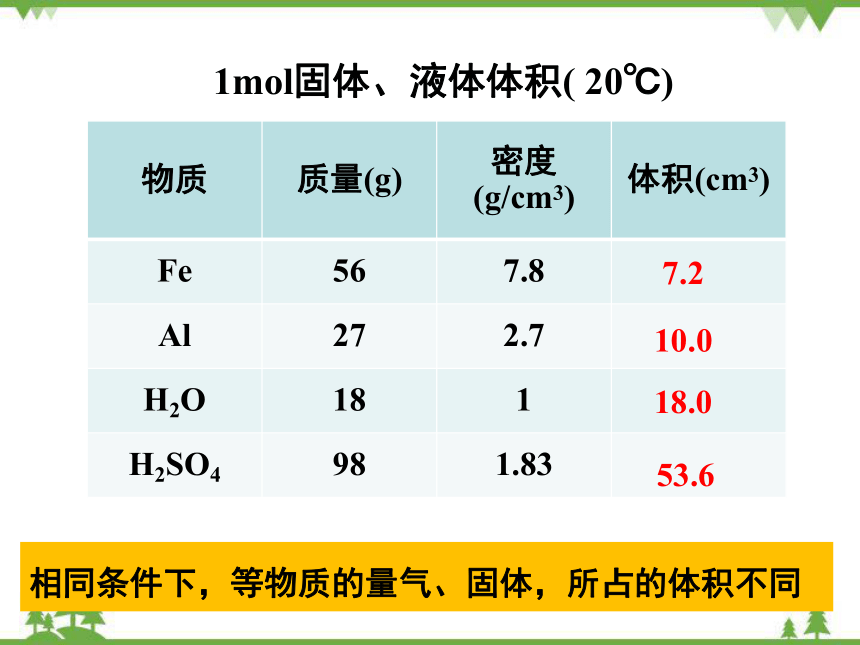
物质 质量(g) 密度(g/cm3) 体积(cm3)
Fe 56 7.8
Al 27 2.7
H2O 18 1
H2SO4 98 1.83
7.2
10.0
18.0
53.6
1mol固体、液体体积( 20℃)
相同条件下,等物质的量气、固体,所占的体积不同
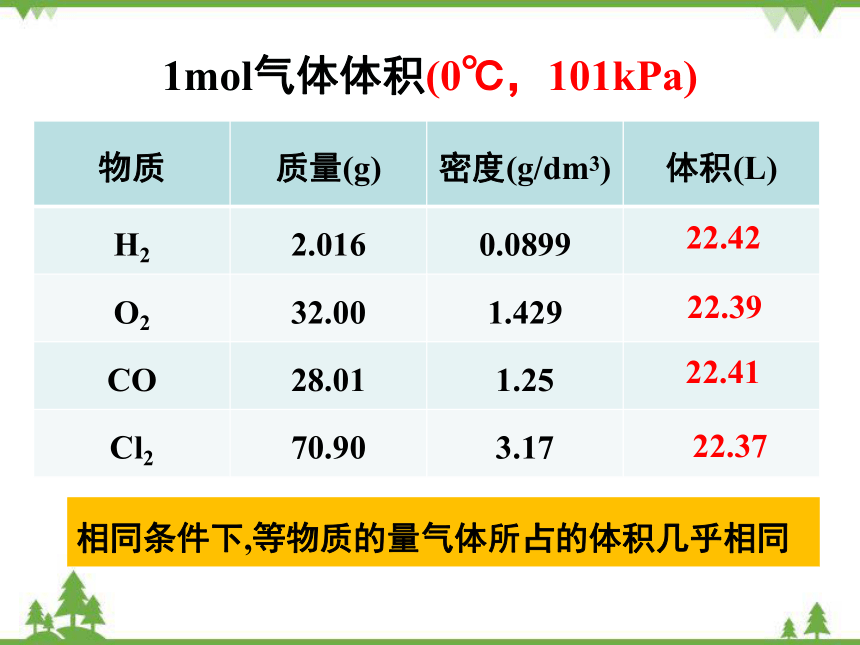
1mol气体体积(0℃,101kPa)
物质 质量(g) 密度(g/dm3) 体积(L)
H2 2.016 0.0899
O2 32.00 1.429
CO 28.01 1.25
Cl2 70.90 3.17
22.42
22.39
22.37
22.41
相同条件下,等物质的量气体所占的体积几乎相同
在同温同压下,为什么等物质的量的固体、液体物质的体积不相等,而等物质的量的气体体积却相等呢?
为什么
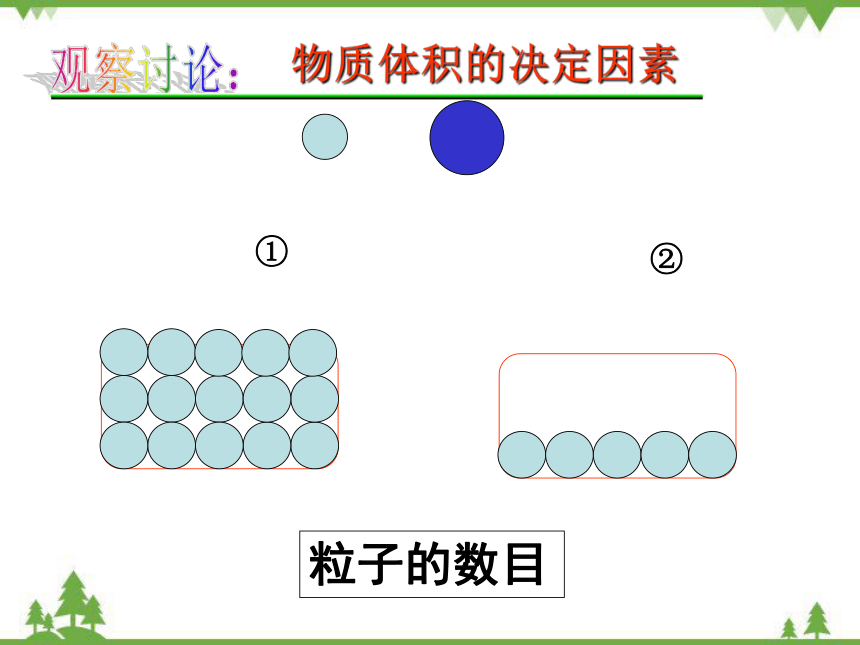
粒子的数目
物质体积的决定因素
①
②
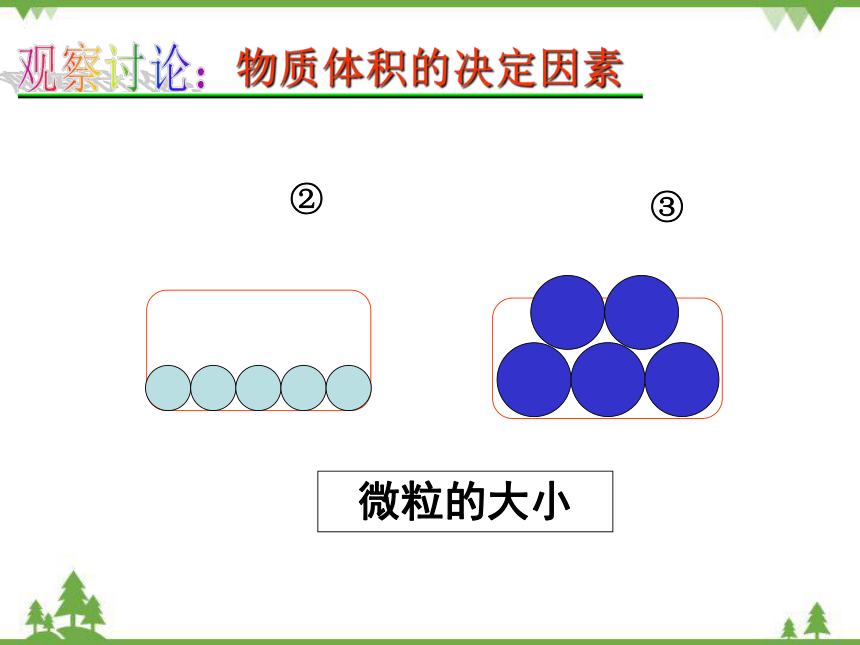
微粒的大小
物质体积的决定因素
②
③
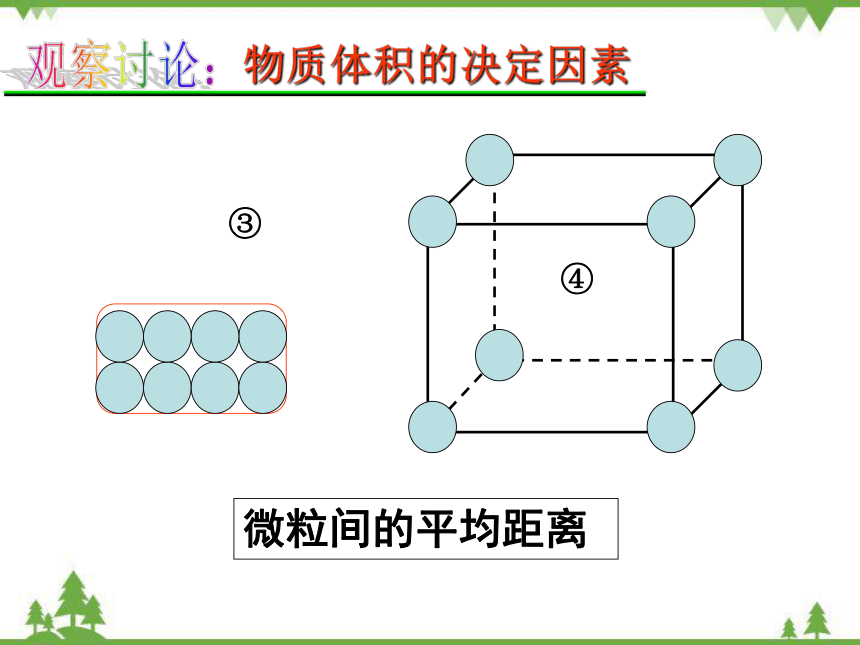
③
④
微粒间的平均距离
物质体积的决定因素
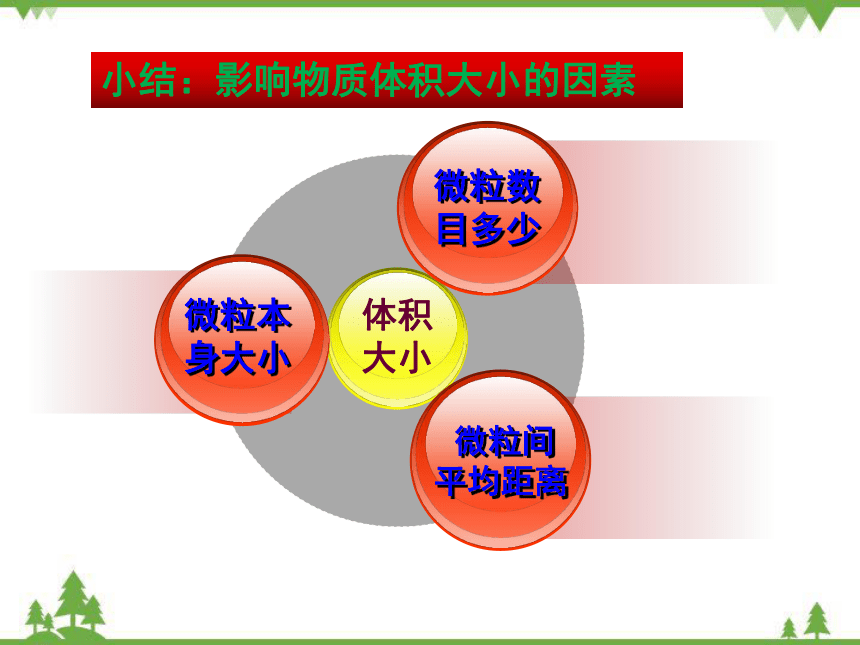
小结:影响物质体积大小的因素
体积
大小
微粒数
目多少
微粒本
身大小
微粒间
平均距离
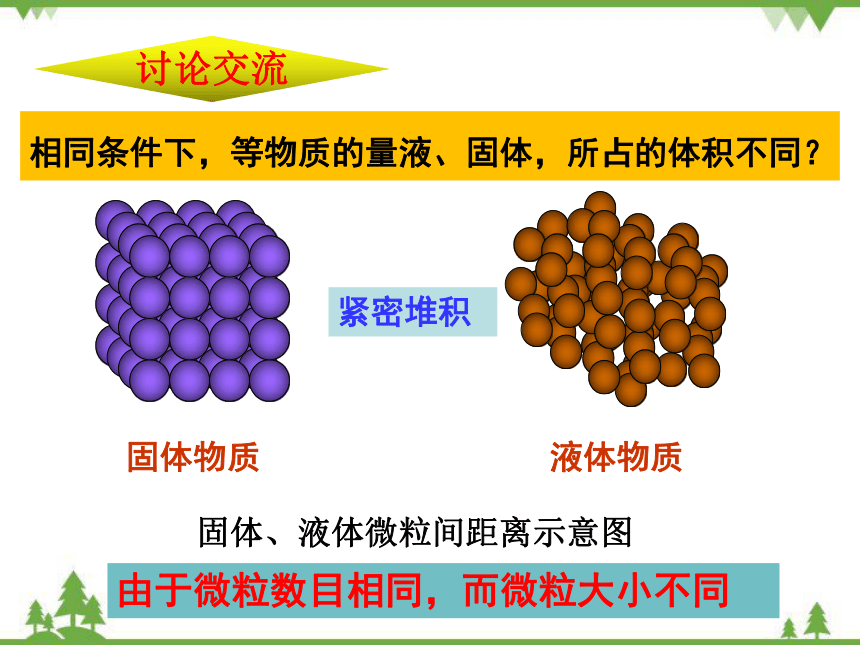
由于微粒数目相同,而微粒大小不同
相同条件下,等物质的量液、固体,所占的体积不同?
固体物质
液体物质
固体、液体微粒间距离示意图
紧密堆积
讨论交流
T.P相同
V 相同
d相同
n相同
相同条件下,等物质的量气体所占的体积几乎相同?
固体、液体的体积
气体的体积
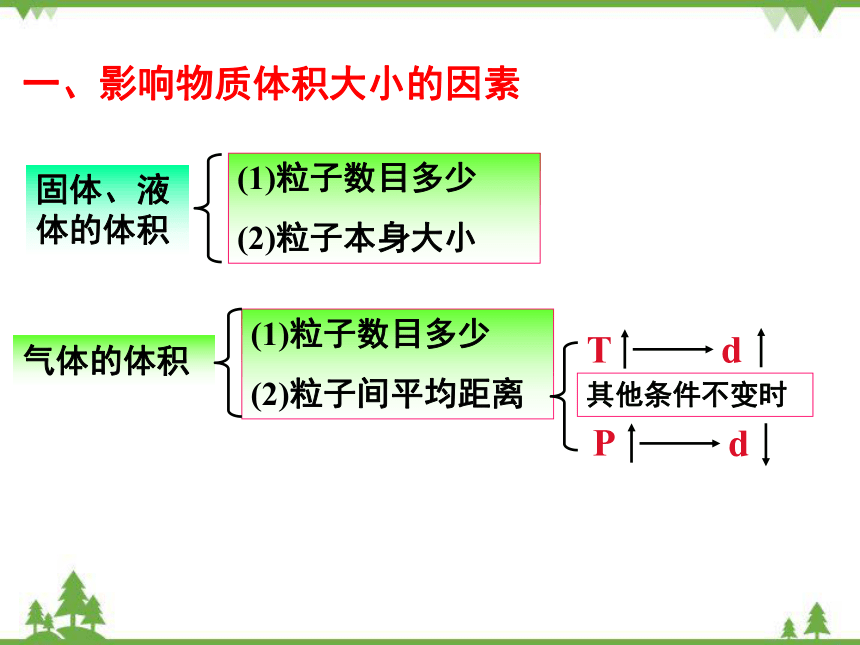
(1)粒子数目多少
(2)粒子本身大小
一、影响物质体积大小的因素
(1)粒子数目多少
(2)粒子间平均距离
d
T
P
其他条件不变时
d
常用单位有L/mol(L·mol-1)和m3/mol。
Vm=
V
n
公式:
符号: Vm
概念:单位物质的量气体所占的体积。
二、气体摩尔体积
即1mol气体所占的体积。
二、气体摩尔体积
标准状况下(0 ℃ 1.013 × 105Pa),1mol任何气体所占的体积都约为22.4 L。即标况下,气体的摩尔体积Vm=22.4 L/mol。
条件:标准状况(S.T.P)
对象:气体(纯净物、混合物)
物质的量:1mol
体积:约为22.4 L,计算时不用近似
273K, 101KPa(1atm)
摩尔体积:单位为L/mol
判断下列说法是否正确?为什么?
×
×
√
×
2、通常状况下,1molH2O的体积约为22.4 L
1、0.5 molCO2占有的体积为11.2L
4、气体的摩尔体积为22.4L/mol 时,一定在标况下。
5、1molHCl在303 KPa 的体积比22.4 L小
6、在标况下,1molO2和1molN2混合体积约为44.8L
3、标况下任何气体的体积都约为22.4 L
×
×
未注明标准状况
未注明状况,且水为液态
温度和压强可同时改变
温度可能不同
1mol的气体
安全气囊
2NaN3 →2Na + 3N2↑
若要得到标准状况下67.2LN2,需____gNaN3;
NaN3的密度约为2g/cm3,则NaN3的体积约为 _____cm3。
“…此一系统能有效运作,只需要相当少量的叠氮化钠就够了。”
65
130
在同温同压下,相同质量的下列气体,
占有的体积由大到小的顺序是_________
①Cl2 ②N2 ③H2 ④CO2 ⑤O2
③>②>⑤>④>①
标准状况下,CO2的密度为_________
1.964 g/L
下列说法正确的是( )
A.在标准状况下,1 mol水和1 molH2的体积 都约是22.4 L
B. 2 gH2和44 gCO2的体积相等
C.1 mol某气体的体积为22.4 L,则该气体 一 定处于标准状况
D.在标准状况下,1 gH2和11.2 LO2的物质的量相等
E.在标准状况下,28 gN2和CO的混合气体的体积为22.4 L
DE
填写下列空白:
(1)标准况状下,0.5molH2占有的体积约是 L
(2)标准况状下, 2molO2占有的体积约是 L
(3)标准况状下,4.48LCO2的物质的量是 mol
(4)标准况状下,33.6LH2 的物质的量是 mol
(5)标准况状下,16gO2 的体积约为 L
(6)标准况状下, 11.2LN2 中含有N2分子的个数约是
11.2
44.8
0.2
1.5
11.2
3.01×1023个
1. 影响物质体积大小的因素:
粒子数目多少
粒子本身大小
粒子间的平均距离
温度
压强
知识总结:
2. 气体摩尔体积(Vm):
表示1mol气体所占的体积
在标准状况下,Vm=22.4 L/mol
体积(V)
×Vm
÷ Vm
÷M
×M
(m)
质量
×NA
÷NA
微粒数
(N)
(n)
物质的量
宏观形式
微观形式
分子
离子
原子
电子等
2.标准状况下的气体摩尔体积(Vm=22.4L/mol)理解要点:
条件:标准状况(S.T.P)
对象:任何气体
物质的量:1mol
体积约占22.4L
结论
1.气体摩尔体积
单位: L/mol
Vm=
V
n
公式:
符号: Vm
概念:单位物质的量气体所占的体积。
知识回顾
掌握气体摩尔体积时应注意以下几点:
1.气体摩尔体积仅仅是针对气体而言
2.气体在不同状况下的气体摩尔体积
是不同的,任何气体在S.T.P下
Vm=22.4 L/mol
3.同温同压下,气体的体积只与气体
的分子数目有关,而与气体的分子
种类无关
4. 当气体摩尔体积Vm=22.4 L/mol时,
气体不一定处于标准状态
在同温同压下,相同分子数的气体,其体积( );
在同温同压下,体积相同的气体,其分子数 ( );
在同温同压下,气体体积的大小与分子数目成( )比。
相同
相同
正
1、阿伏伽德罗定律:相同温度和压力下,相同体积的不同气体均含有相同数目的分子。
同温同压时(T 、P一定时)
=
V1
-
V2
n1
-
n2
=
N1
-
N2
三、阿伏伽德罗定律
(V∝N ∝n)
(1)同温同压时(T 、P一定时)
=
ρ1
-
ρ2
M1
-
M2
Mr1
-
Mr2
=
2、阿伏伽德罗定律的推论
m
=
ρ
-
V
÷n
=
ρ
-
M
Vm
=
V1
-
V2
n1
-
n2
=
m1/M1
m2/M2
(ρ∝M∝Mr)
①
②
(Vm为定值)
(2)同温同体积时(T 、V一定时)
=
P1
-
P2
n1
-
n2
(P∝n∝N)
N1
-
N2
=
四、理想气体状态方程式(Clapyron方程)
pV=nRT
P-压强/Pa
T-温度/K
V-体积/m3
R=8.314Pa m3 K-1 mol-1
n-物质的量/mol
或J K-1 mol-1
T/K=t/ ℃ + 273.15
理想气体: 分子本身的体积和分子间
的作用力都可以忽略不计的气体。
实际气体在 下可近似看成理想气体
高温、低压
(1) 同温同压时(T 、P一定时)
n1
=
V1
-
V2
-
n2
=
N1
-
N2
(2) 同温同体积时(T 、V一定时)
=
P1
-
P2
n1
-
n2
N1
-
N2
=
pV=nRT
ρ=
V
m
-
pM= ρRT
(3) 同温同压时(T 、P一定时)
=
ρ 1
-
ρ 2
M1
-
M2
Mr1
-
Mr2
=
(4) 同温同物质的量时(T 、n一定时)
=
P1
-
P 2
V2
-
V1
...................
(Boyle定律)
(1) 摩尔质量法
五、气体相对分子质量的计算
当摩尔质量以g ·mol-1为单位时,在数值上等于该分子的相对分子质量。
(2) 物质的量分数或体积分数法
Mr1n1% +Mr2n2% + ............
=
m总
n总
M
= M1n1% +M2n2% + ............
Mr
=
(3) 相对密度法(T, P相同条件下)
(4) 标准密度法
=
ρ 1
-
ρ 2
M1
-
M2
Mr1
-
Mr2
=
=
D
(D为相对密度)
=
M
ρVm
=
M
22.4ρ
(标准状况下)
1mol氧气在放电条件下,有30%转化为臭氧(O3),则放电后所得混合气体对氢气的相对密度是( )
A.16 B.17.8 C.18.4 D.35.6
已知阿伏加德罗常数、物质的摩尔质量及摩尔体积,下列物理量中尚不能全部计算出其近似值的是( )
A.固体物质分子的大小和质量
B.液态物质分子的大小及质量
C.气体物质分子的大小和质量
D.气体物质分子的质量
B
C
2、某条件下W完全分解,其反应方程式4W→X3(g)+2Y(g),测得生成物组成的混合气体与H2的相对密度为18,则W的式量为 ( )
A.27 B.18 C.36 D.126
1、阿佛加德罗定律之所以能够成立的本质原因是在一定温度和压强下( )
A.气体体积的大小只随分子数的多少变化
B.相同体积的气体含有相同的分子数
C.不同气体分子的大小几乎相等
D.不同气体分子间的平均距离几乎相等
A
D
课堂检测
3.下列叙述中正确的是( )
A.标准状况下,1 mol任何物质的体积都约为22.4 L
B.1 mol任何气体所含分子数都相等,体积也都约为22.4 L
C.相同状况下,1 L CO一定比1 L O2的质量小
D.在同温同压下,相同体积的任何气体单质所含原子数目相同
4.下列关于气体所含分子数说法正确的是( )
A.同温同压下,体积相同的CO和O2所含的分子数为NA(设NA为阿伏加德罗常数的数值)
B.相同体积的CO和CO2所含气体分子数相同
C.常温常压下1 g CO和1 g N2气体分子数相同
D.同温同压下1 L H2和1 L CO2气体分子数相同
C
CD
5、标准状况下,44.8 L由CO和H2组成的混合气体的质量为30 g,则混合气体的平均摩尔质量为________;CO和H2的物质的量之比为________。
答案:15 g/mol 1∶1
解析:混合气体的物质的量为44.8 L÷22.4 L/mol=2 mol,则平均摩尔质量为30 g/2 mol=15 g/mol;设CO的物质的量为x,则有:28 g/mol×x+(2-x)×2 g/mol=30 g,解方程得x=1 mol,H2的物质的量为2 mol-1 mol=1 mol,CO和H2的物质的量之比为1∶1。
分子直径
气体分子间平均距离示意图
分子间的平均距离
化学家眼中的物质世界
物质的聚集状态
固体(solid)
液体(liquid)
气体(gas)
物质 质量(g) 密度(g/cm3) 体积(cm3)
Fe 56 7.8
Al 27 2.7
H2O 18 1
H2SO4 98 1.83
7.2
10.0
18.0
53.6
1mol固体、液体体积( 20℃)
相同条件下,等物质的量气、固体,所占的体积不同
1mol气体体积(0℃,101kPa)
物质 质量(g) 密度(g/dm3) 体积(L)
H2 2.016 0.0899
O2 32.00 1.429
CO 28.01 1.25
Cl2 70.90 3.17
22.42
22.39
22.37
22.41
相同条件下,等物质的量气体所占的体积几乎相同
在同温同压下,为什么等物质的量的固体、液体物质的体积不相等,而等物质的量的气体体积却相等呢?
为什么
粒子的数目
物质体积的决定因素
①
②
微粒的大小
物质体积的决定因素
②
③
③
④
微粒间的平均距离
物质体积的决定因素
小结:影响物质体积大小的因素
体积
大小
微粒数
目多少
微粒本
身大小
微粒间
平均距离
由于微粒数目相同,而微粒大小不同
相同条件下,等物质的量液、固体,所占的体积不同?
固体物质
液体物质
固体、液体微粒间距离示意图
紧密堆积
讨论交流
T.P相同
V 相同
d相同
n相同
相同条件下,等物质的量气体所占的体积几乎相同?
固体、液体的体积
气体的体积
(1)粒子数目多少
(2)粒子本身大小
一、影响物质体积大小的因素
(1)粒子数目多少
(2)粒子间平均距离
d
T
P
其他条件不变时
d
常用单位有L/mol(L·mol-1)和m3/mol。
Vm=
V
n
公式:
符号: Vm
概念:单位物质的量气体所占的体积。
二、气体摩尔体积
即1mol气体所占的体积。
二、气体摩尔体积
标准状况下(0 ℃ 1.013 × 105Pa),1mol任何气体所占的体积都约为22.4 L。即标况下,气体的摩尔体积Vm=22.4 L/mol。
条件:标准状况(S.T.P)
对象:气体(纯净物、混合物)
物质的量:1mol
体积:约为22.4 L,计算时不用近似
273K, 101KPa(1atm)
摩尔体积:单位为L/mol
判断下列说法是否正确?为什么?
×
×
√
×
2、通常状况下,1molH2O的体积约为22.4 L
1、0.5 molCO2占有的体积为11.2L
4、气体的摩尔体积为22.4L/mol 时,一定在标况下。
5、1molHCl在303 KPa 的体积比22.4 L小
6、在标况下,1molO2和1molN2混合体积约为44.8L
3、标况下任何气体的体积都约为22.4 L
×
×
未注明标准状况
未注明状况,且水为液态
温度和压强可同时改变
温度可能不同
1mol的气体
安全气囊
2NaN3 →2Na + 3N2↑
若要得到标准状况下67.2LN2,需____gNaN3;
NaN3的密度约为2g/cm3,则NaN3的体积约为 _____cm3。
“…此一系统能有效运作,只需要相当少量的叠氮化钠就够了。”
65
130
在同温同压下,相同质量的下列气体,
占有的体积由大到小的顺序是_________
①Cl2 ②N2 ③H2 ④CO2 ⑤O2
③>②>⑤>④>①
标准状况下,CO2的密度为_________
1.964 g/L
下列说法正确的是( )
A.在标准状况下,1 mol水和1 molH2的体积 都约是22.4 L
B. 2 gH2和44 gCO2的体积相等
C.1 mol某气体的体积为22.4 L,则该气体 一 定处于标准状况
D.在标准状况下,1 gH2和11.2 LO2的物质的量相等
E.在标准状况下,28 gN2和CO的混合气体的体积为22.4 L
DE
填写下列空白:
(1)标准况状下,0.5molH2占有的体积约是 L
(2)标准况状下, 2molO2占有的体积约是 L
(3)标准况状下,4.48LCO2的物质的量是 mol
(4)标准况状下,33.6LH2 的物质的量是 mol
(5)标准况状下,16gO2 的体积约为 L
(6)标准况状下, 11.2LN2 中含有N2分子的个数约是
11.2
44.8
0.2
1.5
11.2
3.01×1023个
1. 影响物质体积大小的因素:
粒子数目多少
粒子本身大小
粒子间的平均距离
温度
压强
知识总结:
2. 气体摩尔体积(Vm):
表示1mol气体所占的体积
在标准状况下,Vm=22.4 L/mol
体积(V)
×Vm
÷ Vm
÷M
×M
(m)
质量
×NA
÷NA
微粒数
(N)
(n)
物质的量
宏观形式
微观形式
分子
离子
原子
电子等
2.标准状况下的气体摩尔体积(Vm=22.4L/mol)理解要点:
条件:标准状况(S.T.P)
对象:任何气体
物质的量:1mol
体积约占22.4L
结论
1.气体摩尔体积
单位: L/mol
Vm=
V
n
公式:
符号: Vm
概念:单位物质的量气体所占的体积。
知识回顾
掌握气体摩尔体积时应注意以下几点:
1.气体摩尔体积仅仅是针对气体而言
2.气体在不同状况下的气体摩尔体积
是不同的,任何气体在S.T.P下
Vm=22.4 L/mol
3.同温同压下,气体的体积只与气体
的分子数目有关,而与气体的分子
种类无关
4. 当气体摩尔体积Vm=22.4 L/mol时,
气体不一定处于标准状态
在同温同压下,相同分子数的气体,其体积( );
在同温同压下,体积相同的气体,其分子数 ( );
在同温同压下,气体体积的大小与分子数目成( )比。
相同
相同
正
1、阿伏伽德罗定律:相同温度和压力下,相同体积的不同气体均含有相同数目的分子。
同温同压时(T 、P一定时)
=
V1
-
V2
n1
-
n2
=
N1
-
N2
三、阿伏伽德罗定律
(V∝N ∝n)
(1)同温同压时(T 、P一定时)
=
ρ1
-
ρ2
M1
-
M2
Mr1
-
Mr2
=
2、阿伏伽德罗定律的推论
m
=
ρ
-
V
÷n
=
ρ
-
M
Vm
=
V1
-
V2
n1
-
n2
=
m1/M1
m2/M2
(ρ∝M∝Mr)
①
②
(Vm为定值)
(2)同温同体积时(T 、V一定时)
=
P1
-
P2
n1
-
n2
(P∝n∝N)
N1
-
N2
=
四、理想气体状态方程式(Clapyron方程)
pV=nRT
P-压强/Pa
T-温度/K
V-体积/m3
R=8.314Pa m3 K-1 mol-1
n-物质的量/mol
或J K-1 mol-1
T/K=t/ ℃ + 273.15
理想气体: 分子本身的体积和分子间
的作用力都可以忽略不计的气体。
实际气体在 下可近似看成理想气体
高温、低压
(1) 同温同压时(T 、P一定时)
n1
=
V1
-
V2
-
n2
=
N1
-
N2
(2) 同温同体积时(T 、V一定时)
=
P1
-
P2
n1
-
n2
N1
-
N2
=
pV=nRT
ρ=
V
m
-
pM= ρRT
(3) 同温同压时(T 、P一定时)
=
ρ 1
-
ρ 2
M1
-
M2
Mr1
-
Mr2
=
(4) 同温同物质的量时(T 、n一定时)
=
P1
-
P 2
V2
-
V1
...................
(Boyle定律)
(1) 摩尔质量法
五、气体相对分子质量的计算
当摩尔质量以g ·mol-1为单位时,在数值上等于该分子的相对分子质量。
(2) 物质的量分数或体积分数法
Mr1n1% +Mr2n2% + ............
=
m总
n总
M
= M1n1% +M2n2% + ............
Mr
=
(3) 相对密度法(T, P相同条件下)
(4) 标准密度法
=
ρ 1
-
ρ 2
M1
-
M2
Mr1
-
Mr2
=
=
D
(D为相对密度)
=
M
ρVm
=
M
22.4ρ
(标准状况下)
1mol氧气在放电条件下,有30%转化为臭氧(O3),则放电后所得混合气体对氢气的相对密度是( )
A.16 B.17.8 C.18.4 D.35.6
已知阿伏加德罗常数、物质的摩尔质量及摩尔体积,下列物理量中尚不能全部计算出其近似值的是( )
A.固体物质分子的大小和质量
B.液态物质分子的大小及质量
C.气体物质分子的大小和质量
D.气体物质分子的质量
B
C
2、某条件下W完全分解,其反应方程式4W→X3(g)+2Y(g),测得生成物组成的混合气体与H2的相对密度为18,则W的式量为 ( )
A.27 B.18 C.36 D.126
1、阿佛加德罗定律之所以能够成立的本质原因是在一定温度和压强下( )
A.气体体积的大小只随分子数的多少变化
B.相同体积的气体含有相同的分子数
C.不同气体分子的大小几乎相等
D.不同气体分子间的平均距离几乎相等
A
D
课堂检测
3.下列叙述中正确的是( )
A.标准状况下,1 mol任何物质的体积都约为22.4 L
B.1 mol任何气体所含分子数都相等,体积也都约为22.4 L
C.相同状况下,1 L CO一定比1 L O2的质量小
D.在同温同压下,相同体积的任何气体单质所含原子数目相同
4.下列关于气体所含分子数说法正确的是( )
A.同温同压下,体积相同的CO和O2所含的分子数为NA(设NA为阿伏加德罗常数的数值)
B.相同体积的CO和CO2所含气体分子数相同
C.常温常压下1 g CO和1 g N2气体分子数相同
D.同温同压下1 L H2和1 L CO2气体分子数相同
C
CD
5、标准状况下,44.8 L由CO和H2组成的混合气体的质量为30 g,则混合气体的平均摩尔质量为________;CO和H2的物质的量之比为________。
答案:15 g/mol 1∶1
解析:混合气体的物质的量为44.8 L÷22.4 L/mol=2 mol,则平均摩尔质量为30 g/2 mol=15 g/mol;设CO的物质的量为x,则有:28 g/mol×x+(2-x)×2 g/mol=30 g,解方程得x=1 mol,H2的物质的量为2 mol-1 mol=1 mol,CO和H2的物质的量之比为1∶1。
分子直径
气体分子间平均距离示意图
分子间的平均距离
