第七单元 常见的酸和碱——2021-2022学年化学鲁教版九年级下册单元易错练习(Word版含解析)
文档属性
| 名称 | 第七单元 常见的酸和碱——2021-2022学年化学鲁教版九年级下册单元易错练习(Word版含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 360.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-17 00:00:00 | ||
图片预览



文档简介
(1)常见的酸和碱
——2021-2022学年化学鲁教版九年级下册单元易错练习
1.食醋中含有醋酸,食醋除作调味剂外,生活中还有很多妙用,下列使用食醋肯定不能达到目的的是( )
A.除去水壶壁上的水垢
B.鉴别黄金饰品中是否含有铜
C.除去菜刀上的铁锈
D.减弱皮蛋中的涩味
2.对于浓硫酸的稀释操作,现提出如下注意事项:①边稀释,边搅拌溶液;②将水沿器壁加入浓疏酸中;③稀释操作要缓慢进行;④可在量筒中,也可在烧杯中稀释。其中不正确的( )
A.①和③
B.②和④
C.①、②和④
D.①、②和③
3.忘盖瓶塞的氢氧化钠溶液可能变质。表中分析与设计错误的是( )
选项 问题 分析与设计
A 为何变质
B 是否变质 取样,加入足量稀盐酸,观察是否产生气泡
C 是否全部变质 取样,加入足量氯化钙溶液,观察产生沉淀多少
D 如何除去杂质 取样,加入适量氢氧化钙溶液,过滤
A.A B.B C.C D.D
4.如图表示化学反应中溶液的颜色变化,下列叙述错误的是( )
A.若X是稀硫酸,则a可能是紫色石蕊溶液
B.若X是稀硫酸,则d一定是CuO固体
C.若X是稀盐酸,则c可能是单质
D.若b是,则黄色溶液可能是氯化铁溶液
5.某同学在化学晚会上表演如下魔术,用毛笔蘸取一种无色液体在一张白纸上写了“化学魔术”四字,然后喷一种无色液体,白纸上立即出现红色的字,该生先后所用无色试剂是( )
A.石蕊试液 稀硫酸 B.酚酞试液 雪碧饮料
C.氢氧化钠溶液 酚酞试液 D.氢氧化钠溶液 硫酸铜溶液
6.在饱和氢氧化钙溶液中加入一定量生石灰后,恢复至室温,图像正确的是( )
A.
B.
C.
D.
7.实验小组用传感器研究等量水和NaOH溶液分别吸收的效果,实验装置及测定结果如图所示。下列说法不正确的是( )
A.曲线①是溶解和与水反应的综合结果
B.对比曲线①和②,可说明能与NaOH反应
C.NaOH溶液吸收的效果比水好
D.若选用等量饱和石灰水进行实验,其曲线在①上方
8.生活中一些物质的pH如表所示,下列说法正确的是( )
物质 肥皂水 牙膏 西瓜汁 苹果汁
pH 10.2 8.5 5.8 2.9
A.牙膏和苹果汁都显酸性
B.被蚊虫叮咬可涂抹牙膏或肥皂水
C.西瓜汁比苹果汁的酸性强
D.肥皂水不能使无色酚酞溶液变色
9.某同学想用pH试纸测定一些物质的pH,下列做法能达到实验目的的是( )
A.用干燥的pH试纸测定白醋的pH
B.用干燥的pH试纸测定二氧化碳气体的pH
C.用干燥的pH试纸测定98%的浓硫酸的pH
D.用湿润的pH试纸测定0.4%的氢氧化钠溶液的pH
10.硫酸和氢氧化钠溶液发生中和反应时,溶液pH的变化如图所示。下列说法正确的是( )
A.图中a点所示溶液呈酸性
B.图中c点所示的溶液中,含有和NaOH
C.b点表示酸和碱恰好反应完全
D.该实验是将氢氧化钠溶液逐滴滴入硫酸溶液中
11.实验小组用传感器探究稀NaOH溶液与稀盐酸反应过程中温度和pH的变化,测定结果如图所示。下列说法不正确的是( )
A.反应过程中有热量放出
B.40s时,溶液中溶质为HCl和NaCl
C.该实验中可用氢氧化钠固体代替稀氢氧化钠溶液
D.该实验是将稀NaOH溶液滴入稀盐酸中
12.氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法正确的是( )
A.该实验是将氧化铜逐渐加入稀盐酸中
B.点和点对应溶液中铜元素质量不相等
C.点和点对应溶液中溶质的成分相同
D.该曲线能反映溶液中溶剂质量随时间的变化关系
13.完成下列有关酸的性质的实验。
实验一:图甲所示的电子天平A、B上的表面皿中分别盛有浓HCl、浓,放置一段时间。
(1)A中的示数变小,原因是________。
(2)与图甲中C所示变化相一致的是________(填“A”“B”或“A、B”)。
实验二:如图乙,做对比实验,得出相应结论。
(3)I和Ⅱ试管中都产生气泡,且I中比Ⅱ中反应剧烈。此现象说明物质反应的快慢与________有关。Ⅲ试管中可能出现的现象是_______。请用化学方程式解释其原因:_______、_______。
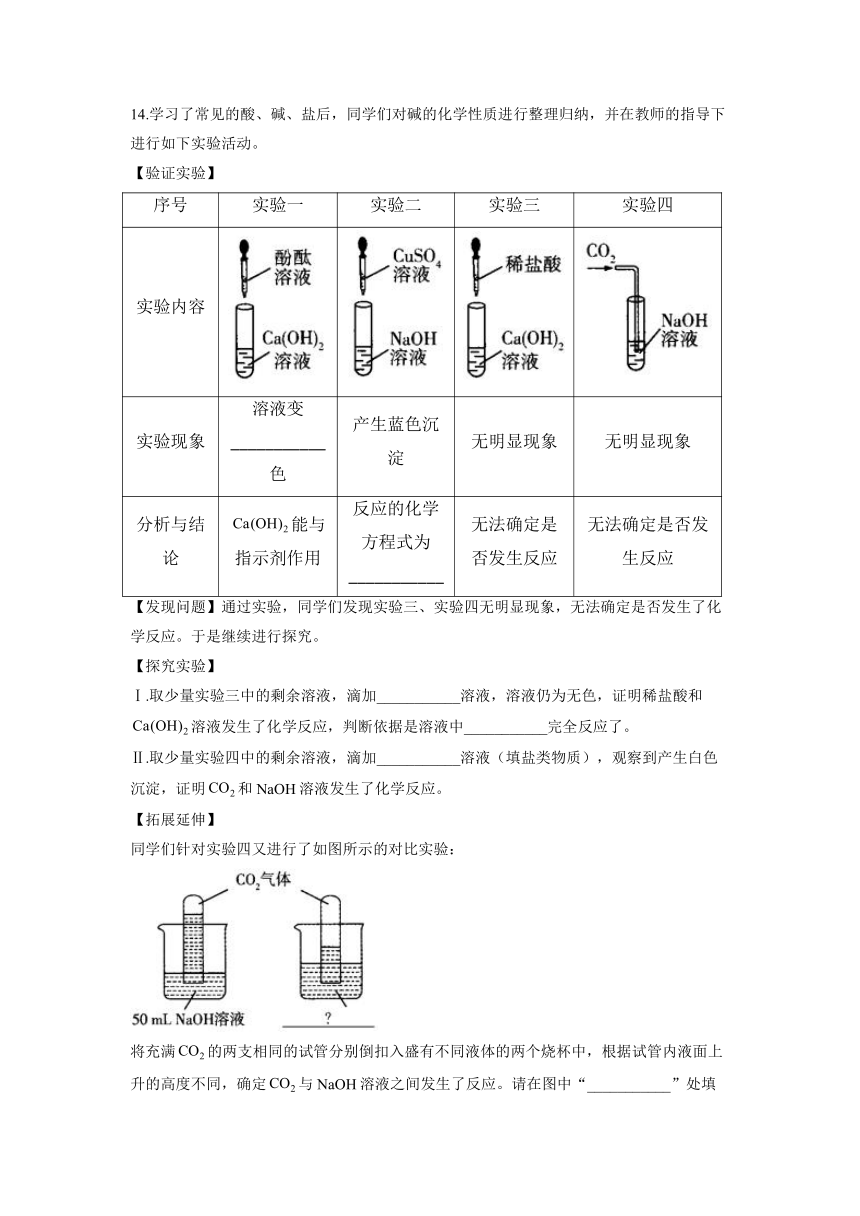
14.学习了常见的酸、碱、盐后,同学们对碱的化学性质进行整理归纳,并在教师的指导下进行如下实验活动。
【验证实验】
序号 实验一 实验二 实验三 实验四
实验内容
实验现象 溶液变___________色 产生蓝色沉淀 无明显现象 无明显现象
分析与结论 能与指示剂作用 反应的化学方程式为___________ 无法确定是否发生反应 无法确定是否发生反应
【发现问题】通过实验,同学们发现实验三、实验四无明显现象,无法确定是否发生了化学反应。于是继续进行探究。
【探究实验】
Ⅰ.取少量实验三中的剩余溶液,滴加___________溶液,溶液仍为无色,证明稀盐酸和溶液发生了化学反应,判断依据是溶液中___________完全反应了。
Ⅱ.取少量实验四中的剩余溶液,滴加___________溶液(填盐类物质),观察到产生白色沉淀,证明和NaOH溶液发生了化学反应。
【拓展延伸】
同学们针对实验四又进行了如图所示的对比实验:
将充满的两支相同的试管分别倒扣入盛有不同液体的两个烧杯中,根据试管内液面上升的高度不同,确定与NaOH溶液之间发生了反应。请在图中“___________”处填上适当的内容。
【总结提升】
(1)通过上述实验验证了碱溶液的化学性质。
(2)没有明显现象的化学反应,可以通过检验反应物消失(或减少)或有新物质生成的方法证明反应发生。
15.以下是今年我市实验操作考查的内容,请回答相关问题。
【实验目的】证明氢氧化钠溶液与稀盐酸发生了反应且生成了新物质。
【实验原理】____________(用化学方程式表示)。
【药品仪器】
【实验步骤】①取_________(填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用_________(填仪器名称)向①中溶液滴加稀盐酸,直至红色消失;
③向②中溶液继续滴加过量稀盐酸,溶液保持无色;
④用F蘸取③中溶液,在酒精灯上灼烧,有白色固体产生。
【思考拓展】(1)步骤③的目的是_________。
(2)如不使用酸碱指示剂,进一步确认步骤④中的白色固体不是氢氧化钠的方法是_________。
(3)已知酚酞试液在不同pH时的变色情况如下表。
pH <8.2 8.2~10.0 >10.0
颜色 无色 红色 无色
某同学发现:向某氢氧化钠溶液中滴加酚酞试液后,溶液显无色;逐滴滴加稀盐酸,溶液先变红,后褪至无色。你认为该氢氧化钠溶液滴加酚酞试液显无色的原因可能是____________。请设计实验证明你的猜想(写出简要的操作步骤与现象):____________。
答案以及解析
1.答案:B
解析:水垢的主要成分是碳酸钙、氢氧化镁,均能与醋酸反应,可使用食醋除去水壶壁上的水垢,A不符合题意。铜在金属活动性顺序中的位置排在氢的后面,不能与醋酸反应,使用食醋不能鉴别黄金饰品中是否含有铜,B符合题意。铁锈的主要成分是氧化铁,能与醋酸反应,可使用食醋除去菜刀上的铁锈,C不符合题意。醋酸能与皮蛋中的碱性物质发生反应,可减弱皮蛋中的涩味,D不符合题意。
2.答案:B
解析:由于浓硫酸溶于水时放出大量的热,所以应边稀释,边搅拌溶液,及时散热,故①正确;应将浓硫酸沿器壁加入水中进行稀释,故②错误;浓硫酸溶于水时放出大量的热,稀释操作要缓慢进行,故③正确;量筒不能用来稀释溶液,故④错误。综上所述,操作不正确的是②和④,故选B。
3.答案:C
解析:氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水而变质,A正确;氢氧化钠和稀盐酸反应无明显现象,碳酸钠和稀盐酸反应会生成二氧化碳气体,可向样品中加入足量稀盐酸,通过观察是否有气泡产生确定氢氧化钠是否变质,B正确;检验氢氧化钠溶液是否全部变质的方法是向样品中加入足量氯化钙溶液,过滤,向滤液中滴加无色酚酞溶液,若溶液变红色说明氢氧化钠部分变质,若溶液不变色说明氢氧化钠完全变质,不能通过观察产生沉淀多少来探究NaOH溶液是否全部变质,C错误;氢氧化钙利和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,加入适量的氢氧化钙溶液,过滤后可得到只含氢氧化钠的溶液,D正确。
4.答案:B
解析:稀硫酸能使紫色石蕊溶液变红,所以若X是稀硫酸,则a可能是紫色石蕊溶液,A正确;稀硫酸与氧化铜反应生成硫酸铜和水,稀硫酸和氢氧化铜反应也生成硫酸铜和水,硫酸铜的水溶液显蓝色,所以若X是稀硫酸,则d不一定是CuO固体,B错误;稀盐酸与铁反应生成浅绿色硫酸亚铁溶液和氢气,所以若X是稀盐酸,则c可能是单质铁,C正确;氧化铁与稀盐酸反应生成黄色氯化铁溶液和水,所以若b是,则黄色溶液可能是氯化铁溶液,D正确。
5.答案:C
解析:从题目信息可知是两种无色物质混合后呈现红色,石蕊溶液为紫色,溶液为蓝色,故A项和D项错误;“雪碧”饮料呈现酸性,遇酚酞不会变色,故选:C。
6.答案:C
解析:A、生石灰遇水会与之反应生成氢氧化钙,使溶液中的溶剂量变小,溶剂量的曲线会下降不是水平线,故图象错误.
B、生石灰放入到饱和石灰水中后会吸收一定量水分,同时原氢氧化钙溶液会析出溶质,但最后剩余溶液为这一温度下的饱和溶液,所以溶液的碱性应与原来的相同,pH不会改变,图象中pH曲线一直上升,故错误.
C、生石灰放入到饱和石灰水中后会吸收一定量水分,同时原氢氧化钙溶液会析出溶质,但最后剩余溶液为这一温度下的饱和溶液,此过程中由于溶剂的量变小所以最终溶液中的溶质的量会变小,而生石灰与水反应时会放热导致溶液温度升高,氢氧化钙的溶解度减小(氢氧化钙的溶解度随温度升高而减小),所以开始溶质的质量会不断下降,到恢复室温溶解度变大,溶质的量又会变多,但最终溶质的质量应小于原来溶液中溶质的量,图象符合该过程;
D、生石灰放入到饱和石灰水中后会吸收一定量水分,同时原氢氧化钙溶液会析出溶质,但最后剩余溶液为这一温度下的饱和溶液,因此最终的溶质质量分数应与原来相同,图象体现溶质的质量分数变大,故错误。
故选C。
7.答案:D
解析:若选用等量饱和石灰水进行实验,其曲线在①下方、②上方,这是因为氢氧化钙溶液吸收的效果比水好,比氢氧化钠溶液差,D不正确。
8.答案:B
解析:酸性溶液的pH<7,中性溶液的pH=7,碱性溶液的pH>7,牙膏的pH=8.5,显碱性,苹果汁的pH=2.9,显酸性,A选项不正确;牙膏、肥皂水的pH均大于7,呈碱性,被蚊虫叮咬可涂抹牙膏或肥皂水中和酸性物质,B选项正确;酸性溶液的pH<7,PH越小,酸性越强,西瓜汁的pH=5.8,苹果汁的pH=2.9,苹果汁的酸性较强,C选项不正确;肥皂水的pH=10.2,呈碱性,能使无色酚酞溶液变红,D选项不正确。
9.答案:A
解析:应用干燥的pH试纸测定白醋的pH,A正确;二氧化碳气体不能使干燥的pH试纸变色,所以不能用干燥的pH试纸测定二氧化碳气体的pH,B错误;浓硫酸具有脱水性,不能用干燥的pH试纸测定98%的浓疏酸的pH,C错误;0.4%的氢氧化钠溶液显碱性,用湿润的pH试纸测其pH,相当于将其稀释,会使测定结果偏小,D错误。
10.答案:C
解析:本题考查中和反应。a点溶液pH>7,显碱性,A项错误;硫酸与氢氧化钠反应生成硫酸钠和水,c点溶液pH<7,显酸性,故溶液中含有硫酸钠和硫酸,B项错误;b点溶液pH=7,显中性,表示酸和碱恰好完全反应,C项正确;分析图像信息可知,最初溶液pH>7,显碱性,说明该实验是将硫酸逐滴滴入氢氧化钠溶液中,D项错误。
11.答案:C
解析:由图可知,反应过程中温度不断升高,为放热反应,所以A选项正确;40s时,溶液pH<7,说明盐酸有剩余,此时溶液中溶质为HCl和NaCl,所以B选项正确;由于氢氧化钠固体溶于水会放热,用氢氧化钠固体代替稀NaOH溶液无法判断氢氧化钠和稀盐酸反应是否放热,所以C选项错误;溶液的pH由小于7逐渐增大到大于7,说明是将稀NaOH溶液滴入稀盐酸中,所以D选项正确。
12.答案:D
解析:由图像可知,溶液总质量从零开始,所以该实验是将稀盐酸逐渐加入氧化铜中,A错误;点表示氧化铜和稀盐酸恰好完全反应,点表示加入的稀盐酸过量,所以点和点对应溶液中铜元素质量相等,B错误;点表示氧化铜和稀盐酸恰好完全反应,溶质为氯化铜,点表示加入的稀盐酸过量,溶液中的溶质为氯化铜和氯化氢,所以点和点对应溶液中溶质成分不相同,C错误;该曲线横坐标是反应时间,纵坐标是溶液总质量,氧化铜与稀盐酸反应生成氯化铜和水,反应过程中溶液中溶剂质量为生成的水与加入稀盐酸中水的两部分之和,当反应完全后,溶液中溶剂增加量为加入的稀盐酸中的水的质量,该曲线能反映溶液中溶剂质量随时间的变化关系,溶液中溶剂质量随时间的推移而逐渐增大,D正确。
13.答案:(1)浓盐酸具有挥发性
(2)A、B
(3)酸的浓度;铁锈消失,溶液变成黄色,随后产生气泡;
解析:(1)浓盐酸具有挥发性,所以敞口放置一段时间后,氯化氢气体的挥发会造成溶液的质量减少。
(2)浓盐酸具有挥发性,挥发出了溶质,溶剂质量不变,而浓硫酸具有吸水性,溶剂质量增大,溶质质量不变,二者溶液中溶质的质量分数均会变小。
(3)I和Ⅱ试管中相同的铁片与不同浓度的盐酸反应,产生气泡的速率不同,盐酸的浓度越大,产生气泡的速率越快,说明物质反应的快慢与酸的浓度有关。生锈的铁钉放入盐酸中时,铁锈中的氧化铁与盐酸反应生成氯化铁和水,溶液变成黄色,铁锈消失:待氧化铁完全反应后,铁与盐酸反应生成氯化亚铁和氢气,又有气泡产生。
14.答案:【验证实验】红;
【探究实验】Ⅰ.酚酞;氢氧化钙Ⅱ.氯化钙(或硝酸钙、氯化钡、硝酸钡,合理即可)
【拓展延伸】50mL水
解析:【验证实验】氢氧化钙溶液显碱性,能使无色酚酞溶液变红。硫酸铜与氢氧化钠溶液反应生成氢氧化铜蓝色沉淀和硫酸钠。
【探究实验】Ⅰ.根据实验现象“溶液仍为无色”及实验结论
“稀盐酸和溶液发生了化学反应”,说明溶液不显碱性所滴加的溶液为无色酚酞溶液。结合实验一,溶液不显碱性,说明氢氧化钙完全反应了,据此可知稀盐酸与氢氧化钙溶液发生了化学反应。Ⅱ根据题干信息“观察到产生白色沉淀,证明和NaOH溶液发生了化学反应”,可知碳酸钠与所加试剂反应生成沉淀,碳酸根离子与钙离子结合生成碳酸钙白色沉淀,碳酸根离子与钡离子结合生成碳酸钡白色沉淀,所滴加的盐溶液中含有钙离子或钡离子,该盐可以是氯化钙、硝酸钙、氯化钡或硝酸钡。
【拓展延伸】二氧化碳溶于水也可导致试管内气压减小,在外界大气压作用下试管内液面升高,因此需取用等量水进行对比实验。
15.答案:【实验原理】
【实验步骤】①A;②2胶头滴管
【思考拓展】(1)充分反应掉所有的氢氧化钠
(2)取少量水将其溶解,观察温度的变化(合理即可)
(3)浓度过大;取少量该氢氧化钠溶液于烧杯中,向其中滴入酚酞试液,溶液为无色,然后用水稀释,若溶液颜色由无色变为红色,则证明猜想正确(合理即可)
解析:【实验原理】盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为。
【实验步骤】①盛放氢氧化钠溶液的试剂瓶应使用橡胶塞,故A瓶盛的是氢氧化钠溶液;②实验过程中,应用胶头滴管滴加稀盐酸。
【思考拓展】(1)步骤③的目的是将氢氧化钠全部反应掉;
(2)氢氧化钠在溶解时会放热,而氯化钠在溶解时温度变化不明显,故可取少量水将步骤④得到的白色固体溶解,观察温度的变化;
(3)由题表信息可知,该氢氧化钠溶液滴加酚酞试液显无色的原因可能是浓度过大;取少量该氢氧化钠溶液于烧杯中,向其中滴入酚酞试液,溶液为无色,然后用水稀释,若溶液颜色由无色变为红色,则证明猜想正确。
——2021-2022学年化学鲁教版九年级下册单元易错练习
1.食醋中含有醋酸,食醋除作调味剂外,生活中还有很多妙用,下列使用食醋肯定不能达到目的的是( )
A.除去水壶壁上的水垢
B.鉴别黄金饰品中是否含有铜
C.除去菜刀上的铁锈
D.减弱皮蛋中的涩味
2.对于浓硫酸的稀释操作,现提出如下注意事项:①边稀释,边搅拌溶液;②将水沿器壁加入浓疏酸中;③稀释操作要缓慢进行;④可在量筒中,也可在烧杯中稀释。其中不正确的( )
A.①和③
B.②和④
C.①、②和④
D.①、②和③
3.忘盖瓶塞的氢氧化钠溶液可能变质。表中分析与设计错误的是( )
选项 问题 分析与设计
A 为何变质
B 是否变质 取样,加入足量稀盐酸,观察是否产生气泡
C 是否全部变质 取样,加入足量氯化钙溶液,观察产生沉淀多少
D 如何除去杂质 取样,加入适量氢氧化钙溶液,过滤
A.A B.B C.C D.D
4.如图表示化学反应中溶液的颜色变化,下列叙述错误的是( )
A.若X是稀硫酸,则a可能是紫色石蕊溶液
B.若X是稀硫酸,则d一定是CuO固体
C.若X是稀盐酸,则c可能是单质
D.若b是,则黄色溶液可能是氯化铁溶液
5.某同学在化学晚会上表演如下魔术,用毛笔蘸取一种无色液体在一张白纸上写了“化学魔术”四字,然后喷一种无色液体,白纸上立即出现红色的字,该生先后所用无色试剂是( )
A.石蕊试液 稀硫酸 B.酚酞试液 雪碧饮料
C.氢氧化钠溶液 酚酞试液 D.氢氧化钠溶液 硫酸铜溶液
6.在饱和氢氧化钙溶液中加入一定量生石灰后,恢复至室温,图像正确的是( )
A.
B.
C.
D.
7.实验小组用传感器研究等量水和NaOH溶液分别吸收的效果,实验装置及测定结果如图所示。下列说法不正确的是( )
A.曲线①是溶解和与水反应的综合结果
B.对比曲线①和②,可说明能与NaOH反应
C.NaOH溶液吸收的效果比水好
D.若选用等量饱和石灰水进行实验,其曲线在①上方
8.生活中一些物质的pH如表所示,下列说法正确的是( )
物质 肥皂水 牙膏 西瓜汁 苹果汁
pH 10.2 8.5 5.8 2.9
A.牙膏和苹果汁都显酸性
B.被蚊虫叮咬可涂抹牙膏或肥皂水
C.西瓜汁比苹果汁的酸性强
D.肥皂水不能使无色酚酞溶液变色
9.某同学想用pH试纸测定一些物质的pH,下列做法能达到实验目的的是( )
A.用干燥的pH试纸测定白醋的pH
B.用干燥的pH试纸测定二氧化碳气体的pH
C.用干燥的pH试纸测定98%的浓硫酸的pH
D.用湿润的pH试纸测定0.4%的氢氧化钠溶液的pH
10.硫酸和氢氧化钠溶液发生中和反应时,溶液pH的变化如图所示。下列说法正确的是( )
A.图中a点所示溶液呈酸性
B.图中c点所示的溶液中,含有和NaOH
C.b点表示酸和碱恰好反应完全
D.该实验是将氢氧化钠溶液逐滴滴入硫酸溶液中
11.实验小组用传感器探究稀NaOH溶液与稀盐酸反应过程中温度和pH的变化,测定结果如图所示。下列说法不正确的是( )
A.反应过程中有热量放出
B.40s时,溶液中溶质为HCl和NaCl
C.该实验中可用氢氧化钠固体代替稀氢氧化钠溶液
D.该实验是将稀NaOH溶液滴入稀盐酸中
12.氧化铜与稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法正确的是( )
A.该实验是将氧化铜逐渐加入稀盐酸中
B.点和点对应溶液中铜元素质量不相等
C.点和点对应溶液中溶质的成分相同
D.该曲线能反映溶液中溶剂质量随时间的变化关系
13.完成下列有关酸的性质的实验。
实验一:图甲所示的电子天平A、B上的表面皿中分别盛有浓HCl、浓,放置一段时间。
(1)A中的示数变小,原因是________。
(2)与图甲中C所示变化相一致的是________(填“A”“B”或“A、B”)。
实验二:如图乙,做对比实验,得出相应结论。
(3)I和Ⅱ试管中都产生气泡,且I中比Ⅱ中反应剧烈。此现象说明物质反应的快慢与________有关。Ⅲ试管中可能出现的现象是_______。请用化学方程式解释其原因:_______、_______。
14.学习了常见的酸、碱、盐后,同学们对碱的化学性质进行整理归纳,并在教师的指导下进行如下实验活动。
【验证实验】
序号 实验一 实验二 实验三 实验四
实验内容
实验现象 溶液变___________色 产生蓝色沉淀 无明显现象 无明显现象
分析与结论 能与指示剂作用 反应的化学方程式为___________ 无法确定是否发生反应 无法确定是否发生反应
【发现问题】通过实验,同学们发现实验三、实验四无明显现象,无法确定是否发生了化学反应。于是继续进行探究。
【探究实验】
Ⅰ.取少量实验三中的剩余溶液,滴加___________溶液,溶液仍为无色,证明稀盐酸和溶液发生了化学反应,判断依据是溶液中___________完全反应了。
Ⅱ.取少量实验四中的剩余溶液,滴加___________溶液(填盐类物质),观察到产生白色沉淀,证明和NaOH溶液发生了化学反应。
【拓展延伸】
同学们针对实验四又进行了如图所示的对比实验:
将充满的两支相同的试管分别倒扣入盛有不同液体的两个烧杯中,根据试管内液面上升的高度不同,确定与NaOH溶液之间发生了反应。请在图中“___________”处填上适当的内容。
【总结提升】
(1)通过上述实验验证了碱溶液的化学性质。
(2)没有明显现象的化学反应,可以通过检验反应物消失(或减少)或有新物质生成的方法证明反应发生。
15.以下是今年我市实验操作考查的内容,请回答相关问题。
【实验目的】证明氢氧化钠溶液与稀盐酸发生了反应且生成了新物质。
【实验原理】____________(用化学方程式表示)。
【药品仪器】
【实验步骤】①取_________(填“A”或“B”)中试剂加入至D中,滴加2滴酚酞试液,溶液呈红色;
②用_________(填仪器名称)向①中溶液滴加稀盐酸,直至红色消失;
③向②中溶液继续滴加过量稀盐酸,溶液保持无色;
④用F蘸取③中溶液,在酒精灯上灼烧,有白色固体产生。
【思考拓展】(1)步骤③的目的是_________。
(2)如不使用酸碱指示剂,进一步确认步骤④中的白色固体不是氢氧化钠的方法是_________。
(3)已知酚酞试液在不同pH时的变色情况如下表。
pH <8.2 8.2~10.0 >10.0
颜色 无色 红色 无色
某同学发现:向某氢氧化钠溶液中滴加酚酞试液后,溶液显无色;逐滴滴加稀盐酸,溶液先变红,后褪至无色。你认为该氢氧化钠溶液滴加酚酞试液显无色的原因可能是____________。请设计实验证明你的猜想(写出简要的操作步骤与现象):____________。
答案以及解析
1.答案:B
解析:水垢的主要成分是碳酸钙、氢氧化镁,均能与醋酸反应,可使用食醋除去水壶壁上的水垢,A不符合题意。铜在金属活动性顺序中的位置排在氢的后面,不能与醋酸反应,使用食醋不能鉴别黄金饰品中是否含有铜,B符合题意。铁锈的主要成分是氧化铁,能与醋酸反应,可使用食醋除去菜刀上的铁锈,C不符合题意。醋酸能与皮蛋中的碱性物质发生反应,可减弱皮蛋中的涩味,D不符合题意。
2.答案:B
解析:由于浓硫酸溶于水时放出大量的热,所以应边稀释,边搅拌溶液,及时散热,故①正确;应将浓硫酸沿器壁加入水中进行稀释,故②错误;浓硫酸溶于水时放出大量的热,稀释操作要缓慢进行,故③正确;量筒不能用来稀释溶液,故④错误。综上所述,操作不正确的是②和④,故选B。
3.答案:C
解析:氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水而变质,A正确;氢氧化钠和稀盐酸反应无明显现象,碳酸钠和稀盐酸反应会生成二氧化碳气体,可向样品中加入足量稀盐酸,通过观察是否有气泡产生确定氢氧化钠是否变质,B正确;检验氢氧化钠溶液是否全部变质的方法是向样品中加入足量氯化钙溶液,过滤,向滤液中滴加无色酚酞溶液,若溶液变红色说明氢氧化钠部分变质,若溶液不变色说明氢氧化钠完全变质,不能通过观察产生沉淀多少来探究NaOH溶液是否全部变质,C错误;氢氧化钙利和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,加入适量的氢氧化钙溶液,过滤后可得到只含氢氧化钠的溶液,D正确。
4.答案:B
解析:稀硫酸能使紫色石蕊溶液变红,所以若X是稀硫酸,则a可能是紫色石蕊溶液,A正确;稀硫酸与氧化铜反应生成硫酸铜和水,稀硫酸和氢氧化铜反应也生成硫酸铜和水,硫酸铜的水溶液显蓝色,所以若X是稀硫酸,则d不一定是CuO固体,B错误;稀盐酸与铁反应生成浅绿色硫酸亚铁溶液和氢气,所以若X是稀盐酸,则c可能是单质铁,C正确;氧化铁与稀盐酸反应生成黄色氯化铁溶液和水,所以若b是,则黄色溶液可能是氯化铁溶液,D正确。
5.答案:C
解析:从题目信息可知是两种无色物质混合后呈现红色,石蕊溶液为紫色,溶液为蓝色,故A项和D项错误;“雪碧”饮料呈现酸性,遇酚酞不会变色,故选:C。
6.答案:C
解析:A、生石灰遇水会与之反应生成氢氧化钙,使溶液中的溶剂量变小,溶剂量的曲线会下降不是水平线,故图象错误.
B、生石灰放入到饱和石灰水中后会吸收一定量水分,同时原氢氧化钙溶液会析出溶质,但最后剩余溶液为这一温度下的饱和溶液,所以溶液的碱性应与原来的相同,pH不会改变,图象中pH曲线一直上升,故错误.
C、生石灰放入到饱和石灰水中后会吸收一定量水分,同时原氢氧化钙溶液会析出溶质,但最后剩余溶液为这一温度下的饱和溶液,此过程中由于溶剂的量变小所以最终溶液中的溶质的量会变小,而生石灰与水反应时会放热导致溶液温度升高,氢氧化钙的溶解度减小(氢氧化钙的溶解度随温度升高而减小),所以开始溶质的质量会不断下降,到恢复室温溶解度变大,溶质的量又会变多,但最终溶质的质量应小于原来溶液中溶质的量,图象符合该过程;
D、生石灰放入到饱和石灰水中后会吸收一定量水分,同时原氢氧化钙溶液会析出溶质,但最后剩余溶液为这一温度下的饱和溶液,因此最终的溶质质量分数应与原来相同,图象体现溶质的质量分数变大,故错误。
故选C。
7.答案:D
解析:若选用等量饱和石灰水进行实验,其曲线在①下方、②上方,这是因为氢氧化钙溶液吸收的效果比水好,比氢氧化钠溶液差,D不正确。
8.答案:B
解析:酸性溶液的pH<7,中性溶液的pH=7,碱性溶液的pH>7,牙膏的pH=8.5,显碱性,苹果汁的pH=2.9,显酸性,A选项不正确;牙膏、肥皂水的pH均大于7,呈碱性,被蚊虫叮咬可涂抹牙膏或肥皂水中和酸性物质,B选项正确;酸性溶液的pH<7,PH越小,酸性越强,西瓜汁的pH=5.8,苹果汁的pH=2.9,苹果汁的酸性较强,C选项不正确;肥皂水的pH=10.2,呈碱性,能使无色酚酞溶液变红,D选项不正确。
9.答案:A
解析:应用干燥的pH试纸测定白醋的pH,A正确;二氧化碳气体不能使干燥的pH试纸变色,所以不能用干燥的pH试纸测定二氧化碳气体的pH,B错误;浓硫酸具有脱水性,不能用干燥的pH试纸测定98%的浓疏酸的pH,C错误;0.4%的氢氧化钠溶液显碱性,用湿润的pH试纸测其pH,相当于将其稀释,会使测定结果偏小,D错误。
10.答案:C
解析:本题考查中和反应。a点溶液pH>7,显碱性,A项错误;硫酸与氢氧化钠反应生成硫酸钠和水,c点溶液pH<7,显酸性,故溶液中含有硫酸钠和硫酸,B项错误;b点溶液pH=7,显中性,表示酸和碱恰好完全反应,C项正确;分析图像信息可知,最初溶液pH>7,显碱性,说明该实验是将硫酸逐滴滴入氢氧化钠溶液中,D项错误。
11.答案:C
解析:由图可知,反应过程中温度不断升高,为放热反应,所以A选项正确;40s时,溶液pH<7,说明盐酸有剩余,此时溶液中溶质为HCl和NaCl,所以B选项正确;由于氢氧化钠固体溶于水会放热,用氢氧化钠固体代替稀NaOH溶液无法判断氢氧化钠和稀盐酸反应是否放热,所以C选项错误;溶液的pH由小于7逐渐增大到大于7,说明是将稀NaOH溶液滴入稀盐酸中,所以D选项正确。
12.答案:D
解析:由图像可知,溶液总质量从零开始,所以该实验是将稀盐酸逐渐加入氧化铜中,A错误;点表示氧化铜和稀盐酸恰好完全反应,点表示加入的稀盐酸过量,所以点和点对应溶液中铜元素质量相等,B错误;点表示氧化铜和稀盐酸恰好完全反应,溶质为氯化铜,点表示加入的稀盐酸过量,溶液中的溶质为氯化铜和氯化氢,所以点和点对应溶液中溶质成分不相同,C错误;该曲线横坐标是反应时间,纵坐标是溶液总质量,氧化铜与稀盐酸反应生成氯化铜和水,反应过程中溶液中溶剂质量为生成的水与加入稀盐酸中水的两部分之和,当反应完全后,溶液中溶剂增加量为加入的稀盐酸中的水的质量,该曲线能反映溶液中溶剂质量随时间的变化关系,溶液中溶剂质量随时间的推移而逐渐增大,D正确。
13.答案:(1)浓盐酸具有挥发性
(2)A、B
(3)酸的浓度;铁锈消失,溶液变成黄色,随后产生气泡;
解析:(1)浓盐酸具有挥发性,所以敞口放置一段时间后,氯化氢气体的挥发会造成溶液的质量减少。
(2)浓盐酸具有挥发性,挥发出了溶质,溶剂质量不变,而浓硫酸具有吸水性,溶剂质量增大,溶质质量不变,二者溶液中溶质的质量分数均会变小。
(3)I和Ⅱ试管中相同的铁片与不同浓度的盐酸反应,产生气泡的速率不同,盐酸的浓度越大,产生气泡的速率越快,说明物质反应的快慢与酸的浓度有关。生锈的铁钉放入盐酸中时,铁锈中的氧化铁与盐酸反应生成氯化铁和水,溶液变成黄色,铁锈消失:待氧化铁完全反应后,铁与盐酸反应生成氯化亚铁和氢气,又有气泡产生。
14.答案:【验证实验】红;
【探究实验】Ⅰ.酚酞;氢氧化钙Ⅱ.氯化钙(或硝酸钙、氯化钡、硝酸钡,合理即可)
【拓展延伸】50mL水
解析:【验证实验】氢氧化钙溶液显碱性,能使无色酚酞溶液变红。硫酸铜与氢氧化钠溶液反应生成氢氧化铜蓝色沉淀和硫酸钠。
【探究实验】Ⅰ.根据实验现象“溶液仍为无色”及实验结论
“稀盐酸和溶液发生了化学反应”,说明溶液不显碱性所滴加的溶液为无色酚酞溶液。结合实验一,溶液不显碱性,说明氢氧化钙完全反应了,据此可知稀盐酸与氢氧化钙溶液发生了化学反应。Ⅱ根据题干信息“观察到产生白色沉淀,证明和NaOH溶液发生了化学反应”,可知碳酸钠与所加试剂反应生成沉淀,碳酸根离子与钙离子结合生成碳酸钙白色沉淀,碳酸根离子与钡离子结合生成碳酸钡白色沉淀,所滴加的盐溶液中含有钙离子或钡离子,该盐可以是氯化钙、硝酸钙、氯化钡或硝酸钡。
【拓展延伸】二氧化碳溶于水也可导致试管内气压减小,在外界大气压作用下试管内液面升高,因此需取用等量水进行对比实验。
15.答案:【实验原理】
【实验步骤】①A;②2胶头滴管
【思考拓展】(1)充分反应掉所有的氢氧化钠
(2)取少量水将其溶解,观察温度的变化(合理即可)
(3)浓度过大;取少量该氢氧化钠溶液于烧杯中,向其中滴入酚酞试液,溶液为无色,然后用水稀释,若溶液颜色由无色变为红色,则证明猜想正确(合理即可)
解析:【实验原理】盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为。
【实验步骤】①盛放氢氧化钠溶液的试剂瓶应使用橡胶塞,故A瓶盛的是氢氧化钠溶液;②实验过程中,应用胶头滴管滴加稀盐酸。
【思考拓展】(1)步骤③的目的是将氢氧化钠全部反应掉;
(2)氢氧化钠在溶解时会放热,而氯化钠在溶解时温度变化不明显,故可取少量水将步骤④得到的白色固体溶解,观察温度的变化;
(3)由题表信息可知,该氢氧化钠溶液滴加酚酞试液显无色的原因可能是浓度过大;取少量该氢氧化钠溶液于烧杯中,向其中滴入酚酞试液,溶液为无色,然后用水稀释,若溶液颜色由无色变为红色,则证明猜想正确。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
