第6章常用的金属和盐测试题-2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案)
文档属性
| 名称 | 第6章常用的金属和盐测试题-2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 174.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-18 14:41:13 | ||
图片预览



文档简介
第6章常用的金属和盐测试题2021-2022学年九年级化学沪教版(上海)下册
一、单选题
1.下列实验中有化学反应发生,且能观察到明显现象的是
A.向氯化钾溶液中滴入稀硫酸
B.向硫酸钠溶液中滴入氯化锌溶液
C.向氧化铜粉末中滴入氢氧化钠溶液
D.高温下向氧化铁粉末中通入一氧化碳
2.健康是人类永恒的主题。下列有关化学与健康的说法不正确的是
A.人体缺钙会导致骨质疏松
B.人体缺碘会引起甲状腺肿大
C.霉变大米经多次淘洗后可食用
D.可用碳酸氢钠做焙制糕点的发酵粉
3.某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
4.下列反应属于置换反应的是( )
A.
B.
C.
D.
5.小明外出游玩,发现路边的小麦叶子发黄、有倒伏现象,他建议田主应该施用一种复合肥料,这种复合肥料是
A.CO(NH2)2
B.KCl
C.KNO3
D.NH4HCO3
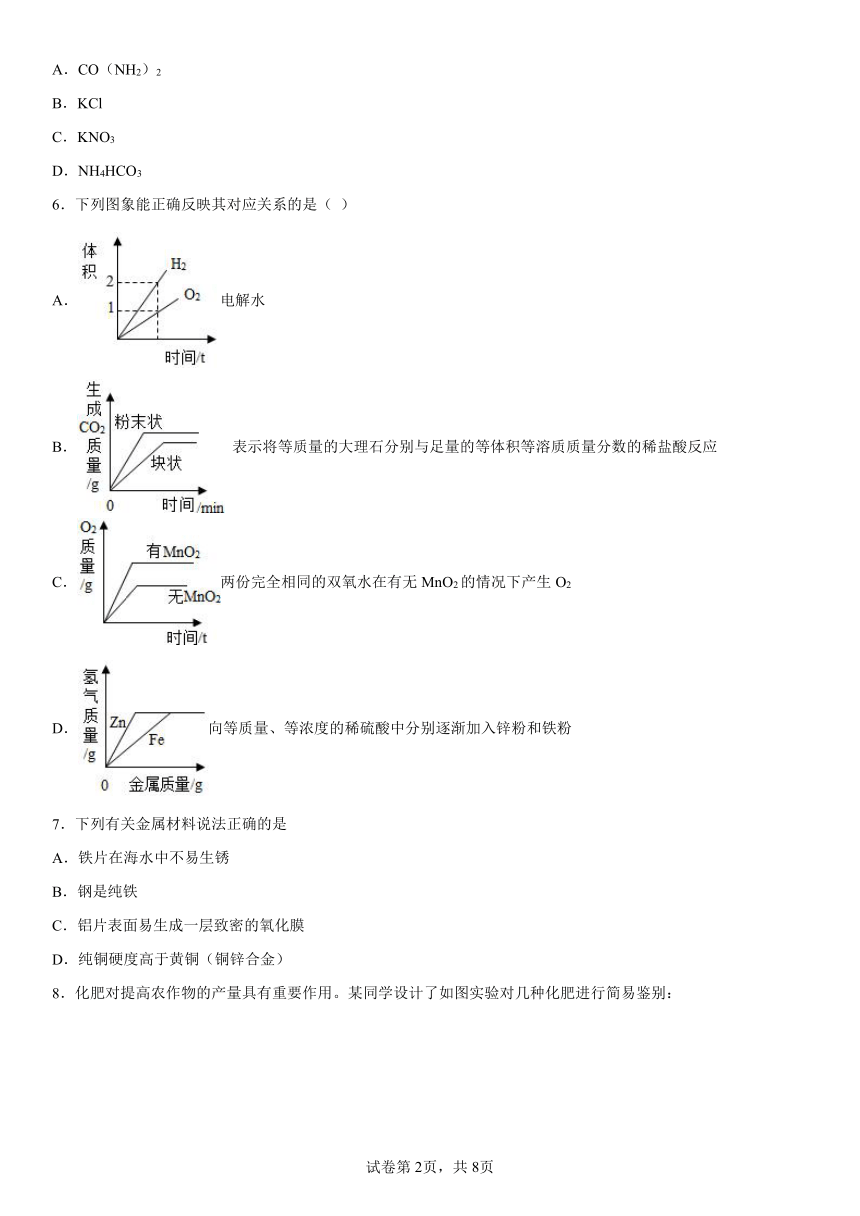
6.下列图象能正确反映其对应关系的是( )
A.电解水
B. 表示将等质量的大理石分别与足量的等体积等溶质质量分数的稀盐酸反应
C.两份完全相同的双氧水在有无MnO2的情况下产生O2
D.向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
7.下列有关金属材料说法正确的是
A.铁片在海水中不易生锈
B.钢是纯铁
C.铝片表面易生成一层致密的氧化膜
D.纯铜硬度高于黄铜(铜锌合金)
8.化肥对提高农作物的产量具有重要作用。某同学设计了如图实验对几种化肥进行简易鉴别:
取少量固体分别进行实验,如表方案中不合理的是( )
选项 实验① 实验②
A 观察固体颜色 与熟石灰粉末混合研磨
B 观察固体颜色 加入Ba(NO3)2溶液中
C 加入足量水中 加入AgNO3溶液中
D 加入足量水中 加入Ba(OH)2溶液中
A.A B.B C.C D.D
9.“中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:,下列说法错误的是( )
A.反应中NiO发生还原反应
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
10.下列各组转化中,一定条件下均能一步实现的组合是
A.①② B.①③ C.②③ D.①②③
11.下列有关实验操作、现象、解释或结论都正确的一组是( )
选项 实验操作 现象 解释或结论
A 将水加入浓硫酸中配置成稀硫酸,将镁条置于其中 有气泡产生 Mg是活泼金属
B 验纯后,将纯净氢气直接在空气中点燃 产生淡蓝色火焰 氢气可以在空气中安静的燃烧
C 向一未知无色溶液中,加入适量的稀盐酸溶液 有无色气体产生 该无色未知溶液中一定有CO32﹣
D 将ag的铁钉投入到硫酸铜溶液中,反应一段时间后,取出、洗净、烘干、称量为bg 铁钉上覆盖一层红色的物质 金属活动顺序为:Fe>Cu,且析出铜的质量为(b﹣a)g
A.A B.B C.C D.D
12.分别将下列各组物质同时加入到足量水中,最终能得到无色、透明溶液的是
A.NaOH H2SO4 BaCl2 B.NaOH CuSO4 NaCl
C.HNO3 KNO3 K2SO4 D.Na2SO4 FeCl3 KCl
二、简答题
13.科学家发现了一种新金属,它的一些性质如表所示,这种金属的表面有一层氧化物保护层。试设想这种金属的可能用途。
溶点 2500℃
密度 3g/cm3
强度 与钢相似
导电性 良好
导热性 良好
抗腐蚀性 优异
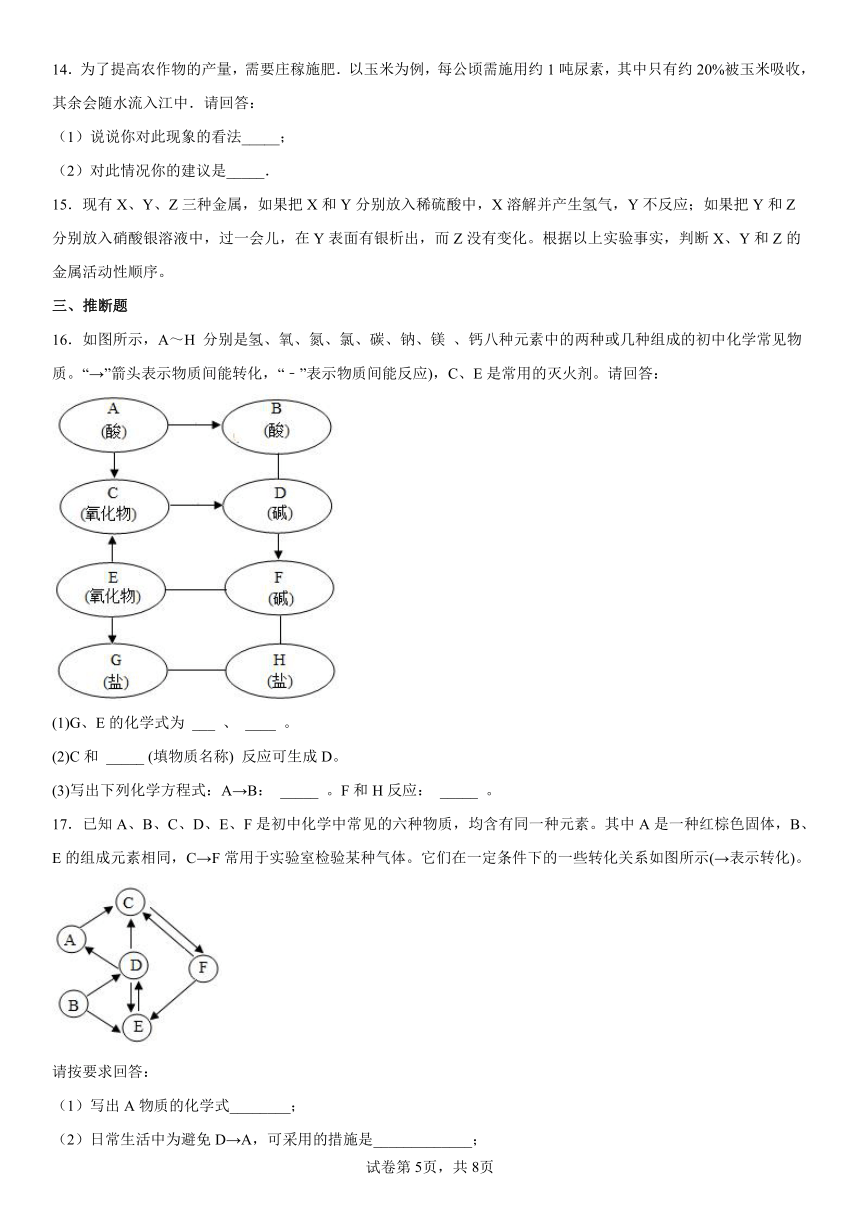
14.为了提高农作物的产量,需要庄稼施肥.以玉米为例,每公顷需施用约1吨尿素,其中只有约20%被玉米吸收,其余会随水流入江中.请回答:
(1)说说你对此现象的看法_____;
(2)对此情况你的建议是_____.
15.现有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和Z的金属活动性顺序。
三、推断题
16.如图所示,A~H 分别是氢、氧、氮、氯、碳、钠、镁 、钙八种元素中的两种或几种组成的初中化学常见物质。“→”箭头表示物质间能转化,“﹣”表示物质间能反应),C、E是常用的灭火剂。请回答:
(1)G、E的化学式为 ___ 、 ____ 。
(2)C和 _____ (填物质名称) 反应可生成D。
(3)写出下列化学方程式:A→B: _____ 。F和H反应: _____ 。
17.已知A、B、C、D、E、F是初中化学中常见的六种物质,均含有同一种元素。其中A是一种红棕色固体,B、E的组成元素相同,C→F常用于实验室检验某种气体。它们在一定条件下的一些转化关系如图所示(→表示转化)。
请按要求回答:
(1)写出A物质的化学式________;
(2)日常生活中为避免D→A,可采用的措施是_____________;
(3)写出C→F的化学方程式 _____________________。
四、实验题
18.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
19.“对比实验”是科学探究常用的方法,根据下列所示的实验示意图回答问题.
(1)实验1中,将大小相同的滤纸片和乒乓球碎片放在薄铜片的两侧,加热铜片的中部,观察现象.通过此实验,可说明燃烧的条件之一的是_____(填序号).
A.可燃物 B.空气 C.温度达到着火点
(2)实验2中,把干燥的紫色纸花和湿润的紫色石蕊纸花分别伸入两瓶干燥的二氧化碳气体中,下列有关说法正确的是_____(填序号).
A.CO2与水发生了反应 B.水具有酸性
C.干燥的紫色石蕊纸花变红 D.湿润的紫色石蕊纸花变红
(3)实验3是探究铁钉条件的实验,会出现明显现象的是试管_____(填序号),说明铁生锈实际上是铁与_____发生反应.
20.化学是一门以实验为基础的科学,对比法是一种常见的实验方法,回答下列问题:
(1)实验一说明可燃物燃烧需要温度达到着火点的现象是______;
(2)实验二喷水后的石蕊纸花放入二氧化碳中,纸花由紫色变为______色;
(3)实验三说明铁生锈是铁与氧气、______共同作用的结果。
五、计算题
21.纯碱(主要成分为碳酸钠)中常含有少量氯化钠。化学兴趣小组的同学为了测定实验室中某盐酸的溶质质量分数,称取了某品牌纯碱样品12g进行了以下实验:将样品置于烧杯中,取50g此稀盐酸分五次加入其中,测得的有关数据如下表所示。
第一次 第二次 第三次 第四次 第五次
加入稀盐酸质量/ 10 10 10 10 10
烧杯中剩余物的质量/ 20.9 29.8 47.6 57.6
试计算:
(1)表中a的值为______。
(2)实验中产生二氧化碳的总质量为______。
(3)所用稀盐酸中溶质的质量分数。(写出计算过程,计算结果保留一位小数)
22.尿素是一种常用氮肥,其化学式为CO(NH2)2.肖林家中有一块稻田,需施15kg尿素,他到农资公司去购买,由于尿素售完,他需购硝酸铵(NH4NO3)代替尿素,他应购的硝酸铵的质量为多少?
(1)尿素的化学式量为_____。
(2)肖林应购的硝酸铵的质量为多少?(写出计算过程)
23.化学兴趣小组为测定某铜锌合金中成分金属的含量,称取10g样品放入烧杯中,向其中加入100g稀硫酸,恰好完全反应后。测得烧杯内所有物质的总质量为109.8g。
请完成下列分析及计算
(1)反应中共生成气体______g。
(2)计算合金中铜的质量分数。
24.某袋装食品的脱氧剂由活性炭、铁粉和食盐混合而成,三者质量比为 2∶2∶1。现用该脱氧剂进行实验,回答下列问题:
(1)将该脱氧剂加入盐酸中,发生反应的化学方程式为________________。
(2)打开失效的脱氧剂小袋,发现里面出现了红褐色物质,该物质的主要成分是________(填化学式)。5.0g未经使用的该脱氧剂最多能够吸收氧气_____ g。
(3)用电子秤称取7.20g完全失效后的脱氧剂放入烧杯中,加入足量稀硝酸,充分溶解后过滤,滤渣为黑色粉末。向所得滤液中加入足量AgNO3溶液,充分反应产生的沉淀质量为2.87g。列式计算该失效脱氧剂中NaCl的质量分数_____(计算结果精确到0.1%)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.B
4.C
5.C
6.A
7.C
8.C
9.D
10.C
11.B
12.C
13.制作自行车车架、导线、炊具和手术刀等
14. 化肥的过量使用会造成水污染 应合理使用化肥,最好与农家肥混合使用
15.三种金属的活动性顺序为:X>Y>Z。
16. Na2CO3 CO2 氧化钙 HCl+AgNO3=AgCl↓+HNO3 2NaOH+ Mg(NO3)2=Mg(OH)2↓+2NaNO3或2NaOH+MgCl2=Mg(OH)2↓+2NaCl
17. Fe2O3 涂油、刷漆
18. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
19. C AD I 氧气、水
20. 铜片上的白磷燃烧,铜片上的红磷不燃烧 红 水
21.(1)38.7;(2)4.4g
(3)根据反应生成二氧化碳的质量,可求出稀盐酸中溶质的质量,根据溶质质量分数的计算公式计算稀盐酸中溶质的质量分数。
设参加反应的HCl的总质量为x。
x=7.3g
稀盐酸中溶质的质量分数为(其他解法合理即可)
答:所用稀盐酸中溶质的质量分数为。
22.(1)60
(2)解:设应购的硝酸铵的质量为x
15kg=x
x=20kg
答:应购的硝酸铵的质量为20kg。
23.(1)0.2g;(2)35%
24.(1)
(2)Fe2O3(或Fe2O3·xH2O);0.86
(3)16.3%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列实验中有化学反应发生,且能观察到明显现象的是
A.向氯化钾溶液中滴入稀硫酸
B.向硫酸钠溶液中滴入氯化锌溶液
C.向氧化铜粉末中滴入氢氧化钠溶液
D.高温下向氧化铁粉末中通入一氧化碳
2.健康是人类永恒的主题。下列有关化学与健康的说法不正确的是
A.人体缺钙会导致骨质疏松
B.人体缺碘会引起甲状腺肿大
C.霉变大米经多次淘洗后可食用
D.可用碳酸氢钠做焙制糕点的发酵粉
3.某同学为验证镁、铁、铜、银的金属活动性顺序,设计了下图所示的四个实验(金属片均已打磨,且其形状大小相同;实验①②③所用盐酸的溶质质量分数和体积均相同)。下列分析不正确的是
A.对比实验①②反应的剧烈程度,能判断出镁和铁的金属活动性强弱
B.分析实验②④的现象,能判断出铁、铜、银的金属活动性强弱
C.分析实验④的现象,能判断出铜和银的金属活动性强弱
D.分析四个实验的现象,能判断出镁、铁、铜、银的金属活动性顺序
4.下列反应属于置换反应的是( )
A.
B.
C.
D.
5.小明外出游玩,发现路边的小麦叶子发黄、有倒伏现象,他建议田主应该施用一种复合肥料,这种复合肥料是
A.CO(NH2)2
B.KCl
C.KNO3
D.NH4HCO3
6.下列图象能正确反映其对应关系的是( )
A.电解水
B. 表示将等质量的大理石分别与足量的等体积等溶质质量分数的稀盐酸反应
C.两份完全相同的双氧水在有无MnO2的情况下产生O2
D.向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
7.下列有关金属材料说法正确的是
A.铁片在海水中不易生锈
B.钢是纯铁
C.铝片表面易生成一层致密的氧化膜
D.纯铜硬度高于黄铜(铜锌合金)
8.化肥对提高农作物的产量具有重要作用。某同学设计了如图实验对几种化肥进行简易鉴别:
取少量固体分别进行实验,如表方案中不合理的是( )
选项 实验① 实验②
A 观察固体颜色 与熟石灰粉末混合研磨
B 观察固体颜色 加入Ba(NO3)2溶液中
C 加入足量水中 加入AgNO3溶液中
D 加入足量水中 加入Ba(OH)2溶液中
A.A B.B C.C D.D
9.“中国高铁,世界第一”,高铁列车车体材料使用了含镍不锈钢,工业上火法炼镍的原理是:,下列说法错误的是( )
A.反应中NiO发生还原反应
B.气体产物中可能有CO
C.该不锈钢中还含有铁和碳
D.该不锈钢合金的硬度小于纯铁
10.下列各组转化中,一定条件下均能一步实现的组合是
A.①② B.①③ C.②③ D.①②③
11.下列有关实验操作、现象、解释或结论都正确的一组是( )
选项 实验操作 现象 解释或结论
A 将水加入浓硫酸中配置成稀硫酸,将镁条置于其中 有气泡产生 Mg是活泼金属
B 验纯后,将纯净氢气直接在空气中点燃 产生淡蓝色火焰 氢气可以在空气中安静的燃烧
C 向一未知无色溶液中,加入适量的稀盐酸溶液 有无色气体产生 该无色未知溶液中一定有CO32﹣
D 将ag的铁钉投入到硫酸铜溶液中,反应一段时间后,取出、洗净、烘干、称量为bg 铁钉上覆盖一层红色的物质 金属活动顺序为:Fe>Cu,且析出铜的质量为(b﹣a)g
A.A B.B C.C D.D
12.分别将下列各组物质同时加入到足量水中,最终能得到无色、透明溶液的是
A.NaOH H2SO4 BaCl2 B.NaOH CuSO4 NaCl
C.HNO3 KNO3 K2SO4 D.Na2SO4 FeCl3 KCl
二、简答题
13.科学家发现了一种新金属,它的一些性质如表所示,这种金属的表面有一层氧化物保护层。试设想这种金属的可能用途。
溶点 2500℃
密度 3g/cm3
强度 与钢相似
导电性 良好
导热性 良好
抗腐蚀性 优异
14.为了提高农作物的产量,需要庄稼施肥.以玉米为例,每公顷需施用约1吨尿素,其中只有约20%被玉米吸收,其余会随水流入江中.请回答:
(1)说说你对此现象的看法_____;
(2)对此情况你的建议是_____.
15.现有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和Z的金属活动性顺序。
三、推断题
16.如图所示,A~H 分别是氢、氧、氮、氯、碳、钠、镁 、钙八种元素中的两种或几种组成的初中化学常见物质。“→”箭头表示物质间能转化,“﹣”表示物质间能反应),C、E是常用的灭火剂。请回答:
(1)G、E的化学式为 ___ 、 ____ 。
(2)C和 _____ (填物质名称) 反应可生成D。
(3)写出下列化学方程式:A→B: _____ 。F和H反应: _____ 。
17.已知A、B、C、D、E、F是初中化学中常见的六种物质,均含有同一种元素。其中A是一种红棕色固体,B、E的组成元素相同,C→F常用于实验室检验某种气体。它们在一定条件下的一些转化关系如图所示(→表示转化)。
请按要求回答:
(1)写出A物质的化学式________;
(2)日常生活中为避免D→A,可采用的措施是_____________;
(3)写出C→F的化学方程式 _____________________。
四、实验题
18.某初级中学学生为了探究化学实验室的一种黑色粉末和一瓶标签破损的无色溶液可能是什么物质,大胆猜想并设计实验进行验证.
【发现问题】当把黑色粉末与无色溶液混合时即产生气泡.
【查阅资料】初中化学实验室常见的黑色粉末:氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉.
【提出假设】黑色粉末是______________,无色溶液是______________.
【设计实验】向盛有少许黑色粉末的试管中加入适量的无色溶液,用___________法收集一试管气体;检验该气体___________________.
【实验结论】此气体是______________________,原假设成立.
19.“对比实验”是科学探究常用的方法,根据下列所示的实验示意图回答问题.
(1)实验1中,将大小相同的滤纸片和乒乓球碎片放在薄铜片的两侧,加热铜片的中部,观察现象.通过此实验,可说明燃烧的条件之一的是_____(填序号).
A.可燃物 B.空气 C.温度达到着火点
(2)实验2中,把干燥的紫色纸花和湿润的紫色石蕊纸花分别伸入两瓶干燥的二氧化碳气体中,下列有关说法正确的是_____(填序号).
A.CO2与水发生了反应 B.水具有酸性
C.干燥的紫色石蕊纸花变红 D.湿润的紫色石蕊纸花变红
(3)实验3是探究铁钉条件的实验,会出现明显现象的是试管_____(填序号),说明铁生锈实际上是铁与_____发生反应.
20.化学是一门以实验为基础的科学,对比法是一种常见的实验方法,回答下列问题:
(1)实验一说明可燃物燃烧需要温度达到着火点的现象是______;
(2)实验二喷水后的石蕊纸花放入二氧化碳中,纸花由紫色变为______色;
(3)实验三说明铁生锈是铁与氧气、______共同作用的结果。
五、计算题
21.纯碱(主要成分为碳酸钠)中常含有少量氯化钠。化学兴趣小组的同学为了测定实验室中某盐酸的溶质质量分数,称取了某品牌纯碱样品12g进行了以下实验:将样品置于烧杯中,取50g此稀盐酸分五次加入其中,测得的有关数据如下表所示。
第一次 第二次 第三次 第四次 第五次
加入稀盐酸质量/ 10 10 10 10 10
烧杯中剩余物的质量/ 20.9 29.8 47.6 57.6
试计算:
(1)表中a的值为______。
(2)实验中产生二氧化碳的总质量为______。
(3)所用稀盐酸中溶质的质量分数。(写出计算过程,计算结果保留一位小数)
22.尿素是一种常用氮肥,其化学式为CO(NH2)2.肖林家中有一块稻田,需施15kg尿素,他到农资公司去购买,由于尿素售完,他需购硝酸铵(NH4NO3)代替尿素,他应购的硝酸铵的质量为多少?
(1)尿素的化学式量为_____。
(2)肖林应购的硝酸铵的质量为多少?(写出计算过程)
23.化学兴趣小组为测定某铜锌合金中成分金属的含量,称取10g样品放入烧杯中,向其中加入100g稀硫酸,恰好完全反应后。测得烧杯内所有物质的总质量为109.8g。
请完成下列分析及计算
(1)反应中共生成气体______g。
(2)计算合金中铜的质量分数。
24.某袋装食品的脱氧剂由活性炭、铁粉和食盐混合而成,三者质量比为 2∶2∶1。现用该脱氧剂进行实验,回答下列问题:
(1)将该脱氧剂加入盐酸中,发生反应的化学方程式为________________。
(2)打开失效的脱氧剂小袋,发现里面出现了红褐色物质,该物质的主要成分是________(填化学式)。5.0g未经使用的该脱氧剂最多能够吸收氧气_____ g。
(3)用电子秤称取7.20g完全失效后的脱氧剂放入烧杯中,加入足量稀硝酸,充分溶解后过滤,滤渣为黑色粉末。向所得滤液中加入足量AgNO3溶液,充分反应产生的沉淀质量为2.87g。列式计算该失效脱氧剂中NaCl的质量分数_____(计算结果精确到0.1%)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.B
4.C
5.C
6.A
7.C
8.C
9.D
10.C
11.B
12.C
13.制作自行车车架、导线、炊具和手术刀等
14. 化肥的过量使用会造成水污染 应合理使用化肥,最好与农家肥混合使用
15.三种金属的活动性顺序为:X>Y>Z。
16. Na2CO3 CO2 氧化钙 HCl+AgNO3=AgCl↓+HNO3 2NaOH+ Mg(NO3)2=Mg(OH)2↓+2NaNO3或2NaOH+MgCl2=Mg(OH)2↓+2NaCl
17. Fe2O3 涂油、刷漆
18. MnO2 H2O2 排水集气法 用带火星的木条伸入试管中,带火星的木条复燃 O2
19. C AD I 氧气、水
20. 铜片上的白磷燃烧,铜片上的红磷不燃烧 红 水
21.(1)38.7;(2)4.4g
(3)根据反应生成二氧化碳的质量,可求出稀盐酸中溶质的质量,根据溶质质量分数的计算公式计算稀盐酸中溶质的质量分数。
设参加反应的HCl的总质量为x。
x=7.3g
稀盐酸中溶质的质量分数为(其他解法合理即可)
答:所用稀盐酸中溶质的质量分数为。
22.(1)60
(2)解:设应购的硝酸铵的质量为x
15kg=x
x=20kg
答:应购的硝酸铵的质量为20kg。
23.(1)0.2g;(2)35%
24.(1)
(2)Fe2O3(或Fe2O3·xH2O);0.86
(3)16.3%
答案第1页,共2页
答案第1页,共2页
