第九单元 溶液测试题—2021-2022学年九年级化学人教版下册 (word版 含答案)
文档属性
| 名称 | 第九单元 溶液测试题—2021-2022学年九年级化学人教版下册 (word版 含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 128.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-18 00:00:00 | ||
图片预览




文档简介
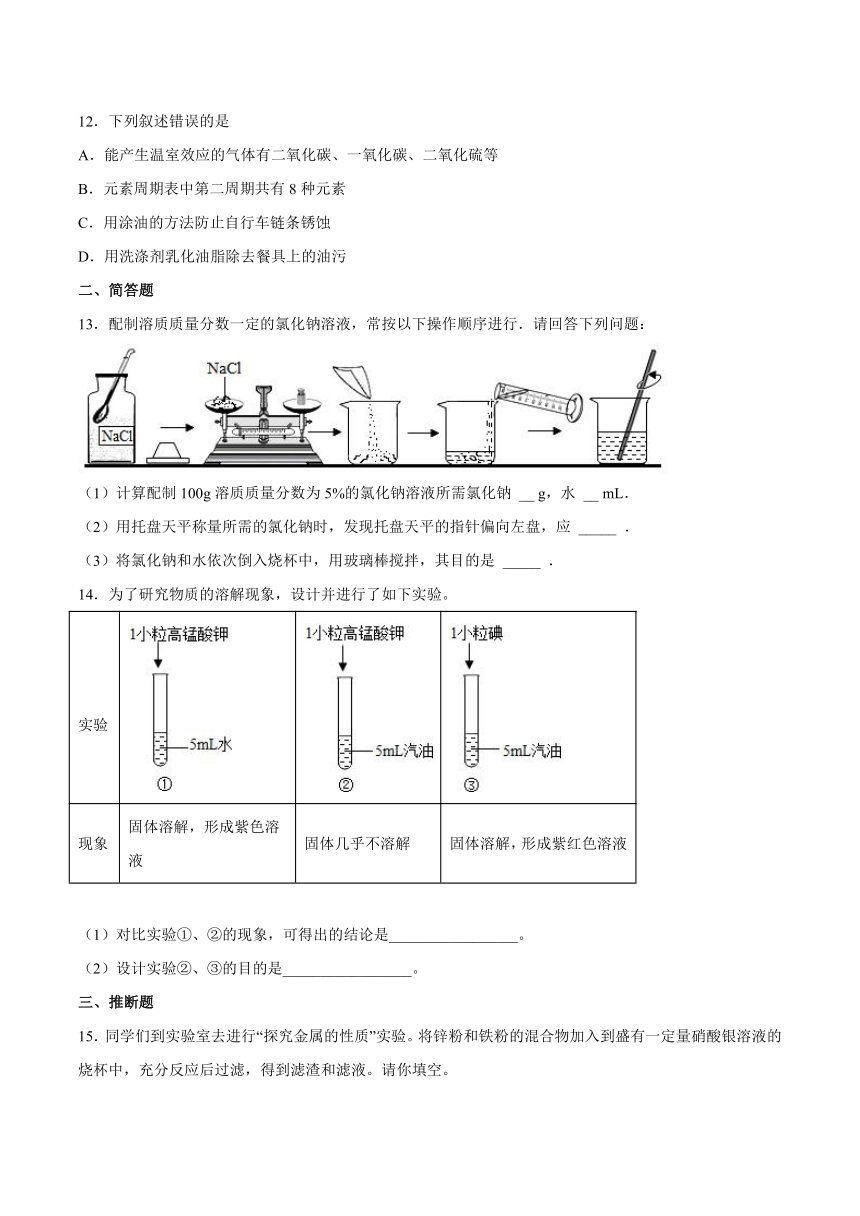
第九单元《溶液》测试题
一、单选题
1.下列关于溶液的说法,正确的是
A.水是最常用的溶剂
B.饱和溶液一定比不饱和溶液浓度大
C.澄清、透明的液体一定是溶液
D.饱和溶液一定不能再继续溶解溶质
2.下列关于溶液说法正确的是( )
A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液
B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制50gl6%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
3.下列物质溶解或稀释过程中,溶液温度没有明显改变的是( )
A.NaOH B.NH4NO3 C.浓硫酸 D.NaCl
4.两个烧杯中分别盛装X、Y的饱和溶液,两只试管中分别装有NaOH和NH4NO3固体,向两只试管中分别滴加适量水,现象如图所示,结合图二判断下列说法正确的是
A.Y的溶解度曲线为b曲线
B.降温可使X的饱和溶液变浑浊
C.X的饱和溶液从t2 ℃降温到t1 ℃,溶质的质量分数变大
D.t3 ℃时,X、Y的饱和溶液质量相等,则溶剂质量X>Y
5.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
6.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t℃时,将50g a物质加入到50g水中充分搅拌,可得到100g a的溶液
B.c物质微溶于水
C.a中含有少量b,可用恒温蒸发溶剂的方法提纯a
D.将20℃的三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a>c
7.下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
8.以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃
Na2CO3的溶解度(g/100g水) 7.1 12.5 21.5 39.7 49.0 48.5 46.0
NaHCO3的溶解度(g/100g水) 6.9 8.1 9.6 11.1 12.7 14.5 16.4
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
9.已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发).下列图象正确的是( )
A. B.
C. D.
10.医用酒精中乙醇的体积分数为75%,它常用于皮肤和物体表面的杀菌消毒,可有效杀灭新型冠状病毒。下列关于乙醇溶液说法错误的是
A.乙醇溶液的溶剂是水
B.乙醇溶液是均一的、稳定的
C.乙醇溶液都是浓溶液
D.医用酒精中乙醇的质量分数小于75%
11.如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀. 如表中液体X和固体Y的组合,符合题意的是
① ② ③ ④
X 双氧水 水 水 水
Y 二氧化锰 氯化钠 氢氧化钠 硝酸铵
A.①② B.①③ C.①③④ D.②③④
12.下列叙述错误的是
A.能产生温室效应的气体有二氧化碳、一氧化碳、二氧化硫等
B.元素周期表中第二周期共有8种元素
C.用涂油的方法防止自行车链条锈蚀
D.用洗涤剂乳化油脂除去餐具上的油污
二、简答题
13.配制溶质质量分数一定的氯化钠溶液,常按以下操作顺序进行.请回答下列问题:
(1)计算配制100g溶质质量分数为5%的氯化钠溶液所需氯化钠 __ g,水 __ mL.
(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 _____ .
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 _____ .
14.为了研究物质的溶解现象,设计并进行了如下实验。
实验
现象 固体溶解,形成紫色溶液 固体几乎不溶解 固体溶解,形成紫红色溶液
(1)对比实验①、②的现象,可得出的结论是_________________。
(2)设计实验②、③的目的是_________________。
三、推断题
15.同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。请你填空。
(1)若将所得滤渣放入稀盐酸中,有气泡产生,则
①滤液里一定含有_____(填写化学式,下同),可能含有_____;
②滤渣中一定含有_____,可能含有_____。
(2)若反应后所得滤液呈无色,则滤渣中一定含有_____(填写化学式)。
(3)反应后所得滤液的溶质质量分数_____(选填“大于”、“等于”或“小于”)原硝酸银溶液的溶质质量分数。
16.A、B、C、D、E是初中化学中常见的五种物质,它们之间有如下图所示的关系(“→”表示物质间的转化关系,“—”表示相互能反应,部分物质和反应条件已经略去)。A是一种最常用的溶剂,A、B、D含有一种相同的元素,D是磁铁矿的主要成分,E为氧化物。则C的一种用途是______; B转化为D的基本反应类型为______;E与D反应的化学方程式______。
17.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
四、实验题
18.下表是硝酸钾和氯化钠的部分溶解度数据,回答下列问题。
温度(℃) 0 20 40 60 80
溶解度(g/100g水) 氯化钠 35.7 36.0 36.6 37.3 38.4
硝酸钾 13.3 31.6 63.9 110.0 169.0
①60℃时,硝酸钾的溶解度是_______。
②20℃,50g水中加入30g硝酸钾,所得溶液的质量是_______g。
③若硝酸钾中混有少量的氯化钠,提纯硝酸钾可采取的方法是_______。
④在20℃时,将等质量的硝酸钾和氯化钠分别加入到各盛有100g水的甲、乙两个烧杯中,充分搅拌后如图,说法错误的是_______(填序号)。
A 烧杯甲中溶液一定是不饱和溶液
B 烧杯乙中溶液的溶质是硝酸钾
C 若使烧杯乙中固体全部溶解,其溶液浓度一定增大
D 将温度升高到50℃,烧杯乙中的固体一定全部溶解
⑤20℃时,在100g水中溶解NaCl和KNO3,进行以下实验:
Ⅰ.溶液c所含溶质为_______,固体a为_______g。
Ⅱ.对整个实验过程分析正确的是_______。
A 固体b是纯净物
B 溶液c、d中NaC1质量分数相等
C 溶液d中硝酸钾的质量小于氯化钠的质量
D 实验过程中硝酸钾溶液始终是不饱和溶液
19.某化学兴趣小组要配制100g质量分数为20%的碳酸钠溶液,下图是他配制碳酸钠溶液的实验操作示意图。请回答下列问题:
(1)计算配制100g溶质质量分数为20%的碳酸钠溶液所需:碳酸钠_____g;水_____mL,量取所需要的水应选择_____(选填“10 mL”、“50 mL”或“100 mL”)量筒。
(2)用上述图示的序号表示配制溶液的操作顺序:_____。
(3)在配制碳酸钠溶液的过程中应该用到的玻璃仪器分别有_____。
(4)分析:如果称取的碳酸钠中含有少量水分,最后配制的碳酸钠溶液的浓度将_____(填“偏高”、“偏低”、或“无影响”)。
(5)用托盘天平正确称量所需的碳酸钠时,发现托盘天平的指针偏向左盘,应_____(填序号)
A 增加适量的碳酸钠固体 B 减少适量的碳酸钠固体 C 调节平衡螺母 D 增加砝码
五、计算题
20.为测定某种贝壳中碳酸钙的含量,取25g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不能与稀盐酸反应,也不溶于水)。请计算:
(1)这种贝壳中碳酸钙的质量分数是多少。
(2)25g贝壳与稀盐酸恰好完全反应时,所用稀盐酸中溶质的质量分数。(写出计算过程,最后结果保留1位小数)
21.实验室用10g8%的氢氧化钠溶液和稀硫酸进行中和反应实验,实验过程中溶液的pH变化如图所示:
(1)A点溶液的溶质_________。(填化学式)
(2)计算所用的该稀硫酸的质量分数为__________?
参考答案:
1.A 2.D 3.D 4.D 5.C 6.D 7.C 8.B 9.B 10.C 11.B 12.A
13. 5 95 减少药品质量 加速溶解
14. 同种溶质在不同溶剂中的溶解性不同 不同溶质在同一种溶剂中的溶解性不同
15. Zn(NO3)2 Fe(NO3)2 Ag、Fe Zn Ag、Fe 小于
16. 高能燃料 化合反应
17. 75 a>b>c
18. 110.0g/100g水 65.8 降温结晶法 AC KNO3、NaCl 114 AD
19. 20 80 100 mL C→B→D→E→A 烧杯、玻璃棒和胶头滴管 偏低 B
20.(1)80%(2)14.7%
21.(1)Na2SO4、H2SO4;(2)9.8%
一、单选题
1.下列关于溶液的说法,正确的是
A.水是最常用的溶剂
B.饱和溶液一定比不饱和溶液浓度大
C.澄清、透明的液体一定是溶液
D.饱和溶液一定不能再继续溶解溶质
2.下列关于溶液说法正确的是( )
A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液
B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制50gl6%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
3.下列物质溶解或稀释过程中,溶液温度没有明显改变的是( )
A.NaOH B.NH4NO3 C.浓硫酸 D.NaCl
4.两个烧杯中分别盛装X、Y的饱和溶液,两只试管中分别装有NaOH和NH4NO3固体,向两只试管中分别滴加适量水,现象如图所示,结合图二判断下列说法正确的是
A.Y的溶解度曲线为b曲线
B.降温可使X的饱和溶液变浑浊
C.X的饱和溶液从t2 ℃降温到t1 ℃,溶质的质量分数变大
D.t3 ℃时,X、Y的饱和溶液质量相等,则溶剂质量X>Y
5.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
6.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t℃时,将50g a物质加入到50g水中充分搅拌,可得到100g a的溶液
B.c物质微溶于水
C.a中含有少量b,可用恒温蒸发溶剂的方法提纯a
D.将20℃的三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a>c
7.下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
8.以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃
Na2CO3的溶解度(g/100g水) 7.1 12.5 21.5 39.7 49.0 48.5 46.0
NaHCO3的溶解度(g/100g水) 6.9 8.1 9.6 11.1 12.7 14.5 16.4
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
9.已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发).下列图象正确的是( )
A. B.
C. D.
10.医用酒精中乙醇的体积分数为75%,它常用于皮肤和物体表面的杀菌消毒,可有效杀灭新型冠状病毒。下列关于乙醇溶液说法错误的是
A.乙醇溶液的溶剂是水
B.乙醇溶液是均一的、稳定的
C.乙醇溶液都是浓溶液
D.医用酒精中乙醇的质量分数小于75%
11.如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐膨胀. 如表中液体X和固体Y的组合,符合题意的是
① ② ③ ④
X 双氧水 水 水 水
Y 二氧化锰 氯化钠 氢氧化钠 硝酸铵
A.①② B.①③ C.①③④ D.②③④
12.下列叙述错误的是
A.能产生温室效应的气体有二氧化碳、一氧化碳、二氧化硫等
B.元素周期表中第二周期共有8种元素
C.用涂油的方法防止自行车链条锈蚀
D.用洗涤剂乳化油脂除去餐具上的油污
二、简答题
13.配制溶质质量分数一定的氯化钠溶液,常按以下操作顺序进行.请回答下列问题:
(1)计算配制100g溶质质量分数为5%的氯化钠溶液所需氯化钠 __ g,水 __ mL.
(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 _____ .
(3)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是 _____ .
14.为了研究物质的溶解现象,设计并进行了如下实验。
实验
现象 固体溶解,形成紫色溶液 固体几乎不溶解 固体溶解,形成紫红色溶液
(1)对比实验①、②的现象,可得出的结论是_________________。
(2)设计实验②、③的目的是_________________。
三、推断题
15.同学们到实验室去进行“探究金属的性质”实验。将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。请你填空。
(1)若将所得滤渣放入稀盐酸中,有气泡产生,则
①滤液里一定含有_____(填写化学式,下同),可能含有_____;
②滤渣中一定含有_____,可能含有_____。
(2)若反应后所得滤液呈无色,则滤渣中一定含有_____(填写化学式)。
(3)反应后所得滤液的溶质质量分数_____(选填“大于”、“等于”或“小于”)原硝酸银溶液的溶质质量分数。
16.A、B、C、D、E是初中化学中常见的五种物质,它们之间有如下图所示的关系(“→”表示物质间的转化关系,“—”表示相互能反应,部分物质和反应条件已经略去)。A是一种最常用的溶剂,A、B、D含有一种相同的元素,D是磁铁矿的主要成分,E为氧化物。则C的一种用途是______; B转化为D的基本反应类型为______;E与D反应的化学方程式______。
17.根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
(1)t2℃时,向50g水中加入30g的b物质,得到b溶液的质量为______g
(2)将t2℃时a、b、c三种物质的饱和溶液降温至t1℃,三种溶液的溶质质量分数由大到小的顺序为______。
四、实验题
18.下表是硝酸钾和氯化钠的部分溶解度数据,回答下列问题。
温度(℃) 0 20 40 60 80
溶解度(g/100g水) 氯化钠 35.7 36.0 36.6 37.3 38.4
硝酸钾 13.3 31.6 63.9 110.0 169.0
①60℃时,硝酸钾的溶解度是_______。
②20℃,50g水中加入30g硝酸钾,所得溶液的质量是_______g。
③若硝酸钾中混有少量的氯化钠,提纯硝酸钾可采取的方法是_______。
④在20℃时,将等质量的硝酸钾和氯化钠分别加入到各盛有100g水的甲、乙两个烧杯中,充分搅拌后如图,说法错误的是_______(填序号)。
A 烧杯甲中溶液一定是不饱和溶液
B 烧杯乙中溶液的溶质是硝酸钾
C 若使烧杯乙中固体全部溶解,其溶液浓度一定增大
D 将温度升高到50℃,烧杯乙中的固体一定全部溶解
⑤20℃时,在100g水中溶解NaCl和KNO3,进行以下实验:
Ⅰ.溶液c所含溶质为_______,固体a为_______g。
Ⅱ.对整个实验过程分析正确的是_______。
A 固体b是纯净物
B 溶液c、d中NaC1质量分数相等
C 溶液d中硝酸钾的质量小于氯化钠的质量
D 实验过程中硝酸钾溶液始终是不饱和溶液
19.某化学兴趣小组要配制100g质量分数为20%的碳酸钠溶液,下图是他配制碳酸钠溶液的实验操作示意图。请回答下列问题:
(1)计算配制100g溶质质量分数为20%的碳酸钠溶液所需:碳酸钠_____g;水_____mL,量取所需要的水应选择_____(选填“10 mL”、“50 mL”或“100 mL”)量筒。
(2)用上述图示的序号表示配制溶液的操作顺序:_____。
(3)在配制碳酸钠溶液的过程中应该用到的玻璃仪器分别有_____。
(4)分析:如果称取的碳酸钠中含有少量水分,最后配制的碳酸钠溶液的浓度将_____(填“偏高”、“偏低”、或“无影响”)。
(5)用托盘天平正确称量所需的碳酸钠时,发现托盘天平的指针偏向左盘,应_____(填序号)
A 增加适量的碳酸钠固体 B 减少适量的碳酸钠固体 C 调节平衡螺母 D 增加砝码
五、计算题
20.为测定某种贝壳中碳酸钙的含量,取25g贝壳,逐渐加入稀盐酸,充分反应后,测得剩余固体质量与加入稀盐酸的质量关系如图所示(已知杂质不能与稀盐酸反应,也不溶于水)。请计算:
(1)这种贝壳中碳酸钙的质量分数是多少。
(2)25g贝壳与稀盐酸恰好完全反应时,所用稀盐酸中溶质的质量分数。(写出计算过程,最后结果保留1位小数)
21.实验室用10g8%的氢氧化钠溶液和稀硫酸进行中和反应实验,实验过程中溶液的pH变化如图所示:
(1)A点溶液的溶质_________。(填化学式)
(2)计算所用的该稀硫酸的质量分数为__________?
参考答案:
1.A 2.D 3.D 4.D 5.C 6.D 7.C 8.B 9.B 10.C 11.B 12.A
13. 5 95 减少药品质量 加速溶解
14. 同种溶质在不同溶剂中的溶解性不同 不同溶质在同一种溶剂中的溶解性不同
15. Zn(NO3)2 Fe(NO3)2 Ag、Fe Zn Ag、Fe 小于
16. 高能燃料 化合反应
17. 75 a>b>c
18. 110.0g/100g水 65.8 降温结晶法 AC KNO3、NaCl 114 AD
19. 20 80 100 mL C→B→D→E→A 烧杯、玻璃棒和胶头滴管 偏低 B
20.(1)80%(2)14.7%
21.(1)Na2SO4、H2SO4;(2)9.8%
同课章节目录
