九年级化学人教版下册 11.1生活中常见的盐同步强化训练(三)(word版 含答案)
文档属性
| 名称 | 九年级化学人教版下册 11.1生活中常见的盐同步强化训练(三)(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 121.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-19 15:27:02 | ||
图片预览


文档简介
2021-2022学年人教版九年级化学《11.1生活中常见的盐》同步强化训练(三)
(时间:60分钟 满分:70分)
一.选择题(每小题2分 共30分)
1、下列各组物质的溶液,不能发生复分解反应的是( )
A、HCl和Ca(OH)2 B、Na2CO3和H2SO4 C、AgNO3和BaCl2 D、KCl和CuSO4
2、下列各组物质能在水溶液中共存的是( )
A.KCl AgNO3 B.H2SO4 BaCl2 C.HCl Ca(OH)2 D.KOH NaNO3
3、下列化学方程式书写不正确的是 ( )
A、BaCl2+H2SO4=BaSO4↓+2HCl B、KOH+NaNO3=NaOH+KNO3
C、2NaOH+CuCl2=Cu(OH)2↓+2NaCl D、Mg(OH)2+ H2SO4=Mg SO4+2H2O
4、下列各组离子在水溶液中能大量共存的是( )
A.Fe2+、Ca2+、CO32—、OH- B.Na+、SO42—、Cl—、OH-
C.Ba2+、H+、Cl—、OH— D.Ag+、NH4+、NO3-、OH—
5、分别将下列各组物质,同时加到水中,得到无色透明溶液的是( )
A、NaCl MgSO4 AgNO3 Na2CO3 B、 Na2CO3 KCl KMnO4 NaNO3
C、NaOH NaCl NaNO3 MgCl2 D、Na2SO4 NaOH KCl NaNO3
6、下列能用作CO32-检验的试剂是( )
A.稀硫酸 B.食盐水 C.石灰水 D.食盐水与澄清石灰水
7、下列各组物质,能在pH=1的溶液中大量共存,且形成无色溶液的是( )
A. NaNO3 HCl Na2SO4 B. NaNO3 NaCl CuSO4
C. NaCl Na2SO4 Na2CO3 D. NaOH BaCl2 Na2SO4
8. 下列各组离子能在水溶液中共存的是( )
A、 Ba2+、K+、NO3-、CO32-、H+ B、 K+、Cl-、Mg2+、NO3-、H+
C、Fe3+、SO42-、OH-、Na+、Cu2+ D、Ag+、Ba2+、Cl-、NO3-、K+
9、不用其它试剂,用最简捷的方法鉴别下列五种溶液:①氢氧化钠②硫酸镁③硝酸钡④氯化铁⑤氯化钾,则被鉴别出来的物质的正确的顺序是( )
A、①②③④⑤ B、④①②③⑤ C、④③①②⑤ D、②③①④⑤
10、在A+B→盐和水的反应中,A和B不可能是( )
A. HCl和NaOH B. CO2和NaOH C. H2SO4和CuO D. H2SO4和BaCl2
11、下列试剂中,不能鉴别氯化钠溶液和碳酸钠溶液的是( )
A.硫酸钾溶液 B.氢氧化钡溶液 C.硝酸钙溶液 D.稀硫酸
12、一般不与其他物质发生复分解反应的是 ( )
A.KNO3 B.NaCl C.Cu(OH)2 D.MgSO4
13、下列各组溶液中,不用其他试剂,只用组内溶液相互混合的方法,就能鉴别的一组溶液是 ( )
A. Na2SO4 BaCl2 KNO3 NaCl B. Na2SO4 Na2CO3 BaCl2 HCl
C. NaOH Na2SO4 FeCl3 BaCl2 D. NaCl AgNO3 NaNO3 HCl
14、下列各组物质在溶液中不能反应的是 ( )
A、HCl 和AgNO3 B、KNO3 和NaCl C、H2SO4 和BaCl2 D、NaOH 和H2SO4
15、以下两幅微观示意图揭示了化学变化的微观实质.下列相关说法中错误的是( )
A. 图①表示的是化合反应
B. 图①表示的反应中元素的化合价没有改变
C. 图②说明酸碱中和反应的实质是H+和OH﹣反应生成了H2O
D. 上述两图说明化学变化前后原子的种类、数目都不会发生变化
二.非选择题(共40分)
16、(3分)A、B两溶液中共含有七种离子:Na+ 、Cu2+、 Ba2+、 Mg2+ 、NO3-、OH-、SO42-。已知两溶液中所含离子各不相同,A溶液中含有四种离子,且能使紫色石蕊试液变蓝,则B溶液中含有的离子是_______________________。
17、(4分)某河道两旁有甲乙两工厂,它们排放的工业废水中,可能含有CuSO4、KOH、Ba(NO3)2、K2SO4、Mg(NO3)2五种物质,且甲乙两厂排放的废水中所含物质各不相同.已知甲厂的废水中含三种物质,则乙厂的废水中所含物质应该是_______________和____________。
18、(4分)有下列两组物质:甲组:稀H2SO4、Na2CO3溶液、FeCl3溶液;乙组:CaCl2溶液、稀盐酸、Ba(OH)2溶液.其中甲组中的___________能够与乙组中的所有物质发生反应;乙组中的___________能够与甲组中的所有物质发生反应。
19.(5分)A,B,C,D为初中化学常见的四种物质,它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“—”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)
(1)若A、B、C、D中均含有一种相同的元素,常温下,A为无色液体,C为黑色固体,则A为________,C与D发生的化学反应________(填“是”或“不是”)置换反应。
(2)若A、B、C、D为四种不同类别的化合物,C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则A为________,写出B→C这一反应的化学方程式________。
20.(6分)亚硝酸钠(NaNO2)外观酷似食盐,有咸味,加热会分解,放出有臭味的气体。我国曾发生过多次将这种工业用盐常被冒充食盐掺假或被误作食盐食用,导致多起中毒事故发生。请你阅读下表中的有关信息,并结合所学化学知识,回答下列问题:
项目 亚硝酸钠(NaNO2) 氯化钠(NaCl)
溶解性 易溶,在15 ℃时溶解度为81.5 g 易溶,在15 ℃时溶解度为35.8g
熔点、沸点 熔点:271 ℃ ,沸点:320 ℃; 熔点:801 ℃;沸点:1413 ℃;
溶液酸碱 碱性 中性
与稀盐酸作用 放出红棕色气体 无现象
与硝酸银溶液作用 生成浅黄色沉淀 生成白色沉淀
⑴根据上表写出亚硝酸钠的两条物理性质 。
⑵亚硝酸钠跟盐酸反应会生成氯化钠、两种氮的氧化物和水,请你写出亚硝酸钠跟盐酸反应的化学方程式为 。
⑶请结合上表信息,判断以下区别亚硝酸钠和氯化钠的方法错误的是 (填序号)
A.滴加稀盐酸 B.滴加硝酸银溶液
C.加热 D.品尝味道
21.(12分)泡菜是常见的腌制食品,因含亚硝酸盐(如NaNO2)而引发人们的关注。根据要求完成三个探究,回答问题:
探究Ⅰ:腌制泡菜时,蔬菜中的NaNO3转化为NaNO2。食用泡菜时,NaNO2与胃酸反应生成HNO2, HNO2不稳定,转化为某氮氧化物(常温下为红棕色气体)进入血液而中毒。
⑴NaNO2与胃酸(主要成分为盐酸)发生复分解反应,该反应的化学方程式为 。
⑵图1为泡菜生产和食用时涉及的四种含氮物质的类别及氮元素化合价关系图。其中,L的化学式为 。
⑶为检验某无色溶液是NaNO2还是NaCl,完成实验方案。
选取的试剂 实验现象 实验结论
该溶液为NaNO2液
探究Ⅱ:室温下,用3%、5%和7%的食盐水浸泡蔬菜,浸泡不同时间获得的泡菜中亚硝酸盐的含量如图2所示。
⑷若往食盐水中添加少量维生素C,泡菜中亚硝酸盐含量明显降低、配制3%的NaCl溶液2000.0g,需用托盘天平称取 g的NaCl。
⑸食盐水的溶质质量分数越大,泡菜中亚硝酸盐含量最大值出现得 (填“越早”、“越迟”或“无影响”)。
探究Ⅲ:实际上,只要合理制作、食用泡菜,将有效避免(或降低)对人体的危害。
⑹列举一条避免(或降低)食用泡菜对人体危害的措施 。
22.(6分)向盛有碳酸钙粉末的试管中加入足量的稀盐酸,完全反应后共收集到4.4g二氧化碳气体,试计算反应消耗的碳酸钙的质量.
教师样卷
一.选择题(每小题2分 共30分)
1、下列各组物质的溶液,不能发生复分解反应的是( D )
A、HCl和Ca(OH)2 B、Na2CO3和H2SO4 C、AgNO3和BaCl2 D、KCl和CuSO4
2、下列各组物质能在水溶液中共存的是( D )
A.KCl AgNO3 B.H2SO4 BaCl2 C.HCl Ca(OH)2 D.KOH NaNO3
3、下列化学方程式书写不正确的是 ( B )
A、BaCl2+H2SO4=BaSO4↓+2HCl B、KOH+NaNO3=NaOH+KNO3
C、2NaOH+CuCl2=Cu(OH)2↓+2NaCl D、Mg(OH)2+ H2SO4=Mg SO4+2H2O
4、下列各组离子在水溶液中能大量共存的是( B )
A.Fe2+、Ca2+、CO32—、OH- B.Na+、SO42—、Cl—、OH-
C.Ba2+、H+、Cl—、OH— D.Ag+、NH4+、NO3-、OH—
5、分别将下列各组物质,同时加到水中,得到无色透明溶液的是( D )
A、NaCl MgSO4 AgNO3 Na2CO3 B、 Na2CO3 KCl KMnO4 NaNO3
C、NaOH NaCl NaNO3 MgCl2 D、Na2SO4 NaOH KCl NaNO3
6、下列能用作CO32-检验的试剂是( B )
A.稀硫酸 B.食盐水 C.石灰水 D.食盐水与澄清石灰水
7、下列各组物质,能在pH=1的溶液中大量共存,且形成无色溶液的是( A )
A. NaNO3 HCl Na2SO4 B. NaNO3 NaCl CuSO4
C. NaCl Na2SO4 Na2CO3 D. NaOH BaCl2 Na2SO4
8. 下列各组离子能在水溶液中共存的是( B )
A、 Ba2+、K+、NO3-、CO32-、H+ B、 K+、Cl-、Mg2+、NO3-、H+
C、Fe3+、SO42-、OH-、Na+、Cu2+ D、Ag+、Ba2+、Cl-、NO3-、K+
9、不用其它试剂,用最简捷的方法鉴别下列五种溶液:①氢氧化钠②硫酸镁③硝酸钡④氯化铁⑤氯化钾,则被鉴别出来的物质的正确的顺序是( B )
A、①②③④⑤ B、④①②③⑤ C、④③①②⑤ D、②③①④⑤
10、在A+B→盐和水的反应中,A和B不可能是( D )
A. HCl和NaOH B. CO2和NaOH C. H2SO4和CuO D. H2SO4和BaCl2
11、下列试剂中,不能鉴别氯化钠溶液和碳酸钠溶液的是( A )
A.硫酸钾溶液 B.氢氧化钡溶液 C.硝酸钙溶液 D.稀硫酸
12、一般不与其他物质发生复分解反应的是 ( A )
A.KNO3 B.NaCl C.Cu(OH)2 D.MgSO4
13、下列各组溶液中,不用其他试剂,只用组内溶液相互混合的方法,就能鉴别的一组溶液是 ( B )
A. Na2SO4 BaCl2 KNO3 NaCl B. Na2SO4 Na2CO3 BaCl2 HCl
C. NaOH Na2SO4 FeCl3 BaCl2 D. NaCl AgNO3 NaNO3 HCl
14、下列各组物质在溶液中不能反应的是 ( B )
A、HCl 和AgNO3 B、KNO3 和NaCl C、H2SO4 和BaCl2 D、NaOH 和H2SO4
15、以下两幅微观示意图揭示了化学变化的微观实质.下列相关说法中错误的是( )
A. 图①表示的是化合反应
B. 图①表示的反应中元素的化合价没有改变
C. 图②说明酸碱中和反应的实质是H+和OH﹣反应生成了H2O
D. 上述两图说明化学变化前后原子的种类、数目都不会发生变化
二.非选择题(共40分)
16、(3分)A、B两溶液中共含有七种离子:Na+ 、Cu2+、 Ba2+、 Mg2+ 、NO3-、OH-、SO42-。已知两溶液中所含离子各不相同,A溶液中含有四种离子,且能使紫色石蕊试液变蓝,则B溶液中含有的离子是_______________________。
【答案】Cu2+ Mg2+ SO42-
17、(4分)某河道两旁有甲乙两工厂,它们排放的工业废水中,可能含有CuSO4、KOH、Ba(NO3)2、K2SO4、Mg(NO3)2五种物质,且甲乙两厂排放的废水中所含物质各不相同.已知甲厂的废水中含三种物质,则乙厂的废水中所含物质应该是_______________和____________。
【答案】KOH K2SO4
18、(4分)有下列两组物质:甲组:稀H2SO4、Na2CO3溶液、FeCl3溶液;乙组:CaCl2溶液、稀盐酸、Ba(OH)2溶液.其中甲组中的___________能够与乙组中的所有物质发生反应;乙组中的___________能够与甲组中的所有物质发生反应。
【答案】Na2CO3溶液 Ba(OH)2
19.(5分)A,B,C,D为初中化学常见的四种物质,它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“—”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)
(1)若A、B、C、D中均含有一种相同的元素,常温下,A为无色液体,C为黑色固体,则A为________,C与D发生的化学反应________(填“是”或“不是”)置换反应。
(2)若A、B、C、D为四种不同类别的化合物,C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则A为________,写出B→C这一反应的化学方程式________。
【答案】 (1)H2O(或水);不是 (2)CO2(或二氧化碳);Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(其他合理答案也可)
20.(6分)亚硝酸钠(NaNO2)外观酷似食盐,有咸味,加热会分解,放出有臭味的气体。我国曾发生过多次将这种工业用盐常被冒充食盐掺假或被误作食盐食用,导致多起中毒事故发生。请你阅读下表中的有关信息,并结合所学化学知识,回答下列问题:
项目 亚硝酸钠(NaNO2) 氯化钠(NaCl)
溶解性 易溶,在15 ℃时溶解度为81.5 g 易溶,在15 ℃时溶解度为35.8g
熔点、沸点 熔点:271 ℃ ,沸点:320 ℃; 熔点:801 ℃;沸点:1413 ℃;
溶液酸碱 碱性 中性
与稀盐酸作用 放出红棕色气体 无现象
与硝酸银溶液作用 生成浅黄色沉淀 生成白色沉淀
⑴根据上表写出亚硝酸钠的两条物理性质 。
⑵亚硝酸钠跟盐酸反应会生成氯化钠、两种氮的氧化物和水,请你写出亚硝酸钠跟盐酸反应的化学方程式为 。
⑶请结合上表信息,判断以下区别亚硝酸钠和氯化钠的方法错误的是 (填序号)
A.滴加稀盐酸 B.滴加硝酸银溶液
C.加热 D.品尝味道
【答案】⑴亚硝酸钠的物理性质有易溶于水,熔点2710℃;熔点低等;⑵2NaNO2+2HCl=NO↑+NO2↑+2NaCl+H2O;⑶D
21.(12分)泡菜是常见的腌制食品,因含亚硝酸盐(如NaNO2)而引发人们的关注。根据要求完成三个探究,回答问题:
探究Ⅰ:腌制泡菜时,蔬菜中的NaNO3转化为NaNO2。食用泡菜时,NaNO2与胃酸反应生成HNO2, HNO2不稳定,转化为某氮氧化物(常温下为红棕色气体)进入血液而中毒。
⑴NaNO2与胃酸(主要成分为盐酸)发生复分解反应,该反应的化学方程式为 。
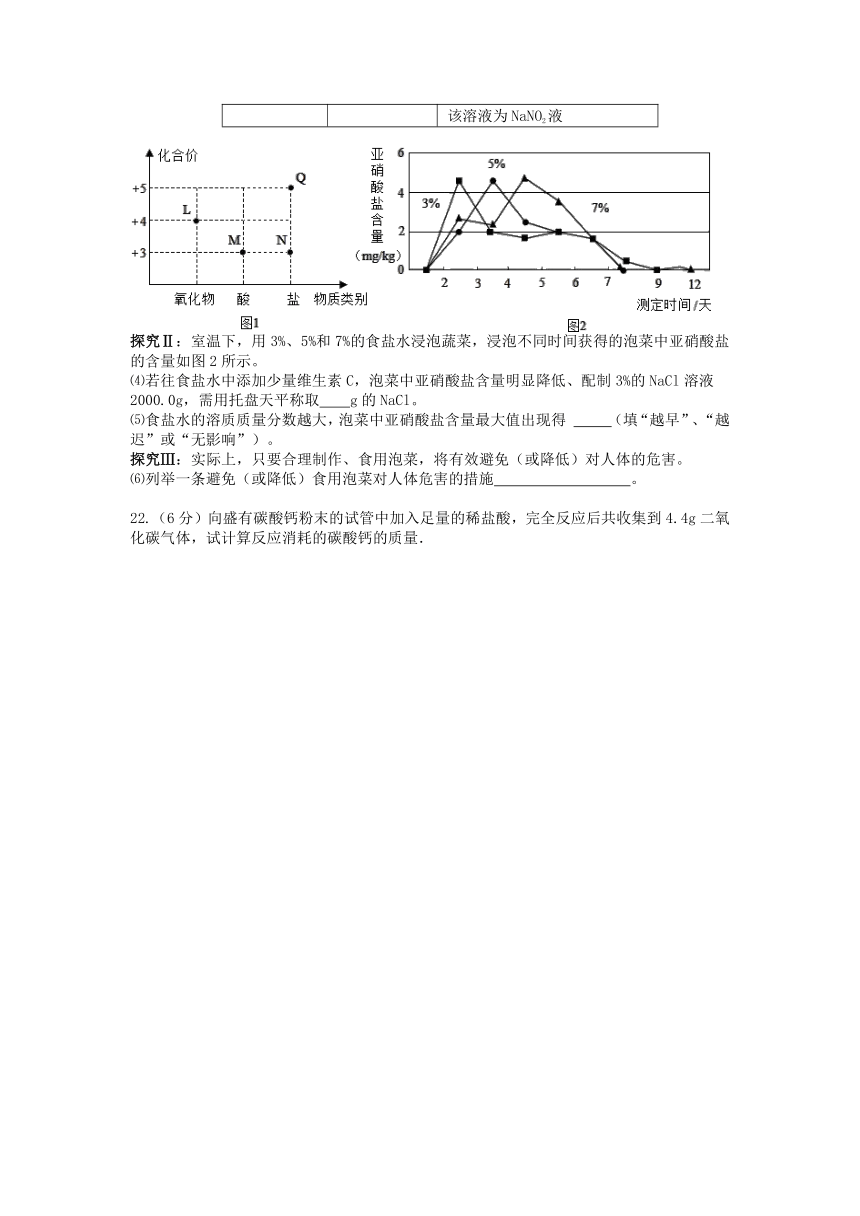
⑵图1为泡菜生产和食用时涉及的四种含氮物质的类别及氮元素化合价关系图。其中,L的化学式为 。
⑶为检验某无色溶液是NaNO2还是NaCl,完成实验方案。
选取的试剂 实验现象 实验结论
该溶液为NaNO2液
探究Ⅱ:室温下,用3%、5%和7%的食盐水浸泡蔬菜,浸泡不同时间获得的泡菜中亚硝酸盐的含量如图2所示。
⑷若往食盐水中添加少量维生素C,泡菜中亚硝酸盐含量明显降低、配制3%的NaCl溶液2000.0g,需用托盘天平称取 g的NaCl。
⑸食盐水的溶质质量分数越大,泡菜中亚硝酸盐含量最大值出现得 (填“越早”、“越迟”或“无影响”)。
探究Ⅲ:实际上,只要合理制作、食用泡菜,将有效避免(或降低)对人体的危害。
⑹列举一条避免(或降低)食用泡菜对人体危害的措施 。
【答案】.⑴NaNO2+HCl=NaCl+HNO2;⑵NO2;⑶稀盐酸;出现红棕色气体;⑷60;⑸越迟;⑹合理食用泡菜的量,制作时控制温度和盐水浓度,减少亚硝酸盐含量等。
22.(6分)向盛有碳酸钙粉末的试管中加入足量的稀盐酸,完全反应后共收集到4.4g二氧化碳气体,试计算反应消耗的碳酸钙的质量.
解:设生成4.4g二氧化碳需要碳酸钙的质量为x则:
CaCO3 +2HCl═ CaCl2+ CO2↑ +H2O
100 44
x 4.4g
x=10g
答:反应消耗的碳酸钙的质量10g.
(时间:60分钟 满分:70分)
一.选择题(每小题2分 共30分)
1、下列各组物质的溶液,不能发生复分解反应的是( )
A、HCl和Ca(OH)2 B、Na2CO3和H2SO4 C、AgNO3和BaCl2 D、KCl和CuSO4
2、下列各组物质能在水溶液中共存的是( )
A.KCl AgNO3 B.H2SO4 BaCl2 C.HCl Ca(OH)2 D.KOH NaNO3
3、下列化学方程式书写不正确的是 ( )
A、BaCl2+H2SO4=BaSO4↓+2HCl B、KOH+NaNO3=NaOH+KNO3
C、2NaOH+CuCl2=Cu(OH)2↓+2NaCl D、Mg(OH)2+ H2SO4=Mg SO4+2H2O
4、下列各组离子在水溶液中能大量共存的是( )
A.Fe2+、Ca2+、CO32—、OH- B.Na+、SO42—、Cl—、OH-
C.Ba2+、H+、Cl—、OH— D.Ag+、NH4+、NO3-、OH—
5、分别将下列各组物质,同时加到水中,得到无色透明溶液的是( )
A、NaCl MgSO4 AgNO3 Na2CO3 B、 Na2CO3 KCl KMnO4 NaNO3
C、NaOH NaCl NaNO3 MgCl2 D、Na2SO4 NaOH KCl NaNO3
6、下列能用作CO32-检验的试剂是( )
A.稀硫酸 B.食盐水 C.石灰水 D.食盐水与澄清石灰水
7、下列各组物质,能在pH=1的溶液中大量共存,且形成无色溶液的是( )
A. NaNO3 HCl Na2SO4 B. NaNO3 NaCl CuSO4
C. NaCl Na2SO4 Na2CO3 D. NaOH BaCl2 Na2SO4
8. 下列各组离子能在水溶液中共存的是( )
A、 Ba2+、K+、NO3-、CO32-、H+ B、 K+、Cl-、Mg2+、NO3-、H+
C、Fe3+、SO42-、OH-、Na+、Cu2+ D、Ag+、Ba2+、Cl-、NO3-、K+
9、不用其它试剂,用最简捷的方法鉴别下列五种溶液:①氢氧化钠②硫酸镁③硝酸钡④氯化铁⑤氯化钾,则被鉴别出来的物质的正确的顺序是( )
A、①②③④⑤ B、④①②③⑤ C、④③①②⑤ D、②③①④⑤
10、在A+B→盐和水的反应中,A和B不可能是( )
A. HCl和NaOH B. CO2和NaOH C. H2SO4和CuO D. H2SO4和BaCl2
11、下列试剂中,不能鉴别氯化钠溶液和碳酸钠溶液的是( )
A.硫酸钾溶液 B.氢氧化钡溶液 C.硝酸钙溶液 D.稀硫酸
12、一般不与其他物质发生复分解反应的是 ( )
A.KNO3 B.NaCl C.Cu(OH)2 D.MgSO4
13、下列各组溶液中,不用其他试剂,只用组内溶液相互混合的方法,就能鉴别的一组溶液是 ( )
A. Na2SO4 BaCl2 KNO3 NaCl B. Na2SO4 Na2CO3 BaCl2 HCl
C. NaOH Na2SO4 FeCl3 BaCl2 D. NaCl AgNO3 NaNO3 HCl
14、下列各组物质在溶液中不能反应的是 ( )
A、HCl 和AgNO3 B、KNO3 和NaCl C、H2SO4 和BaCl2 D、NaOH 和H2SO4
15、以下两幅微观示意图揭示了化学变化的微观实质.下列相关说法中错误的是( )
A. 图①表示的是化合反应
B. 图①表示的反应中元素的化合价没有改变
C. 图②说明酸碱中和反应的实质是H+和OH﹣反应生成了H2O
D. 上述两图说明化学变化前后原子的种类、数目都不会发生变化
二.非选择题(共40分)
16、(3分)A、B两溶液中共含有七种离子:Na+ 、Cu2+、 Ba2+、 Mg2+ 、NO3-、OH-、SO42-。已知两溶液中所含离子各不相同,A溶液中含有四种离子,且能使紫色石蕊试液变蓝,则B溶液中含有的离子是_______________________。
17、(4分)某河道两旁有甲乙两工厂,它们排放的工业废水中,可能含有CuSO4、KOH、Ba(NO3)2、K2SO4、Mg(NO3)2五种物质,且甲乙两厂排放的废水中所含物质各不相同.已知甲厂的废水中含三种物质,则乙厂的废水中所含物质应该是_______________和____________。
18、(4分)有下列两组物质:甲组:稀H2SO4、Na2CO3溶液、FeCl3溶液;乙组:CaCl2溶液、稀盐酸、Ba(OH)2溶液.其中甲组中的___________能够与乙组中的所有物质发生反应;乙组中的___________能够与甲组中的所有物质发生反应。
19.(5分)A,B,C,D为初中化学常见的四种物质,它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“—”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)
(1)若A、B、C、D中均含有一种相同的元素,常温下,A为无色液体,C为黑色固体,则A为________,C与D发生的化学反应________(填“是”或“不是”)置换反应。
(2)若A、B、C、D为四种不同类别的化合物,C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则A为________,写出B→C这一反应的化学方程式________。
20.(6分)亚硝酸钠(NaNO2)外观酷似食盐,有咸味,加热会分解,放出有臭味的气体。我国曾发生过多次将这种工业用盐常被冒充食盐掺假或被误作食盐食用,导致多起中毒事故发生。请你阅读下表中的有关信息,并结合所学化学知识,回答下列问题:
项目 亚硝酸钠(NaNO2) 氯化钠(NaCl)
溶解性 易溶,在15 ℃时溶解度为81.5 g 易溶,在15 ℃时溶解度为35.8g
熔点、沸点 熔点:271 ℃ ,沸点:320 ℃; 熔点:801 ℃;沸点:1413 ℃;
溶液酸碱 碱性 中性
与稀盐酸作用 放出红棕色气体 无现象
与硝酸银溶液作用 生成浅黄色沉淀 生成白色沉淀
⑴根据上表写出亚硝酸钠的两条物理性质 。
⑵亚硝酸钠跟盐酸反应会生成氯化钠、两种氮的氧化物和水,请你写出亚硝酸钠跟盐酸反应的化学方程式为 。
⑶请结合上表信息,判断以下区别亚硝酸钠和氯化钠的方法错误的是 (填序号)
A.滴加稀盐酸 B.滴加硝酸银溶液
C.加热 D.品尝味道
21.(12分)泡菜是常见的腌制食品,因含亚硝酸盐(如NaNO2)而引发人们的关注。根据要求完成三个探究,回答问题:
探究Ⅰ:腌制泡菜时,蔬菜中的NaNO3转化为NaNO2。食用泡菜时,NaNO2与胃酸反应生成HNO2, HNO2不稳定,转化为某氮氧化物(常温下为红棕色气体)进入血液而中毒。
⑴NaNO2与胃酸(主要成分为盐酸)发生复分解反应,该反应的化学方程式为 。
⑵图1为泡菜生产和食用时涉及的四种含氮物质的类别及氮元素化合价关系图。其中,L的化学式为 。
⑶为检验某无色溶液是NaNO2还是NaCl,完成实验方案。
选取的试剂 实验现象 实验结论
该溶液为NaNO2液
探究Ⅱ:室温下,用3%、5%和7%的食盐水浸泡蔬菜,浸泡不同时间获得的泡菜中亚硝酸盐的含量如图2所示。
⑷若往食盐水中添加少量维生素C,泡菜中亚硝酸盐含量明显降低、配制3%的NaCl溶液2000.0g,需用托盘天平称取 g的NaCl。
⑸食盐水的溶质质量分数越大,泡菜中亚硝酸盐含量最大值出现得 (填“越早”、“越迟”或“无影响”)。
探究Ⅲ:实际上,只要合理制作、食用泡菜,将有效避免(或降低)对人体的危害。
⑹列举一条避免(或降低)食用泡菜对人体危害的措施 。
22.(6分)向盛有碳酸钙粉末的试管中加入足量的稀盐酸,完全反应后共收集到4.4g二氧化碳气体,试计算反应消耗的碳酸钙的质量.
教师样卷
一.选择题(每小题2分 共30分)
1、下列各组物质的溶液,不能发生复分解反应的是( D )
A、HCl和Ca(OH)2 B、Na2CO3和H2SO4 C、AgNO3和BaCl2 D、KCl和CuSO4
2、下列各组物质能在水溶液中共存的是( D )
A.KCl AgNO3 B.H2SO4 BaCl2 C.HCl Ca(OH)2 D.KOH NaNO3
3、下列化学方程式书写不正确的是 ( B )
A、BaCl2+H2SO4=BaSO4↓+2HCl B、KOH+NaNO3=NaOH+KNO3
C、2NaOH+CuCl2=Cu(OH)2↓+2NaCl D、Mg(OH)2+ H2SO4=Mg SO4+2H2O
4、下列各组离子在水溶液中能大量共存的是( B )
A.Fe2+、Ca2+、CO32—、OH- B.Na+、SO42—、Cl—、OH-
C.Ba2+、H+、Cl—、OH— D.Ag+、NH4+、NO3-、OH—
5、分别将下列各组物质,同时加到水中,得到无色透明溶液的是( D )
A、NaCl MgSO4 AgNO3 Na2CO3 B、 Na2CO3 KCl KMnO4 NaNO3
C、NaOH NaCl NaNO3 MgCl2 D、Na2SO4 NaOH KCl NaNO3
6、下列能用作CO32-检验的试剂是( B )
A.稀硫酸 B.食盐水 C.石灰水 D.食盐水与澄清石灰水
7、下列各组物质,能在pH=1的溶液中大量共存,且形成无色溶液的是( A )
A. NaNO3 HCl Na2SO4 B. NaNO3 NaCl CuSO4
C. NaCl Na2SO4 Na2CO3 D. NaOH BaCl2 Na2SO4
8. 下列各组离子能在水溶液中共存的是( B )
A、 Ba2+、K+、NO3-、CO32-、H+ B、 K+、Cl-、Mg2+、NO3-、H+
C、Fe3+、SO42-、OH-、Na+、Cu2+ D、Ag+、Ba2+、Cl-、NO3-、K+
9、不用其它试剂,用最简捷的方法鉴别下列五种溶液:①氢氧化钠②硫酸镁③硝酸钡④氯化铁⑤氯化钾,则被鉴别出来的物质的正确的顺序是( B )
A、①②③④⑤ B、④①②③⑤ C、④③①②⑤ D、②③①④⑤
10、在A+B→盐和水的反应中,A和B不可能是( D )
A. HCl和NaOH B. CO2和NaOH C. H2SO4和CuO D. H2SO4和BaCl2
11、下列试剂中,不能鉴别氯化钠溶液和碳酸钠溶液的是( A )
A.硫酸钾溶液 B.氢氧化钡溶液 C.硝酸钙溶液 D.稀硫酸
12、一般不与其他物质发生复分解反应的是 ( A )
A.KNO3 B.NaCl C.Cu(OH)2 D.MgSO4
13、下列各组溶液中,不用其他试剂,只用组内溶液相互混合的方法,就能鉴别的一组溶液是 ( B )
A. Na2SO4 BaCl2 KNO3 NaCl B. Na2SO4 Na2CO3 BaCl2 HCl
C. NaOH Na2SO4 FeCl3 BaCl2 D. NaCl AgNO3 NaNO3 HCl
14、下列各组物质在溶液中不能反应的是 ( B )
A、HCl 和AgNO3 B、KNO3 和NaCl C、H2SO4 和BaCl2 D、NaOH 和H2SO4
15、以下两幅微观示意图揭示了化学变化的微观实质.下列相关说法中错误的是( )
A. 图①表示的是化合反应
B. 图①表示的反应中元素的化合价没有改变
C. 图②说明酸碱中和反应的实质是H+和OH﹣反应生成了H2O
D. 上述两图说明化学变化前后原子的种类、数目都不会发生变化
二.非选择题(共40分)
16、(3分)A、B两溶液中共含有七种离子:Na+ 、Cu2+、 Ba2+、 Mg2+ 、NO3-、OH-、SO42-。已知两溶液中所含离子各不相同,A溶液中含有四种离子,且能使紫色石蕊试液变蓝,则B溶液中含有的离子是_______________________。
【答案】Cu2+ Mg2+ SO42-
17、(4分)某河道两旁有甲乙两工厂,它们排放的工业废水中,可能含有CuSO4、KOH、Ba(NO3)2、K2SO4、Mg(NO3)2五种物质,且甲乙两厂排放的废水中所含物质各不相同.已知甲厂的废水中含三种物质,则乙厂的废水中所含物质应该是_______________和____________。
【答案】KOH K2SO4
18、(4分)有下列两组物质:甲组:稀H2SO4、Na2CO3溶液、FeCl3溶液;乙组:CaCl2溶液、稀盐酸、Ba(OH)2溶液.其中甲组中的___________能够与乙组中的所有物质发生反应;乙组中的___________能够与甲组中的所有物质发生反应。
【答案】Na2CO3溶液 Ba(OH)2
19.(5分)A,B,C,D为初中化学常见的四种物质,它们之间有如图所示的转化和反应关系(“→”表示某一种物质经一步反应可转化为另一种物质,“—”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去)
(1)若A、B、C、D中均含有一种相同的元素,常温下,A为无色液体,C为黑色固体,则A为________,C与D发生的化学反应________(填“是”或“不是”)置换反应。
(2)若A、B、C、D为四种不同类别的化合物,C在生活中可用来除油污,且C的固体可作某些气体的干燥剂,则A为________,写出B→C这一反应的化学方程式________。
【答案】 (1)H2O(或水);不是 (2)CO2(或二氧化碳);Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(其他合理答案也可)
20.(6分)亚硝酸钠(NaNO2)外观酷似食盐,有咸味,加热会分解,放出有臭味的气体。我国曾发生过多次将这种工业用盐常被冒充食盐掺假或被误作食盐食用,导致多起中毒事故发生。请你阅读下表中的有关信息,并结合所学化学知识,回答下列问题:
项目 亚硝酸钠(NaNO2) 氯化钠(NaCl)
溶解性 易溶,在15 ℃时溶解度为81.5 g 易溶,在15 ℃时溶解度为35.8g
熔点、沸点 熔点:271 ℃ ,沸点:320 ℃; 熔点:801 ℃;沸点:1413 ℃;
溶液酸碱 碱性 中性
与稀盐酸作用 放出红棕色气体 无现象
与硝酸银溶液作用 生成浅黄色沉淀 生成白色沉淀
⑴根据上表写出亚硝酸钠的两条物理性质 。
⑵亚硝酸钠跟盐酸反应会生成氯化钠、两种氮的氧化物和水,请你写出亚硝酸钠跟盐酸反应的化学方程式为 。
⑶请结合上表信息,判断以下区别亚硝酸钠和氯化钠的方法错误的是 (填序号)
A.滴加稀盐酸 B.滴加硝酸银溶液
C.加热 D.品尝味道
【答案】⑴亚硝酸钠的物理性质有易溶于水,熔点2710℃;熔点低等;⑵2NaNO2+2HCl=NO↑+NO2↑+2NaCl+H2O;⑶D
21.(12分)泡菜是常见的腌制食品,因含亚硝酸盐(如NaNO2)而引发人们的关注。根据要求完成三个探究,回答问题:
探究Ⅰ:腌制泡菜时,蔬菜中的NaNO3转化为NaNO2。食用泡菜时,NaNO2与胃酸反应生成HNO2, HNO2不稳定,转化为某氮氧化物(常温下为红棕色气体)进入血液而中毒。
⑴NaNO2与胃酸(主要成分为盐酸)发生复分解反应,该反应的化学方程式为 。
⑵图1为泡菜生产和食用时涉及的四种含氮物质的类别及氮元素化合价关系图。其中,L的化学式为 。
⑶为检验某无色溶液是NaNO2还是NaCl,完成实验方案。
选取的试剂 实验现象 实验结论
该溶液为NaNO2液
探究Ⅱ:室温下,用3%、5%和7%的食盐水浸泡蔬菜,浸泡不同时间获得的泡菜中亚硝酸盐的含量如图2所示。
⑷若往食盐水中添加少量维生素C,泡菜中亚硝酸盐含量明显降低、配制3%的NaCl溶液2000.0g,需用托盘天平称取 g的NaCl。
⑸食盐水的溶质质量分数越大,泡菜中亚硝酸盐含量最大值出现得 (填“越早”、“越迟”或“无影响”)。
探究Ⅲ:实际上,只要合理制作、食用泡菜,将有效避免(或降低)对人体的危害。
⑹列举一条避免(或降低)食用泡菜对人体危害的措施 。
【答案】.⑴NaNO2+HCl=NaCl+HNO2;⑵NO2;⑶稀盐酸;出现红棕色气体;⑷60;⑸越迟;⑹合理食用泡菜的量,制作时控制温度和盐水浓度,减少亚硝酸盐含量等。
22.(6分)向盛有碳酸钙粉末的试管中加入足量的稀盐酸,完全反应后共收集到4.4g二氧化碳气体,试计算反应消耗的碳酸钙的质量.
解:设生成4.4g二氧化碳需要碳酸钙的质量为x则:
CaCO3 +2HCl═ CaCl2+ CO2↑ +H2O
100 44
x 4.4g
x=10g
答:反应消耗的碳酸钙的质量10g.
同课章节目录
