7.3溶液浓稀的表示 同步练习(word版含解析)
文档属性
| 名称 | 7.3溶液浓稀的表示 同步练习(word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 189.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-19 16:37:48 | ||
图片预览


文档简介
7.3 溶液浓稀的表示
一、单选题
1.如图为甲、乙两物质的溶解度曲线,下列说法正确的是
A.甲、乙两物质均属于难溶物质
B.甲物质的溶解度大于乙物质的溶解度
C.t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等
D.t2℃时,甲物质饱和溶液的溶质质量分数为50%
2.向l00g10%NaOH溶液中加入12.5gNaOH固体,完全溶解后.所得溶液中溶质质量分数为
A.12. 5% B.20.0% C.22.5% D.25%
3.向200 g溶质质量分数为10%的蔗糖溶液中加入200 g水,搅拌后把所得溶液倒掉一半后,剩余的溶液溶质质量分数为
A.10% B.5% C.2.5% D.0.5%
4.高氯酸钾( KClO4 ) 可用作火箭推进剂, 其溶解度如下表。下列说法不正确的是
温度 /℃ 20 40 60 80
溶解度 /g 1.68 3.73 7.3 13.4
A.高氯酸钾的溶解度随温度降低而减小
B.20℃时, 将 2g 高氯酸钾溶于 98g 水中, 所得溶液中溶质的质量分数小于 2%
C.60℃时, 高氯酸钾饱和溶液中溶质的质量分数小于 7.3%
D.80℃的高氯酸钾溶液冷却至 40℃肯定有晶体析出
5.关于100g10%的硝酸钾溶液,下列叙述正确的是
A.100g水中溶有10g硝酸钾
B.溶液中硝酸钾与水的质量比为1:10
C.将硝酸钾和水按9:1的质量比配成的溶液
D.将10g硝酸钾溶于90g水中,可制得该溶液
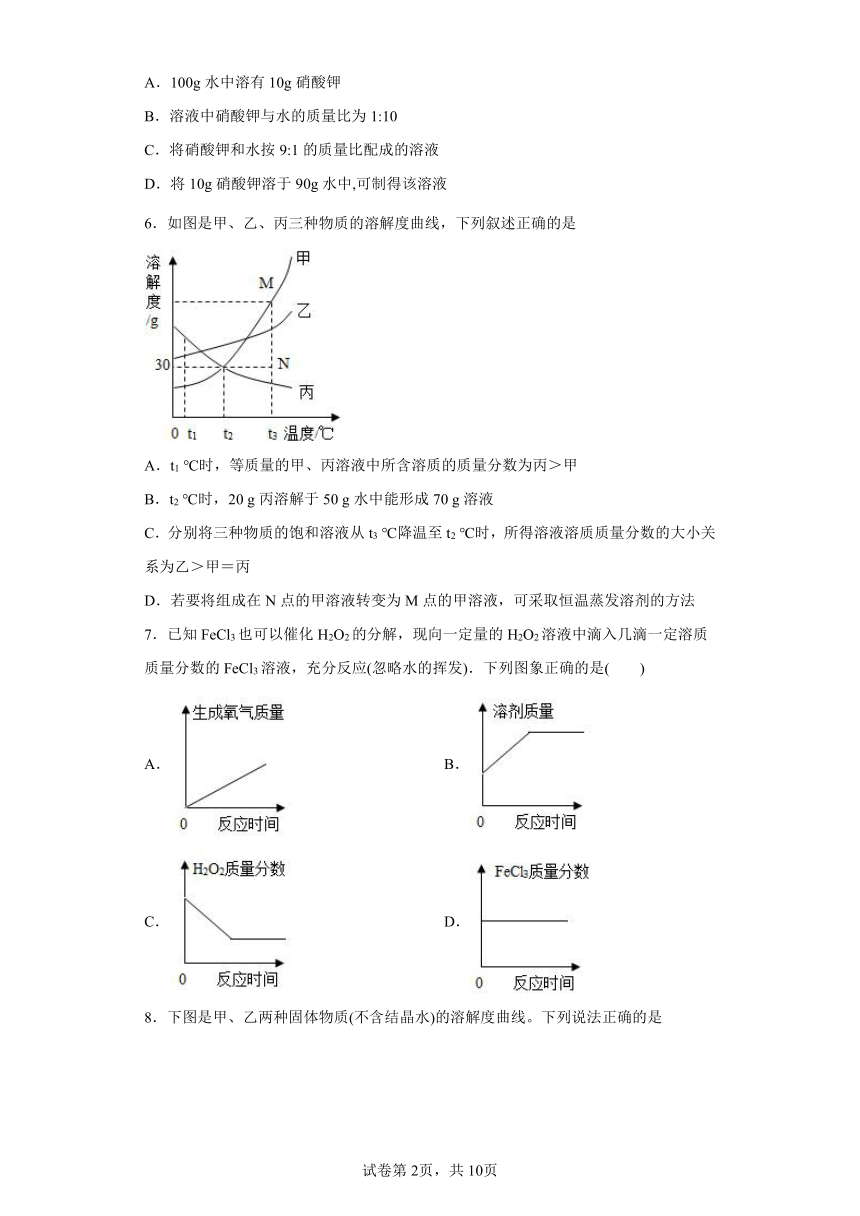
6.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是
A.t1 ℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲
B.t2 ℃时,20 g丙溶解于50 g水中能形成70 g溶液
C.分别将三种物质的饱和溶液从t3 ℃降温至t2 ℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
7.已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发).下列图象正确的是( )
A. B.
C. D.
8.下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.a1℃时,甲、乙饱和溶液的温度升温至a2℃时,均有固体析出
C.a2℃时,M点对应的甲溶液不饱和
D.a2℃时,乙饱和溶液的质量分数为20%
9.根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成如图中斜线.下列说法正确是( )
A.该物质的溶解度随温度的升高而增大
B.t℃时该物质的溶解度为40
C.G点表示溶液中溶质的质量分数为20%
D.图中4个点表示的溶液中溶质质量分数的关系是:G<m<w=z
10.下列关于溶液的说法正确的是
A.溶液一定是无色透明的
B.溶液一定是均一的、稳定的混合物
C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
D.将40g溶质质量分数为20%的氯化钠溶液倒出20g,剩余溶液溶质质量分数为10%
11.如图所示图像中,能正确反映对应变化关系的是( )
A B C D
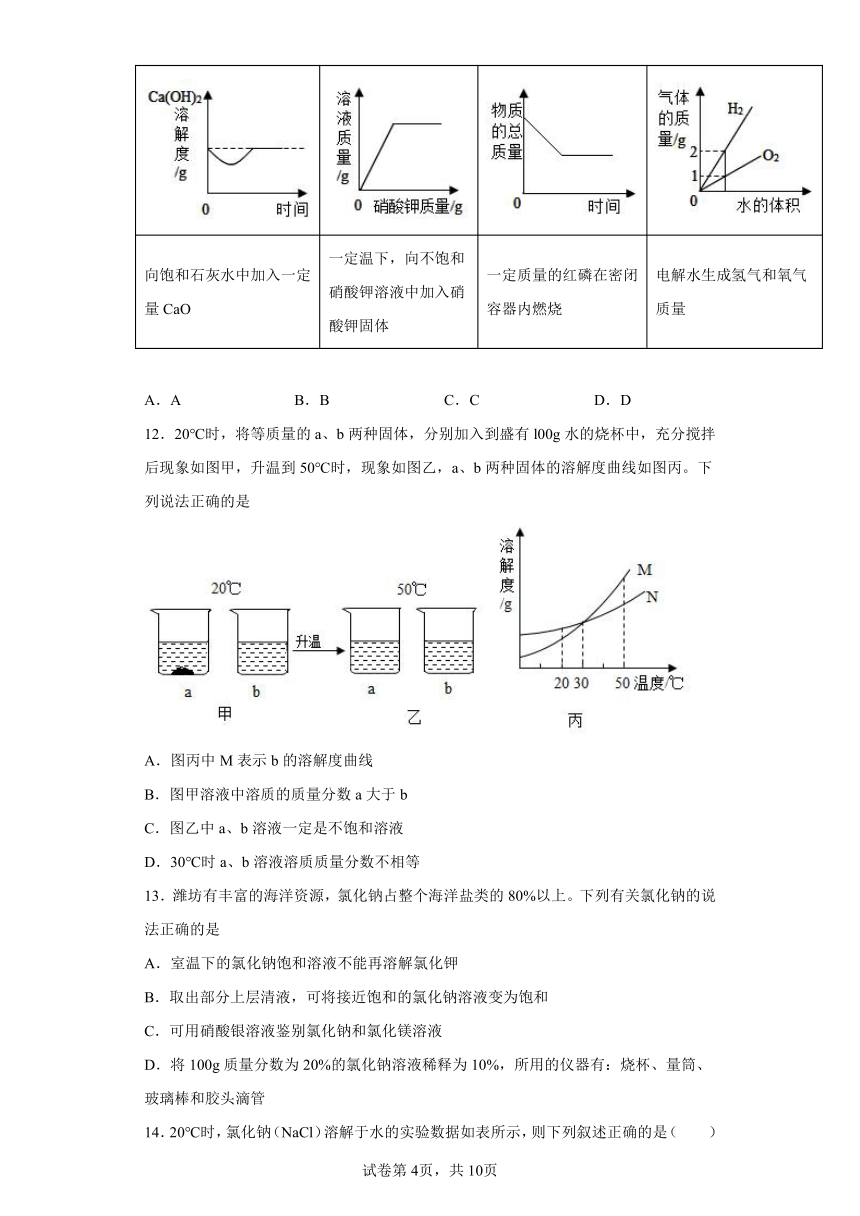
向饱和石灰水中加入一定量CaO 一定温下,向不饱和硝酸钾溶液中加入硝酸钾固体 一定质量的红磷在密闭容器内燃烧 电解水生成氢气和氧气质量
A.A B.B C.C D.D
12.20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是
A.图丙中M表示b的溶解度曲线
B.图甲溶液中溶质的质量分数a大于b
C.图乙中a、b溶液一定是不饱和溶液
D.30℃时a、b溶液溶质质量分数不相等
13.潍坊有丰富的海洋资源,氯化钠占整个海洋盐类的80%以上。下列有关氯化钠的说法正确的是
A.室温下的氯化钠饱和溶液不能再溶解氯化钾
B.取出部分上层清液,可将接近饱和的氯化钠溶液变为饱和
C.可用硝酸银溶液鉴别氯化钠和氯化镁溶液
D.将100g质量分数为20%的氯化钠溶液稀释为10%,所用的仪器有:烧杯、量筒、玻璃棒和胶头滴管
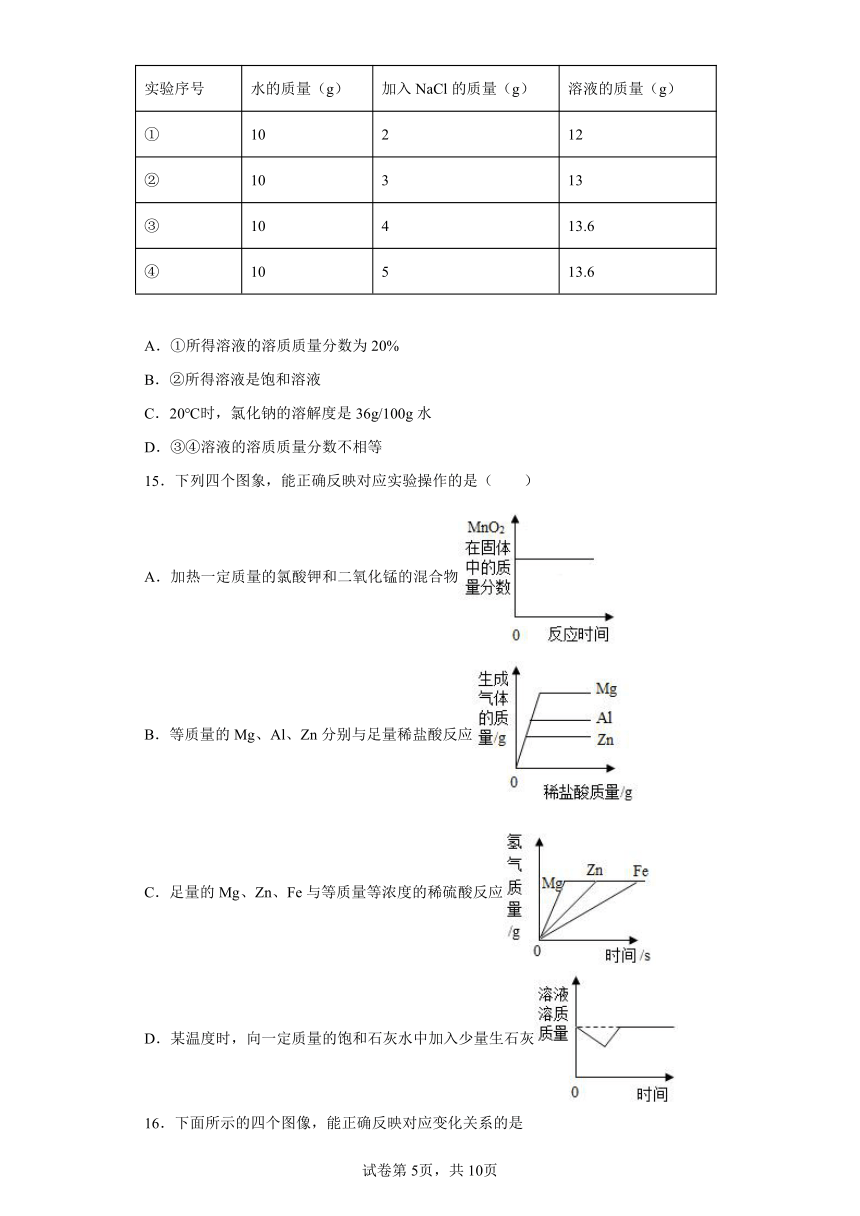
14.20℃时,氯化钠(NaCl)溶解于水的实验数据如表所示,则下列叙述正确的是( )
实验序号 水的质量(g) 加入NaCl的质量(g) 溶液的质量(g)
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.①所得溶液的溶质质量分数为20%
B.②所得溶液是饱和溶液
C.20℃时,氯化钠的溶解度是36g/100g水
D.③④溶液的溶质质量分数不相等
15.下列四个图象,能正确反映对应实验操作的是( )
A.加热一定质量的氯酸钾和二氧化锰的混合物
B.等质量的Mg、Al、Zn分别与足量稀盐酸反应
C.足量的Mg、Zn、Fe与等质量等浓度的稀硫酸反应
D.某温度时,向一定质量的饱和石灰水中加入少量生石灰
16.下面所示的四个图像,能正确反映对应变化关系的是
A.镁在氧气中燃烧
B.向二氧化锰中加入过氧化氢溶液
C.向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液
D.等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
二、综合应用题
17.下列三套装置都能用于实验室制取二氧化碳
(1)写出实验室制取二氧化碳的化学方程式: ____________________ ,
(2)仪器A的名称是 __________________
(3)利用图2装取制取二氧化碳时,长颈漏斗的下端管口必须浸没在溶液中,理由是 _____________ ,
(4)图1和图3装置相比.利用图1装置来制取二氧化碳,时主要的不足是 _______ (写一条即可)
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取一定量的石灰石样品,将20g稀盐酸分4次加人样品中(样品中除碳酸钙外,其余成分不与盐酸反应,也不溶 于水).充分反应后经过过滤、千操等操作,最后称量,数据如下表
稀盐酸的用量 剩余固体的质量
第一次加入5g 1.5g
第二次加入5g 1.0g
第三次加入5g 0.5g
第四次加入5g 0.3g
①石灰石样品中碳酸钙的质量分数为 _________________
②原稀盐酸中溶质的质量分数为 ________ (写出计算过程)
18.小明在实验室加热57g氯酸钾和二氧化锰的混合物一段时间后,剩余固体的质量为47.4g。小明继续加热剩余固体至完全反应,又收集到一些氧气。为了回收催化剂,进行了如图所示实验:
请回答下列问题:
(1)实验过程中发生反应的化学方程式为____________________________________;
(2)第一次加热后收集到的氧气质量为______________________________________;
(3)列出求解两次总共参加反应的氯酸钾质量X的比例式_____________________;
(4)小明两次加热过程中,消耗氯酸钾的质量比为____________________________;
(5)如将所得溶液制成溶质质量分数为10%的溶液,需加入水的质量是__________。
19.掌握仪器的使用方法并严格按照操作要求进行实验,才能保障实验的成功和安全。根据所学化学知识,回答下列问题:
(1)固体药品通常保存在____________里(填仪器名称)。
(2)实验室取用药品要注意节约,如果没有说明用量,一般应该取用最少量,液体药品取用_____mL。
(3)利用量筒读数时,视线与量筒内液体的___________________保持水平。
(4)取液后的滴管,平放或倒置可能造成的后果是__________________ (答一点即可)。
(5)用托盘天平称量12.6g药品时,向左盘中加入药品后,发现指针向左偏转,应进行的操作是________(填序号)
①右边的平衡螺母向右调至天平平衡
②移动游码至天平平衡
③左盘中减少药品至天平平衡
④左盘中添加药品至天平平衡
20.硝酸钾、氯化钠固体溶解度曲线如图1所示。20℃时,将硝酸钾、氯化钠固体各35g分别加入到100g水中,充分搅拌后现象如图2所示,加热到50℃时现象如图3所示(不考虑水分蒸发)。
(1)图1中P点含义是________
(2)图2中烧杯甲中溶液的溶质是________(填化学式)。
(3)下列说法正确的是________(填标号)。
A图2烧杯甲中的溶液是饱和溶液
B图2烧杯乙中的溶液为饱和溶液
C.图3烧杯甲中溶液质量比烧杯乙中溶液质量大
(4)图3烧杯乙溶液中溶质的质量分数是________(结果保留一位小数),为使该溶液转化成饱和溶液,将溶液恒温蒸发50g水,是否可行_____(填“是”或“否”)。
21.(人类的日常生活和工农业生产离不开水和溶液。请回答下列问题:
(1)如下图所示,三个实验分别用到水。
请回答:
①实验A中热水的作用是提供热量和_________。
②实验B能说明CO2可溶于水,同时发生的化学反应方程式为_________。
③实验C,滴加水后看到U型管中_________(填“左边”或“右边”)液面升高。(2)如下图是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①t1℃时,甲的溶解度是_________。
②下列说法一定正确的是 _________
A.甲的溶解度比乙的溶解度大 B.t1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C.常温下,乙易溶于水 D.从t2℃降至t1℃,甲、乙溶液中均有晶体析出
③某同学设计的鉴别甲、乙固体的方案如下:t2℃时,取4.0g甲和4.0g乙分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL),用玻璃棒充分搅拌后,观察现象。你认为此方案______﹙“是”还是“否”﹚可行 并说明由_________。
④甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓缩,_________,然后过滤。
22.钠及其化合物是中学化学学习和研究的重要内容.
(1)如图1是钠的原子结构示意图,钠在反应中失电子后形成离子的符号是_____.
(2)钠在氯气中燃烧生成氯化钠,化学方程式为_____.
(3)配制一瓶符合如图2所示的氯化钠溶液,需氯化钠_____g;小明同学配制的氯化钠溶液质量分数偏小了,请写出他操作中可能出现的错误(提示:1g以下用游码,至少答出两点)_____.
(4)如何测定一瓶苏打水的酸碱度(写出实验操作步骤)_____.
(5)小苏打受热分解生成碳酸钠、二氧化碳和水,化学方程式为_____.
(6)钛和钛合金性能优良,广泛用于航空、造船和化学工作中.工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛.若用该方法制取2.4kg钛,理论上需要钠的质量是多少_____?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【解析】
【详解】
A、通过分析溶解度曲线可知,在10℃时,甲、乙物质的溶解度大于10g,所以甲、乙两物质均属于易溶物质,故A错误;
B、在比较物质的溶解度时,需要指明温度,故B错误;
C、t1℃时,甲、乙两物质的溶解度相等,所以饱和溶液的溶质质量分数相等,故C正确;
D、t2℃时,甲的溶解度是50g,所以甲饱和溶液的溶质质量分数=,故D错误。故选C。
2.B
【解析】
【详解】
所得溶液中溶质质量分数=(100g×10%+12.5g )/(100g+12.5g0 ×100%=20%
故选B
3.B
【解析】
【详解】
根据溶液稀释前后,溶质质量相等。向200g溶质质量分数为10%的蔗糖溶液中加入200g水,搅拌后把所得溶液倒掉一半后,剩余的溶液溶质质量分数为
200g×10%=﹙200g+200g﹚×x,x=5%.
4.D
【解析】
【详解】
A、由表格信息可知高氯酸钾的溶解度随温度降低而减小,正确;B、20℃时, 高氯酸钾的溶解度为1.68g,即该温度时,1.68g高氯酸钾溶解在100g水恰好形成饱和溶液,那么2g 高氯酸钾加入 98g 水中,高氯酸钾不能完全溶解,故所得溶液中溶质的质量分数小于 2%,正确;C、60℃时, 高氯酸钾的溶解度为7.3g,溶质的质量分数= 6.8%,即60℃时, 高氯酸钾饱和溶液中溶质的质量分数为6.8%,正确;D、80℃的高氯酸钾饱和溶液冷却至 40℃肯定有晶体析出,若是不饱和溶液那么不一定有晶体析出,错误。故选D。
5.D
【解析】
【详解】
A.表示100g硝酸钾溶液中溶有10g硝酸钾,选项说法错误;
B.该溶液中,硝酸钾与水的质量比为:10%:90%=1:9,选项说法错误;
C.将硝酸钾和水按1:9的质量比配成的溶液,选项说法错误;
D.将10g硝酸钾溶于90g水中,可制得100g10%的硝酸钾溶液,选项说法正确。
故选:D。
6.D
【解析】
【详解】
A、t1℃时,甲的溶解度小于丙的溶解度,等质量的甲、丙饱和溶液中所含溶质的质量分数为丙>甲,但此题不知溶液是否饱和,故错误;
B、t2℃时,丙的溶解度是30g,将20g丙加入到50g水中只溶解15g,充分搅拌后,所形成溶液的质量=15g+50g=65g;故错误;
C、甲、乙物质的溶解度随温度的升高而增大,丙物质的溶解度随温度的升高而减小,t3℃时,甲、乙、丙三种物质的饱和溶液降温到t2℃时,乙物质的溶解度最大,甲次之,丙物质应该是t3℃时的溶解度,所以所得的溶液中溶质的质量分数的大小关系为乙>甲>丙,故错误;
D、甲物质的溶解度随温度的升高而增大,所以要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂或添加溶质的方法,故正确。故选D。
7.B
【解析】
【详解】
A、向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,过氧化氢分解为氧气和水,完全反应后,氧气质量不再变化,错误;
B、过氧化氢分解为氧气和水,溶剂质量增加,完全反应后,溶剂质量不再变化,正确;
C、过氧化氢分解为氧气和水,过氧化氢的质量分数减小,完全反应后,过氧化氢的质量为0,质量分数为0,错误;
D、FeCl3是催化剂,反应前后质量不变,过氧化氢分解为氧气和水,溶液质量减小,FeCl3的质量分数变大,错误。故选B。
8.C
【解析】
【详解】
A、比较溶解度的大小要指明温度,错误;
B、甲的溶解度随温度的升高而增大,乙的溶解度随温度的升高而减小,故a1℃时,甲、乙饱和溶液的温度升温至a2℃时,乙中有固体析出,甲中没有,错误;
C、溶解度曲线上的点对应的是该温度下的饱和溶液,曲线下方的点表示的是该温度下的不饱和溶液,故a2℃时,M点对应的甲溶液不饱和,正确;
D、a2℃时,乙的溶解度为20g,那么它的饱和溶液的溶质质量分数=16.7%,错误。
故选C。
9.D
【解析】
【分析】
饱和溶液的质量分数=×100%
【详解】
A、该图示是溶剂和溶质的质量,没有说溶解度,所以不能说该物质的溶解度随温度的升高而增大,故A错;
B、溶解度单位是克,少了单位,故B错;
C、G点表示溶液中溶质的质量分数为:×100%=16.67%,故C错;
D、G和m的区别是G中有100g水,m中有80g水,溶质相同都是20g,所以G中溶质质量分数要小于m中质量分数,G都是m该温度下的不饱和溶液,w和z都在曲线上,都属于饱和溶液,温度没变,溶解度就不变,所以w和z溶质质量分数相同,因为在同一温度,同一溶质饱和溶液的质量分数最大,所以图中4个点表示的溶液中溶质质量分数的关系是:G<m<w=z,故D正确,故选D。
10.B
【解析】
【详解】
A、溶液不一定是无色、透明的,如硫酸铜溶液是蓝色,选项说法错误;
B、溶液一定是均一、稳定的混合物,选项说法正确;
C、饱和溶液针对的是溶液的状态,浓、稀针对的是溶液的溶质质量质量分数,所以饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,选项说法错误;
D、将40g溶质质量分数为20%的氯化钠溶液倒出20g,剩余溶液溶质质量分数应为20%,溶液具有均一性,选项说法错误。
故选B。
11.A
【解析】
【详解】
A、向饱和石灰水中加入少量的生石灰,生石灰和水反应生成氢氧化钙,该反应放出热量,溶液温度升高,氢氧化钙的溶解度随温度的升高而减小,随后随着温度的下降,氢氧化钙的溶解度又变大,恢复到常温保持不变,能正确反映对应变化关系;
B、根据饱和溶液的定义可以知道温度不变,向不饱和硝酸钾溶液中加入硝酸钾至饱和后,溶液质量不再改变,但是由于是向不饱和硝酸钾溶液中加入硝酸钾,所以溶液的质量一开始不会是0,不能正确反映对应变化关系;
C、磷在氧气中燃烧生成五氧化二磷,根据质量守恒定律,密闭容器内物质总质量不变,不能正确反映对应变化关系;
D、通电分解水时产生氢气的体积是氧气的二倍,不能正确反映对应变化关系。故选A。
12.C
【解析】
【详解】
A、由甲图可知,20℃时a的溶解度小于b的溶解度,故M表示的是a的溶解度曲线,N表示的是b的溶解度曲线,选项A错误;
B、20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,a中有固体剩余,b完全溶解,说明此时b的溶质质量分数大于a的溶质质量分数,选项B错误;
C、20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,a中有固体剩余,那么得到的是该温度下的饱和溶液;b中完全溶解,那么可能是饱和溶液,也可能是不饱和溶液;升温到50℃时,a和b中均没有固体剩余,ab的溶解度均大于20℃时b的溶解度,所以ab一定是不饱和溶液,选项C正确;
D、30℃时a、b的溶解度相等,那么等质量的a、b两种固体,分别加入到盛有l00g水中所得溶液的溶质质量分数相等,选项D错误。故选C。
13.D
【解析】
【详解】
A.饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。室温下的氯化钠饱和溶液不能再溶解氯化钠,但能溶解其它的可溶物质;B.溶液是均一的,溶液各处的组成和性质完全相同,取出部分上层清液,不能改变溶液的状态;C.硝酸银溶液与氯化钠和氯化镁溶液都能生成氯化银白色沉淀;D.将100g质量分数为20%的氯化钠溶液稀释为10%,需要量取100mL水,并与原溶液充分混合,所用的仪器有:烧杯、量筒、玻璃棒和胶头滴管;选D
14.C
【解析】
【详解】
A、①所得溶液的溶质质量分数为100%<20%,故选项说法错误。
B、20℃时,氯化钠(NaCl)溶解于水的实验数据,10g水中最多能溶解能形成氯化钠溶液13.6g,②所得溶液是不饱和溶液,故选项说法错误。
C、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,20℃时,10g水中最多能溶解能形成氯化钠溶液13.6g,溶解的溶质质量为13.6g﹣10g=3.6g,20℃时,氯化钠的溶解度是36g/100g水,故选项说法正确。
D、③④均为该温度下的饱和溶液,③④溶液的溶质质量分数相等,故选项说法错误。
故选:C。
15.C
【解析】
【详解】
A、二氧化锰做催化剂,质量不变,但是加热氯酸钾生成氧气所以二氧化锰的质量分数会增大,A错误;
B、根据,,可知,产生等质量的氢气,消耗金属的质量锌>铁>铝;等质量铝、铁、锌分别和足量稀盐酸反应,若消耗盐酸相同,则生成氢气质量相同,故开始三斜线重合,后因盐酸过量,产生氢气的质量铝>铁>锌,生成氢气多,拐点高些,故选项B图象不能正确反映对应变化关系;
C、足量的Zn、Mg、Fe与等质量等浓度的硫酸反应时,生成的氢气质量相等,由于金属的活动性镁>锌>铁,斜线的斜率应是k(Mg)>k(Zn)>k(Fe),故C正确;
D、向饱和石灰水中加入少量生石灰,由于氧化钙与水反应放热,溶液中溶剂质量减少,最终溶液中溶质质量少于开始时的溶质质量,故D错误。
故选C。
16.B
【解析】
【详解】
A.镁跟氧气反应生成氧化镁,氧化镁的质量由“0”开始,逐渐增加,直至反应完全,氧化镁的质量不再增加,保持不变;而镁和氧气的质量逐渐减少,直到反应不再发生,若镁有剩余,则氧气的质量为“0”,或氧气有剩余,则镁的质量为“0”,若二者恰好反应,则均无剩余,其质量均为“0”。故A不正确;
B.向二氧化锰中加入过氧化氢溶液,随着过氧化氢溶液质量的增加,氧气的质量由“0”开始逐渐增加,故B正确;
C.向一定量铁粉和铜粉的混合物中加入硫酸铜溶液,其曲线应从纵坐标上一点开始,再随着硫酸铜溶液的加入,固体质量逐渐增加(因为Fe+CuSO4=Cu+FeSO4),直至反应不再发生,固体的质量不再改变,故C不正确;
D.等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应,镁生成的氢气质量应比铝少,故D不正确。
故选B。
17. 烧瓶 防止产生的气体从长颈漏斗中逸出 不能控制反应速率 85% 解:设5g稀盐酸中溶质的质量为x
答:原稀盐酸中溶质的质量分数为7.3%。
【解析】
【详解】
(1)实验室用大理石和稀盐酸反应制取二氧化碳,其反应的化学方程式为:。
(2)仪器A是可作为反应容器的烧瓶,故填烧瓶。
(3)图2装置中的长颈漏斗可添加液体试剂,制取二氧化碳时,为防止产生的气体从长颈漏斗中逸出,长颈漏斗的下端管口必须浸没在溶液中液封。
(4)图1和图3比较,图3可以通过分液漏斗控制液体滴加速度,从而控制反应速率。而图1装置无法控制反应速率。所以利用图1装置来制取二氧化碳时主要的不足是无法控制反应速率。
(5)①由题意可知,每加入5g稀盐酸,碳酸钙的质量消耗1.5g-1.0g=0.5g,第四次加入同样的盐酸固体剩余0.3g,则原石灰石样品为2g,其中碳酸钙的质量为2g-0.3g=1.7g,所以石灰石样品中碳酸钙的质量分数为 。
②见答案。
18. 2KClO32KCl + 3O2 ↑ 9.6g 1:1 98g
【解析】
【详解】
(1)氯酸钾在二氧化锰的催化作用下受热生成氯化钾和氧气,化学方程式为: 2KClO32KCl + 3O2 ↑;
(2)生成氧气的质量就是固态混合物减少的质量,第一次加热后收集到的氧气质量为:57g-47.4g=9.6克;
(3)根据题意可知,反应生成的氯化钾的质量=200g×14.9%=29.8g;
设两次总共参加反应的氯酸钾质量X
X=49g
(4)设第一次分解的氯酸钾的质量为y。
y=24.5g;
小明两次加热过程中,消耗氯酸钾的质量比=24.5g:(49g-24.5g)=1:1;
(5)设需加入水的质量是z。
溶液稀释过程中,溶质的质量不变,则有:
200g×14.9%=(200g+z)×10% z=98g,即需加入水的质量是98g。
19. 广口瓶 1--2 凹液面的最低处 腐蚀胶帽(合理即可) ③
【解析】
【详解】
(1)固体药品通常保存在广口瓶中,液体药品保存在细口瓶中;
(2)未说明用量时,液体药品一般取1-2mL,固体药品只需盖满试管底部即可,避免浪费;
(3)利用量筒读数时,视线与量筒内液体的凹液面的最低处保持水平;
(4)取液后,将胶头滴管平放后倒置,会使残余液体流至胶帽中,腐蚀胶帽;
(5)用托盘天平称量12.6g药品时,向左盘中加入药品后,发现指针向左偏转,说明药品添加过多,应该减少药品至天平平衡。
20. 在t℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g KNO3 B 25.9% 否
【解析】
【详解】
(1)P点为硝酸钾和氯化钠溶解度曲线的交点,因此P点的含义是在t℃时,氯化钠和硝酸钾的溶解度都是36.2g或者在t℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g;
故填:在t1℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g。
(2)20℃时,将硝酸钾、氯化钠固体各35g分别加入到100g水中,乙烧杯中固体全部溶解,甲烧杯固体还有部分未溶解,根据溶解度曲线可知20℃时,氯化钠的溶解度大于硝酸钾,因此烧杯甲中溶液的溶质是KNO3;
故填:KNO3。
(3)20℃时,氯化钠的溶解度为36g,而甲烧杯中是100g的水放了35g的氯化钠,因此没有达到饱和状态,故A错;图2中乙烧杯中还有部分固体未溶解,因此肯定是饱和溶液,故B对;图3中甲、乙烧杯中溶剂的质量都是100g,溶质的质量都是35g,因此溶质的质量分数都是一样的,故C错;
故填:B。
(4)图3中乙烧杯中溶剂的质量是100g,溶质的质量是35g,根据溶质的质量分数公式可知,w(KNO3)=×100%=25.9%;50℃时硝酸钾的溶解度是85.5g,则50g水中最多可以溶解42.75g,将烧杯乙蒸发掉50g水,则水有50g,硝酸钾有35g,因此还是不饱和状态。
故填:25.9% 否。
【点睛】
本题考查的是溶解度曲线的应用、溶液中溶质质量分数的计算。要准确理解溶解度的定义、溶液中溶质质量分数的计算式。
21. 隔绝氧气 CO2 + H2O = H2CO3 左边 20g BC 可行 t2℃时4g甲能溶解在10g水中形成溶液,而4g乙不能全部溶解在10g水中形成溶液 降温结晶
【解析】
【详解】
(1)①根据对照试验变量要唯一,实验A中铜片上的白磷和水里的白磷对照,探究燃烧是否需要氧气,所以热水的作用是提供热量和隔绝氧气;②实验B能说明CO2可溶于水,同时发生的化学反应方程式为CO2 + H2O = H2CO3;③硝酸铵固体溶于水要吸收热量,实验C,滴加水后锥形瓶中的气体温度降低,体积减小,瓶内压强较小,所以看到U型管中左边液面升高;(2)①从图像信息可知,t1℃时,甲的溶解度是20g;②A、没有指明温度,无法比较甲的溶解度比乙的溶解度;B、根据溶解度曲线的意义可知,t1℃时,甲、乙的溶解度相等,故它们的饱和溶液的溶质的质量分数相等;C、从图像信息可知,常温下,乙的溶解度大于10g,易溶于水 ,正确; D、没有指明是不是饱和溶液,错误。
22. Na+ 2Na+Cl22NaCl 4.5 称量时砝码和试剂放反了,量取水时仰视读数,溶解前用蒸馏水润洗了烧杯 用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的Ph 2NaHCO3 Na2CO3+H2O+CO2↑ 4.6kg
【解析】
【分析】
(1)根据钠原子的结构图进行分析;
(2)根据钠和氯气会生成氯化钠进行分析.
(3)根据溶质质量=溶液质量×溶质质量分数进行分析;根据俯视读数会使读出的数据大于实际数据进行分析;
(4)根据测定溶液pH的方法判断,使用pH试纸测定溶液pH,测定时,用玻璃棒蘸取待测溶液,滴在试纸上,然后再与标准比色卡对照,便可测出溶液的pH;
(5)根据碳酸氢钠受热后的产物进行分析,
(6)根据在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛,然后结合题中的数据进行解答.
【详解】
(1)钠元素的最外层有1个电子,容易失去电子,形成钠离子Na+;
(2)钠和氯气在点燃的条件下生成氯化钠,故答案为2Na+Cl22NaCl;
(3)氯化钠的质量为:500mL×1g/mL×0.9%=4.5g,小明同学配制的氯化钠溶液质量分数偏小了,可能是称量时砝码和试剂放反了,量取水时仰视读数,溶解前用蒸馏水润洗了烧杯;
(4)测定溶液酸碱度的方法:用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
(5)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:
2NaHCO3Na2CO3+H2O+CO2↑;
(6)设理论上需要钠的质量是x,则
所以制取2.4kg钛,理论上需要钠的质量是4.6kg。
【点睛】
本题主要考查了钠的相关知识,难度不大,需要认真审题即可完成解答.掌握正确的实验操作是保证实验安全与成功的重要手段,了解实验的注意事项是解答本题的关键.
答案第1页,共2页
答案第1页,共2页
一、单选题
1.如图为甲、乙两物质的溶解度曲线,下列说法正确的是
A.甲、乙两物质均属于难溶物质
B.甲物质的溶解度大于乙物质的溶解度
C.t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等
D.t2℃时,甲物质饱和溶液的溶质质量分数为50%
2.向l00g10%NaOH溶液中加入12.5gNaOH固体,完全溶解后.所得溶液中溶质质量分数为
A.12. 5% B.20.0% C.22.5% D.25%
3.向200 g溶质质量分数为10%的蔗糖溶液中加入200 g水,搅拌后把所得溶液倒掉一半后,剩余的溶液溶质质量分数为
A.10% B.5% C.2.5% D.0.5%
4.高氯酸钾( KClO4 ) 可用作火箭推进剂, 其溶解度如下表。下列说法不正确的是
温度 /℃ 20 40 60 80
溶解度 /g 1.68 3.73 7.3 13.4
A.高氯酸钾的溶解度随温度降低而减小
B.20℃时, 将 2g 高氯酸钾溶于 98g 水中, 所得溶液中溶质的质量分数小于 2%
C.60℃时, 高氯酸钾饱和溶液中溶质的质量分数小于 7.3%
D.80℃的高氯酸钾溶液冷却至 40℃肯定有晶体析出
5.关于100g10%的硝酸钾溶液,下列叙述正确的是
A.100g水中溶有10g硝酸钾
B.溶液中硝酸钾与水的质量比为1:10
C.将硝酸钾和水按9:1的质量比配成的溶液
D.将10g硝酸钾溶于90g水中,可制得该溶液
6.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是
A.t1 ℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲
B.t2 ℃时,20 g丙溶解于50 g水中能形成70 g溶液
C.分别将三种物质的饱和溶液从t3 ℃降温至t2 ℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
7.已知FeCl3也可以催化H2O2的分解,现向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,充分反应(忽略水的挥发).下列图象正确的是( )
A. B.
C. D.
8.下图是甲、乙两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.a1℃时,甲、乙饱和溶液的温度升温至a2℃时,均有固体析出
C.a2℃时,M点对应的甲溶液不饱和
D.a2℃时,乙饱和溶液的质量分数为20%
9.根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成如图中斜线.下列说法正确是( )
A.该物质的溶解度随温度的升高而增大
B.t℃时该物质的溶解度为40
C.G点表示溶液中溶质的质量分数为20%
D.图中4个点表示的溶液中溶质质量分数的关系是:G<m<w=z
10.下列关于溶液的说法正确的是
A.溶液一定是无色透明的
B.溶液一定是均一的、稳定的混合物
C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
D.将40g溶质质量分数为20%的氯化钠溶液倒出20g,剩余溶液溶质质量分数为10%
11.如图所示图像中,能正确反映对应变化关系的是( )
A B C D
向饱和石灰水中加入一定量CaO 一定温下,向不饱和硝酸钾溶液中加入硝酸钾固体 一定质量的红磷在密闭容器内燃烧 电解水生成氢气和氧气质量
A.A B.B C.C D.D
12.20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,充分搅拌后现象如图甲,升温到50℃时,现象如图乙,a、b两种固体的溶解度曲线如图丙。下列说法正确的是
A.图丙中M表示b的溶解度曲线
B.图甲溶液中溶质的质量分数a大于b
C.图乙中a、b溶液一定是不饱和溶液
D.30℃时a、b溶液溶质质量分数不相等
13.潍坊有丰富的海洋资源,氯化钠占整个海洋盐类的80%以上。下列有关氯化钠的说法正确的是
A.室温下的氯化钠饱和溶液不能再溶解氯化钾
B.取出部分上层清液,可将接近饱和的氯化钠溶液变为饱和
C.可用硝酸银溶液鉴别氯化钠和氯化镁溶液
D.将100g质量分数为20%的氯化钠溶液稀释为10%,所用的仪器有:烧杯、量筒、玻璃棒和胶头滴管
14.20℃时,氯化钠(NaCl)溶解于水的实验数据如表所示,则下列叙述正确的是( )
实验序号 水的质量(g) 加入NaCl的质量(g) 溶液的质量(g)
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.①所得溶液的溶质质量分数为20%
B.②所得溶液是饱和溶液
C.20℃时,氯化钠的溶解度是36g/100g水
D.③④溶液的溶质质量分数不相等
15.下列四个图象,能正确反映对应实验操作的是( )
A.加热一定质量的氯酸钾和二氧化锰的混合物
B.等质量的Mg、Al、Zn分别与足量稀盐酸反应
C.足量的Mg、Zn、Fe与等质量等浓度的稀硫酸反应
D.某温度时,向一定质量的饱和石灰水中加入少量生石灰
16.下面所示的四个图像,能正确反映对应变化关系的是
A.镁在氧气中燃烧
B.向二氧化锰中加入过氧化氢溶液
C.向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液
D.等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
二、综合应用题
17.下列三套装置都能用于实验室制取二氧化碳
(1)写出实验室制取二氧化碳的化学方程式: ____________________ ,
(2)仪器A的名称是 __________________
(3)利用图2装取制取二氧化碳时,长颈漏斗的下端管口必须浸没在溶液中,理由是 _____________ ,
(4)图1和图3装置相比.利用图1装置来制取二氧化碳,时主要的不足是 _______ (写一条即可)
(5)化学兴趣小组为了测定石灰石样品中碳酸钙的质量分数,取一定量的石灰石样品,将20g稀盐酸分4次加人样品中(样品中除碳酸钙外,其余成分不与盐酸反应,也不溶 于水).充分反应后经过过滤、千操等操作,最后称量,数据如下表
稀盐酸的用量 剩余固体的质量
第一次加入5g 1.5g
第二次加入5g 1.0g
第三次加入5g 0.5g
第四次加入5g 0.3g
①石灰石样品中碳酸钙的质量分数为 _________________
②原稀盐酸中溶质的质量分数为 ________ (写出计算过程)
18.小明在实验室加热57g氯酸钾和二氧化锰的混合物一段时间后,剩余固体的质量为47.4g。小明继续加热剩余固体至完全反应,又收集到一些氧气。为了回收催化剂,进行了如图所示实验:
请回答下列问题:
(1)实验过程中发生反应的化学方程式为____________________________________;
(2)第一次加热后收集到的氧气质量为______________________________________;
(3)列出求解两次总共参加反应的氯酸钾质量X的比例式_____________________;
(4)小明两次加热过程中,消耗氯酸钾的质量比为____________________________;
(5)如将所得溶液制成溶质质量分数为10%的溶液,需加入水的质量是__________。
19.掌握仪器的使用方法并严格按照操作要求进行实验,才能保障实验的成功和安全。根据所学化学知识,回答下列问题:
(1)固体药品通常保存在____________里(填仪器名称)。
(2)实验室取用药品要注意节约,如果没有说明用量,一般应该取用最少量,液体药品取用_____mL。
(3)利用量筒读数时,视线与量筒内液体的___________________保持水平。
(4)取液后的滴管,平放或倒置可能造成的后果是__________________ (答一点即可)。
(5)用托盘天平称量12.6g药品时,向左盘中加入药品后,发现指针向左偏转,应进行的操作是________(填序号)
①右边的平衡螺母向右调至天平平衡
②移动游码至天平平衡
③左盘中减少药品至天平平衡
④左盘中添加药品至天平平衡
20.硝酸钾、氯化钠固体溶解度曲线如图1所示。20℃时,将硝酸钾、氯化钠固体各35g分别加入到100g水中,充分搅拌后现象如图2所示,加热到50℃时现象如图3所示(不考虑水分蒸发)。
(1)图1中P点含义是________
(2)图2中烧杯甲中溶液的溶质是________(填化学式)。
(3)下列说法正确的是________(填标号)。
A图2烧杯甲中的溶液是饱和溶液
B图2烧杯乙中的溶液为饱和溶液
C.图3烧杯甲中溶液质量比烧杯乙中溶液质量大
(4)图3烧杯乙溶液中溶质的质量分数是________(结果保留一位小数),为使该溶液转化成饱和溶液,将溶液恒温蒸发50g水,是否可行_____(填“是”或“否”)。
21.(人类的日常生活和工农业生产离不开水和溶液。请回答下列问题:
(1)如下图所示,三个实验分别用到水。
请回答:
①实验A中热水的作用是提供热量和_________。
②实验B能说明CO2可溶于水,同时发生的化学反应方程式为_________。
③实验C,滴加水后看到U型管中_________(填“左边”或“右边”)液面升高。(2)如下图是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
①t1℃时,甲的溶解度是_________。
②下列说法一定正确的是 _________
A.甲的溶解度比乙的溶解度大 B.t1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C.常温下,乙易溶于水 D.从t2℃降至t1℃,甲、乙溶液中均有晶体析出
③某同学设计的鉴别甲、乙固体的方案如下:t2℃时,取4.0g甲和4.0g乙分别放入两只小烧杯中,各加入10mL水(水的密度为1g/mL),用玻璃棒充分搅拌后,观察现象。你认为此方案______﹙“是”还是“否”﹚可行 并说明由_________。
④甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓缩,_________,然后过滤。
22.钠及其化合物是中学化学学习和研究的重要内容.
(1)如图1是钠的原子结构示意图,钠在反应中失电子后形成离子的符号是_____.
(2)钠在氯气中燃烧生成氯化钠,化学方程式为_____.
(3)配制一瓶符合如图2所示的氯化钠溶液,需氯化钠_____g;小明同学配制的氯化钠溶液质量分数偏小了,请写出他操作中可能出现的错误(提示:1g以下用游码,至少答出两点)_____.
(4)如何测定一瓶苏打水的酸碱度(写出实验操作步骤)_____.
(5)小苏打受热分解生成碳酸钠、二氧化碳和水,化学方程式为_____.
(6)钛和钛合金性能优良,广泛用于航空、造船和化学工作中.工业上常用钠来制取钛,在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛.若用该方法制取2.4kg钛,理论上需要钠的质量是多少_____?
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【解析】
【详解】
A、通过分析溶解度曲线可知,在10℃时,甲、乙物质的溶解度大于10g,所以甲、乙两物质均属于易溶物质,故A错误;
B、在比较物质的溶解度时,需要指明温度,故B错误;
C、t1℃时,甲、乙两物质的溶解度相等,所以饱和溶液的溶质质量分数相等,故C正确;
D、t2℃时,甲的溶解度是50g,所以甲饱和溶液的溶质质量分数=,故D错误。故选C。
2.B
【解析】
【详解】
所得溶液中溶质质量分数=(100g×10%+12.5g )/(100g+12.5g0 ×100%=20%
故选B
3.B
【解析】
【详解】
根据溶液稀释前后,溶质质量相等。向200g溶质质量分数为10%的蔗糖溶液中加入200g水,搅拌后把所得溶液倒掉一半后,剩余的溶液溶质质量分数为
200g×10%=﹙200g+200g﹚×x,x=5%.
4.D
【解析】
【详解】
A、由表格信息可知高氯酸钾的溶解度随温度降低而减小,正确;B、20℃时, 高氯酸钾的溶解度为1.68g,即该温度时,1.68g高氯酸钾溶解在100g水恰好形成饱和溶液,那么2g 高氯酸钾加入 98g 水中,高氯酸钾不能完全溶解,故所得溶液中溶质的质量分数小于 2%,正确;C、60℃时, 高氯酸钾的溶解度为7.3g,溶质的质量分数= 6.8%,即60℃时, 高氯酸钾饱和溶液中溶质的质量分数为6.8%,正确;D、80℃的高氯酸钾饱和溶液冷却至 40℃肯定有晶体析出,若是不饱和溶液那么不一定有晶体析出,错误。故选D。
5.D
【解析】
【详解】
A.表示100g硝酸钾溶液中溶有10g硝酸钾,选项说法错误;
B.该溶液中,硝酸钾与水的质量比为:10%:90%=1:9,选项说法错误;
C.将硝酸钾和水按1:9的质量比配成的溶液,选项说法错误;
D.将10g硝酸钾溶于90g水中,可制得100g10%的硝酸钾溶液,选项说法正确。
故选:D。
6.D
【解析】
【详解】
A、t1℃时,甲的溶解度小于丙的溶解度,等质量的甲、丙饱和溶液中所含溶质的质量分数为丙>甲,但此题不知溶液是否饱和,故错误;
B、t2℃时,丙的溶解度是30g,将20g丙加入到50g水中只溶解15g,充分搅拌后,所形成溶液的质量=15g+50g=65g;故错误;
C、甲、乙物质的溶解度随温度的升高而增大,丙物质的溶解度随温度的升高而减小,t3℃时,甲、乙、丙三种物质的饱和溶液降温到t2℃时,乙物质的溶解度最大,甲次之,丙物质应该是t3℃时的溶解度,所以所得的溶液中溶质的质量分数的大小关系为乙>甲>丙,故错误;
D、甲物质的溶解度随温度的升高而增大,所以要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂或添加溶质的方法,故正确。故选D。
7.B
【解析】
【详解】
A、向一定量的H2O2溶液中滴入几滴一定溶质质量分数的FeCl3溶液,过氧化氢分解为氧气和水,完全反应后,氧气质量不再变化,错误;
B、过氧化氢分解为氧气和水,溶剂质量增加,完全反应后,溶剂质量不再变化,正确;
C、过氧化氢分解为氧气和水,过氧化氢的质量分数减小,完全反应后,过氧化氢的质量为0,质量分数为0,错误;
D、FeCl3是催化剂,反应前后质量不变,过氧化氢分解为氧气和水,溶液质量减小,FeCl3的质量分数变大,错误。故选B。
8.C
【解析】
【详解】
A、比较溶解度的大小要指明温度,错误;
B、甲的溶解度随温度的升高而增大,乙的溶解度随温度的升高而减小,故a1℃时,甲、乙饱和溶液的温度升温至a2℃时,乙中有固体析出,甲中没有,错误;
C、溶解度曲线上的点对应的是该温度下的饱和溶液,曲线下方的点表示的是该温度下的不饱和溶液,故a2℃时,M点对应的甲溶液不饱和,正确;
D、a2℃时,乙的溶解度为20g,那么它的饱和溶液的溶质质量分数=16.7%,错误。
故选C。
9.D
【解析】
【分析】
饱和溶液的质量分数=×100%
【详解】
A、该图示是溶剂和溶质的质量,没有说溶解度,所以不能说该物质的溶解度随温度的升高而增大,故A错;
B、溶解度单位是克,少了单位,故B错;
C、G点表示溶液中溶质的质量分数为:×100%=16.67%,故C错;
D、G和m的区别是G中有100g水,m中有80g水,溶质相同都是20g,所以G中溶质质量分数要小于m中质量分数,G都是m该温度下的不饱和溶液,w和z都在曲线上,都属于饱和溶液,温度没变,溶解度就不变,所以w和z溶质质量分数相同,因为在同一温度,同一溶质饱和溶液的质量分数最大,所以图中4个点表示的溶液中溶质质量分数的关系是:G<m<w=z,故D正确,故选D。
10.B
【解析】
【详解】
A、溶液不一定是无色、透明的,如硫酸铜溶液是蓝色,选项说法错误;
B、溶液一定是均一、稳定的混合物,选项说法正确;
C、饱和溶液针对的是溶液的状态,浓、稀针对的是溶液的溶质质量质量分数,所以饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液,选项说法错误;
D、将40g溶质质量分数为20%的氯化钠溶液倒出20g,剩余溶液溶质质量分数应为20%,溶液具有均一性,选项说法错误。
故选B。
11.A
【解析】
【详解】
A、向饱和石灰水中加入少量的生石灰,生石灰和水反应生成氢氧化钙,该反应放出热量,溶液温度升高,氢氧化钙的溶解度随温度的升高而减小,随后随着温度的下降,氢氧化钙的溶解度又变大,恢复到常温保持不变,能正确反映对应变化关系;
B、根据饱和溶液的定义可以知道温度不变,向不饱和硝酸钾溶液中加入硝酸钾至饱和后,溶液质量不再改变,但是由于是向不饱和硝酸钾溶液中加入硝酸钾,所以溶液的质量一开始不会是0,不能正确反映对应变化关系;
C、磷在氧气中燃烧生成五氧化二磷,根据质量守恒定律,密闭容器内物质总质量不变,不能正确反映对应变化关系;
D、通电分解水时产生氢气的体积是氧气的二倍,不能正确反映对应变化关系。故选A。
12.C
【解析】
【详解】
A、由甲图可知,20℃时a的溶解度小于b的溶解度,故M表示的是a的溶解度曲线,N表示的是b的溶解度曲线,选项A错误;
B、20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,a中有固体剩余,b完全溶解,说明此时b的溶质质量分数大于a的溶质质量分数,选项B错误;
C、20℃时,将等质量的a、b两种固体,分别加入到盛有l00g水的烧杯中,a中有固体剩余,那么得到的是该温度下的饱和溶液;b中完全溶解,那么可能是饱和溶液,也可能是不饱和溶液;升温到50℃时,a和b中均没有固体剩余,ab的溶解度均大于20℃时b的溶解度,所以ab一定是不饱和溶液,选项C正确;
D、30℃时a、b的溶解度相等,那么等质量的a、b两种固体,分别加入到盛有l00g水中所得溶液的溶质质量分数相等,选项D错误。故选C。
13.D
【解析】
【详解】
A.饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。室温下的氯化钠饱和溶液不能再溶解氯化钠,但能溶解其它的可溶物质;B.溶液是均一的,溶液各处的组成和性质完全相同,取出部分上层清液,不能改变溶液的状态;C.硝酸银溶液与氯化钠和氯化镁溶液都能生成氯化银白色沉淀;D.将100g质量分数为20%的氯化钠溶液稀释为10%,需要量取100mL水,并与原溶液充分混合,所用的仪器有:烧杯、量筒、玻璃棒和胶头滴管;选D
14.C
【解析】
【详解】
A、①所得溶液的溶质质量分数为100%<20%,故选项说法错误。
B、20℃时,氯化钠(NaCl)溶解于水的实验数据,10g水中最多能溶解能形成氯化钠溶液13.6g,②所得溶液是不饱和溶液,故选项说法错误。
C、溶解度是在一定温度下,某固体溶质在100g溶剂里达到饱和状态所溶解的溶质质量,20℃时,10g水中最多能溶解能形成氯化钠溶液13.6g,溶解的溶质质量为13.6g﹣10g=3.6g,20℃时,氯化钠的溶解度是36g/100g水,故选项说法正确。
D、③④均为该温度下的饱和溶液,③④溶液的溶质质量分数相等,故选项说法错误。
故选:C。
15.C
【解析】
【详解】
A、二氧化锰做催化剂,质量不变,但是加热氯酸钾生成氧气所以二氧化锰的质量分数会增大,A错误;
B、根据,,可知,产生等质量的氢气,消耗金属的质量锌>铁>铝;等质量铝、铁、锌分别和足量稀盐酸反应,若消耗盐酸相同,则生成氢气质量相同,故开始三斜线重合,后因盐酸过量,产生氢气的质量铝>铁>锌,生成氢气多,拐点高些,故选项B图象不能正确反映对应变化关系;
C、足量的Zn、Mg、Fe与等质量等浓度的硫酸反应时,生成的氢气质量相等,由于金属的活动性镁>锌>铁,斜线的斜率应是k(Mg)>k(Zn)>k(Fe),故C正确;
D、向饱和石灰水中加入少量生石灰,由于氧化钙与水反应放热,溶液中溶剂质量减少,最终溶液中溶质质量少于开始时的溶质质量,故D错误。
故选C。
16.B
【解析】
【详解】
A.镁跟氧气反应生成氧化镁,氧化镁的质量由“0”开始,逐渐增加,直至反应完全,氧化镁的质量不再增加,保持不变;而镁和氧气的质量逐渐减少,直到反应不再发生,若镁有剩余,则氧气的质量为“0”,或氧气有剩余,则镁的质量为“0”,若二者恰好反应,则均无剩余,其质量均为“0”。故A不正确;
B.向二氧化锰中加入过氧化氢溶液,随着过氧化氢溶液质量的增加,氧气的质量由“0”开始逐渐增加,故B正确;
C.向一定量铁粉和铜粉的混合物中加入硫酸铜溶液,其曲线应从纵坐标上一点开始,再随着硫酸铜溶液的加入,固体质量逐渐增加(因为Fe+CuSO4=Cu+FeSO4),直至反应不再发生,固体的质量不再改变,故C不正确;
D.等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应,镁生成的氢气质量应比铝少,故D不正确。
故选B。
17. 烧瓶 防止产生的气体从长颈漏斗中逸出 不能控制反应速率 85% 解:设5g稀盐酸中溶质的质量为x
答:原稀盐酸中溶质的质量分数为7.3%。
【解析】
【详解】
(1)实验室用大理石和稀盐酸反应制取二氧化碳,其反应的化学方程式为:。
(2)仪器A是可作为反应容器的烧瓶,故填烧瓶。
(3)图2装置中的长颈漏斗可添加液体试剂,制取二氧化碳时,为防止产生的气体从长颈漏斗中逸出,长颈漏斗的下端管口必须浸没在溶液中液封。
(4)图1和图3比较,图3可以通过分液漏斗控制液体滴加速度,从而控制反应速率。而图1装置无法控制反应速率。所以利用图1装置来制取二氧化碳时主要的不足是无法控制反应速率。
(5)①由题意可知,每加入5g稀盐酸,碳酸钙的质量消耗1.5g-1.0g=0.5g,第四次加入同样的盐酸固体剩余0.3g,则原石灰石样品为2g,其中碳酸钙的质量为2g-0.3g=1.7g,所以石灰石样品中碳酸钙的质量分数为 。
②见答案。
18. 2KClO32KCl + 3O2 ↑ 9.6g 1:1 98g
【解析】
【详解】
(1)氯酸钾在二氧化锰的催化作用下受热生成氯化钾和氧气,化学方程式为: 2KClO32KCl + 3O2 ↑;
(2)生成氧气的质量就是固态混合物减少的质量,第一次加热后收集到的氧气质量为:57g-47.4g=9.6克;
(3)根据题意可知,反应生成的氯化钾的质量=200g×14.9%=29.8g;
设两次总共参加反应的氯酸钾质量X
X=49g
(4)设第一次分解的氯酸钾的质量为y。
y=24.5g;
小明两次加热过程中,消耗氯酸钾的质量比=24.5g:(49g-24.5g)=1:1;
(5)设需加入水的质量是z。
溶液稀释过程中,溶质的质量不变,则有:
200g×14.9%=(200g+z)×10% z=98g,即需加入水的质量是98g。
19. 广口瓶 1--2 凹液面的最低处 腐蚀胶帽(合理即可) ③
【解析】
【详解】
(1)固体药品通常保存在广口瓶中,液体药品保存在细口瓶中;
(2)未说明用量时,液体药品一般取1-2mL,固体药品只需盖满试管底部即可,避免浪费;
(3)利用量筒读数时,视线与量筒内液体的凹液面的最低处保持水平;
(4)取液后,将胶头滴管平放后倒置,会使残余液体流至胶帽中,腐蚀胶帽;
(5)用托盘天平称量12.6g药品时,向左盘中加入药品后,发现指针向左偏转,说明药品添加过多,应该减少药品至天平平衡。
20. 在t℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g KNO3 B 25.9% 否
【解析】
【详解】
(1)P点为硝酸钾和氯化钠溶解度曲线的交点,因此P点的含义是在t℃时,氯化钠和硝酸钾的溶解度都是36.2g或者在t℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g;
故填:在t1℃时,氯化钠和硝酸钾的溶解度相等,都是36.2g。
(2)20℃时,将硝酸钾、氯化钠固体各35g分别加入到100g水中,乙烧杯中固体全部溶解,甲烧杯固体还有部分未溶解,根据溶解度曲线可知20℃时,氯化钠的溶解度大于硝酸钾,因此烧杯甲中溶液的溶质是KNO3;
故填:KNO3。
(3)20℃时,氯化钠的溶解度为36g,而甲烧杯中是100g的水放了35g的氯化钠,因此没有达到饱和状态,故A错;图2中乙烧杯中还有部分固体未溶解,因此肯定是饱和溶液,故B对;图3中甲、乙烧杯中溶剂的质量都是100g,溶质的质量都是35g,因此溶质的质量分数都是一样的,故C错;
故填:B。
(4)图3中乙烧杯中溶剂的质量是100g,溶质的质量是35g,根据溶质的质量分数公式可知,w(KNO3)=×100%=25.9%;50℃时硝酸钾的溶解度是85.5g,则50g水中最多可以溶解42.75g,将烧杯乙蒸发掉50g水,则水有50g,硝酸钾有35g,因此还是不饱和状态。
故填:25.9% 否。
【点睛】
本题考查的是溶解度曲线的应用、溶液中溶质质量分数的计算。要准确理解溶解度的定义、溶液中溶质质量分数的计算式。
21. 隔绝氧气 CO2 + H2O = H2CO3 左边 20g BC 可行 t2℃时4g甲能溶解在10g水中形成溶液,而4g乙不能全部溶解在10g水中形成溶液 降温结晶
【解析】
【详解】
(1)①根据对照试验变量要唯一,实验A中铜片上的白磷和水里的白磷对照,探究燃烧是否需要氧气,所以热水的作用是提供热量和隔绝氧气;②实验B能说明CO2可溶于水,同时发生的化学反应方程式为CO2 + H2O = H2CO3;③硝酸铵固体溶于水要吸收热量,实验C,滴加水后锥形瓶中的气体温度降低,体积减小,瓶内压强较小,所以看到U型管中左边液面升高;(2)①从图像信息可知,t1℃时,甲的溶解度是20g;②A、没有指明温度,无法比较甲的溶解度比乙的溶解度;B、根据溶解度曲线的意义可知,t1℃时,甲、乙的溶解度相等,故它们的饱和溶液的溶质的质量分数相等;C、从图像信息可知,常温下,乙的溶解度大于10g,易溶于水 ,正确; D、没有指明是不是饱和溶液,错误。
22. Na+ 2Na+Cl22NaCl 4.5 称量时砝码和试剂放反了,量取水时仰视读数,溶解前用蒸馏水润洗了烧杯 用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的Ph 2NaHCO3 Na2CO3+H2O+CO2↑ 4.6kg
【解析】
【分析】
(1)根据钠原子的结构图进行分析;
(2)根据钠和氯气会生成氯化钠进行分析.
(3)根据溶质质量=溶液质量×溶质质量分数进行分析;根据俯视读数会使读出的数据大于实际数据进行分析;
(4)根据测定溶液pH的方法判断,使用pH试纸测定溶液pH,测定时,用玻璃棒蘸取待测溶液,滴在试纸上,然后再与标准比色卡对照,便可测出溶液的pH;
(5)根据碳酸氢钠受热后的产物进行分析,
(6)根据在高温时,钠与四氯化钛(TiCl4)反应生成氯化钠和钛,然后结合题中的数据进行解答.
【详解】
(1)钠元素的最外层有1个电子,容易失去电子,形成钠离子Na+;
(2)钠和氯气在点燃的条件下生成氯化钠,故答案为2Na+Cl22NaCl;
(3)氯化钠的质量为:500mL×1g/mL×0.9%=4.5g,小明同学配制的氯化钠溶液质量分数偏小了,可能是称量时砝码和试剂放反了,量取水时仰视读数,溶解前用蒸馏水润洗了烧杯;
(4)测定溶液酸碱度的方法:用干燥的玻璃棒蘸取(或胶头滴管吸取)少量的待测溶液,并滴在放在干燥的玻璃皿或白瓷板上的干燥pH试纸上,再把试纸显示的颜色与标准比色卡比较,即可得出待测溶液的pH;
(5)碳酸氢钠在加热的条件下生成碳酸钠、水和二氧化碳,化学方程式为:
2NaHCO3Na2CO3+H2O+CO2↑;
(6)设理论上需要钠的质量是x,则
所以制取2.4kg钛,理论上需要钠的质量是4.6kg。
【点睛】
本题主要考查了钠的相关知识,难度不大,需要认真审题即可完成解答.掌握正确的实验操作是保证实验安全与成功的重要手段,了解实验的注意事项是解答本题的关键.
答案第1页,共2页
答案第1页,共2页
