第十单元课题2酸和碱的中和反应课后练习-2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 第十单元课题2酸和碱的中和反应课后练习-2021-2022学年九年级化学人教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 111.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-19 19:29:47 | ||
图片预览


文档简介
2021——2022学年度人教版九年级化学下册 第十单元 酸和碱
课题2 酸和碱的中和反应 课后练习
一、选择题
1.下列有关教材实验的说法正确的是
A.在测定空气中氧气含量实验中,燃烧匙中红磷的量越多,最后水位上升越高
B.在加热高锰酸钾制取氧气实验中,试管口应略向下倾斜,以防止生成冷凝水
C.实验室利用大理石和稀盐酸制取二氧化碳并用久置澄清石灰水检验生成的气体,若澄清石灰水始终未变浑浊,则一定是二氧化碳气体中混有氯化氢气体所致
D.在氢氧化钠溶液+酚酞+逐滴滴加过量的稀盐酸实验中,若将试剂添加顺序改为:稀盐酸+酚酞+逐滴滴加过量的氢氧化钠溶液,也可以达到证明氢氧化钠溶液和稀盐酸发生了化学反应的目的
2.化学方程式是重要的“化学语言”。下列化学方程式与文字表述均正确的是
A.用氢氧化铝治疗胃酸过多:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
B.用稀盐酸除去铁锈:Fe2O3+4HCl=2FeCl2+2H2O
C.铁丝在氧气中燃烧:3Fe+2O2Fe3O4
D.加热氯酸钾制取氧气:2KClO3=2KCl+3O2↑
3.某同学想用pH试纸测定一些物质的pH,下列做法能达到实验目的的是
A.用湿润的pH试纸测定稀硫酸的pH B.用干燥的pH试纸测定二氧化碳气体的pH
C.用干燥的pH试纸测定浓硫酸的pH D.用干燥的pH试纸测定氢氧化钠稀溶液的pH
4.苯甲酸(C6H5COOH)是一种酸,可用于食品防腐,下列说法正确的是
A.苯甲酸能使湿润的紫色石蕊试液变蓝 B.苯甲酸能和铜反应产生氢气
C.苯甲酸能与氢氧化钠溶液反应生成盐和水 D.在食品中可以大量添加苯甲酸以延长保质期
5. S2-、SO32-和SO42-是比较常见的离子。对这三种离子的认识正确的是
A.三种离子中都含有硫元素 B.SO32-和SO42-都属于氧化物
C.硫元素在化合物中的化合价有-2、+4、+6 D.S2-和H+不能结合成酸分子
6.在NaCl和HCl的混合溶液中,逐滴加入NaOH溶液至过量。下列图象正确的是
A. B. C. D.
7.已知:物质X与Ca(OH)2在水溶液中能发生反应,反应的化学方程式如下:X+Ca(OH)2=Y+Cu(OH)2↓下列分析错误的是( )
A.X肯定不可能是酸 B.X和Y的相对分子质量之差为24
C.X可能是单质,也可能是化合物 D.Y可以是CaCl2或Ca(NO3)2
8.下列关于混合物提纯的方法正确的是
A.除去二氧化碳中混有的少量氯化氢——将气体通入氢氧化钠溶液
B.除去生石灰中混有的少量碳酸钙——将混合物溶于水后过滤
C.除去硝酸钾固体中含有的少量氯化钠——将混合物溶于水后蒸发结晶
D.除去铜粉中混有的少量氧化铜——加入适量稀盐酸充分反应后过滤
9.有些化学变化可以用X+Y=M+R表示.关于此类变化,下列说法正确的是
A.若X是单质,则该反应一定是置换反应 B.若Y为金属,则该反应一定生成氢气
C.若X为酸,Y为碱,则该反应一定是中和反应 D.若X为盐,Y为碱,则该反应一定能够生成沉淀
10.向一定量的碳酸氢钠和氯化钠的混合溶液中加入稀盐酸溶液至过量,某变量 y随x的变化趋势如下图所示。若x表示稀盐酸的质量,则y表示的含义是
A.氯化钠的质量 B.溶液的总质量
C.二氧化碳的质量 D.溶液中钠元素的质量
11.某溶液由氯化钾溶液、稀盐酸、稀硫酸、和氯化铜中一一种若几种混合而成,现向该混合液中滴入Ba(OH)2溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示.则下列判断正确的是( )
A.肯定含有HCl B.肯定有H2SO4 C.CuCl2不能确定 D.肯定没有KCl
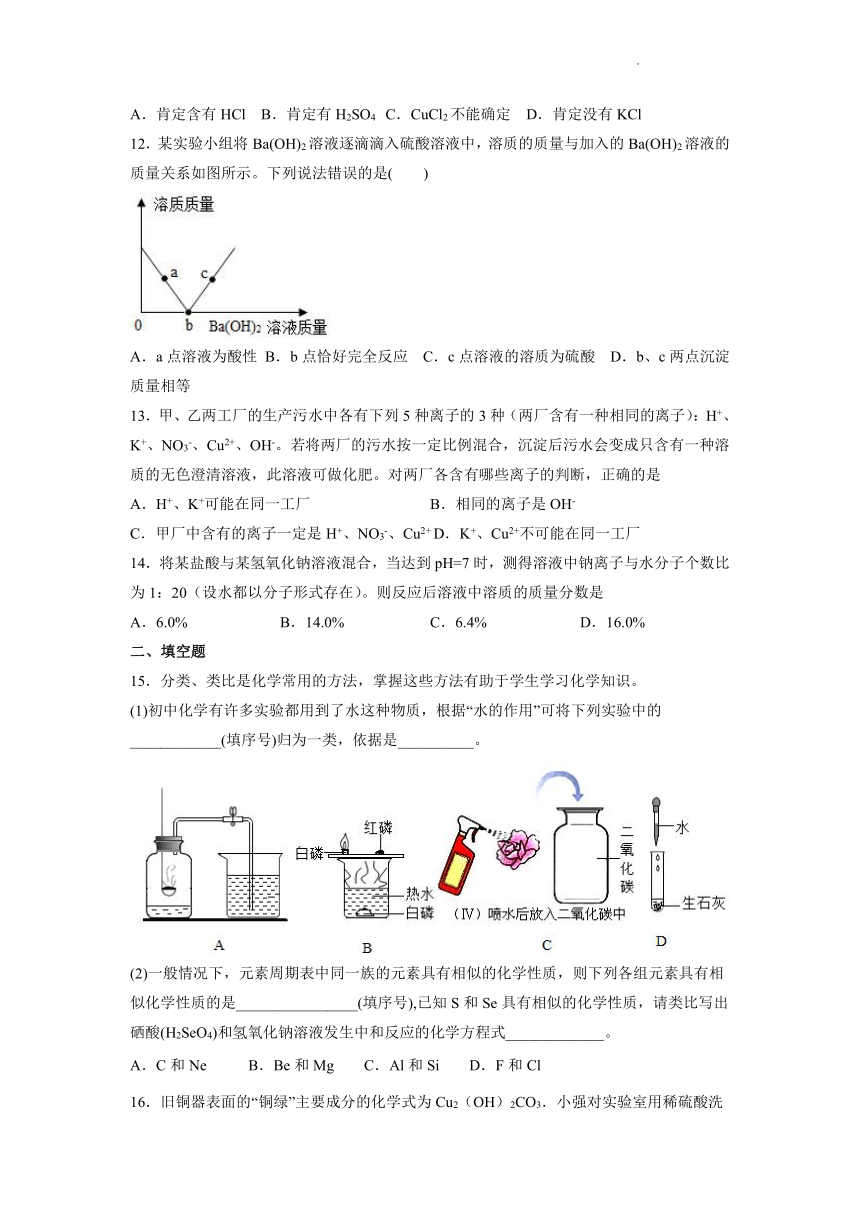
12.某实验小组将Ba(OH)2溶液逐滴滴入硫酸溶液中,溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示。下列说法错误的是( )
A.a点溶液为酸性 B.b点恰好完全反应 C.c点溶液的溶质为硫酸 D.b、c两点沉淀质量相等
13.甲、乙两工厂的生产污水中各有下列5种离子的3种(两厂含有一种相同的离子):H+、K+、NO3-、Cu2+、OH-。若将两厂的污水按一定比例混合,沉淀后污水会变成只含有一种溶质的无色澄清溶液,此溶液可做化肥。对两厂各含有哪些离子的判断,正确的是
A.H+、K+可能在同一工厂 B.相同的离子是OH-
C.甲厂中含有的离子一定是H+、NO3-、Cu2+ D.K+、Cu2+不可能在同一工厂
14.将某盐酸与某氢氧化钠溶液混合,当达到pH=7时,测得溶液中钠离子与水分子个数比为1:20(设水都以分子形式存在)。则反应后溶液中溶质的质量分数是
A.6.0% B.14.0% C.6.4% D.16.0%
二、填空题
15.分类、类比是化学常用的方法,掌握这些方法有助于学生学习化学知识。
(1)初中化学有许多实验都用到了水这种物质,根据“水的作用”可将下列实验中的____________(填序号)归为一类,依据是__________。
(2)一般情况下,元素周期表中同一族的元素具有相似的化学性质,则下列各组元素具有相似化学性质的是________________(填序号),已知S和Se具有相似的化学性质,请类比写出硒酸(H2SeO4)和氢氧化钠溶液发生中和反应的化学方程式_____________。
A.C和Ne B.Be和Mg C.Al和Si D.F和Cl
16.旧铜器表面的“铜绿”主要成分的化学式为Cu2(OH)2CO3.小强对实验室用稀硫酸洗去“铜绿”所形成的废液进行实验:
(1)观察废液呈____色。测量废液的pH=1,说明废液中还含有____。
(2)取废液滴加到澄清石灰水中,能观察到的现象是____,溶液中发生反应的化学方程式为(写一个)____。
17.某化学小组用一定量 AgNO3 和 Cu(NO3)2 的混合溶液进行了如图实验,已知溶液甲呈蓝色。
(1)向固体乙上滴加盐酸时_____(填“有”或“没有”)气泡产生。
(2)原混合溶液的质量比溶液甲的质量_____(填“大”“小”或“无法判断”)。
18.学习酸碱中和反应时,很多同学对其产生探究兴趣。
(1)甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论。乙同学认为甲同学推理不合理,理由是__________________。
(2)乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出氢氧化钠溶液温度随加入稀硫酸质量的变化如下图:
①由图知,稀硫酸与氢氧化钠溶液发生的反应是_________(填“放热”或“吸热”)反应,B点表示的含义是__________________。
②从A到B的过程中,烧杯中溶液pH逐渐 ____________。
③B到C的过程中,烧杯内溶液中含有的阳离子有 ________(填离子符号)。
19.将5%的NaOH溶液逐滴加入到20克稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示,请计算:
(1)当恰好完全反应时,消耗NaOH溶液的质量为____克;
(2)请计算稀盐酸中溶质的质量分数为________(写出计算过程).
20.下图是常见物质的转化关系图(个别产物可能略去)。其中A、B常温下均为液态,且组成元素相同;F是大理石的主要成分。Y为氧化物,Z是紫红色固体。
请回答下列问题:
(1)在反应①中,物质X起_____________作用。
(2)反应⑥的化学方程式为________________________________________。
(3)反应①--⑥中没有涉及的化学反应基本类型是___________________。
三、简答题
21.通过学习化学你会发现化学就在身边,请运用化学知识解释生活中一些现象。
(1)在糕点盒里,放纳米级铁粉防止糕点变质,其原理是什么?______。
(2)油锅着火,用锅盖盖灭,其应用的灭火原理是什么?______。
(3)婷婷被蚊子叮咬后,痛痒难忍(蚊虫分泌一种蚁酸)。妈妈给她买了一种“绿膏药”,其成分中有稀氨水,抹上后果然有效。请你说说其中的化学原理______。
22.写出下列反应的化学方程式:
(1)碳还原氧化铜:________;
(2)用含氢氧化铝的药物治疗胃酸过多:__________。
23.向一定量 NaOH 溶液中,滴加稀盐酸,所加盐酸的量与溶液 pH 的变化如图所示:
(1)当加入稀盐酸的体积为_____mL 时,稀盐酸与 NaOH 溶液恰好完全反应;
(2)向上述加了 12mL 稀盐酸后的 NaOH 溶液中滴加紫色石蕊试液,溶液显_____色;
(3)当加入 8 mL 稀盐酸时,溶液中的溶质有_____。
24.某实验小组做中和反应的实验,向盛有氢氧化钠溶液(滴有酚酞试液)的烧杯中逐滴加入稀盐酸,并不断搅拌。下图为依据实验数据绘制的v盐酸)-pH图。请填空:
(1)滴加盐酸之前,烧杯中溶液的颜色为_______,滴加盐酸的体积为V2时,烧杯中溶液颜色为_________。
(2)滴加盐酸的体积为V1时,溶液中除了水分子外,其他的成分为____________.
(3)该反应的化学方程式为________________________________.
四、综合应用题
25.酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
【实验探究】在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度_______,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示
(1)由图可知,盐酸、氢氧化钠溶液稀释时均_______(填“放热”或“吸热”),但它们稀释时温度的变化量远_______两溶液混合时温度的变化量;
(2)小王同学用质量分数为10%的稀盐酸和20%的氢氧化钠溶液进行酸碱反应实验(如图一),用pH传感器测得烧杯内溶液的pH变化图象(如图二),同时用温度传感器测得烧杯内温度变化图象(如图三),实验过程中保温良好,忽略热量散失。
①A点溶液的溶质_______(填化学式)。
②计算所用的稀盐酸溶液的质量_____。(保留小数点后一位)
【参考答案】
1.D 2.C 3.D 4.C 5.C 6.D 7.C 8.D 9.C 10.A 11.A 12.C 13.D 14.B
15. C D 水在实验中均作为反应物 B D
16. 蓝 硫酸 产生蓝色沉淀
17. 没有 无法判断
18. NaOH固体溶于水放热 放热 恰好完全反应 减小 Na+ H+
19.(1)32(2)7.3%
20. 催化 2NaOH+CuSO 4===2Na2SO4+Cu(OH)2↓ 置换反应
21. 铁粉既能吸收水又能吸收氧气而发生缓慢氧化反应生成铁锈,从而保护食品 隔绝空气(或氧气) 蚊虫分泌一种蚁酸,显酸性,“绿药膏”成分中有稀氨水,显碱性,稀氨水与蚁酸发生了化学反应而把酸性物质反应掉(或稀氨水显碱性与蚁酸发生了中和反应)
22. C+2CuO2Cu+CO2 Al(OH)3+3HCl=AlCl3+3H2O
23. 10 红 氯化钠和氢氧化钠
24. 红色 无色 氢氧根离子、氯离子、钠离子 NaOH+HCl=NaCl+H2O
25. 升高 (1)放热 小于 (2)NaCl、NaOH 54.75g。
课题2 酸和碱的中和反应 课后练习
一、选择题
1.下列有关教材实验的说法正确的是
A.在测定空气中氧气含量实验中,燃烧匙中红磷的量越多,最后水位上升越高
B.在加热高锰酸钾制取氧气实验中,试管口应略向下倾斜,以防止生成冷凝水
C.实验室利用大理石和稀盐酸制取二氧化碳并用久置澄清石灰水检验生成的气体,若澄清石灰水始终未变浑浊,则一定是二氧化碳气体中混有氯化氢气体所致
D.在氢氧化钠溶液+酚酞+逐滴滴加过量的稀盐酸实验中,若将试剂添加顺序改为:稀盐酸+酚酞+逐滴滴加过量的氢氧化钠溶液,也可以达到证明氢氧化钠溶液和稀盐酸发生了化学反应的目的
2.化学方程式是重要的“化学语言”。下列化学方程式与文字表述均正确的是
A.用氢氧化铝治疗胃酸过多:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
B.用稀盐酸除去铁锈:Fe2O3+4HCl=2FeCl2+2H2O
C.铁丝在氧气中燃烧:3Fe+2O2Fe3O4
D.加热氯酸钾制取氧气:2KClO3=2KCl+3O2↑
3.某同学想用pH试纸测定一些物质的pH,下列做法能达到实验目的的是
A.用湿润的pH试纸测定稀硫酸的pH B.用干燥的pH试纸测定二氧化碳气体的pH
C.用干燥的pH试纸测定浓硫酸的pH D.用干燥的pH试纸测定氢氧化钠稀溶液的pH
4.苯甲酸(C6H5COOH)是一种酸,可用于食品防腐,下列说法正确的是
A.苯甲酸能使湿润的紫色石蕊试液变蓝 B.苯甲酸能和铜反应产生氢气
C.苯甲酸能与氢氧化钠溶液反应生成盐和水 D.在食品中可以大量添加苯甲酸以延长保质期
5. S2-、SO32-和SO42-是比较常见的离子。对这三种离子的认识正确的是
A.三种离子中都含有硫元素 B.SO32-和SO42-都属于氧化物
C.硫元素在化合物中的化合价有-2、+4、+6 D.S2-和H+不能结合成酸分子
6.在NaCl和HCl的混合溶液中,逐滴加入NaOH溶液至过量。下列图象正确的是
A. B. C. D.
7.已知:物质X与Ca(OH)2在水溶液中能发生反应,反应的化学方程式如下:X+Ca(OH)2=Y+Cu(OH)2↓下列分析错误的是( )
A.X肯定不可能是酸 B.X和Y的相对分子质量之差为24
C.X可能是单质,也可能是化合物 D.Y可以是CaCl2或Ca(NO3)2
8.下列关于混合物提纯的方法正确的是
A.除去二氧化碳中混有的少量氯化氢——将气体通入氢氧化钠溶液
B.除去生石灰中混有的少量碳酸钙——将混合物溶于水后过滤
C.除去硝酸钾固体中含有的少量氯化钠——将混合物溶于水后蒸发结晶
D.除去铜粉中混有的少量氧化铜——加入适量稀盐酸充分反应后过滤
9.有些化学变化可以用X+Y=M+R表示.关于此类变化,下列说法正确的是
A.若X是单质,则该反应一定是置换反应 B.若Y为金属,则该反应一定生成氢气
C.若X为酸,Y为碱,则该反应一定是中和反应 D.若X为盐,Y为碱,则该反应一定能够生成沉淀
10.向一定量的碳酸氢钠和氯化钠的混合溶液中加入稀盐酸溶液至过量,某变量 y随x的变化趋势如下图所示。若x表示稀盐酸的质量,则y表示的含义是
A.氯化钠的质量 B.溶液的总质量
C.二氧化碳的质量 D.溶液中钠元素的质量
11.某溶液由氯化钾溶液、稀盐酸、稀硫酸、和氯化铜中一一种若几种混合而成,现向该混合液中滴入Ba(OH)2溶液,产生沉淀的质量与加入氢氧化钡溶液体积的关系如图所示.则下列判断正确的是( )
A.肯定含有HCl B.肯定有H2SO4 C.CuCl2不能确定 D.肯定没有KCl
12.某实验小组将Ba(OH)2溶液逐滴滴入硫酸溶液中,溶质的质量与加入的Ba(OH)2溶液的质量关系如图所示。下列说法错误的是( )
A.a点溶液为酸性 B.b点恰好完全反应 C.c点溶液的溶质为硫酸 D.b、c两点沉淀质量相等
13.甲、乙两工厂的生产污水中各有下列5种离子的3种(两厂含有一种相同的离子):H+、K+、NO3-、Cu2+、OH-。若将两厂的污水按一定比例混合,沉淀后污水会变成只含有一种溶质的无色澄清溶液,此溶液可做化肥。对两厂各含有哪些离子的判断,正确的是
A.H+、K+可能在同一工厂 B.相同的离子是OH-
C.甲厂中含有的离子一定是H+、NO3-、Cu2+ D.K+、Cu2+不可能在同一工厂
14.将某盐酸与某氢氧化钠溶液混合,当达到pH=7时,测得溶液中钠离子与水分子个数比为1:20(设水都以分子形式存在)。则反应后溶液中溶质的质量分数是
A.6.0% B.14.0% C.6.4% D.16.0%
二、填空题
15.分类、类比是化学常用的方法,掌握这些方法有助于学生学习化学知识。
(1)初中化学有许多实验都用到了水这种物质,根据“水的作用”可将下列实验中的____________(填序号)归为一类,依据是__________。
(2)一般情况下,元素周期表中同一族的元素具有相似的化学性质,则下列各组元素具有相似化学性质的是________________(填序号),已知S和Se具有相似的化学性质,请类比写出硒酸(H2SeO4)和氢氧化钠溶液发生中和反应的化学方程式_____________。
A.C和Ne B.Be和Mg C.Al和Si D.F和Cl
16.旧铜器表面的“铜绿”主要成分的化学式为Cu2(OH)2CO3.小强对实验室用稀硫酸洗去“铜绿”所形成的废液进行实验:
(1)观察废液呈____色。测量废液的pH=1,说明废液中还含有____。
(2)取废液滴加到澄清石灰水中,能观察到的现象是____,溶液中发生反应的化学方程式为(写一个)____。
17.某化学小组用一定量 AgNO3 和 Cu(NO3)2 的混合溶液进行了如图实验,已知溶液甲呈蓝色。
(1)向固体乙上滴加盐酸时_____(填“有”或“没有”)气泡产生。
(2)原混合溶液的质量比溶液甲的质量_____(填“大”“小”或“无法判断”)。
18.学习酸碱中和反应时,很多同学对其产生探究兴趣。
(1)甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论。乙同学认为甲同学推理不合理,理由是__________________。
(2)乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出氢氧化钠溶液温度随加入稀硫酸质量的变化如下图:
①由图知,稀硫酸与氢氧化钠溶液发生的反应是_________(填“放热”或“吸热”)反应,B点表示的含义是__________________。
②从A到B的过程中,烧杯中溶液pH逐渐 ____________。
③B到C的过程中,烧杯内溶液中含有的阳离子有 ________(填离子符号)。
19.将5%的NaOH溶液逐滴加入到20克稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示,请计算:
(1)当恰好完全反应时,消耗NaOH溶液的质量为____克;
(2)请计算稀盐酸中溶质的质量分数为________(写出计算过程).
20.下图是常见物质的转化关系图(个别产物可能略去)。其中A、B常温下均为液态,且组成元素相同;F是大理石的主要成分。Y为氧化物,Z是紫红色固体。
请回答下列问题:
(1)在反应①中,物质X起_____________作用。
(2)反应⑥的化学方程式为________________________________________。
(3)反应①--⑥中没有涉及的化学反应基本类型是___________________。
三、简答题
21.通过学习化学你会发现化学就在身边,请运用化学知识解释生活中一些现象。
(1)在糕点盒里,放纳米级铁粉防止糕点变质,其原理是什么?______。
(2)油锅着火,用锅盖盖灭,其应用的灭火原理是什么?______。
(3)婷婷被蚊子叮咬后,痛痒难忍(蚊虫分泌一种蚁酸)。妈妈给她买了一种“绿膏药”,其成分中有稀氨水,抹上后果然有效。请你说说其中的化学原理______。
22.写出下列反应的化学方程式:
(1)碳还原氧化铜:________;
(2)用含氢氧化铝的药物治疗胃酸过多:__________。
23.向一定量 NaOH 溶液中,滴加稀盐酸,所加盐酸的量与溶液 pH 的变化如图所示:
(1)当加入稀盐酸的体积为_____mL 时,稀盐酸与 NaOH 溶液恰好完全反应;
(2)向上述加了 12mL 稀盐酸后的 NaOH 溶液中滴加紫色石蕊试液,溶液显_____色;
(3)当加入 8 mL 稀盐酸时,溶液中的溶质有_____。
24.某实验小组做中和反应的实验,向盛有氢氧化钠溶液(滴有酚酞试液)的烧杯中逐滴加入稀盐酸,并不断搅拌。下图为依据实验数据绘制的v盐酸)-pH图。请填空:
(1)滴加盐酸之前,烧杯中溶液的颜色为_______,滴加盐酸的体积为V2时,烧杯中溶液颜色为_________。
(2)滴加盐酸的体积为V1时,溶液中除了水分子外,其他的成分为____________.
(3)该反应的化学方程式为________________________________.
四、综合应用题
25.酸碱中和反应是初中阶段重要的一类反应,请你一起参与探究。
【实验探究】在50mL一定浓度的氢氧化钠溶液中滴加50mL一定浓度的盐酸,并用玻璃棒搅拌,观察到溶液的温度_______,由此现象小李同学得出两者能发生反应的结论。通过查阅相关资料后,小张同学发现此结论不够严谨,设计了下列3个对比实验:
①50mL一定浓度的盐酸与50mL蒸馏水混合,测量溶液温度的变化
②50mL一定浓度的氢氧化钠溶液与50mL蒸馏水混合,测量溶液温度的变化
③50mL一定浓度的盐酸与50mL一定浓度的氢氧化钠溶液混合,测量溶液温度的变化
用数字化实验技术测得3个实验,溶液温度随时间变化的关系如图所示
(1)由图可知,盐酸、氢氧化钠溶液稀释时均_______(填“放热”或“吸热”),但它们稀释时温度的变化量远_______两溶液混合时温度的变化量;
(2)小王同学用质量分数为10%的稀盐酸和20%的氢氧化钠溶液进行酸碱反应实验(如图一),用pH传感器测得烧杯内溶液的pH变化图象(如图二),同时用温度传感器测得烧杯内温度变化图象(如图三),实验过程中保温良好,忽略热量散失。
①A点溶液的溶质_______(填化学式)。
②计算所用的稀盐酸溶液的质量_____。(保留小数点后一位)
【参考答案】
1.D 2.C 3.D 4.C 5.C 6.D 7.C 8.D 9.C 10.A 11.A 12.C 13.D 14.B
15. C D 水在实验中均作为反应物 B D
16. 蓝 硫酸 产生蓝色沉淀
17. 没有 无法判断
18. NaOH固体溶于水放热 放热 恰好完全反应 减小 Na+ H+
19.(1)32(2)7.3%
20. 催化 2NaOH+CuSO 4===2Na2SO4+Cu(OH)2↓ 置换反应
21. 铁粉既能吸收水又能吸收氧气而发生缓慢氧化反应生成铁锈,从而保护食品 隔绝空气(或氧气) 蚊虫分泌一种蚁酸,显酸性,“绿药膏”成分中有稀氨水,显碱性,稀氨水与蚁酸发生了化学反应而把酸性物质反应掉(或稀氨水显碱性与蚁酸发生了中和反应)
22. C+2CuO2Cu+CO2 Al(OH)3+3HCl=AlCl3+3H2O
23. 10 红 氯化钠和氢氧化钠
24. 红色 无色 氢氧根离子、氯离子、钠离子 NaOH+HCl=NaCl+H2O
25. 升高 (1)放热 小于 (2)NaCl、NaOH 54.75g。
同课章节目录
