9.2溶解度同步测试——2021-2022学年人教版九年级下册(word版 含答案)
文档属性
| 名称 | 9.2溶解度同步测试——2021-2022学年人教版九年级下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 207.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-19 20:52:12 | ||
图片预览




文档简介
9.2 溶解度
一、单选题
1.甲和乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )
①甲的溶解度随温度的升高而增大
②40℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法
③20℃时,向125g溶质质量分数为20%的乙溶液中加入15g乙固体并振荡,有固体不溶解
④将相同质量的甲和乙的饱和溶液分别从40℃降温至10℃,甲析出晶体的质量大
A.①② B.③④ C.①③④ D.②③④
2.下列叙述错误的是
A.蔗糖溶解的过程就是在水分子作用下,蔗糖分子均匀分散到水分子中的过程
B.搅拌和升温能加快溶解,是因为加快了分子的运动速率
C.用汽油清洗衣服上的油污,是利用了乳化作用
D.室温下,向接近饱和的硝酸钾溶液中加入适量硝酸钾固体能形成硝酸钾饱和溶液
3.下列关于溶液的说法,正确的是
A.水是最常用的溶剂
B.饱和溶液一定比不饱和溶液浓度大
C.澄清、透明的液体一定是溶液
D.饱和溶液一定不能再继续溶解溶质
4.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
5.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时, KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度与压强大小无关
6.在装有水的烧杯中分别加入以下物质,其中形成的溶液温度降低的是
A.生石灰 B.氢氧化钠 C.氯化钠 D.硝酸铵
7.现对某物质的不饱和溶液进行恒温蒸发,若蒸发水析出固体,若蒸发水析出固体,若蒸发水析出固体,则下列关系正确的是
A. B.
C. D.
8.除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
9.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2℃时,乙物质的饱和溶液降温至t1℃,乙溶液变为不饱和溶液
D.t2℃时,30g甲物质能溶解于50g水中形成80g的溶液
10.25℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是
A.
B.
C.
D.
11.如图是MgCl2、KCl和MgSO4的溶解度曲线。下列说法错误的是( )
A.P点表示t2℃时KCl和MgSO4的溶解度相等
B.t1℃时三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
C.将t2℃时的三种物质的饱和溶液分别升温至t3℃,会析出晶体的是MgSO4
D.t2℃时,将40g MgCl2加入50g水中充分搅拌,所得溶液质量为90g
12.下列关于溶液的说法正确的是
A.能溶解其他物质的物质叫做溶剂 B.凡是均一的、稳定的液体一定是溶液
C.溶液一定是无色透明的 D.饱和溶液一定是浓溶液
13.下表是某同学的实验记录,以下说法不正确的是( )
溶质 碘 高锰酸钾
溶剂 水 汽油 酒精 水 汽油
溶解性 不溶 易溶 可溶 易溶 不溶
A.衣服不慎沾上碘酒,可用汽油擦洗
B.溶液都是均一、稳定、无色的混合物
C.水、汽油、酒精都可以做溶剂
D.同一物质在不同溶剂中溶解性不同
14.下列说法中,正确的是( )
A.任何一种固体物质在水中的溶解度都是一定的,只有一个值
B.固体溶质的溶解度随温度的升高而增大,气体溶质的溶解度随温度升高而减小
C.某物质的溶解度就是该物质在100 g溶剂中所溶解的克数
D.在一定温度下,溶质A的溶解度为SAg,溶质B的溶解度为SBg。已知SA>SB,相同质量的A和B的饱和溶液,A溶液的溶剂量小于B溶液里的溶剂量
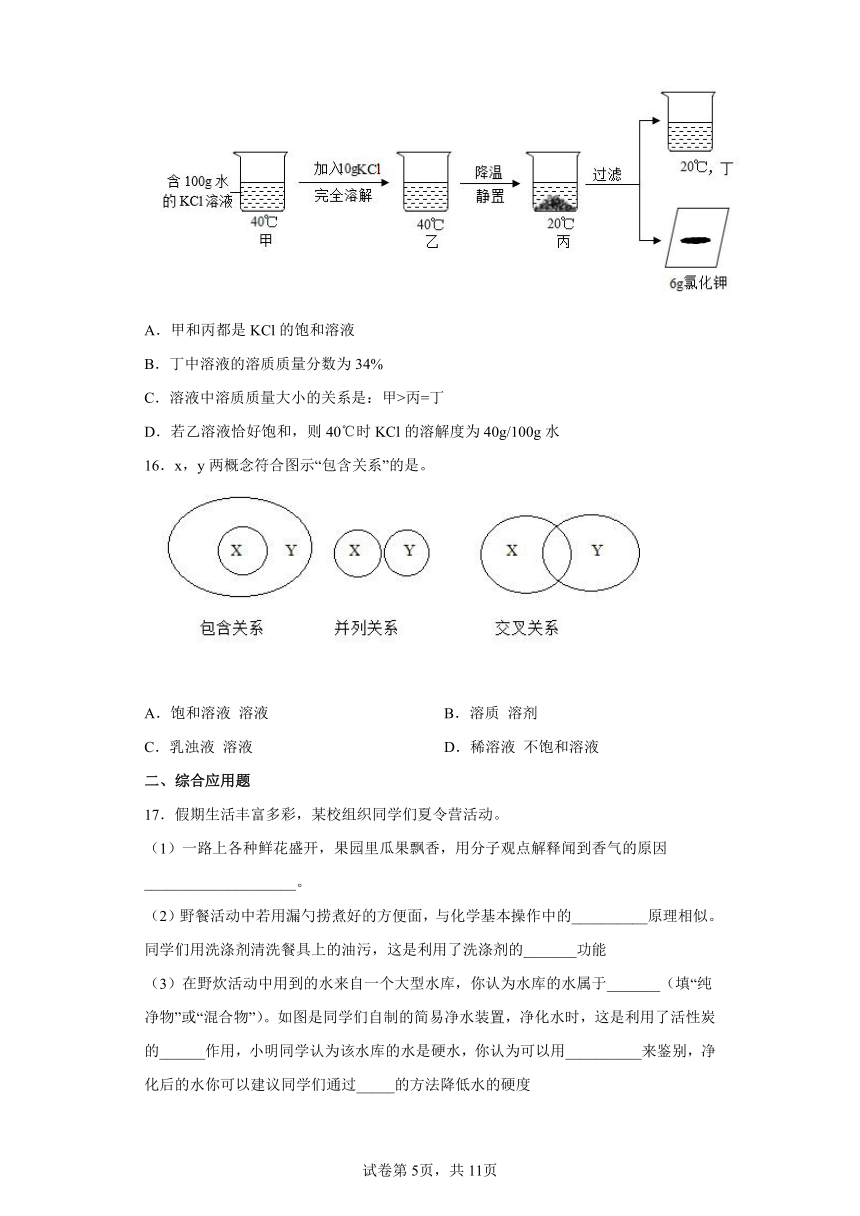
15.20℃时KCl的溶解度是34g/100g水,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是
A.甲和丙都是KCl的饱和溶液
B.丁中溶液的溶质质量分数为34%
C.溶液中溶质质量大小的关系是:甲>丙=丁
D.若乙溶液恰好饱和,则40℃时KCl的溶解度为40g/100g水
16.x,y两概念符合图示“包含关系”的是。
A.饱和溶液 溶液 B.溶质 溶剂
C.乳浊液 溶液 D.稀溶液 不饱和溶液
二、综合应用题
17.假期生活丰富多彩,某校组织同学们夏令营活动。
(1)一路上各种鲜花盛开,果园里瓜果飘香,用分子观点解释闻到香气的原因____________________。
(2)野餐活动中若用漏勺捞煮好的方便面,与化学基本操作中的__________原理相似。同学们用洗涤剂清洗餐具上的油污,这是利用了洗涤剂的_______功能
(3)在野炊活动中用到的水来自一个大型水库,你认为水库的水属于_______(填“纯净物”或“混合物”)。如图是同学们自制的简易净水装置,净化水时,这是利用了活性炭的______作用,小明同学认为该水库的水是硬水,你认为可以用__________来鉴别,净化后的水你可以建议同学们通过_____的方法降低水的硬度
(4)“低碳生活,绿色出行”。学校建议同学们骑自行车出行。请回答下列问题
①图中所标示的各部件中,属于金属材料的是____________填序号)
②自行车车架一般用生铁制造,某些部件为不锈钢。工业上常以赤铁矿(主要成分为Fe2O3)为原料炼铁,请写出一氧化碳与氧化铁在高温下反应的化学方程式:________________。
③车架表面喷漆不仅美观,而且可有效防止其与__________________接触而生锈。防止公共自行车链条生锈的有效措施是_____________。
④自行车轮圈一般用铝合金制造,这是因为铝合金既轻便又耐用。铝制品比较耐腐蚀的原因是____________________。
⑤天气太热,建议同学们车胎气压不能太高试用。用分子、原子的相关知识解释_________________。有些同学带的碳酸饮料,其中溶有二氧化碳气体,当打开汽水瓶盖时,汽水会自动喷出来,原因是_________________有的同学们带了“摇摇冰”的罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动使它们混合,罐内饮料温度就会降低.这种固体物质可能是__________(填字母)
A.生石灰B.烧碱C.食盐D.硝酸铵
⑥为防止旅途中皮肤的以外擦伤感染,常备有碘酒,碘酒中的溶剂是________(写化学式)。
⑦同学们准备将垃圾分类处理,其中属于不可回收垃圾的是__________填字母)。
A.废纸 B.果皮 C. 饮料罐 D.废弃塑料
18.A、B、C三种固体物质(均不含结晶水)的溶解度曲线。
(1)A中混有少量的B是可用______方法提纯A。
(2)t2℃时,A物质的饱和溶液,为了进一步提高该溶液溶质质量分数,可进行的操作是______。
(3)对于溶解度曲线上的点p,以下描述一定正确的是______。
a. A、B、C溶液的溶质质量分数相同;
b.C的溶液100g有10g溶质;
c.B溶液处于不饱和状态;
d.A、C溶液质量相等
19.科学探究是学习化学的重要方法。
(1)实验室常用气体制备装置,据图回答:
若用A、D装置组合制取氧气,写出反应的化学方程式______;若用E装置收集氢气,请将集气瓶内的导管补画完整_____;实验室制取气体时,确定发生装置需要考虑的因素是_____(填序号)。
A.反应物的状态 B.气体的密度 C.反应的条件 D.气体的溶解性
(2)医用酒精是体积分数为75%的酒精溶液,在抗击“新冠肺炎”过程中应用非常广泛。
①将酒精溶液提纯为无水乙醇时,常加生石灰除水,其反应的化学方程式为_______;
②请设计实验证明酒精中含有碳元素(写出操作步骤、现象)_______。
③如图是与酒精有关的实验,该实验说明:相同条件下,同一种物质在不同溶剂中的_______不同。
④实验室常用酒精灯加热,酒精燃烧的化学方程式为_______。
(3)实验室为测定某石灰石样品中碳酸钙的质量分数,称取10g石灰石(杂质不参加反应)放入烧杯中,加入100g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为106.7g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数_____。
20.CO2的捕集与资源化利用是目前化学研究的热点。
Ⅰ.二氧化碳的捕集
加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度______(填“增大”“不变”或“减小”)。捕集CO2后的溶液可以使紫色石蕊试液变红,原因是______(用化学方程式表示)。
Ⅱ.二氧化碳的资源化利用
(1)对CO2气体加压、降温,可获得干冰,从微观角度分析,该过程主要改变的是______。
(2)科学家利用新型催化剂,将二氧化碳转化为甲醇(CH4O),反应的微观示意图为:
生成甲醇时参加反应的CO2与H2的质量比______ 。
(3)以二氧化碳为原料,制取炭黑的太阳能工艺如图所示。
①写出图中反应2的化学方程式:______。
②该工艺中Fe3O4的作用是______。
(4)一种新型“人造树叶”可在光照条件下将二氧化碳转化为乙醇(C2H6O),反应的化学方程式为 。研究显示,每升“人造树叶”每天能从空气中吸收968g二氧化碳。计算2L“人造树叶”工作一天得到的乙醇,可以配制溶质质量分数为70%的乙醇溶液多少克?(写出计算过程,结果保留一位小数)______。
21.根据所给硝酸钾和氯化钾的溶解度曲线,回答下列问题:
(1)硝酸钾和氯化钾两物质溶解度受温度影响较大的是_______。
(2)t1℃时,将50g硝酸钾加入到50g水中,充分溶解后,所得溶液的质量为__________。
(3)硝酸钾的饱和溶液中含有少量氯化钾,提纯硝酸钾的方法是_________________。
(4)现有t2℃时硝酸钾和氯化钾的两饱和溶液。不考虑水的蒸发,下列关系一定成立的有_______(填字母标号)
A 两饱和溶液中溶质的质量分数相等
B 分别降温到t1℃,析出硝酸钾晶体的质量大于析出氯化钾晶体的质量
C 分别升温至t3℃,所得溶液中溶质的质量分数相等
D 保持t2℃不变,恒温蒸发等质量的水析出晶体质量相等
22.溶解度与速度、密度一样,都是控制某变量,度量另一变量,以表达事物固有属性。
(1)20℃时NaCl的溶解度为36g,其含义是_______。
(2)影响固体溶解度大小的因素有 (填字母,下同)。
A.温度 B.压强 C.溶质、溶剂的种类
D.搅拌 E.颗粒大小 F.溶质、溶剂的质量
(3)影响固体物质溶解速度快慢的因素有 。
A.温度 B.搅拌 C.颗粒大小 D.振荡
(4)不同温度下,O2的溶解度随压强的变化如图所示,图中t1对应的温度为40℃,则t2对应的温度 。
A.大于40℃ B.小于40% C.无法确定
(5)某学生在教师的指导下完成KNO3溶解度的测定实验。
步骤1:分别准确称取3.5g、1.5g、2.0gKNO3.加入药品后发现托盘天平指针偏向右边,则接下来的操作是________。
A.添加KNO3直至天平平衡 B.取出KNO3直至天平平衡
C.改变砝码、游码,直至天平平衡 D.重新调节平衡螺母至天平平衡
步骤2:将3.5gKNO3放入大试管中,并用量筒量取10.0mL蒸馏水于试管内。注意量筒必须放平稳,视线要与液体_______保持水平。
步骤3:振荡大试管,发现有固体未溶解,于是用如下图所示方法进行水浴加热,使固体全部溶解,则此加热方法的优点是________。
步骤4:取出大试管,插入温度计,用玻璃棒轻轻搅拌并摩擦试管壁,同时观察温度计的读数。当刚有晶体析出时,立即记下此时的温度T1。
步骤5:此时在大试管中再加入1.5gKNO3,重复步骤3、4,记录温度为T2;
同样方法,再加入2.0gKNO3实验,记录温度为T3.则T3时KNO3的溶解度为_____g。
实验交流与反思:
交流1:判断溶液的饱和状态是溶解度测量的关键点。欲使接近饱和的KNO3溶液变为饱和溶液的三种方法是_______。
交流2:依据学生实验后绘制的下图溶解度曲线,下列说法正确的是_______。
A.NaCl的溶解度小于KNO3的溶解度
B.分别将b℃时,两种物质的饱和溶液降温至a℃,KNO3溶液析出的晶体多
C.在a℃时若配制等质量的两物质的饱和溶液,KNO3所需的水量多
D.从含有少量NaCl的KNO3中提纯KNO3,可采用降温结晶的方法
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.A
4.C
5.C
6.D
7.B
8.D
9.A
10.C
11.D
12.A
13.B
14.D
15.D
16.A
17. 分子不断运动 过滤 乳化 混合物 吸附 肥皂水 煮沸 序号为②③ 3CO+ Fe2O3 高温 2Fe + 3CO2 氧气(O2) 和水(H2O) 涂油 铝的表面有一层致密的氧化膜保护内部不被腐蚀 气体受热膨胀,分子间隔变大,导致爆胎 压强降低CO2溶解度变小 D C2H5OH B
18.(1)降温结晶
(2)升高温度同时加入A溶质
(3)c
19.(1) (或) AC##CA
(2)
将酒精灯点燃,在火焰上方罩一个内壁附有澄清石灰水的烧杯,若石灰水变浑浊,则说明酒精中含有碳元素 溶解性
(3)根据题意可知,CO2气体的质量为:100g+10g-106.7g=3.3g,设样品中碳酸钙的质量分数为x,
答:该样品中碳酸钙的质量分数为75%。
20. 增大 CO2+H2O=H2CO3 分子间间隔 22:3 6FeO+CO22Fe3O4+C 催化作用
解:设2L人造树叶工作一天得到的乙醇的质量为x
m(溶液)=1012g÷70%=1445.7g
答:制得溶质质量分数为70%的乙醇溶液的质量1445.7g
21. 硝酸钾 62.5g 降温结晶 ACD
22.(1)20℃时,在100g水中溶解36gNaCl形成饱和溶液
(2)AC
(3)ABCD
(4)A
(5) A 凹液面最低处 温度可控、受热均匀 70 加入溶质硝酸钾、蒸发水、降低温度 CD
答案第1页,共2页
答案第1页,共2页
一、单选题
1.甲和乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )
①甲的溶解度随温度的升高而增大
②40℃时,使甲的饱和溶液析出晶体可用加热升温、冷却降温和蒸发溶剂三种方法
③20℃时,向125g溶质质量分数为20%的乙溶液中加入15g乙固体并振荡,有固体不溶解
④将相同质量的甲和乙的饱和溶液分别从40℃降温至10℃,甲析出晶体的质量大
A.①② B.③④ C.①③④ D.②③④
2.下列叙述错误的是
A.蔗糖溶解的过程就是在水分子作用下,蔗糖分子均匀分散到水分子中的过程
B.搅拌和升温能加快溶解,是因为加快了分子的运动速率
C.用汽油清洗衣服上的油污,是利用了乳化作用
D.室温下,向接近饱和的硝酸钾溶液中加入适量硝酸钾固体能形成硝酸钾饱和溶液
3.下列关于溶液的说法,正确的是
A.水是最常用的溶剂
B.饱和溶液一定比不饱和溶液浓度大
C.澄清、透明的液体一定是溶液
D.饱和溶液一定不能再继续溶解溶质
4.NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是
温度/℃ 0 20 40 60
NaCl的溶解度/g 35.7 36.0 36.6 37.3
KNO3的溶解度/g 13.3 31.6 63.9 110
A.20℃时,100gH2O最多能溶解36.0gNaCl
B.40℃时,KNO3饱和溶液的溶质质量分数小于63.9%
C.可用冷却海水的方法获取大量食盐
D.其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液
5.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时, KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度与压强大小无关
6.在装有水的烧杯中分别加入以下物质,其中形成的溶液温度降低的是
A.生石灰 B.氢氧化钠 C.氯化钠 D.硝酸铵
7.现对某物质的不饱和溶液进行恒温蒸发,若蒸发水析出固体,若蒸发水析出固体,若蒸发水析出固体,则下列关系正确的是
A. B.
C. D.
8.除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
9.甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是
A.t1℃时,甲、乙两物质的溶解度相等
B.乙物质的溶解度大于甲物质的溶解度
C.t2℃时,乙物质的饱和溶液降温至t1℃,乙溶液变为不饱和溶液
D.t2℃时,30g甲物质能溶解于50g水中形成80g的溶液
10.25℃时向一定量不饱和KNO3溶液中逐渐加入KNO3固体,则下列图像中能正确表示此过程溶质质量变化规律的是
A.
B.
C.
D.
11.如图是MgCl2、KCl和MgSO4的溶解度曲线。下列说法错误的是( )
A.P点表示t2℃时KCl和MgSO4的溶解度相等
B.t1℃时三种物质的饱和溶液中,溶质质量分数最大的是MgCl2
C.将t2℃时的三种物质的饱和溶液分别升温至t3℃,会析出晶体的是MgSO4
D.t2℃时,将40g MgCl2加入50g水中充分搅拌,所得溶液质量为90g
12.下列关于溶液的说法正确的是
A.能溶解其他物质的物质叫做溶剂 B.凡是均一的、稳定的液体一定是溶液
C.溶液一定是无色透明的 D.饱和溶液一定是浓溶液
13.下表是某同学的实验记录,以下说法不正确的是( )
溶质 碘 高锰酸钾
溶剂 水 汽油 酒精 水 汽油
溶解性 不溶 易溶 可溶 易溶 不溶
A.衣服不慎沾上碘酒,可用汽油擦洗
B.溶液都是均一、稳定、无色的混合物
C.水、汽油、酒精都可以做溶剂
D.同一物质在不同溶剂中溶解性不同
14.下列说法中,正确的是( )
A.任何一种固体物质在水中的溶解度都是一定的,只有一个值
B.固体溶质的溶解度随温度的升高而增大,气体溶质的溶解度随温度升高而减小
C.某物质的溶解度就是该物质在100 g溶剂中所溶解的克数
D.在一定温度下,溶质A的溶解度为SAg,溶质B的溶解度为SBg。已知SA>SB,相同质量的A和B的饱和溶液,A溶液的溶剂量小于B溶液里的溶剂量
15.20℃时KCl的溶解度是34g/100g水,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是
A.甲和丙都是KCl的饱和溶液
B.丁中溶液的溶质质量分数为34%
C.溶液中溶质质量大小的关系是:甲>丙=丁
D.若乙溶液恰好饱和,则40℃时KCl的溶解度为40g/100g水
16.x,y两概念符合图示“包含关系”的是。
A.饱和溶液 溶液 B.溶质 溶剂
C.乳浊液 溶液 D.稀溶液 不饱和溶液
二、综合应用题
17.假期生活丰富多彩,某校组织同学们夏令营活动。
(1)一路上各种鲜花盛开,果园里瓜果飘香,用分子观点解释闻到香气的原因____________________。
(2)野餐活动中若用漏勺捞煮好的方便面,与化学基本操作中的__________原理相似。同学们用洗涤剂清洗餐具上的油污,这是利用了洗涤剂的_______功能
(3)在野炊活动中用到的水来自一个大型水库,你认为水库的水属于_______(填“纯净物”或“混合物”)。如图是同学们自制的简易净水装置,净化水时,这是利用了活性炭的______作用,小明同学认为该水库的水是硬水,你认为可以用__________来鉴别,净化后的水你可以建议同学们通过_____的方法降低水的硬度
(4)“低碳生活,绿色出行”。学校建议同学们骑自行车出行。请回答下列问题
①图中所标示的各部件中,属于金属材料的是____________填序号)
②自行车车架一般用生铁制造,某些部件为不锈钢。工业上常以赤铁矿(主要成分为Fe2O3)为原料炼铁,请写出一氧化碳与氧化铁在高温下反应的化学方程式:________________。
③车架表面喷漆不仅美观,而且可有效防止其与__________________接触而生锈。防止公共自行车链条生锈的有效措施是_____________。
④自行车轮圈一般用铝合金制造,这是因为铝合金既轻便又耐用。铝制品比较耐腐蚀的原因是____________________。
⑤天气太热,建议同学们车胎气压不能太高试用。用分子、原子的相关知识解释_________________。有些同学带的碳酸饮料,其中溶有二氧化碳气体,当打开汽水瓶盖时,汽水会自动喷出来,原因是_________________有的同学们带了“摇摇冰”的罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动使它们混合,罐内饮料温度就会降低.这种固体物质可能是__________(填字母)
A.生石灰B.烧碱C.食盐D.硝酸铵
⑥为防止旅途中皮肤的以外擦伤感染,常备有碘酒,碘酒中的溶剂是________(写化学式)。
⑦同学们准备将垃圾分类处理,其中属于不可回收垃圾的是__________填字母)。
A.废纸 B.果皮 C. 饮料罐 D.废弃塑料
18.A、B、C三种固体物质(均不含结晶水)的溶解度曲线。
(1)A中混有少量的B是可用______方法提纯A。
(2)t2℃时,A物质的饱和溶液,为了进一步提高该溶液溶质质量分数,可进行的操作是______。
(3)对于溶解度曲线上的点p,以下描述一定正确的是______。
a. A、B、C溶液的溶质质量分数相同;
b.C的溶液100g有10g溶质;
c.B溶液处于不饱和状态;
d.A、C溶液质量相等
19.科学探究是学习化学的重要方法。
(1)实验室常用气体制备装置,据图回答:
若用A、D装置组合制取氧气,写出反应的化学方程式______;若用E装置收集氢气,请将集气瓶内的导管补画完整_____;实验室制取气体时,确定发生装置需要考虑的因素是_____(填序号)。
A.反应物的状态 B.气体的密度 C.反应的条件 D.气体的溶解性
(2)医用酒精是体积分数为75%的酒精溶液,在抗击“新冠肺炎”过程中应用非常广泛。
①将酒精溶液提纯为无水乙醇时,常加生石灰除水,其反应的化学方程式为_______;
②请设计实验证明酒精中含有碳元素(写出操作步骤、现象)_______。
③如图是与酒精有关的实验,该实验说明:相同条件下,同一种物质在不同溶剂中的_______不同。
④实验室常用酒精灯加热,酒精燃烧的化学方程式为_______。
(3)实验室为测定某石灰石样品中碳酸钙的质量分数,称取10g石灰石(杂质不参加反应)放入烧杯中,加入100g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为106.7g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数_____。
20.CO2的捕集与资源化利用是目前化学研究的热点。
Ⅰ.二氧化碳的捕集
加压水洗法可捕集CO2,是因为压强增大时CO2在水中的溶解度______(填“增大”“不变”或“减小”)。捕集CO2后的溶液可以使紫色石蕊试液变红,原因是______(用化学方程式表示)。
Ⅱ.二氧化碳的资源化利用
(1)对CO2气体加压、降温,可获得干冰,从微观角度分析,该过程主要改变的是______。
(2)科学家利用新型催化剂,将二氧化碳转化为甲醇(CH4O),反应的微观示意图为:
生成甲醇时参加反应的CO2与H2的质量比______ 。
(3)以二氧化碳为原料,制取炭黑的太阳能工艺如图所示。
①写出图中反应2的化学方程式:______。
②该工艺中Fe3O4的作用是______。
(4)一种新型“人造树叶”可在光照条件下将二氧化碳转化为乙醇(C2H6O),反应的化学方程式为 。研究显示,每升“人造树叶”每天能从空气中吸收968g二氧化碳。计算2L“人造树叶”工作一天得到的乙醇,可以配制溶质质量分数为70%的乙醇溶液多少克?(写出计算过程,结果保留一位小数)______。
21.根据所给硝酸钾和氯化钾的溶解度曲线,回答下列问题:
(1)硝酸钾和氯化钾两物质溶解度受温度影响较大的是_______。
(2)t1℃时,将50g硝酸钾加入到50g水中,充分溶解后,所得溶液的质量为__________。
(3)硝酸钾的饱和溶液中含有少量氯化钾,提纯硝酸钾的方法是_________________。
(4)现有t2℃时硝酸钾和氯化钾的两饱和溶液。不考虑水的蒸发,下列关系一定成立的有_______(填字母标号)
A 两饱和溶液中溶质的质量分数相等
B 分别降温到t1℃,析出硝酸钾晶体的质量大于析出氯化钾晶体的质量
C 分别升温至t3℃,所得溶液中溶质的质量分数相等
D 保持t2℃不变,恒温蒸发等质量的水析出晶体质量相等
22.溶解度与速度、密度一样,都是控制某变量,度量另一变量,以表达事物固有属性。
(1)20℃时NaCl的溶解度为36g,其含义是_______。
(2)影响固体溶解度大小的因素有 (填字母,下同)。
A.温度 B.压强 C.溶质、溶剂的种类
D.搅拌 E.颗粒大小 F.溶质、溶剂的质量
(3)影响固体物质溶解速度快慢的因素有 。
A.温度 B.搅拌 C.颗粒大小 D.振荡
(4)不同温度下,O2的溶解度随压强的变化如图所示,图中t1对应的温度为40℃,则t2对应的温度 。
A.大于40℃ B.小于40% C.无法确定
(5)某学生在教师的指导下完成KNO3溶解度的测定实验。
步骤1:分别准确称取3.5g、1.5g、2.0gKNO3.加入药品后发现托盘天平指针偏向右边,则接下来的操作是________。
A.添加KNO3直至天平平衡 B.取出KNO3直至天平平衡
C.改变砝码、游码,直至天平平衡 D.重新调节平衡螺母至天平平衡
步骤2:将3.5gKNO3放入大试管中,并用量筒量取10.0mL蒸馏水于试管内。注意量筒必须放平稳,视线要与液体_______保持水平。
步骤3:振荡大试管,发现有固体未溶解,于是用如下图所示方法进行水浴加热,使固体全部溶解,则此加热方法的优点是________。
步骤4:取出大试管,插入温度计,用玻璃棒轻轻搅拌并摩擦试管壁,同时观察温度计的读数。当刚有晶体析出时,立即记下此时的温度T1。
步骤5:此时在大试管中再加入1.5gKNO3,重复步骤3、4,记录温度为T2;
同样方法,再加入2.0gKNO3实验,记录温度为T3.则T3时KNO3的溶解度为_____g。
实验交流与反思:
交流1:判断溶液的饱和状态是溶解度测量的关键点。欲使接近饱和的KNO3溶液变为饱和溶液的三种方法是_______。
交流2:依据学生实验后绘制的下图溶解度曲线,下列说法正确的是_______。
A.NaCl的溶解度小于KNO3的溶解度
B.分别将b℃时,两种物质的饱和溶液降温至a℃,KNO3溶液析出的晶体多
C.在a℃时若配制等质量的两物质的饱和溶液,KNO3所需的水量多
D.从含有少量NaCl的KNO3中提纯KNO3,可采用降温结晶的方法
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.A
4.C
5.C
6.D
7.B
8.D
9.A
10.C
11.D
12.A
13.B
14.D
15.D
16.A
17. 分子不断运动 过滤 乳化 混合物 吸附 肥皂水 煮沸 序号为②③ 3CO+ Fe2O3 高温 2Fe + 3CO2 氧气(O2) 和水(H2O) 涂油 铝的表面有一层致密的氧化膜保护内部不被腐蚀 气体受热膨胀,分子间隔变大,导致爆胎 压强降低CO2溶解度变小 D C2H5OH B
18.(1)降温结晶
(2)升高温度同时加入A溶质
(3)c
19.(1) (或) AC##CA
(2)
将酒精灯点燃,在火焰上方罩一个内壁附有澄清石灰水的烧杯,若石灰水变浑浊,则说明酒精中含有碳元素 溶解性
(3)根据题意可知,CO2气体的质量为:100g+10g-106.7g=3.3g,设样品中碳酸钙的质量分数为x,
答:该样品中碳酸钙的质量分数为75%。
20. 增大 CO2+H2O=H2CO3 分子间间隔 22:3 6FeO+CO22Fe3O4+C 催化作用
解:设2L人造树叶工作一天得到的乙醇的质量为x
m(溶液)=1012g÷70%=1445.7g
答:制得溶质质量分数为70%的乙醇溶液的质量1445.7g
21. 硝酸钾 62.5g 降温结晶 ACD
22.(1)20℃时,在100g水中溶解36gNaCl形成饱和溶液
(2)AC
(3)ABCD
(4)A
(5) A 凹液面最低处 温度可控、受热均匀 70 加入溶质硝酸钾、蒸发水、降低温度 CD
答案第1页,共2页
答案第1页,共2页
同课章节目录
