9.3溶液的浓度同步测试——2021-2022学年人教版九年级下册(word版 含答案)
文档属性
| 名称 | 9.3溶液的浓度同步测试——2021-2022学年人教版九年级下册(word版 含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 149.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-19 00:00:00 | ||
图片预览


文档简介
9.3 溶液的浓度
一、单选题
1.一杯70 ℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比
A.由饱和溶液变为不饱和溶液
B.溶质质量不变
C.溶液质量不变
D.溶质的质量分数减小
2.下列条件下的氢氧化钙溶液最浓的是( )
A.80℃时的不饱和溶液 B.20℃时的不饱和溶液
C.80℃时的饱和溶液 D.20℃时的饱和溶液
3.按下列方法配制的溶液,其溶质质量分数为5%的是
A.称取5.0 g氯化钾,溶解在95 mL水中,充分搅拌
B.称取5.0 g生石灰,放入95 mL水中,充分搅拌
C.量取5.0 mL浓盐酸,倒入95 mL水中,充分搅拌
D.称取5.0 g二氧化锰,放入95 mL水中,充分搅拌
4.保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是
A. B. C. D.
5.下列说法正确的是
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
6.如图是甲、乙固体的溶解度曲线。下列说法正确的是
A.图中P点所表示的溶液是t3℃时甲的饱和溶液
B.可用t1℃时20%的甲溶液配制10%的甲溶液
C.若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲
D.分别将t3℃等质量的甲、乙饱和溶液降温至t2℃,析出晶体质量相等
7.下列有关溶液及溶解度的说法正确的是( )
A.同一种溶质的水溶液,饱和溶液中溶质的质量分数一定大于不饱和溶液中溶质的质量分数
B.在T℃时,某物质A的溶液,若蒸发掉5克水时,析出A(不含结晶水)2克;若蒸发掉10克水时,析出A 5克。则T℃时,A的溶解度为40克
C.室温下,5mL水和5mL酒精混合后总体积为10mL
D.现要配制10%的稀硫酸2940g,用98%的浓硫酸进行稀释,需加水2640g.
8.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
9.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
10.实验室有一瓶稀盐酸,欲测定其溶质的质量分数,取200g样品于烧杯中,先加入12.5g大理石粉末,充分反应后得固液混合物208.1g,再继续加入25g该种大理石粉末,充分反应后过滤,得滤液211.2g,则该瓶稀盐酸中溶质的质量分数为
A.14.6% B.3.65% C.7.3% D.10.95%
11.氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。
其中措施正确的是
A.①②④ B.①③④ C.①③⑤ D.①②⑤
12.要使质量分数为10%的氯化钠溶液50g 变成质量分数为20%的氯化钠溶液,可采取的方法是
A.加入5g氯化钠 B.蒸发20g水
C.加入50g的30%氯化钠溶液 D.将溶液取出25g
13.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙。下列说法正确的是( )
A.该温度下,KNO3的溶解度为30g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
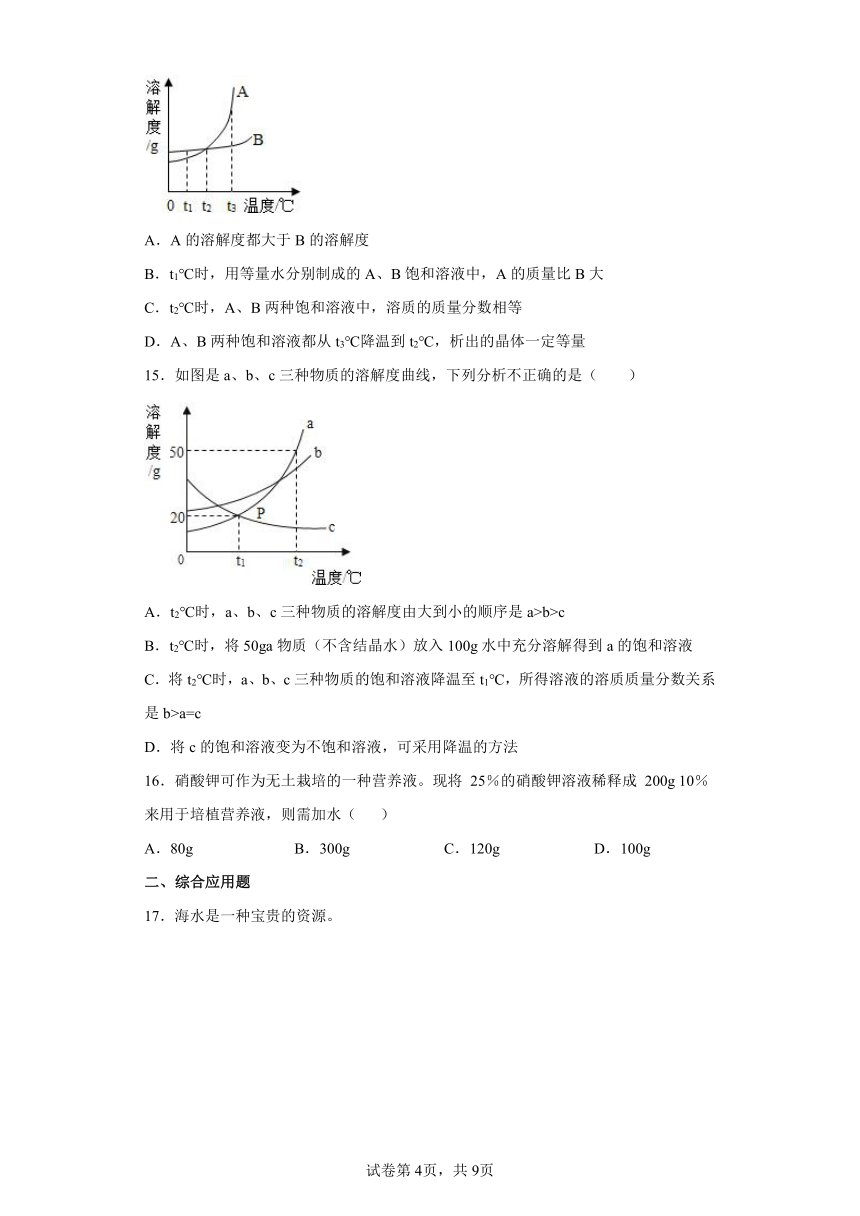
14.如图是A、B两种固体物质的溶解度曲线,下列说法正确的是
A.A的溶解度都大于B的溶解度
B.t1℃时,用等量水分别制成的A、B饱和溶液中,A的质量比B大
C.t2℃时,A、B两种饱和溶液中,溶质的质量分数相等
D.A、B两种饱和溶液都从t3℃降温到t2℃,析出的晶体一定等量
15.如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是( )
A.t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c
B.t2℃时,将50ga物质(不含结晶水)放入100g水中充分溶解得到a的饱和溶液
C.将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是b>a=c
D.将c的饱和溶液变为不饱和溶液,可采用降温的方法
16.硝酸钾可作为无土栽培的一种营养液。现将 25%的硝酸钾溶液稀释成 200g 10%来用于培植营养液,则需加水( )
A.80g B.300g C.120g D.100g
二、综合应用题
17.海水是一种宝贵的资源。
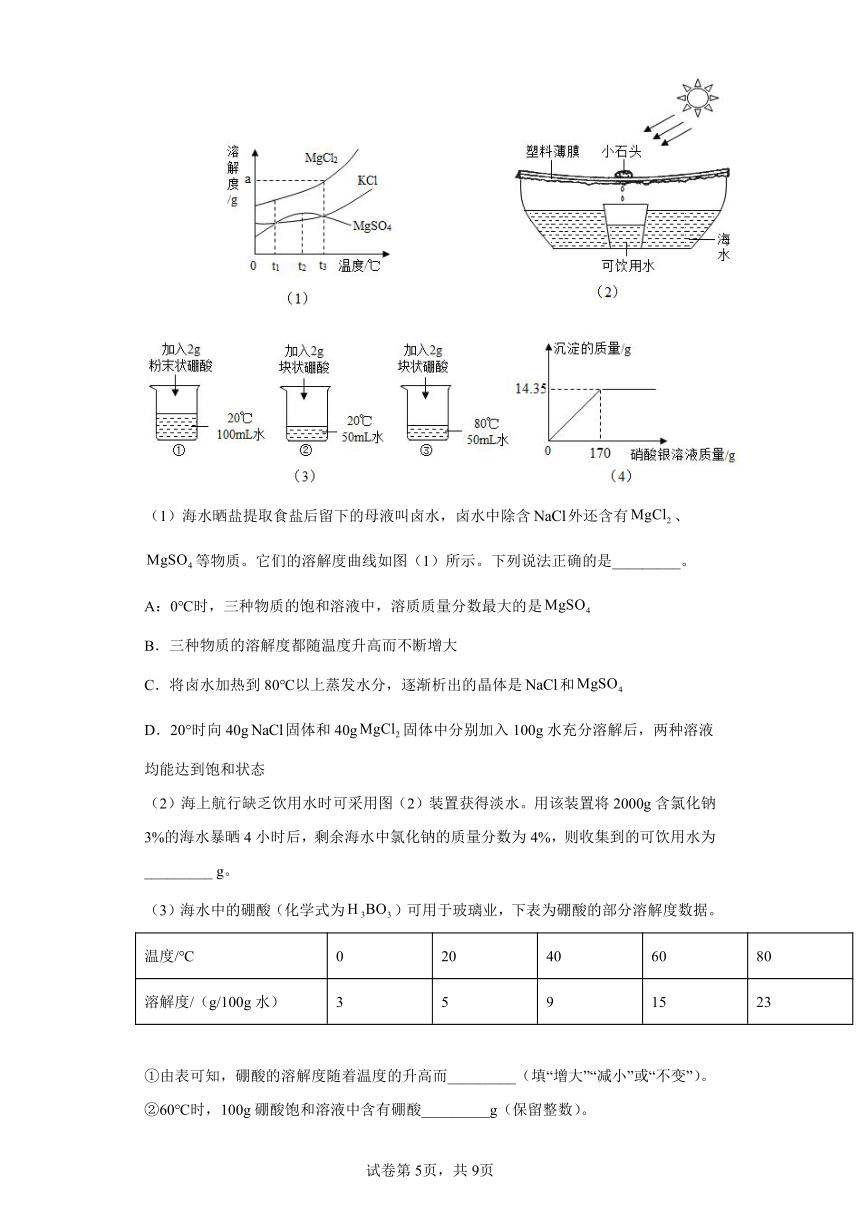
(1)海水晒盐提取食盐后留下的母液叫卤水,卤水中除含外还含有、等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是_________。
A:0℃时,三种物质的饱和溶液中,溶质质量分数最大的是
B.三种物质的溶解度都随温度升高而不断增大
C.将卤水加热到80℃以上蒸发水分,逐渐析出的晶体是和
D.20°时向40g固体和40g固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
(2)海上航行缺乏饮用水时可采用图(2)装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒4小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为_________ g。
(3)海水中的硼酸(化学式为)可用于玻璃业,下表为硼酸的部分溶解度数据。
温度/℃ 0 20 40 60 80
溶解度/(g/100g水) 3 5 9 15 23
①由表可知,硼酸的溶解度随着温度的升高而_________(填“增大”“减小”或“不变”)。
②60℃时,100g硼酸饱和溶液中含有硼酸_________g(保留整数)。
③某同学设计如图(3)实验探究“温度”及“固体溶质的形态”对溶解速率的影响。
a.上述三个烧杯中,所得溶液浓度的大小关系是_________(用“甲”“乙”“丙”表示)
b.若要达到实验目的,需改变实验甲中的一个条件是_________(填编号)。
A.将20℃的水改为80℃ B.将水的体积改为50mL C.将粉末状固体改为块状
(4)某同学取模拟海水(含,、)200g,向溶液中先滴加足量的_________,充分反应后,过滤,在滤液中滴加10%的硝酸银溶液,其沉淀质量变化如图(4)所示,测得模拟海水中氯元素的质量分数为_________%(保留三位小数)。
18.实验室里现有氯酸钾、二氧化锰、稀硫酸、石灰石和稀盐酸以及下列仪器:
(1)利用上述仪器和药品可以制取二氧化碳,你选择的仪器是______(填序号),药品是______,反应的化学方程式为______。
(2)若补充一种仪器______(填仪器名称),再利用上述仪器和药品还可以制取氧气,你选择的仪器是______(填序号),药品是______,反应的化学方程式为______。
(3)100g某硫酸恰好与13g锌完全反应,试计算这种硫酸中溶质的质量分数。______
19.溶液与人类生产、生活密切相关。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
①时,A、B、C三种物质的溶解度由大到小的顺序是 _____ 。
②A、B、C三种物质中,溶解度随温度升高而减小的是 _____ 。
③时,完全溶解ag A物质最少需要水的质量是 _____ g。
④时,相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量 _____ B的饱和溶液中所含水的质量(填“大于”、“等于”或“小于”)
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、玻璃棒、 _____ 和滤纸。
(3)在实验室中,配制溶质质量分数为的氯化钠溶液45g,需要氯化钠固体的质量是 _____ g。将的氯化钠溶液配成含氯化钠为0.9%的溶液,得到氯化钠溶液的质量是 _____ g。
20.水是生命之源,人类的生产、生活离不开水。
(1)我国规定生活饮用水的水质必须达到下列四项指标,通过过滤可达到_____________ (填字母序号)。
A无异色
B无异味
C澄清透明
D无细菌和病毒
(2)镁与碘的化合反应十分缓慢,若滴加少量水,则反应立即剧烈进行,反应前后水的质量和化学性质不发生改变,此时水的作用是_______________。
(3)如图1分别将2g高锰酸钾加入到A、B两支试管中,A试管中固体全部溶解B试管中固体部分溶解,该实验说明物质的溶解性和_______________有关。
(4)甲、乙、丙三种固体物质的溶解度曲线如图2所示,请回答下列问题:
①甲、乙两物质溶解度相等时的温度为_______________℃;
②t1℃时,丙物质的饱和溶液中溶质质量分数为________________(结果精确到0.1% );
③将t3℃甲、乙、丙三种物质的饱和溶液降温至0℃,所得溶液中溶质质量分数的大小关系为___________。
21.水是一种重要的自然资源,是生活、生产必不可少的物质.
(1)如图所示,实验I是制备蒸馏水的装置,实验II是电解水的装置.
①实验Ⅰ中水从A转移到B中,体现分子的性质是_______.
②实验Ⅱ中反应的化学方程式是_______.试管D中产生的气体可以使带火星的木条复燃,当试管D中气体的体积为n时,试管C中气体体积约为___.
(2)如图是甲、乙两种固体物质的溶解度曲线.
①t2℃时,甲、乙两种物质的饱和溶液所含溶质的质量相同,则溶液质量的大小关系为甲____乙(填“>”、“<”或“=”).
②将甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是_____(填字母序号).
A 溶剂的质量一定变小 B 溶质的质量可能不变 C 溶质的质量分数一定变大 D 溶液的质量一定变大 E 该饱和溶液还可以溶解其它物质
(3)下图是硝酸钾的溶解度曲线.某同学进行了如下实验,得到相应的溶液①~⑤.下列说法正确的是___(填字母序号).
A ④→⑤可析出53.9g KNO3晶体
B ②③⑤中溶质的质量分数相等
C ①③④均为不饱和溶液
D 保持温度不变,若在④中加入6gKNO3固体可得到饱和溶液.
22.从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是___________;金属B是___________。
(2)操作a的名称是___________;在过程中需要使用玻璃棒,其作用是___________。
(3)写出步骤②所涉及的化学反应方程式__________,该反应属于的基本反应类型是______。判断步骤②硫酸是否适量的依据是________。若没有稀硫酸,步骤②可以加入适量的____溶液。
(4)将某Fe-Cu合金样品20g,放入足量的稀硫酸中,产生氢气质量与反应时间的关系如图。实验测得20g该合金样品与70.6g某稀硫酸恰好完全反应,求此时所得溶液中溶质的质量分数______。(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.A
4.A
5.C
6.C
7.D
8.D
9.B
10.C
11.D
12.C
13.C
14.C
15.C
16.C
17. C 500 增大 13 乙=丙>甲 B 溶液 1.775
18. ①②⑦⑧ 石灰石和稀盐酸 CaCO3+2HCl=CaCl2+H2O+CO2↑ 试管 ①③④⑤⑥ 氯酸钾和二氧化锰 2KClO32KCl+3O2↑ 解:设参加反应的硫酸的质量为x,
硫酸中溶质的质量分数为×100%=19.6%;
答:硫酸中溶质的质量分数为19.6%。
19. CBA .C 100 小于 漏斗 4.5 500
20. C 作催化剂 温度 t2 28.6% 乙>甲=丙(或丙=甲<乙)
21. 分子在不断运动 2H2O2H2↑+O2↑ 2n < BE CD
22. 铁 铜 过滤 引流 置换反应 向溶液中加入镁,观察有无气泡产生 硫酸铜 20%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.一杯70 ℃的硝酸钾饱和溶液,冷却后有晶体析出(晶体不含结晶水),若不考虑溶剂的蒸发,则剩余溶液与原溶液相比
A.由饱和溶液变为不饱和溶液
B.溶质质量不变
C.溶液质量不变
D.溶质的质量分数减小
2.下列条件下的氢氧化钙溶液最浓的是( )
A.80℃时的不饱和溶液 B.20℃时的不饱和溶液
C.80℃时的饱和溶液 D.20℃时的饱和溶液
3.按下列方法配制的溶液,其溶质质量分数为5%的是
A.称取5.0 g氯化钾,溶解在95 mL水中,充分搅拌
B.称取5.0 g生石灰,放入95 mL水中,充分搅拌
C.量取5.0 mL浓盐酸,倒入95 mL水中,充分搅拌
D.称取5.0 g二氧化锰,放入95 mL水中,充分搅拌
4.保持温度不变,小心蒸发NaCl不饱和溶液(蒸发皿中始终有溶液),则溶液中溶质的质量分数(m%)与时间(t)的关系合理的是
A. B. C. D.
5.下列说法正确的是
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
6.如图是甲、乙固体的溶解度曲线。下列说法正确的是
A.图中P点所表示的溶液是t3℃时甲的饱和溶液
B.可用t1℃时20%的甲溶液配制10%的甲溶液
C.若甲中含有少量乙,可采用冷却热饱和溶液的方法提纯甲
D.分别将t3℃等质量的甲、乙饱和溶液降温至t2℃,析出晶体质量相等
7.下列有关溶液及溶解度的说法正确的是( )
A.同一种溶质的水溶液,饱和溶液中溶质的质量分数一定大于不饱和溶液中溶质的质量分数
B.在T℃时,某物质A的溶液,若蒸发掉5克水时,析出A(不含结晶水)2克;若蒸发掉10克水时,析出A 5克。则T℃时,A的溶解度为40克
C.室温下,5mL水和5mL酒精混合后总体积为10mL
D.现要配制10%的稀硫酸2940g,用98%的浓硫酸进行稀释,需加水2640g.
8.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
9.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
10.实验室有一瓶稀盐酸,欲测定其溶质的质量分数,取200g样品于烧杯中,先加入12.5g大理石粉末,充分反应后得固液混合物208.1g,再继续加入25g该种大理石粉末,充分反应后过滤,得滤液211.2g,则该瓶稀盐酸中溶质的质量分数为
A.14.6% B.3.65% C.7.3% D.10.95%
11.氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。
其中措施正确的是
A.①②④ B.①③④ C.①③⑤ D.①②⑤
12.要使质量分数为10%的氯化钠溶液50g 变成质量分数为20%的氯化钠溶液,可采取的方法是
A.加入5g氯化钠 B.蒸发20g水
C.加入50g的30%氯化钠溶液 D.将溶液取出25g
13.某温度下,在100g质量分数为20%的KNO3不饱和溶液甲中加入10gKNO3固体,恰好得到饱和溶液乙。下列说法正确的是( )
A.该温度下,KNO3的溶解度为30g
B.乙溶液的质量分数为30%
C.降低温度,可以使甲溶液变成饱和溶液
D.升高温度,甲、乙两溶液的质量分数都增大
14.如图是A、B两种固体物质的溶解度曲线,下列说法正确的是
A.A的溶解度都大于B的溶解度
B.t1℃时,用等量水分别制成的A、B饱和溶液中,A的质量比B大
C.t2℃时,A、B两种饱和溶液中,溶质的质量分数相等
D.A、B两种饱和溶液都从t3℃降温到t2℃,析出的晶体一定等量
15.如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是( )
A.t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c
B.t2℃时,将50ga物质(不含结晶水)放入100g水中充分溶解得到a的饱和溶液
C.将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是b>a=c
D.将c的饱和溶液变为不饱和溶液,可采用降温的方法
16.硝酸钾可作为无土栽培的一种营养液。现将 25%的硝酸钾溶液稀释成 200g 10%来用于培植营养液,则需加水( )
A.80g B.300g C.120g D.100g
二、综合应用题
17.海水是一种宝贵的资源。
(1)海水晒盐提取食盐后留下的母液叫卤水,卤水中除含外还含有、等物质。它们的溶解度曲线如图(1)所示。下列说法正确的是_________。
A:0℃时,三种物质的饱和溶液中,溶质质量分数最大的是
B.三种物质的溶解度都随温度升高而不断增大
C.将卤水加热到80℃以上蒸发水分,逐渐析出的晶体是和
D.20°时向40g固体和40g固体中分别加入100g水充分溶解后,两种溶液均能达到饱和状态
(2)海上航行缺乏饮用水时可采用图(2)装置获得淡水。用该装置将2000g含氯化钠3%的海水暴晒4小时后,剩余海水中氯化钠的质量分数为4%,则收集到的可饮用水为_________ g。
(3)海水中的硼酸(化学式为)可用于玻璃业,下表为硼酸的部分溶解度数据。
温度/℃ 0 20 40 60 80
溶解度/(g/100g水) 3 5 9 15 23
①由表可知,硼酸的溶解度随着温度的升高而_________(填“增大”“减小”或“不变”)。
②60℃时,100g硼酸饱和溶液中含有硼酸_________g(保留整数)。
③某同学设计如图(3)实验探究“温度”及“固体溶质的形态”对溶解速率的影响。
a.上述三个烧杯中,所得溶液浓度的大小关系是_________(用“甲”“乙”“丙”表示)
b.若要达到实验目的,需改变实验甲中的一个条件是_________(填编号)。
A.将20℃的水改为80℃ B.将水的体积改为50mL C.将粉末状固体改为块状
(4)某同学取模拟海水(含,、)200g,向溶液中先滴加足量的_________,充分反应后,过滤,在滤液中滴加10%的硝酸银溶液,其沉淀质量变化如图(4)所示,测得模拟海水中氯元素的质量分数为_________%(保留三位小数)。
18.实验室里现有氯酸钾、二氧化锰、稀硫酸、石灰石和稀盐酸以及下列仪器:
(1)利用上述仪器和药品可以制取二氧化碳,你选择的仪器是______(填序号),药品是______,反应的化学方程式为______。
(2)若补充一种仪器______(填仪器名称),再利用上述仪器和药品还可以制取氧气,你选择的仪器是______(填序号),药品是______,反应的化学方程式为______。
(3)100g某硫酸恰好与13g锌完全反应,试计算这种硫酸中溶质的质量分数。______
19.溶液与人类生产、生活密切相关。
(1)A、B、C三种固体物质的溶解度曲线如图所示。
①时,A、B、C三种物质的溶解度由大到小的顺序是 _____ 。
②A、B、C三种物质中,溶解度随温度升高而减小的是 _____ 。
③时,完全溶解ag A物质最少需要水的质量是 _____ g。
④时,相同质量的A、B饱和溶液中,A的饱和溶液中所含水的质量 _____ B的饱和溶液中所含水的质量(填“大于”、“等于”或“小于”)
(2)实验室欲除去粗盐样品中含有的不溶性泥沙,在过滤操作中需要用到的实验仪器和用品有:烧杯、铁架台(带铁圈)、玻璃棒、 _____ 和滤纸。
(3)在实验室中,配制溶质质量分数为的氯化钠溶液45g,需要氯化钠固体的质量是 _____ g。将的氯化钠溶液配成含氯化钠为0.9%的溶液,得到氯化钠溶液的质量是 _____ g。
20.水是生命之源,人类的生产、生活离不开水。
(1)我国规定生活饮用水的水质必须达到下列四项指标,通过过滤可达到_____________ (填字母序号)。
A无异色
B无异味
C澄清透明
D无细菌和病毒
(2)镁与碘的化合反应十分缓慢,若滴加少量水,则反应立即剧烈进行,反应前后水的质量和化学性质不发生改变,此时水的作用是_______________。
(3)如图1分别将2g高锰酸钾加入到A、B两支试管中,A试管中固体全部溶解B试管中固体部分溶解,该实验说明物质的溶解性和_______________有关。
(4)甲、乙、丙三种固体物质的溶解度曲线如图2所示,请回答下列问题:
①甲、乙两物质溶解度相等时的温度为_______________℃;
②t1℃时,丙物质的饱和溶液中溶质质量分数为________________(结果精确到0.1% );
③将t3℃甲、乙、丙三种物质的饱和溶液降温至0℃,所得溶液中溶质质量分数的大小关系为___________。
21.水是一种重要的自然资源,是生活、生产必不可少的物质.
(1)如图所示,实验I是制备蒸馏水的装置,实验II是电解水的装置.
①实验Ⅰ中水从A转移到B中,体现分子的性质是_______.
②实验Ⅱ中反应的化学方程式是_______.试管D中产生的气体可以使带火星的木条复燃,当试管D中气体的体积为n时,试管C中气体体积约为___.
(2)如图是甲、乙两种固体物质的溶解度曲线.
①t2℃时,甲、乙两种物质的饱和溶液所含溶质的质量相同,则溶液质量的大小关系为甲____乙(填“>”、“<”或“=”).
②将甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是_____(填字母序号).
A 溶剂的质量一定变小 B 溶质的质量可能不变 C 溶质的质量分数一定变大 D 溶液的质量一定变大 E 该饱和溶液还可以溶解其它物质
(3)下图是硝酸钾的溶解度曲线.某同学进行了如下实验,得到相应的溶液①~⑤.下列说法正确的是___(填字母序号).
A ④→⑤可析出53.9g KNO3晶体
B ②③⑤中溶质的质量分数相等
C ①③④均为不饱和溶液
D 保持温度不变,若在④中加入6gKNO3固体可得到饱和溶液.
22.从含有金属镁、铁、铜的粉末中,分离和提取出重要化工原料MgSO4和有关金属,实验过程如下:
请回答:
(1)操作①中被磁铁吸引的金属A是___________;金属B是___________。
(2)操作a的名称是___________;在过程中需要使用玻璃棒,其作用是___________。
(3)写出步骤②所涉及的化学反应方程式__________,该反应属于的基本反应类型是______。判断步骤②硫酸是否适量的依据是________。若没有稀硫酸,步骤②可以加入适量的____溶液。
(4)将某Fe-Cu合金样品20g,放入足量的稀硫酸中,产生氢气质量与反应时间的关系如图。实验测得20g该合金样品与70.6g某稀硫酸恰好完全反应,求此时所得溶液中溶质的质量分数______。(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.D
3.A
4.A
5.C
6.C
7.D
8.D
9.B
10.C
11.D
12.C
13.C
14.C
15.C
16.C
17. C 500 增大 13 乙=丙>甲 B 溶液 1.775
18. ①②⑦⑧ 石灰石和稀盐酸 CaCO3+2HCl=CaCl2+H2O+CO2↑ 试管 ①③④⑤⑥ 氯酸钾和二氧化锰 2KClO32KCl+3O2↑ 解:设参加反应的硫酸的质量为x,
硫酸中溶质的质量分数为×100%=19.6%;
答:硫酸中溶质的质量分数为19.6%。
19. CBA .C 100 小于 漏斗 4.5 500
20. C 作催化剂 温度 t2 28.6% 乙>甲=丙(或丙=甲<乙)
21. 分子在不断运动 2H2O2H2↑+O2↑ 2n < BE CD
22. 铁 铜 过滤 引流 置换反应 向溶液中加入镁,观察有无气泡产生 硫酸铜 20%
答案第1页,共2页
答案第1页,共2页
同课章节目录
