10.2酸和碱的中和反应同步测试——2021-2022学年人教版九年级下册(word版 含答案)
文档属性
| 名称 | 10.2酸和碱的中和反应同步测试——2021-2022学年人教版九年级下册(word版 含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 217.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-19 00:00:00 | ||
图片预览



文档简介
10.2 酸和碱的中和反应
一、单选题
1.如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图。下列有关说法正确的是:
A.反应前后,溶液的pH不变
B.反应前后,Na+和Cl-的数目不变
C.反应前后,H+和OH-的数目不变
D.反应前后,H2O的数目不变
2.实验小组用pH传感器探究稀盐酸和氢氧化钠溶液的反应,实验中溶液pH的变化如图所示。下列说法正确的是( )
A.该实验是将氢氧化钠溶液滴加到稀盐酸中
B.向a点时的溶液中滴加无色酚酞试液,酚酞试液不变色
C.c点时的溶液中溶质只有氯化钠
D.该反应的微观实质是H+和OH﹣结合生成H2O
3.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
4.生活中一些物质的pH如下:
物质 白醋 橘子汁 料酒 炉具清洁剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是A.白醋 B.橘子汁 C.料酒 D.炉具清洁剂
5.推理是化学学习中常用的思维方法。下列推理正确的是( )
A.酸碱中和反应有盐和水生成,则有盐和水生成的反应一定是酸碱中和反应
B.碱能使无色酚酞溶液变红,则能使无色酞溶液变红的一定是碱
C.单质是由同种元素组成的,则由同种元素组成的物质一定是单质
D.浓硫酸敞放于空气中浓度会减小,则可证明浓硫酸具有吸水性
6.U形管中是滴有酚酞试液的蒸馏水,向左、右两管中分别同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。下列说法正确的是
A.开始时左边溶液呈蓝色,右边溶液呈红色
B.开始时左边溶液呈无色,右边溶液呈红色、
C.充分反应后U形管中溶液可能呈红色
D.充分反应后U形管中溶液一定呈无色
7.下列关于氢氧化钠的描述中不正确的是
A.曝露在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊溶液变红 D.对皮肤有强烈的腐蚀作用
8.分别向甲、乙、丙三种无色溶液中滴加紫色石蕊试液,观察到甲溶液变红色,乙溶液变蓝色,丙溶液变紫色。则它们的pH由小到大的排列是( )
A.甲、乙、丙 B.甲、丙、乙 C.乙、甲、丙 D.丙、甲、乙
9.有关下列说法正确的是
A.生活中用洗涤剂去油污和用汽油去油污的原理相同
B.用硫酸除铁锈,是利用的中和反应原理
C.酒精溶液不导电,是因为不存在自由移动的离子
D.用肥皂水无法区分蒸馏水和硝酸镁溶液
10.中和反应在工农业生产和日常生活中有广泛的用途.下列应用一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤
B.用胃舒平(主要成分氢氧化铝)治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
11.下列应用与中和反应原理无关的是
A.用浓硫酸干燥湿润的氧气
B.用熟石灰改良酸性土壤
C.服用含氢氧化铝的药物治疗胃酸过多
D.用氢氧化钠溶液洗涤石油产品中的残留硫酸
12.碳酸锌与碳酸钙其有相似的化学性质。现将12.5g碳酸锌固体高温锻烧一段时间,冷却后,向剩余固体中加入足量稀硫酸。下列结论正确的个数是
①共生成16.1g硫酸锌
②煅烧越充分则消耗的硫酸越少
③煅烧后固体中氧元素的质量分数减小
④最终生成二氧化碳的总质量与煅烧时间的长短有关
A.1个 B.2个 C.3个 D.4个
13.某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中
D.由c点到d点的变化过程中没有发生化学反应
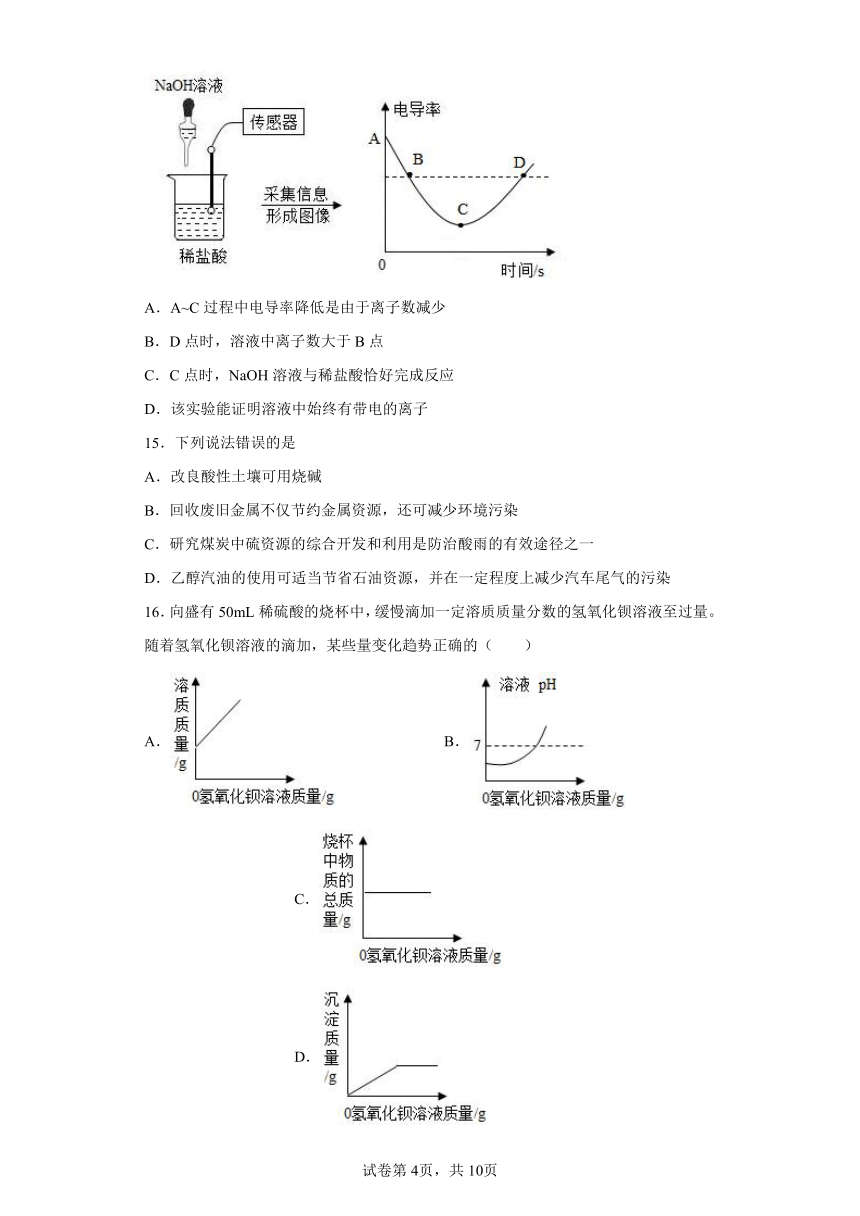
14.某同学利用数据传感技术测定溶液中电导率来辅助探究中和反应,如下图。已知:电导率与溶液中离子浓度(单位体积离子数)成正比。下列说法不正确的是
A.A~C过程中电导率降低是由于离子数减少
B.D点时,溶液中离子数大于B点
C.C点时,NaOH溶液与稀盐酸恰好完成反应
D.该实验能证明溶液中始终有带电的离子
15.下列说法错误的是
A.改良酸性土壤可用烧碱
B.回收废旧金属不仅节约金属资源,还可减少环境污染
C.研究煤炭中硫资源的综合开发和利用是防治酸雨的有效途径之一
D.乙醇汽油的使用可适当节省石油资源,并在一定程度上减少汽车尾气的污染
16.向盛有50mL稀硫酸的烧杯中,缓慢滴加一定溶质质量分数的氢氧化钡溶液至过量。随着氢氧化钡溶液的滴加,某些量变化趋势正确的( )
A. B. C. D.
二、综合应用题
17.溶液对于动植物的生理活动和人类生产,生活、科学研究具有重受意义。
(1)某化学实验小组欲配制100g溶质质量分数为20%的氢氧化钠溶液,按如图所示步骤进行操作:
①计算:需要NaOH固体_____g和水_____mL(水的密度约为1.0g/mL)。
②称量(或量取):如图操作中有一处错误,即_____。
③溶解:将量筒量取好的水倒入盛有NaOH的烧杯中,用玻璃棒搅拌至固体全部溶解即可。
④存放:将配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(2)小组成员在反思与交流时,意识到实验过程中的错误操作会影响最终所配溶液的溶质质量分数,因此,需要对所配氢氧化钠溶液的溶质质量分数进行重新测定并更新标签,其实验方案如下:
取上述所配氢氧化钠溶液50g,逐滴滴入溶质质量分数为7.3%的稀盐酸。该实验过程中所加稀盐酸的质量与溶液pH的变化曲线如图F所示。
①当滴入稀盐酸60g时(即图中A点),此时所得溶液中的溶质为_____(写化学式)。
②当滴入稀盐酸100g时(即图中B点),溶液pH恰好为7。试根据化学方程式计算:该实验所配氢氧化钠溶液的溶质质量分数实际为______ ?(即试剂瓶标签上的实际浓度填写,结果精确至0.1%)
18.化学兴趣小组活动中,甲、乙、丙三位同学对某化工厂的污水取样后进行了相关实验,请回答下列问题。
I.用pH试纸检测污水的酸碱性。三位同学分别进行如下实验:
甲同学:取pH试纸于表面皿上,用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7.
乙同学:取pH试纸于表面皿上,先用蒸馏水湿润,再用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7。
丙同学:取pH试纸直接浸入待测液中,测得pH <7.
(1)以上三位同学中操作规范的是___________同学。
Ⅱ.利用中和反应原理测定污水中污染物(设为盐酸)的质量分数。甲、乙两同学设计的方案分别如图甲、图乙所示:
(2)甲同学取少量图甲所示反应后的溶液于试管中,滴加3滴紫色石蕊试液,溶液呈蓝色,于是得出了“两种物质已恰好中和”的结论,甲同学的结论是否正确 _____________ (选填“正确”或“不正确”),理由是______________。
(3)乙同学按图乙方案进行实验,实验过程中,NaOH溶液必须用胶头滴管逐滴加入,且用玻璃棒不断搅拌。当观察到____________现象时, 停止滴加NaOH溶液,此时可认为酸碱恰好完全反应。
(4)若要除去污水中的盐酸,从环保、原材料成本等角度考虑,最好选用________________。
A NaOH
B Ca(OH)2
C Fe2O3
D CaCO3
(5)若图乙方案实验中共消耗了NaOH溶液20g,请计算:
①20g NaOH溶液中溶质质量=______________g.
②污水中HCl的质量分数是多少 ____ (列式计算)
19.兴趣小组的同学对金属的某些性质进行相关探究。
【实验回顾】
(1)如图所示,将两块金属片进行相互刻划。该实验的目的是_____。
(2)用坩埚钳夹住一块铝箔在酒精灯上加热至较高温度时,轻轻摇晃,发现熔化的铝不滴落,好像有一层膜兜着(资料:铝的熔点660℃,氧化铝的熔点2054℃。)。请解释原因_____。
【实验探究】铝与氯化铜溶液的反应
将打磨过的铝片放在15%氯化铜溶液中,观察到铝片表面逸出大量无色气体,且附着红色物质,过一段时间还有白色沉淀产生。利用温度传感器和pH传感器监测实验过程中的相关数据(如图所示)。
【实验反思】
(1)写出生成红色物质的化学方程式为_____。
(2)结合图1分析,铝和氯化铜溶液反应生成的无色气体是_____(填名称)。
【提出问题】白色沉淀的化学成分是什么?
【查阅资料】
①氢氧化铝、氯化亚铜(CuCl)均是难溶于水的白色固体。
②CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl—。
③Cu(NH3)2+在空气中易被氧化变为蓝色;Cl—可与硝酸银溶液反应,产生白色沉淀。
【实验方案】将上述实验中产生的沉淀过滤出来,并洗涤干净后,加入浓氨水,沉淀部分溶解得到无色溶液,将无色溶液分为两份,进行实验。
操作步骤 实验现象 实验结论
用试管取其中一份溶液,滴加适量AgNO3溶液 _____ 该溶液中含有Cl—
将另一份溶液置于空气中一段时间 _____ 该溶液中含有Cu(NH3)2+
【实验结论】通过实验可以确定,该白色固体是CuCl。
【反思与评价】
(1)小组同学将Cu粉与15%CuCl2溶液混合,没有观察到白色沉淀。在老师的启发下,结合图2“温度-时间变化曲线”,对实验进行改进,确证了Cu与CuCl2溶液反应生成CuCl。请你写出改进后的实验方案是_____。
(2)经过讨论CuCl是Cu与CuCl2化合反应生成。
【思维拓展】
(1)金属锌、铜和稀硫酸构成化学电池(如图)。观察到铜片表面有气泡(H2),小电珠发光、烧杯中溶液始终无色。下列关于实验的分析不正确的是_____(填序号)。
A 铜与稀硫酸发生了置换反应
B 铜的金属活动性变得比锌强
C 烧杯中溶液的pH会逐渐增大
D 该装置将电能转化为化学能
(2)某工厂化验室用20%NaOH溶液来中和上图实验前烧杯中的H2SO4,共消耗NaOH溶液20g,反应后的溶液呈中性,则上图烧杯中原来所含H2SO4的质量为_____(写出计算过程)。
20.回答下列问题
(1)用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示。由图可知,该反应是将______(选填“酸加入碱中”或“碱加入酸中”)熟石灰与盐酸反应的化学方程式为___________;当加入熟石灰mg时,溶液中的溶质为___________。若改用ng氢氧化钠与相同量盐酸反应,所得溶液的pH___________7(填“>”、“<”或“=”)。
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体;以下是探究白色固体成分的实验,已知CaCl2溶液呈中性。请填写下表:
实验操作 测定结果 白色固体成分
用pH试纸测定反应后溶液的酸碱度 操作方法___________ pH>7 __________
________ CaCl2
实验反思:无明显现象的中和反应可借助酸碱指示剂判断是否发生。
(3)LiOH和NaOH的化学性质相似。“神舟”飞船内,可用盛有LiOH的过滤网吸收航天员呼出的气体,以降低CO2含量。请计算:用LiOH完全吸收176gCO2生成Li2CO3和H2O,理论上至少需要LiOH的质量是多少?(写出计算过程)
21.探索化学世界的奥秘,需要掌握科学的方法。
⑴实验是学习化学的一条重要途径。观察下图实验装置,回答下列问题。
若用高锰酸钾来制取氧气,应选择装置______(填字母),化学反应方程式为______;为了在较短时间内获得尽可能纯净的氧气,所选的收集装置为______(填字母)。
⑵“宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方式。图A、B是从不同视角对稀盐酸与氢氧化钠的反应描述,其中图A表示实际操作,图B表示反应过程中微观粒子的变化情况。
①图A中仪器a的名称是______。
②由图B可以看出,该反应中实际参与反应的离子是______(填离子符号)。
③另取29.4g稀硫酸于烧杯中,匀速滴加质量分数为15%的NaOH溶液,并用传感器实时测定混合溶液的pH和温度变化情况,所得曲线如图C。
根据图C分析,硫酸和氢氧化钠的反应属于______(填“吸热”或“放热”)反应;若当加入的NaOH溶液的质量为40g时,混合溶液的pH=7,试求所用的稀硫酸中溶质的质量分数______(写出解题过程,否则不得分)。
22.某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
(1)配制溶液:
①配制200g 8%的氢氧化钠溶液,需水的体积为___________mL(水的密度近似看作1g/cm3)。
②称量时先调节托盘天平平衡,将一只烧杯放在托盘天平的___________盘,称量其质量。然后___________(按操作的先后顺序选填字母),直至天平平衡。
A将氢氧化钠固体加入烧杯中 B按需要添加砝码、移动游码
③加水充分溶解,并冷却至室温(约20℃)。
(2)如图表示用上述配制的氢氧化钠溶液与20g某稀盐酸发生反应过程中,使用数字传感仪测得溶液温度变化的曲线。
①当加入15g氢氧化钠溶液时,所得溶液中的溶质为___________(用化学式表示)。
②加入___________g氢氧化钠溶液,恰好完全中和。
③试计算此盐酸的溶质质量分数_________。(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.D
4.D
5.D
6.C
7.C
8.B
9.C
10.C
11.A
12.B
13.D
14.A
15.A
16.D
17. 20 80 B中仰视量筒(或视线没有与凹液面最低处相平) NaOH、NaCl 16.0%
18. 甲 不正确 溶液呈蓝色,说明氢氧化钠溶液已过量 无色溶液刚刚变为红色时 D 0.008 0.0365%
19. 比较硬度 氧气和铝生成了一层致密的氧化铝氧化膜,氧化铝的熔点高于铝。 2Al+3CuCl2=3Cu+2AlCl3 氢气 生成白色沉淀 溶液变为蓝色 加热观察是否产生白色沉淀,若加热沉淀出现说明Cu与CuCl2反应生成CuCl,若不产生沉淀说明Cu不与CuCl2反应生成CuCl。 ABD 4.9g(详见解析)
20.(1) 碱加入酸中 Ca(OH)2+2HCl=CaCl2+H2O HCl、CaCl2 <
(2) 用玻璃棒蘸取待测液,然后点在pH试纸上,将pH试纸与标准比色卡比较 Ca(OH)2 pH=7
(3)192g
解:设理论上至少需要LiOH的质量是x
x=192g
答:理论上至少需要LiOH的质量是192g。
21. A 2KMnO4 K2MnO4 + MnO2 + O2↑ C 烧杯 H+、OH-(漏、误均不得分) 放热 25%或0.25
22.(1) 184 左 BA
(2) NaCl、HCl 20 设氯化氢的质量为x
x=1.46g
盐酸的溶质质量分数为:
答:此盐酸的溶质质量分数为7.3%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图。下列有关说法正确的是:
A.反应前后,溶液的pH不变
B.反应前后,Na+和Cl-的数目不变
C.反应前后,H+和OH-的数目不变
D.反应前后,H2O的数目不变
2.实验小组用pH传感器探究稀盐酸和氢氧化钠溶液的反应,实验中溶液pH的变化如图所示。下列说法正确的是( )
A.该实验是将氢氧化钠溶液滴加到稀盐酸中
B.向a点时的溶液中滴加无色酚酞试液,酚酞试液不变色
C.c点时的溶液中溶质只有氯化钠
D.该反应的微观实质是H+和OH﹣结合生成H2O
3.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
4.生活中一些物质的pH如下:
物质 白醋 橘子汁 料酒 炉具清洁剂
pH 2~3 3~4 6~7 12~13
其中能使无色酚酞溶液变红的是A.白醋 B.橘子汁 C.料酒 D.炉具清洁剂
5.推理是化学学习中常用的思维方法。下列推理正确的是( )
A.酸碱中和反应有盐和水生成,则有盐和水生成的反应一定是酸碱中和反应
B.碱能使无色酚酞溶液变红,则能使无色酞溶液变红的一定是碱
C.单质是由同种元素组成的,则由同种元素组成的物质一定是单质
D.浓硫酸敞放于空气中浓度会减小,则可证明浓硫酸具有吸水性
6.U形管中是滴有酚酞试液的蒸馏水,向左、右两管中分别同时逐滴滴加一定量的氢氧化钠稀溶液和稀盐酸(如图所示)。下列说法正确的是
A.开始时左边溶液呈蓝色,右边溶液呈红色
B.开始时左边溶液呈无色,右边溶液呈红色、
C.充分反应后U形管中溶液可能呈红色
D.充分反应后U形管中溶液一定呈无色
7.下列关于氢氧化钠的描述中不正确的是
A.曝露在空气中易潮解 B.能与酸发生中和反应
C.其水溶液能使石蕊溶液变红 D.对皮肤有强烈的腐蚀作用
8.分别向甲、乙、丙三种无色溶液中滴加紫色石蕊试液,观察到甲溶液变红色,乙溶液变蓝色,丙溶液变紫色。则它们的pH由小到大的排列是( )
A.甲、乙、丙 B.甲、丙、乙 C.乙、甲、丙 D.丙、甲、乙
9.有关下列说法正确的是
A.生活中用洗涤剂去油污和用汽油去油污的原理相同
B.用硫酸除铁锈,是利用的中和反应原理
C.酒精溶液不导电,是因为不存在自由移动的离子
D.用肥皂水无法区分蒸馏水和硝酸镁溶液
10.中和反应在工农业生产和日常生活中有广泛的用途.下列应用一定与中和反应原理无关的是
A.施用熟石灰改良酸性土壤
B.用胃舒平(主要成分氢氧化铝)治疗胃酸过多
C.用熟石灰和硫酸铜配制波尔多液
D.用NaOH溶液洗涤石油产品中的残余硫酸
11.下列应用与中和反应原理无关的是
A.用浓硫酸干燥湿润的氧气
B.用熟石灰改良酸性土壤
C.服用含氢氧化铝的药物治疗胃酸过多
D.用氢氧化钠溶液洗涤石油产品中的残留硫酸
12.碳酸锌与碳酸钙其有相似的化学性质。现将12.5g碳酸锌固体高温锻烧一段时间,冷却后,向剩余固体中加入足量稀硫酸。下列结论正确的个数是
①共生成16.1g硫酸锌
②煅烧越充分则消耗的硫酸越少
③煅烧后固体中氧元素的质量分数减小
④最终生成二氧化碳的总质量与煅烧时间的长短有关
A.1个 B.2个 C.3个 D.4个
13.某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是
A.图中c点所示溶液呈碱性
B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4
C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中
D.由c点到d点的变化过程中没有发生化学反应
14.某同学利用数据传感技术测定溶液中电导率来辅助探究中和反应,如下图。已知:电导率与溶液中离子浓度(单位体积离子数)成正比。下列说法不正确的是
A.A~C过程中电导率降低是由于离子数减少
B.D点时,溶液中离子数大于B点
C.C点时,NaOH溶液与稀盐酸恰好完成反应
D.该实验能证明溶液中始终有带电的离子
15.下列说法错误的是
A.改良酸性土壤可用烧碱
B.回收废旧金属不仅节约金属资源,还可减少环境污染
C.研究煤炭中硫资源的综合开发和利用是防治酸雨的有效途径之一
D.乙醇汽油的使用可适当节省石油资源,并在一定程度上减少汽车尾气的污染
16.向盛有50mL稀硫酸的烧杯中,缓慢滴加一定溶质质量分数的氢氧化钡溶液至过量。随着氢氧化钡溶液的滴加,某些量变化趋势正确的( )
A. B. C. D.
二、综合应用题
17.溶液对于动植物的生理活动和人类生产,生活、科学研究具有重受意义。
(1)某化学实验小组欲配制100g溶质质量分数为20%的氢氧化钠溶液,按如图所示步骤进行操作:
①计算:需要NaOH固体_____g和水_____mL(水的密度约为1.0g/mL)。
②称量(或量取):如图操作中有一处错误,即_____。
③溶解:将量筒量取好的水倒入盛有NaOH的烧杯中,用玻璃棒搅拌至固体全部溶解即可。
④存放:将配制好的溶液装入试剂瓶中,盖好瓶塞并贴上标签。
(2)小组成员在反思与交流时,意识到实验过程中的错误操作会影响最终所配溶液的溶质质量分数,因此,需要对所配氢氧化钠溶液的溶质质量分数进行重新测定并更新标签,其实验方案如下:
取上述所配氢氧化钠溶液50g,逐滴滴入溶质质量分数为7.3%的稀盐酸。该实验过程中所加稀盐酸的质量与溶液pH的变化曲线如图F所示。
①当滴入稀盐酸60g时(即图中A点),此时所得溶液中的溶质为_____(写化学式)。
②当滴入稀盐酸100g时(即图中B点),溶液pH恰好为7。试根据化学方程式计算:该实验所配氢氧化钠溶液的溶质质量分数实际为______ ?(即试剂瓶标签上的实际浓度填写,结果精确至0.1%)
18.化学兴趣小组活动中,甲、乙、丙三位同学对某化工厂的污水取样后进行了相关实验,请回答下列问题。
I.用pH试纸检测污水的酸碱性。三位同学分别进行如下实验:
甲同学:取pH试纸于表面皿上,用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7.
乙同学:取pH试纸于表面皿上,先用蒸馏水湿润,再用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7。
丙同学:取pH试纸直接浸入待测液中,测得pH <7.
(1)以上三位同学中操作规范的是___________同学。
Ⅱ.利用中和反应原理测定污水中污染物(设为盐酸)的质量分数。甲、乙两同学设计的方案分别如图甲、图乙所示:
(2)甲同学取少量图甲所示反应后的溶液于试管中,滴加3滴紫色石蕊试液,溶液呈蓝色,于是得出了“两种物质已恰好中和”的结论,甲同学的结论是否正确 _____________ (选填“正确”或“不正确”),理由是______________。
(3)乙同学按图乙方案进行实验,实验过程中,NaOH溶液必须用胶头滴管逐滴加入,且用玻璃棒不断搅拌。当观察到____________现象时, 停止滴加NaOH溶液,此时可认为酸碱恰好完全反应。
(4)若要除去污水中的盐酸,从环保、原材料成本等角度考虑,最好选用________________。
A NaOH
B Ca(OH)2
C Fe2O3
D CaCO3
(5)若图乙方案实验中共消耗了NaOH溶液20g,请计算:
①20g NaOH溶液中溶质质量=______________g.
②污水中HCl的质量分数是多少 ____ (列式计算)
19.兴趣小组的同学对金属的某些性质进行相关探究。
【实验回顾】
(1)如图所示,将两块金属片进行相互刻划。该实验的目的是_____。
(2)用坩埚钳夹住一块铝箔在酒精灯上加热至较高温度时,轻轻摇晃,发现熔化的铝不滴落,好像有一层膜兜着(资料:铝的熔点660℃,氧化铝的熔点2054℃。)。请解释原因_____。
【实验探究】铝与氯化铜溶液的反应
将打磨过的铝片放在15%氯化铜溶液中,观察到铝片表面逸出大量无色气体,且附着红色物质,过一段时间还有白色沉淀产生。利用温度传感器和pH传感器监测实验过程中的相关数据(如图所示)。
【实验反思】
(1)写出生成红色物质的化学方程式为_____。
(2)结合图1分析,铝和氯化铜溶液反应生成的无色气体是_____(填名称)。
【提出问题】白色沉淀的化学成分是什么?
【查阅资料】
①氢氧化铝、氯化亚铜(CuCl)均是难溶于水的白色固体。
②CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl—。
③Cu(NH3)2+在空气中易被氧化变为蓝色;Cl—可与硝酸银溶液反应,产生白色沉淀。
【实验方案】将上述实验中产生的沉淀过滤出来,并洗涤干净后,加入浓氨水,沉淀部分溶解得到无色溶液,将无色溶液分为两份,进行实验。
操作步骤 实验现象 实验结论
用试管取其中一份溶液,滴加适量AgNO3溶液 _____ 该溶液中含有Cl—
将另一份溶液置于空气中一段时间 _____ 该溶液中含有Cu(NH3)2+
【实验结论】通过实验可以确定,该白色固体是CuCl。
【反思与评价】
(1)小组同学将Cu粉与15%CuCl2溶液混合,没有观察到白色沉淀。在老师的启发下,结合图2“温度-时间变化曲线”,对实验进行改进,确证了Cu与CuCl2溶液反应生成CuCl。请你写出改进后的实验方案是_____。
(2)经过讨论CuCl是Cu与CuCl2化合反应生成。
【思维拓展】
(1)金属锌、铜和稀硫酸构成化学电池(如图)。观察到铜片表面有气泡(H2),小电珠发光、烧杯中溶液始终无色。下列关于实验的分析不正确的是_____(填序号)。
A 铜与稀硫酸发生了置换反应
B 铜的金属活动性变得比锌强
C 烧杯中溶液的pH会逐渐增大
D 该装置将电能转化为化学能
(2)某工厂化验室用20%NaOH溶液来中和上图实验前烧杯中的H2SO4,共消耗NaOH溶液20g,反应后的溶液呈中性,则上图烧杯中原来所含H2SO4的质量为_____(写出计算过程)。
20.回答下列问题
(1)用熟石灰中和一定量的盐酸时,溶液的pH与加入的熟石灰质量的关系如图所示。由图可知,该反应是将______(选填“酸加入碱中”或“碱加入酸中”)熟石灰与盐酸反应的化学方程式为___________;当加入熟石灰mg时,溶液中的溶质为___________。若改用ng氢氧化钠与相同量盐酸反应,所得溶液的pH___________7(填“>”、“<”或“=”)。
(2)某化学小组进行“酸和碱的中和反应”实验:将盐酸滴入一定量的澄清石灰水中,实验无明显现象。取反应后的部分溶液加热、蒸干、得到白色固体;以下是探究白色固体成分的实验,已知CaCl2溶液呈中性。请填写下表:
实验操作 测定结果 白色固体成分
用pH试纸测定反应后溶液的酸碱度 操作方法___________ pH>7 __________
________ CaCl2
实验反思:无明显现象的中和反应可借助酸碱指示剂判断是否发生。
(3)LiOH和NaOH的化学性质相似。“神舟”飞船内,可用盛有LiOH的过滤网吸收航天员呼出的气体,以降低CO2含量。请计算:用LiOH完全吸收176gCO2生成Li2CO3和H2O,理论上至少需要LiOH的质量是多少?(写出计算过程)
21.探索化学世界的奥秘,需要掌握科学的方法。
⑴实验是学习化学的一条重要途径。观察下图实验装置,回答下列问题。
若用高锰酸钾来制取氧气,应选择装置______(填字母),化学反应方程式为______;为了在较短时间内获得尽可能纯净的氧气,所选的收集装置为______(填字母)。
⑵“宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方式。图A、B是从不同视角对稀盐酸与氢氧化钠的反应描述,其中图A表示实际操作,图B表示反应过程中微观粒子的变化情况。
①图A中仪器a的名称是______。
②由图B可以看出,该反应中实际参与反应的离子是______(填离子符号)。
③另取29.4g稀硫酸于烧杯中,匀速滴加质量分数为15%的NaOH溶液,并用传感器实时测定混合溶液的pH和温度变化情况,所得曲线如图C。
根据图C分析,硫酸和氢氧化钠的反应属于______(填“吸热”或“放热”)反应;若当加入的NaOH溶液的质量为40g时,混合溶液的pH=7,试求所用的稀硫酸中溶质的质量分数______(写出解题过程,否则不得分)。
22.某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数。
(1)配制溶液:
①配制200g 8%的氢氧化钠溶液,需水的体积为___________mL(水的密度近似看作1g/cm3)。
②称量时先调节托盘天平平衡,将一只烧杯放在托盘天平的___________盘,称量其质量。然后___________(按操作的先后顺序选填字母),直至天平平衡。
A将氢氧化钠固体加入烧杯中 B按需要添加砝码、移动游码
③加水充分溶解,并冷却至室温(约20℃)。
(2)如图表示用上述配制的氢氧化钠溶液与20g某稀盐酸发生反应过程中,使用数字传感仪测得溶液温度变化的曲线。
①当加入15g氢氧化钠溶液时,所得溶液中的溶质为___________(用化学式表示)。
②加入___________g氢氧化钠溶液,恰好完全中和。
③试计算此盐酸的溶质质量分数_________。(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.D
4.D
5.D
6.C
7.C
8.B
9.C
10.C
11.A
12.B
13.D
14.A
15.A
16.D
17. 20 80 B中仰视量筒(或视线没有与凹液面最低处相平) NaOH、NaCl 16.0%
18. 甲 不正确 溶液呈蓝色,说明氢氧化钠溶液已过量 无色溶液刚刚变为红色时 D 0.008 0.0365%
19. 比较硬度 氧气和铝生成了一层致密的氧化铝氧化膜,氧化铝的熔点高于铝。 2Al+3CuCl2=3Cu+2AlCl3 氢气 生成白色沉淀 溶液变为蓝色 加热观察是否产生白色沉淀,若加热沉淀出现说明Cu与CuCl2反应生成CuCl,若不产生沉淀说明Cu不与CuCl2反应生成CuCl。 ABD 4.9g(详见解析)
20.(1) 碱加入酸中 Ca(OH)2+2HCl=CaCl2+H2O HCl、CaCl2 <
(2) 用玻璃棒蘸取待测液,然后点在pH试纸上,将pH试纸与标准比色卡比较 Ca(OH)2 pH=7
(3)192g
解:设理论上至少需要LiOH的质量是x
x=192g
答:理论上至少需要LiOH的质量是192g。
21. A 2KMnO4 K2MnO4 + MnO2 + O2↑ C 烧杯 H+、OH-(漏、误均不得分) 放热 25%或0.25
22.(1) 184 左 BA
(2) NaCl、HCl 20 设氯化氢的质量为x
x=1.46g
盐酸的溶质质量分数为:
答:此盐酸的溶质质量分数为7.3%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
