第12章盐基础练习—2021-2022学年九年级化学京改版(2013)下册(word版有答案)
文档属性
| 名称 | 第12章盐基础练习—2021-2022学年九年级化学京改版(2013)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 186.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-19 22:39:45 | ||
图片预览



文档简介
第12章盐基础练习2021-2022学年九年级化学京改版(2013)下册
一、单选题
1.下列各组离子在溶液中能大量共存的是( )
A.NH、SO、NO
B.H+、Ba2+、OH-
C.Fe2+、Na+、OH-
D.Ca2+、Cl-、CO
2.Na2CO3俗称纯碱,侯德榜为纯碱工业的发展做出了杰出贡献。Na2CO3属于
A.氧化物
B.盐
C.有机物
D.混合物
3.小明外出游玩,发现路边的小麦叶子发黄、有倒伏现象,他建议田主应该施用一种复合肥料,这种复合肥料是
A.CO(NH2)2
B.KCl
C.KNO3
D.NH4HCO3
4.某pH=12的无色溶液中大量存在的离子有Na+、Ba2+、NO、X,则X可能是
A.Cu2+ B.Cl- C.H+ D.SO
5.下图是甲转化为丁的微观过程。下列说法正确的是( )
A.转化①中原子种类不变,个数改变 B.转化②是化合反应
C.整个过程中共有2种氧化物 D.物质丁是复合肥
6.下列各图像中有关量的变化趋势与选项要求相符合的是
A.向含有NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸至过量
B.向等质量的锌粉、镁粉中分别加入少量的相同浓度相同质量的稀硫酸
C.向一定浓度的NaOH溶液中加入水
D.向一定质量的镁粉和银粉固体混合物中逐滴加入Cu(NO3)2溶液
7.下列离子组在强酸性和强碱性溶液中都能大量共存的是( )
A.,,, B.,,,
C.,,, D.,,,
8.关于碳酸钠的说法错误的是
A.易溶于水 B.可用于洗涤油污 C.受热易分解 D.可用于制造普通玻璃
9.下列溶液分别能跟硫酸铜、盐酸、碳酸钠溶液反应,并产生不同现象的是( )
A.Ca(OH)2 B.AgNO3 C.H2SO4 D.NaOH
10.利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如下:(反应条件已略去)
已知:
下列说法正确的是
A.步骤II中分离操作必须用到的玻璃仪器是烧杯和漏斗
B.溶液A中溶质是H2SO4、CuSO4
C.上述流程中物质B是锌,物质D是盐酸
D.A~E中都含有铜、锌两种元素的物质有A和C
11.下列有关NaOH的实验方案中,正确的是
A.用NaOH固体干燥CO2气体
B.用酚酞溶液检验NaOH溶液是否变质
C.用熟石灰和纯碱为原料制取NaOH
D.用CaCl2溶液除去NaOH溶液中的少量Na2CO3
二、简答题
12.回答下列与含碳物质有关的问题。
(1)金刚石、石墨都是碳元素组成的单质,但它们的物理性质差异较大,其原因是_____;
(2)下列说法中,正确的是_____。
A 干冰不是冰
B 某物质燃烧只生成CO2,则该物质一定是碳单质
C 在一定条件下,CO2、CO可以互相转化
D 用点燃的方法可除去CO2气体中少量的CO
(3)变质的 NaOH溶液中含有少量Na2CO3,除去其中杂质的方法是_____;
13.请用线段连接有对应关系的两行间的点(每个点只能连接一次)。
物质的类别:
物质的化学式:
_______________
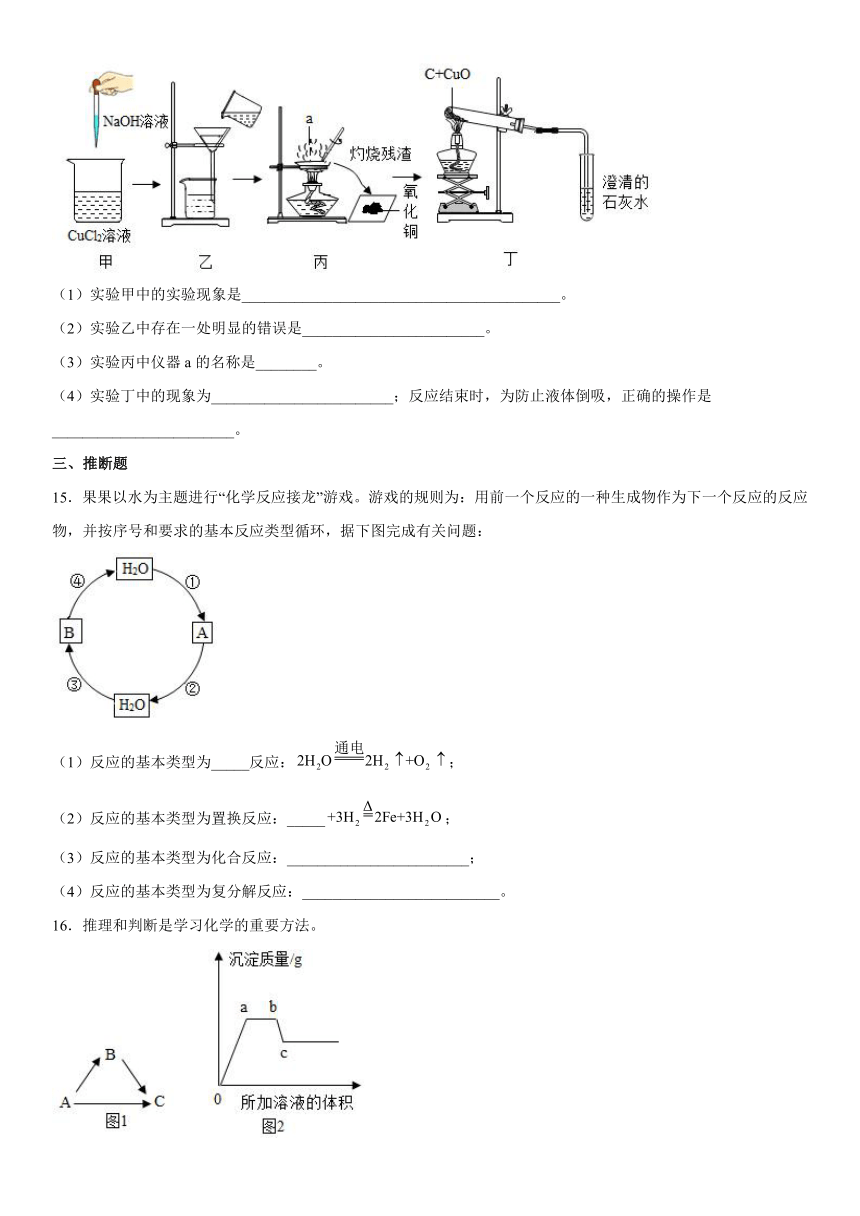
14.如图所示是某化学实验小组进行的一系列实验,请回答下列问题:
(1)实验甲中的实验现象是__________________________________________。
(2)实验乙中存在一处明显的错误是________________________。
(3)实验丙中仪器a的名称是________。
(4)实验丁中的现象为________________________;反应结束时,为防止液体倒吸,正确的操作是________________________。
三、推断题
15.果果以水为主题进行“化学反应接龙”游戏。游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环,据下图完成有关问题:
(1)反应的基本类型为_____反应:;
(2)反应的基本类型为置换反应:_____;
(3)反应的基本类型为化合反应:________________________;
(4)反应的基本类型为复分解反应:__________________________。
16.推理和判断是学习化学的重要方法。
(1)A、B、C为初中化学常见的三种物质,它们之间的转化关系如图1所示(“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物及反应条件已略去)请回答下列问题:
①若A、B、C均含有同一种元素,B、C组成元素相同,C的固体俗称“干冰”,则B的化学式是_____。
②若A、B、C是含相同金属元素的化合物,B、C的水溶液为蓝色,三种物质相互间发生的反应均为复分解反应,则A的化学式可能是_____(写出一个即可)。
③若A、B、C均为碱,其中B易溶于水,C难溶于水,写出一个由B转化为C的化学方程式_____。
(2)只含一种杂质的硫酸溶液M,加入足量的氢氧化钡溶液后,再加足量的稀盐酸,过程如图2所示。下列判断合理的有_____(填序号)。
①M中一定不含有碳酸钠
②图中ab间(不含a、b两点)滴入酚酞溶液变红色
③bc段表示沉淀部分消失,无气泡产生
④c点后溶液中的溶质不少于两种
四、实验题
17.完成下列实验问题
(1)实验1:滴加液体的仪器是______。白色点滴板孔穴4中溶液变为红色,说明柠檬汁显______性。使用白色点滴板进行实验的优点是______(答一点)。
(2)实验2:水电解反应的化学方程式为______。
(3)实验3:托盘天平向右倾斜。整个实验过程中气球的作用是______。
(4)有关上述三个实验,以下说法正确的是______。(填序号)
①实验1草木灰(K2CO3)是一种钾肥
②实验2加入食盐可增强水的导电性
③实验3天平向右倾斜是因为锥形瓶内未充分冷却
④实验2中b端收集的是氢气
⑤实验3锥形瓶内事先放少量细沙的作用是吸收白烟和热量
18.味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaC1(其他成分不考虑),某兴趣小组配制味精溶液并测定NaC1质量分数,请回答下列问题:
(1)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是______(填字母)。
A.10mL B.50mL C.100mL
(2)如图是配制过程,正确的操作顺序为______。
(3)为测定味精中NaC1的质量分数,进行如下实验:向所配制的50g溶液中加入过量的AgNO3溶液充分反应(硝酸银不与味精发生反应),过滤后,洗涤、干燥、称量沉淀的质量为2.87g。试计算该味精中氯化钠的质量分数______。
(4)将(1)配制的50g溶液稀释成100g,求此时溶液中氯化钠的溶质质量分数______。
19.补全实验方案。
实验 实验目的 实验操作
1 检验钙片中含有碳酸钙 ______
2 ______ 先将粗盐放入烧杯中加水溶解,再将浑浊液过滤,最后将澄清滤液蒸发
五、计算题
20.某化学小组进行硫酸铜溶液和氢氧化钠溶液相混合的实验实验过程及数据如下图所示:[反应原理为]。
计算氢氧化钠溶液中溶质的质量分数。
21.实验室有一瓶存放时间过长的氢氧化钠,其中一部分已转化成为了碳酸钠。现
需用该药品配制氢氧化钠溶液。取50克该药品,溶于200mL水中(水的密度为1g/cm3),然后慢慢地滴加7.4%的澄清石灰水,当用去100克澄清石灰水时,碳酸钠恰好反应完全。
计算:(1)50克该药品中碳酸钠的质量;(2)滤出沉淀后所得溶液的溶质质量分数。(精确到0.01%)]
22.我国春秋战国时期,就已经掌握用草木灰和高温煅烧得到的贝壳灰混合加水,达到洗涤丝帛的目的,其原理为:,生成强碱KOH从而去油污。现有50gK2CO3溶液样品,为测定其溶质质量分数,向其中加入足量Ca(OH)2溶液,生成了5g沉淀。请计算K2CO3溶液样品的溶质质量分数。
23.用光卤石为原料提取的氯化钾产品中含有氯化镁杂质,产品等级中氯化钾指标为:
指标名称 优良品 一级品 二级品
氯化钾质量分数(≥) 93.00% 90.00% 87.00%
为确定某氯化钾产品等级进行了以下实验:
步骤一(溶解):取40.0g氯化钾产品溶于水,配制成溶液。
步骤二(沉淀):向步骤一所得溶液中加入过量的质量分数为10%的氢氧化钾溶液112.0g,充分反应后过滤,得2.9g沉淀和一定质量的滤液。
步骤三(回收):向步骤二所得滤液中加入盐酸至溶液呈中性,得到400.0g溶液,将所得溶液蒸发结晶,回收氯化钾固体。
回答下列问题:(提示:KCl溶液呈中性;不考虑实验过程中的损失)
(1)通过计算判断该产品的等级。(写出解题过程)
(2)步骤三所得溶液中氯化钾的质量分数为 。
试卷第1页,共3页
参考答案:
1.A
2.B
3.C
4.B
5.C
6.B
7.D
8.C
9.A
10.D
11.C
12. 碳原子的排列方式不同 AC 加入适量的氢氧化钙溶液,充分反应后过滤
13.
14. 产生蓝色絮状沉淀 没有用玻璃棒引流 蒸发皿 黑色固体变成红色,澄清石灰水变浑浊 先将导管移出石灰水,再熄灭酒精灯
15. 分解 Fe2O3 Ca(OH)2+2HCl=CaCl2+2H2O
16. CO CuO 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4 ①②③④
17. 胶头滴管 酸性 节约药品等 平衡装置内外压强、缓冲作用 ①③
18. B ②①④③ 23.4% 1.17%
19. 取一片钙片放入试管中,再加入稀盐酸,并将生成的气体导入澄清石灰水中 去除粗盐中难溶性杂质
20.解:设参加反应的氢氧化钠质量为x。
x=4g
×100%=8%
答:氢氧化钠溶液中溶质的质量分数为8%。
21.10.6g, 13.94%
22.解:设碳酸钾质量为x,
解得:x=6.9g
K2CO3溶液样品的溶质质量分数=
答:K2CO3溶液样品的溶质质量分数是13.8%。
23.(1)二级品;(2)3.725%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列各组离子在溶液中能大量共存的是( )
A.NH、SO、NO
B.H+、Ba2+、OH-
C.Fe2+、Na+、OH-
D.Ca2+、Cl-、CO
2.Na2CO3俗称纯碱,侯德榜为纯碱工业的发展做出了杰出贡献。Na2CO3属于
A.氧化物
B.盐
C.有机物
D.混合物
3.小明外出游玩,发现路边的小麦叶子发黄、有倒伏现象,他建议田主应该施用一种复合肥料,这种复合肥料是
A.CO(NH2)2
B.KCl
C.KNO3
D.NH4HCO3
4.某pH=12的无色溶液中大量存在的离子有Na+、Ba2+、NO、X,则X可能是
A.Cu2+ B.Cl- C.H+ D.SO
5.下图是甲转化为丁的微观过程。下列说法正确的是( )
A.转化①中原子种类不变,个数改变 B.转化②是化合反应
C.整个过程中共有2种氧化物 D.物质丁是复合肥
6.下列各图像中有关量的变化趋势与选项要求相符合的是
A.向含有NaOH和Na2CO3的混合溶液中逐滴加入稀盐酸至过量
B.向等质量的锌粉、镁粉中分别加入少量的相同浓度相同质量的稀硫酸
C.向一定浓度的NaOH溶液中加入水
D.向一定质量的镁粉和银粉固体混合物中逐滴加入Cu(NO3)2溶液
7.下列离子组在强酸性和强碱性溶液中都能大量共存的是( )
A.,,, B.,,,
C.,,, D.,,,
8.关于碳酸钠的说法错误的是
A.易溶于水 B.可用于洗涤油污 C.受热易分解 D.可用于制造普通玻璃
9.下列溶液分别能跟硫酸铜、盐酸、碳酸钠溶液反应,并产生不同现象的是( )
A.Ca(OH)2 B.AgNO3 C.H2SO4 D.NaOH
10.利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如下:(反应条件已略去)
已知:
下列说法正确的是
A.步骤II中分离操作必须用到的玻璃仪器是烧杯和漏斗
B.溶液A中溶质是H2SO4、CuSO4
C.上述流程中物质B是锌,物质D是盐酸
D.A~E中都含有铜、锌两种元素的物质有A和C
11.下列有关NaOH的实验方案中,正确的是
A.用NaOH固体干燥CO2气体
B.用酚酞溶液检验NaOH溶液是否变质
C.用熟石灰和纯碱为原料制取NaOH
D.用CaCl2溶液除去NaOH溶液中的少量Na2CO3
二、简答题
12.回答下列与含碳物质有关的问题。
(1)金刚石、石墨都是碳元素组成的单质,但它们的物理性质差异较大,其原因是_____;
(2)下列说法中,正确的是_____。
A 干冰不是冰
B 某物质燃烧只生成CO2,则该物质一定是碳单质
C 在一定条件下,CO2、CO可以互相转化
D 用点燃的方法可除去CO2气体中少量的CO
(3)变质的 NaOH溶液中含有少量Na2CO3,除去其中杂质的方法是_____;
13.请用线段连接有对应关系的两行间的点(每个点只能连接一次)。
物质的类别:
物质的化学式:
_______________
14.如图所示是某化学实验小组进行的一系列实验,请回答下列问题:
(1)实验甲中的实验现象是__________________________________________。
(2)实验乙中存在一处明显的错误是________________________。
(3)实验丙中仪器a的名称是________。
(4)实验丁中的现象为________________________;反应结束时,为防止液体倒吸,正确的操作是________________________。
三、推断题
15.果果以水为主题进行“化学反应接龙”游戏。游戏的规则为:用前一个反应的一种生成物作为下一个反应的反应物,并按序号和要求的基本反应类型循环,据下图完成有关问题:
(1)反应的基本类型为_____反应:;
(2)反应的基本类型为置换反应:_____;
(3)反应的基本类型为化合反应:________________________;
(4)反应的基本类型为复分解反应:__________________________。
16.推理和判断是学习化学的重要方法。
(1)A、B、C为初中化学常见的三种物质,它们之间的转化关系如图1所示(“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物及反应条件已略去)请回答下列问题:
①若A、B、C均含有同一种元素,B、C组成元素相同,C的固体俗称“干冰”,则B的化学式是_____。
②若A、B、C是含相同金属元素的化合物,B、C的水溶液为蓝色,三种物质相互间发生的反应均为复分解反应,则A的化学式可能是_____(写出一个即可)。
③若A、B、C均为碱,其中B易溶于水,C难溶于水,写出一个由B转化为C的化学方程式_____。
(2)只含一种杂质的硫酸溶液M,加入足量的氢氧化钡溶液后,再加足量的稀盐酸,过程如图2所示。下列判断合理的有_____(填序号)。
①M中一定不含有碳酸钠
②图中ab间(不含a、b两点)滴入酚酞溶液变红色
③bc段表示沉淀部分消失,无气泡产生
④c点后溶液中的溶质不少于两种
四、实验题
17.完成下列实验问题
(1)实验1:滴加液体的仪器是______。白色点滴板孔穴4中溶液变为红色,说明柠檬汁显______性。使用白色点滴板进行实验的优点是______(答一点)。
(2)实验2:水电解反应的化学方程式为______。
(3)实验3:托盘天平向右倾斜。整个实验过程中气球的作用是______。
(4)有关上述三个实验,以下说法正确的是______。(填序号)
①实验1草木灰(K2CO3)是一种钾肥
②实验2加入食盐可增强水的导电性
③实验3天平向右倾斜是因为锥形瓶内未充分冷却
④实验2中b端收集的是氢气
⑤实验3锥形瓶内事先放少量细沙的作用是吸收白烟和热量
18.味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaC1(其他成分不考虑),某兴趣小组配制味精溶液并测定NaC1质量分数,请回答下列问题:
(1)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是______(填字母)。
A.10mL B.50mL C.100mL
(2)如图是配制过程,正确的操作顺序为______。
(3)为测定味精中NaC1的质量分数,进行如下实验:向所配制的50g溶液中加入过量的AgNO3溶液充分反应(硝酸银不与味精发生反应),过滤后,洗涤、干燥、称量沉淀的质量为2.87g。试计算该味精中氯化钠的质量分数______。
(4)将(1)配制的50g溶液稀释成100g,求此时溶液中氯化钠的溶质质量分数______。
19.补全实验方案。
实验 实验目的 实验操作
1 检验钙片中含有碳酸钙 ______
2 ______ 先将粗盐放入烧杯中加水溶解,再将浑浊液过滤,最后将澄清滤液蒸发
五、计算题
20.某化学小组进行硫酸铜溶液和氢氧化钠溶液相混合的实验实验过程及数据如下图所示:[反应原理为]。
计算氢氧化钠溶液中溶质的质量分数。
21.实验室有一瓶存放时间过长的氢氧化钠,其中一部分已转化成为了碳酸钠。现
需用该药品配制氢氧化钠溶液。取50克该药品,溶于200mL水中(水的密度为1g/cm3),然后慢慢地滴加7.4%的澄清石灰水,当用去100克澄清石灰水时,碳酸钠恰好反应完全。
计算:(1)50克该药品中碳酸钠的质量;(2)滤出沉淀后所得溶液的溶质质量分数。(精确到0.01%)]
22.我国春秋战国时期,就已经掌握用草木灰和高温煅烧得到的贝壳灰混合加水,达到洗涤丝帛的目的,其原理为:,生成强碱KOH从而去油污。现有50gK2CO3溶液样品,为测定其溶质质量分数,向其中加入足量Ca(OH)2溶液,生成了5g沉淀。请计算K2CO3溶液样品的溶质质量分数。
23.用光卤石为原料提取的氯化钾产品中含有氯化镁杂质,产品等级中氯化钾指标为:
指标名称 优良品 一级品 二级品
氯化钾质量分数(≥) 93.00% 90.00% 87.00%
为确定某氯化钾产品等级进行了以下实验:
步骤一(溶解):取40.0g氯化钾产品溶于水,配制成溶液。
步骤二(沉淀):向步骤一所得溶液中加入过量的质量分数为10%的氢氧化钾溶液112.0g,充分反应后过滤,得2.9g沉淀和一定质量的滤液。
步骤三(回收):向步骤二所得滤液中加入盐酸至溶液呈中性,得到400.0g溶液,将所得溶液蒸发结晶,回收氯化钾固体。
回答下列问题:(提示:KCl溶液呈中性;不考虑实验过程中的损失)
(1)通过计算判断该产品的等级。(写出解题过程)
(2)步骤三所得溶液中氯化钾的质量分数为 。
试卷第1页,共3页
参考答案:
1.A
2.B
3.C
4.B
5.C
6.B
7.D
8.C
9.A
10.D
11.C
12. 碳原子的排列方式不同 AC 加入适量的氢氧化钙溶液,充分反应后过滤
13.
14. 产生蓝色絮状沉淀 没有用玻璃棒引流 蒸发皿 黑色固体变成红色,澄清石灰水变浑浊 先将导管移出石灰水,再熄灭酒精灯
15. 分解 Fe2O3 Ca(OH)2+2HCl=CaCl2+2H2O
16. CO CuO 2NaOH+CuSO4═Cu(OH)2↓+Na2SO4 ①②③④
17. 胶头滴管 酸性 节约药品等 平衡装置内外压强、缓冲作用 ①③
18. B ②①④③ 23.4% 1.17%
19. 取一片钙片放入试管中,再加入稀盐酸,并将生成的气体导入澄清石灰水中 去除粗盐中难溶性杂质
20.解:设参加反应的氢氧化钠质量为x。
x=4g
×100%=8%
答:氢氧化钠溶液中溶质的质量分数为8%。
21.10.6g, 13.94%
22.解:设碳酸钾质量为x,
解得:x=6.9g
K2CO3溶液样品的溶质质量分数=
答:K2CO3溶液样品的溶质质量分数是13.8%。
23.(1)二级品;(2)3.725%
答案第1页,共2页
答案第1页,共2页
