8.1海洋化学资源 同步测试——2021-2022学年鲁教版九年级下册(word版 含答案)
文档属性
| 名称 | 8.1海洋化学资源 同步测试——2021-2022学年鲁教版九年级下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 259.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-20 07:51:57 | ||
图片预览



文档简介
8.1 海洋化学资源
一、单选题
1.自然界的水都不是纯净水,下列有关水的净化的说法不正确的是
A.过滤不能使硬水转化为软水
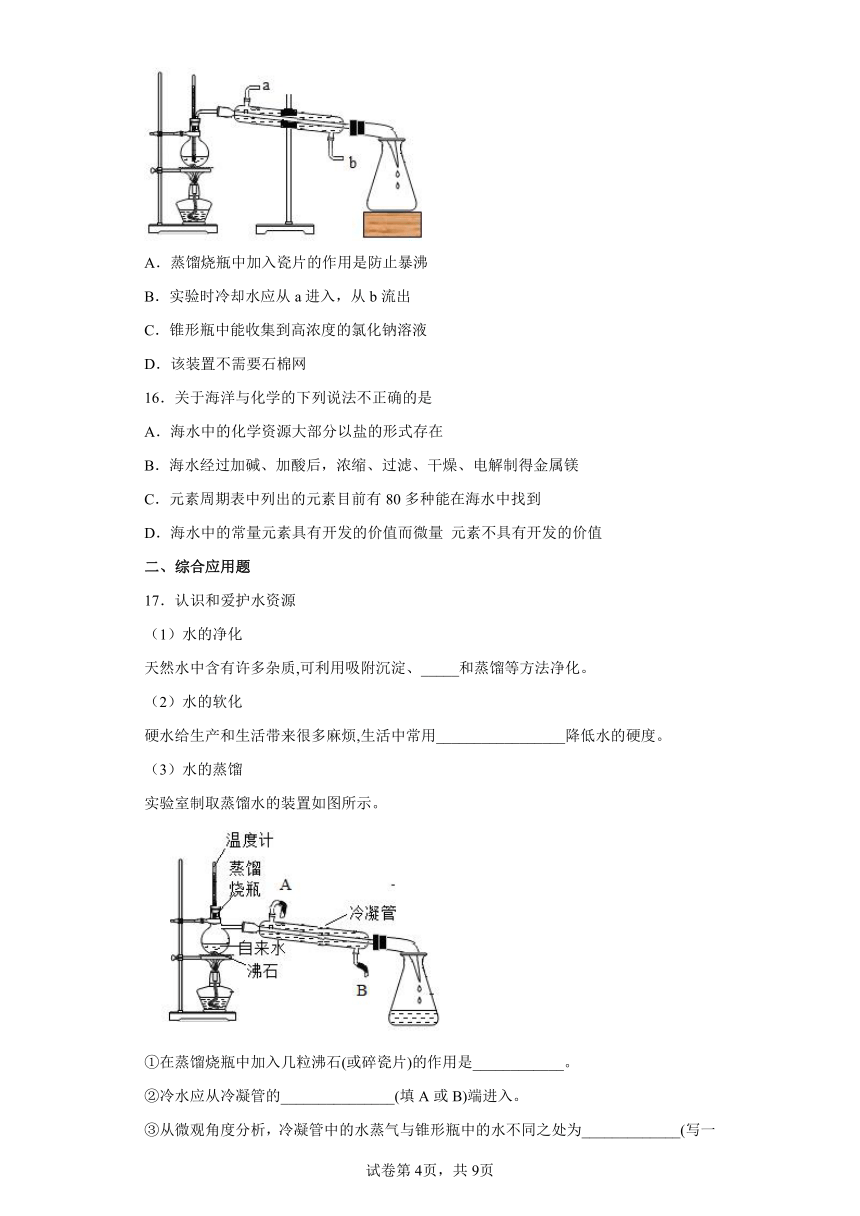
B.净水时活性炭起吸附作用
C.蒸馏可将海水淡化
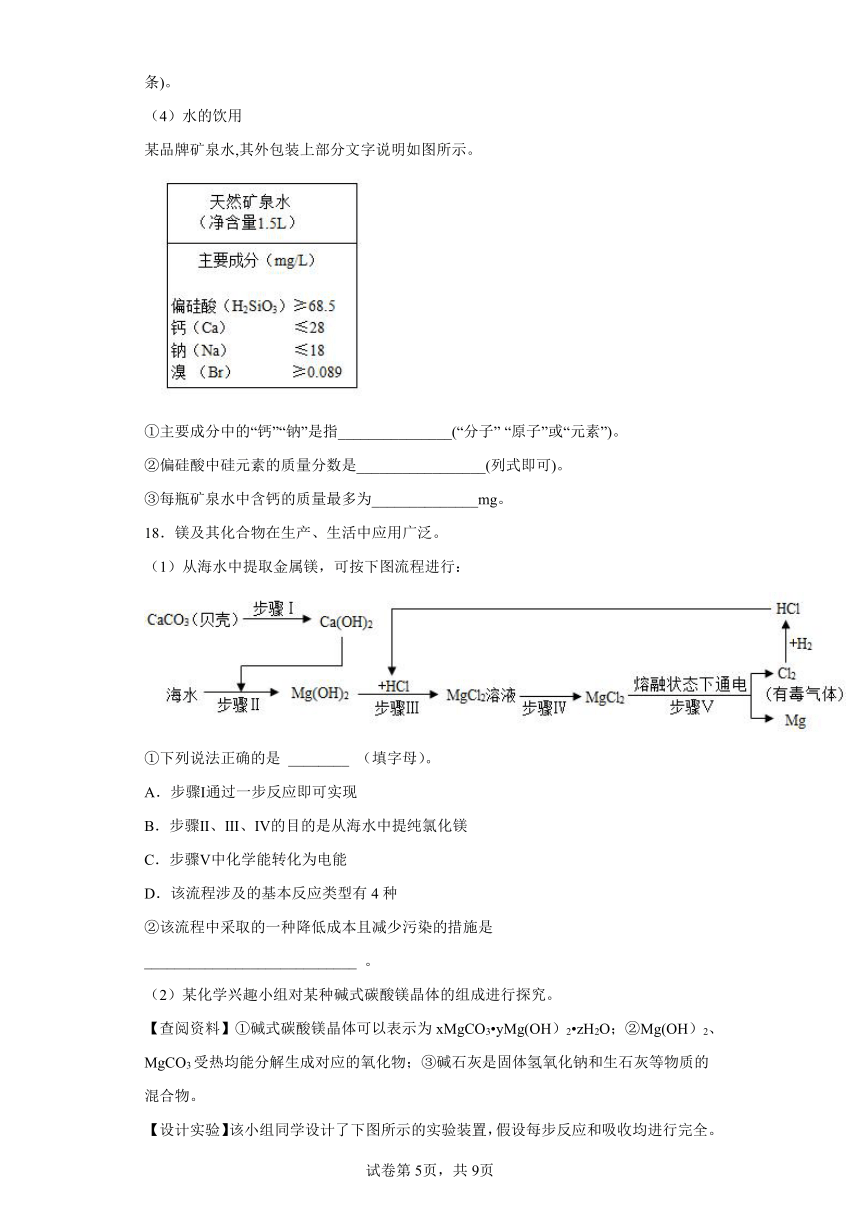
D.电解水是一种常用的净水方法
2.下图所示的实验操作,不正确的是
A.熄灭酒精灯 B.读取液体的体积
C.除去CO中的CO2 D.制取蒸馏水
3.许多化学反应的发生离不开反应条件的支持,以下化学方程式的书写,来自同学们的作业中,其中反应条件错误的是
A. B.
C. D.
4.下列实验操作和目的都正确的是
选项 操作 目的
A 将一小片pH试纸润湿后放在玻璃片上,用玻璃棒蘸取溶液滴到pH试纸上 测定某溶液的pH
B 制取蒸馏水时,应加入几粒沸石(或碎瓷片) 防止加热时出现暴沸
C 先将胶头滴管挤压,再伸入试剂中吸取液体 保证滴管的胶头部分也充满液体
D 将水沿烧杯壁缓慢地注入盛有浓硫酸的烧杯里,并用玻璃棒不断搅拌 稀释浓硫酸
A.A B.B C.C D.D
5.下面所示过程发生化学变化的是
A. 用高分子分离膜淡化海水 B.氖管发光
C.电炉丝通电后发红 D.将喷洒石蕊溶液的纸花放入CO2中
6.淡化海水可采用膜分离技术(如图所示),水分子可以透过淡化膜(海水中其他离子不能透过)进入左侧的池子,从而得到淡水。以下分析中正确的是( )
A.右侧池中海水的密度不变 B.右侧池中溶质的质量分数变大
C.淡化膜可用滤纸代替 D.用膜分离技术得到的淡水为硬水
7.海洋资源的开发前景十分广泛,下图是我们从海水中提取镁的流程:
上述一系列转化过程中,没有涉及的基本反应类型是
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
8.海洋是人类丰富的资源宝库,下列措施不属于保护海洋环境,也不属于合理利用海洋资源的是
A.禁止向大海排放污水 B.海水制镁
C.海水淡化 D.船舶垃圾直接倾倒入海中
9.我国海水晒盐具有悠久的历史,所得“盐”的主要成分是( )
A.Na2SO4 B.NaCl C.CaCl2 D.Na2CO3
10.下列有关水的说法中,不正确的是
A.用肥皂水可区分硬水和软水
B.水是实验室中最常用的溶剂
C.电解水实验中得到的氧气和氢气的质量比为1:2
D.海水淡化是向海水要淡水的一种方法
11.实验室用如图所示的装置蒸馏海水,下列说法不正确的是
A.蒸馏烧瓶中加入沸石的目的是防止暴沸 B.蒸馏后分子没有改变
C.连接好装置,使各连接部位严密不漏气 D.该装置不需要用石棉网
12.用硬水洗衣服,既浪费肥皂又洗不干净,生活中要使硬水软化,可采用的方法是
A.过滤 B.煮沸 C.吸附 D.搅拌
13.在实验室常用的蒸馏装置中,不需要用到的仪器
A.烧瓶 B.玻璃棒 C.酒精灯 D.温度计
14.关于多金属结核的叙述正确的是
A.多金属结核是锰的合金
B.多金属结核也称锰结核
C.锰结核只有一种金属
D.全世界多金属结核含量微乎其微
15.实验室用如图所示的装置蒸馏海水,下列说法正确的是
A.蒸馏烧瓶中加入瓷片的作用是防止暴沸
B.实验时冷却水应从a进入,从b流出
C.锥形瓶中能收集到高浓度的氯化钠溶液
D.该装置不需要石棉网
16.关于海洋与化学的下列说法不正确的是
A.海水中的化学资源大部分以盐的形式存在
B.海水经过加碱、加酸后,浓缩、过滤、干燥、电解制得金属镁
C.元素周期表中列出的元素目前有80多种能在海水中找到
D.海水中的常量元素具有开发的价值而微量 元素不具有开发的价值
二、综合应用题
17.认识和爱护水资源
(1)水的净化
天然水中含有许多杂质,可利用吸附沉淀、_____和蒸馏等方法净化。
(2)水的软化
硬水给生产和生活带来很多麻烦,生活中常用_________________降低水的硬度。
(3)水的蒸馏
实验室制取蒸馏水的装置如图所示。
①在蒸馏烧瓶中加入几粒沸石(或碎瓷片)的作用是____________。
②冷水应从冷凝管的_______________(填A或B)端进入。
③从微观角度分析,冷凝管中的水蒸气与锥形瓶中的水不同之处为_____________(写一条)。
(4)水的饮用
某品牌矿泉水,其外包装上部分文字说明如图所示。
①主要成分中的“钙”“钠”是指_______________(“分子” “原子”或“元素”)。
②偏硅酸中硅元素的质量分数是_________________(列式即可)。
③每瓶矿泉水中含钙的质量最多为______________mg。
18.镁及其化合物在生产、生活中应用广泛。
(1)从海水中提取金属镁,可按下图流程进行:
①下列说法正确的是 ________ (填字母)。
A.步骤Ⅰ通过一步反应即可实现
B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁
C.步骤Ⅴ中化学能转化为电能
D.该流程涉及的基本反应类型有4种
②该流程中采取的一种降低成本且减少污染的措施是 ____________________________ 。
(2)某化学兴趣小组对某种碱式碳酸镁晶体的组成进行探究。
【查阅资料】①碱式碳酸镁晶体可以表示为xMgCO3 yMg(OH)2 zH2O;②Mg(OH)2、MgCO3受热均能分解生成对应的氧化物;③碱石灰是固体氢氧化钠和生石灰等物质的混合物。
【设计实验】该小组同学设计了下图所示的实验装置,假设每步反应和吸收均进行完全。
【进行实验】取23.3g碱式碳酸镁晶体进行实验,步骤如下:
①连接好装置并检查气密性。
②装入药品,打开活塞K,通入一段时间空气。
③分别称量装置C、D的质量(数据见下表)。
装置C的质量 装置D的质量
步骤③ 292.4g 198.2g
步骤⑥ 296.9g 207.0g
④关闭活塞K,点燃酒精灯,使碱式碳酸镁晶体完全分解。
⑤停止加热,同时打开活塞K,通入空气至恢复到室温。
⑥再次分别称量装置C、D的质量(数据见右表)。
【实验分析】
①装置A的作用为 ___________________ ,装置D的作用为 ___________________ 。
②反应后,装置B中的剩余固体是 ________ ,质量为 _______ g。
③该碱式碳酸镁晶体[xMgCO3 yMg(OH)2 zH2O]中,x︰y︰z = ______ (写最简整数比)。
19.我国海洋资源丰富,开发前景十分远大。从海洋中提取的金属镁,可以广泛应用于生活、生产和国防工业、如图是单质镁的制取和转化过程,试回答下列问题:
(1)步骤一中生石灰的化学式为______。
(2)写出上述流程中发生的中和反应的化学方程式______。
(3)有关步骤四中能量转化的说法中正确的是______(填下列各选项序号字母)
A.化学能转化为电能 B.电能转化为化学能 C.潮汐能转化为化学能
(4)海水或卤水中本来就含有氯化镁,还需要步骤一、二、三操作的原因是______。
(5)某化学兴趣小组欲测定某氯化镁样品中氯化镁的含量(杂质为氯化钠),称取 20g 样品将其置于干净的烧杯中,加入 80g 水使固体样品完全溶解,向所得溶液中逐滴加入溶质质量分数为 20%的氢氧化钠溶液,反应过程中溶液总质量与滴入氢氧化钠溶液的质量关系如图所示。试回答下列问题:
①当滴入 20%的氢氧化钠溶液 80g 时(即图中 P 点),恰好完全反应,试通过计算,求20g氯化镁样品中氯化镁的质量分数______。
②P 点对应的纵坐标的数值是多少?______
20.水是人类宝贵的自然资源,与人类的生产、生活密切相关。
(1)水是常见的溶剂,将下列生活中的物质分别放入水中,不能形成溶液的是_________。
A 蔗糖 B 纯碱 C 食盐 D 花生油
用质量分数为20%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水_________g。
(2)净化水的常用方法有:①消毒杀菌②过滤③蒸馏④活性炭吸附⑤加明矾吸附沉降。天然水中往往含有许多杂质,要把天然水净化成生活中的自来水,所选用的净化方法按净化过程排序是(填序号)_________。
(3)漂白粉可用于水的杀菌消毒,其有效成分是次氯酸钙【化学式为Ca(ClO)2】。次氯酸钙可发生如下反应:,则X的化学式为_________。
(4)一种新型净水剂高铁酸钾(K2FeO4),具有高效消毒作用,该高铁酸钾中铁元素的化合价为_________。
(5)工业上可用海水提取粗盐后的母液来提取金属镁,其流程如下:
该流程中,加溶液A时所发生的反应方程式为_________,其中没有发生的基本反应类型为化合反应和_________。
21.食盐是一种重要的化工原料。请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和____。
②在蒸发过程中,待___时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是____(用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有____(用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是____。已知:20 ℃时氯化钠的溶解度为36g。
22.镁是重要的国防金属,充分利用海边的贝壳(主要成分是CaCO3)和卤水制取金属镁的流程图如下:
(1)步骤②的化学方程式为______,试剂X的名称是______。
(2)步骤⑤电解熔融状态的C得到金属镁的过程,是将______能转化为______能。
(3)某校学生在实验室中模拟步骤③的反应,将氯化镁和氯化钠的固体混合物样品20g,完全溶于113.7g水中,再将100g氢氧化钠溶液平均分四次加入其中,充分振荡,生成白色沉淀的质量与所加氢氧化钠溶液的质量关系如图所示。发生反应的化学方程式为:
请根据有关数据完成下列计算:
①M点对应的纵坐标应为______。
②恰好完全反应时,所得溶液的溶质质量分数?______(写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.A
4.B
5.D
6.B
7.C
8.D
9.B
10.C
11.D
12.B
13.B
14.B
15.A
16.D
17. 过滤 煮沸 防止暴沸(局部沸腾) B 分子间间隔不同(或分子运动速率不同) 元素 42
18. B 电解产生的Cl2用于生产HCl,与Mg(OH)2发生中和反应 除去空气中的二氧化碳和水 吸收反应生成的二氧化碳 ##氧化镁 10
19. CaO B 将氯化镁富集提纯 解:设20g氯化镁样品中氯化镁的质量为x,生成沉淀的质量为y
x=19g
y=11.6g
氯化镁样品中氯化镁的质量分数为: P 点对应的溶液总质量为:
答:氯化镁样品中氯化镁的质量分数 95%;P 点对应的纵坐标的数值是 168.4g。
20. D 75 ⑤②④① CO2 +6 置换反应
21. 漏斗 蒸发皿中出现较多固体时 BaCl2 + Na2CO3 = BaCO3↓+ 2NaCl Na2CO3、NaCl 、NaOH 加入22.4kg氯化钠固体
22. 稀盐酸 电 化学 2.9g 解:设恰好完全反应时,生成氯化钠的质量为x,氯化镁的质量为y
x=17.55g
y=14.25g
恰好完全反应时,所得溶液的溶质质量分数为:
答:恰好完全反应时,所得溶液的溶质质量分数为11.65%。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.自然界的水都不是纯净水,下列有关水的净化的说法不正确的是
A.过滤不能使硬水转化为软水
B.净水时活性炭起吸附作用
C.蒸馏可将海水淡化
D.电解水是一种常用的净水方法
2.下图所示的实验操作,不正确的是
A.熄灭酒精灯 B.读取液体的体积
C.除去CO中的CO2 D.制取蒸馏水
3.许多化学反应的发生离不开反应条件的支持,以下化学方程式的书写,来自同学们的作业中,其中反应条件错误的是
A. B.
C. D.
4.下列实验操作和目的都正确的是
选项 操作 目的
A 将一小片pH试纸润湿后放在玻璃片上,用玻璃棒蘸取溶液滴到pH试纸上 测定某溶液的pH
B 制取蒸馏水时,应加入几粒沸石(或碎瓷片) 防止加热时出现暴沸
C 先将胶头滴管挤压,再伸入试剂中吸取液体 保证滴管的胶头部分也充满液体
D 将水沿烧杯壁缓慢地注入盛有浓硫酸的烧杯里,并用玻璃棒不断搅拌 稀释浓硫酸
A.A B.B C.C D.D
5.下面所示过程发生化学变化的是
A. 用高分子分离膜淡化海水 B.氖管发光
C.电炉丝通电后发红 D.将喷洒石蕊溶液的纸花放入CO2中
6.淡化海水可采用膜分离技术(如图所示),水分子可以透过淡化膜(海水中其他离子不能透过)进入左侧的池子,从而得到淡水。以下分析中正确的是( )
A.右侧池中海水的密度不变 B.右侧池中溶质的质量分数变大
C.淡化膜可用滤纸代替 D.用膜分离技术得到的淡水为硬水
7.海洋资源的开发前景十分广泛,下图是我们从海水中提取镁的流程:
上述一系列转化过程中,没有涉及的基本反应类型是
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
8.海洋是人类丰富的资源宝库,下列措施不属于保护海洋环境,也不属于合理利用海洋资源的是
A.禁止向大海排放污水 B.海水制镁
C.海水淡化 D.船舶垃圾直接倾倒入海中
9.我国海水晒盐具有悠久的历史,所得“盐”的主要成分是( )
A.Na2SO4 B.NaCl C.CaCl2 D.Na2CO3
10.下列有关水的说法中,不正确的是
A.用肥皂水可区分硬水和软水
B.水是实验室中最常用的溶剂
C.电解水实验中得到的氧气和氢气的质量比为1:2
D.海水淡化是向海水要淡水的一种方法
11.实验室用如图所示的装置蒸馏海水,下列说法不正确的是
A.蒸馏烧瓶中加入沸石的目的是防止暴沸 B.蒸馏后分子没有改变
C.连接好装置,使各连接部位严密不漏气 D.该装置不需要用石棉网
12.用硬水洗衣服,既浪费肥皂又洗不干净,生活中要使硬水软化,可采用的方法是
A.过滤 B.煮沸 C.吸附 D.搅拌
13.在实验室常用的蒸馏装置中,不需要用到的仪器
A.烧瓶 B.玻璃棒 C.酒精灯 D.温度计
14.关于多金属结核的叙述正确的是
A.多金属结核是锰的合金
B.多金属结核也称锰结核
C.锰结核只有一种金属
D.全世界多金属结核含量微乎其微
15.实验室用如图所示的装置蒸馏海水,下列说法正确的是
A.蒸馏烧瓶中加入瓷片的作用是防止暴沸
B.实验时冷却水应从a进入,从b流出
C.锥形瓶中能收集到高浓度的氯化钠溶液
D.该装置不需要石棉网
16.关于海洋与化学的下列说法不正确的是
A.海水中的化学资源大部分以盐的形式存在
B.海水经过加碱、加酸后,浓缩、过滤、干燥、电解制得金属镁
C.元素周期表中列出的元素目前有80多种能在海水中找到
D.海水中的常量元素具有开发的价值而微量 元素不具有开发的价值
二、综合应用题
17.认识和爱护水资源
(1)水的净化
天然水中含有许多杂质,可利用吸附沉淀、_____和蒸馏等方法净化。
(2)水的软化
硬水给生产和生活带来很多麻烦,生活中常用_________________降低水的硬度。
(3)水的蒸馏
实验室制取蒸馏水的装置如图所示。
①在蒸馏烧瓶中加入几粒沸石(或碎瓷片)的作用是____________。
②冷水应从冷凝管的_______________(填A或B)端进入。
③从微观角度分析,冷凝管中的水蒸气与锥形瓶中的水不同之处为_____________(写一条)。
(4)水的饮用
某品牌矿泉水,其外包装上部分文字说明如图所示。
①主要成分中的“钙”“钠”是指_______________(“分子” “原子”或“元素”)。
②偏硅酸中硅元素的质量分数是_________________(列式即可)。
③每瓶矿泉水中含钙的质量最多为______________mg。
18.镁及其化合物在生产、生活中应用广泛。
(1)从海水中提取金属镁,可按下图流程进行:
①下列说法正确的是 ________ (填字母)。
A.步骤Ⅰ通过一步反应即可实现
B.步骤Ⅱ、Ⅲ、Ⅳ的目的是从海水中提纯氯化镁
C.步骤Ⅴ中化学能转化为电能
D.该流程涉及的基本反应类型有4种
②该流程中采取的一种降低成本且减少污染的措施是 ____________________________ 。
(2)某化学兴趣小组对某种碱式碳酸镁晶体的组成进行探究。
【查阅资料】①碱式碳酸镁晶体可以表示为xMgCO3 yMg(OH)2 zH2O;②Mg(OH)2、MgCO3受热均能分解生成对应的氧化物;③碱石灰是固体氢氧化钠和生石灰等物质的混合物。
【设计实验】该小组同学设计了下图所示的实验装置,假设每步反应和吸收均进行完全。
【进行实验】取23.3g碱式碳酸镁晶体进行实验,步骤如下:
①连接好装置并检查气密性。
②装入药品,打开活塞K,通入一段时间空气。
③分别称量装置C、D的质量(数据见下表)。
装置C的质量 装置D的质量
步骤③ 292.4g 198.2g
步骤⑥ 296.9g 207.0g
④关闭活塞K,点燃酒精灯,使碱式碳酸镁晶体完全分解。
⑤停止加热,同时打开活塞K,通入空气至恢复到室温。
⑥再次分别称量装置C、D的质量(数据见右表)。
【实验分析】
①装置A的作用为 ___________________ ,装置D的作用为 ___________________ 。
②反应后,装置B中的剩余固体是 ________ ,质量为 _______ g。
③该碱式碳酸镁晶体[xMgCO3 yMg(OH)2 zH2O]中,x︰y︰z = ______ (写最简整数比)。
19.我国海洋资源丰富,开发前景十分远大。从海洋中提取的金属镁,可以广泛应用于生活、生产和国防工业、如图是单质镁的制取和转化过程,试回答下列问题:
(1)步骤一中生石灰的化学式为______。
(2)写出上述流程中发生的中和反应的化学方程式______。
(3)有关步骤四中能量转化的说法中正确的是______(填下列各选项序号字母)
A.化学能转化为电能 B.电能转化为化学能 C.潮汐能转化为化学能
(4)海水或卤水中本来就含有氯化镁,还需要步骤一、二、三操作的原因是______。
(5)某化学兴趣小组欲测定某氯化镁样品中氯化镁的含量(杂质为氯化钠),称取 20g 样品将其置于干净的烧杯中,加入 80g 水使固体样品完全溶解,向所得溶液中逐滴加入溶质质量分数为 20%的氢氧化钠溶液,反应过程中溶液总质量与滴入氢氧化钠溶液的质量关系如图所示。试回答下列问题:
①当滴入 20%的氢氧化钠溶液 80g 时(即图中 P 点),恰好完全反应,试通过计算,求20g氯化镁样品中氯化镁的质量分数______。
②P 点对应的纵坐标的数值是多少?______
20.水是人类宝贵的自然资源,与人类的生产、生活密切相关。
(1)水是常见的溶剂,将下列生活中的物质分别放入水中,不能形成溶液的是_________。
A 蔗糖 B 纯碱 C 食盐 D 花生油
用质量分数为20%的氢氧化钠溶液配制5%的氢氧化钠溶液100g,需要水_________g。
(2)净化水的常用方法有:①消毒杀菌②过滤③蒸馏④活性炭吸附⑤加明矾吸附沉降。天然水中往往含有许多杂质,要把天然水净化成生活中的自来水,所选用的净化方法按净化过程排序是(填序号)_________。
(3)漂白粉可用于水的杀菌消毒,其有效成分是次氯酸钙【化学式为Ca(ClO)2】。次氯酸钙可发生如下反应:,则X的化学式为_________。
(4)一种新型净水剂高铁酸钾(K2FeO4),具有高效消毒作用,该高铁酸钾中铁元素的化合价为_________。
(5)工业上可用海水提取粗盐后的母液来提取金属镁,其流程如下:
该流程中,加溶液A时所发生的反应方程式为_________,其中没有发生的基本反应类型为化合反应和_________。
21.食盐是一种重要的化工原料。请回答下列问题。
(1)请完善实验室除去粗盐中泥沙等难溶性杂质的实验步骤。
①操作Ⅰ所用的玻璃仪器有:烧杯、玻璃棒和____。
②在蒸发过程中,待___时,停止加热,利用余热将滤液蒸干。
(2)由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图。
①加入稍过量的Na2CO3溶液除了能除去粗盐中的CaCl2外,它还有一个作用是____(用化学方程式表示)。
②通过操作Ⅲ所得滤液中的溶质有____(用化学式表示)。
(3)若有溶质质量分数为10%的氯化钠不饱和溶液100 kg,要将其变成20 ℃时氯化钠的饱和溶液,以满足化工生产的需要,可采用的最简便方法是____。已知:20 ℃时氯化钠的溶解度为36g。
22.镁是重要的国防金属,充分利用海边的贝壳(主要成分是CaCO3)和卤水制取金属镁的流程图如下:
(1)步骤②的化学方程式为______,试剂X的名称是______。
(2)步骤⑤电解熔融状态的C得到金属镁的过程,是将______能转化为______能。
(3)某校学生在实验室中模拟步骤③的反应,将氯化镁和氯化钠的固体混合物样品20g,完全溶于113.7g水中,再将100g氢氧化钠溶液平均分四次加入其中,充分振荡,生成白色沉淀的质量与所加氢氧化钠溶液的质量关系如图所示。发生反应的化学方程式为:
请根据有关数据完成下列计算:
①M点对应的纵坐标应为______。
②恰好完全反应时,所得溶液的溶质质量分数?______(写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
2.C
3.A
4.B
5.D
6.B
7.C
8.D
9.B
10.C
11.D
12.B
13.B
14.B
15.A
16.D
17. 过滤 煮沸 防止暴沸(局部沸腾) B 分子间间隔不同(或分子运动速率不同) 元素 42
18. B 电解产生的Cl2用于生产HCl,与Mg(OH)2发生中和反应 除去空气中的二氧化碳和水 吸收反应生成的二氧化碳 ##氧化镁 10
19. CaO B 将氯化镁富集提纯 解:设20g氯化镁样品中氯化镁的质量为x,生成沉淀的质量为y
x=19g
y=11.6g
氯化镁样品中氯化镁的质量分数为: P 点对应的溶液总质量为:
答:氯化镁样品中氯化镁的质量分数 95%;P 点对应的纵坐标的数值是 168.4g。
20. D 75 ⑤②④① CO2 +6 置换反应
21. 漏斗 蒸发皿中出现较多固体时 BaCl2 + Na2CO3 = BaCO3↓+ 2NaCl Na2CO3、NaCl 、NaOH 加入22.4kg氯化钠固体
22. 稀盐酸 电 化学 2.9g 解:设恰好完全反应时,生成氯化钠的质量为x,氯化镁的质量为y
x=17.55g
y=14.25g
恰好完全反应时,所得溶液的溶质质量分数为:
答:恰好完全反应时,所得溶液的溶质质量分数为11.65%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
