8.2海水“晒盐” 同步测试——2021-2022学年鲁教版九年级下册(word版 含答案)
文档属性
| 名称 | 8.2海水“晒盐” 同步测试——2021-2022学年鲁教版九年级下册(word版 含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 199.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-20 07:52:16 | ||
图片预览


文档简介
8.2 海水“晒盐”
一、单选题
1.下列有关溶液的说法正确的是
A.饱和溶液一定是浓溶液
B.溶液是均一、稳定的混合物
C.溶液蒸发溶剂,一定会析出晶体
D.不饱和溶液一定是稀溶液
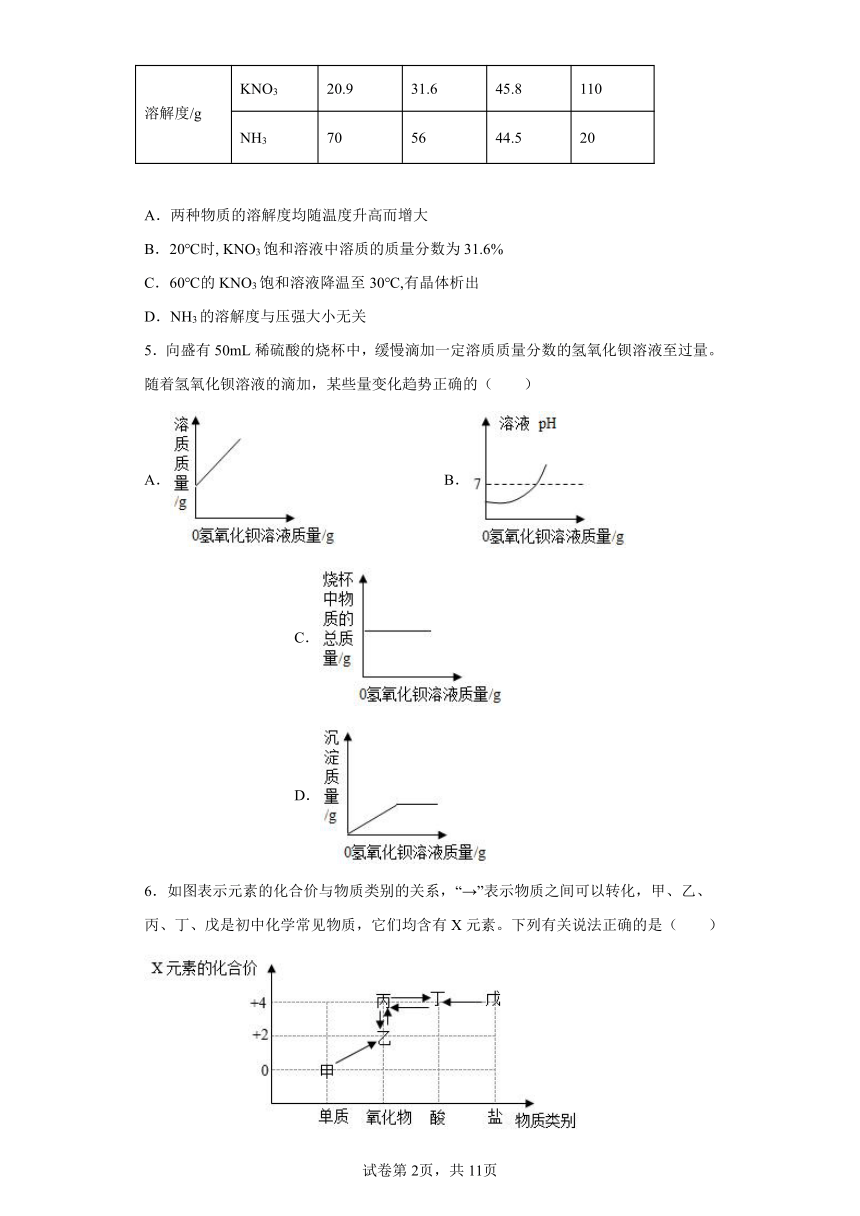
2.根据实验判断下列说法不正确的是
A.溶液①和溶液②中溶质的质量分数相同,但均小于溶液③
B.溶液③可能是饱和溶液
C.溶液④的溶质质量分数大于溶液⑤的溶质质量分数
D.溶液中溶剂质量:①=②=③=④=⑤
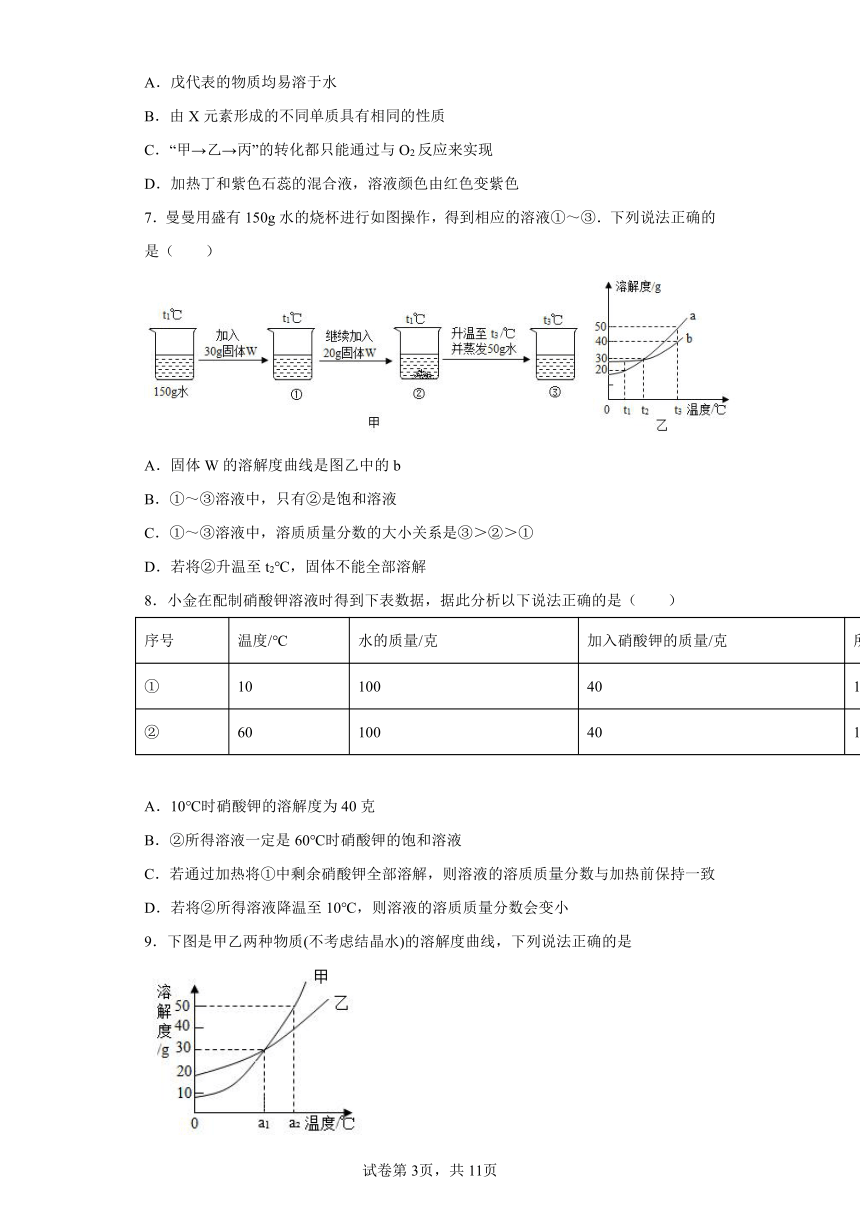
3.硝酸钾和氯化钠的溶解度曲线如下图所示。30℃时,分别将30g硝酸钾和氯化钠放入100 g水中,充分溶解。下列结论中,不正确的是
A.两种溶液中溶质的质量分数相等
B.通常情况下,采取降温的方法能将两种溶液都变成饱和溶液
C.若将硝酸钾溶液降温到20℃,溶液中溶质和溶剂的质量比为3∶10
D.若将硝酸钾溶液变为10℃时的饱和溶液,溶液中溶质的质量分数一定减小
4.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时, KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度与压强大小无关
5.向盛有50mL稀硫酸的烧杯中,缓慢滴加一定溶质质量分数的氢氧化钡溶液至过量。随着氢氧化钡溶液的滴加,某些量变化趋势正确的( )
A. B. C. D.
6.如图表示元素的化合价与物质类别的关系,“→”表示物质之间可以转化,甲、乙、丙、丁、戊是初中化学常见物质,它们均含有X元素。下列有关说法正确的是( )
A.戊代表的物质均易溶于水
B.由X元素形成的不同单质具有相同的性质
C.“甲→乙→丙”的转化都只能通过与O2反应来实现
D.加热丁和紫色石蕊的混合液,溶液颜色由红色变紫色
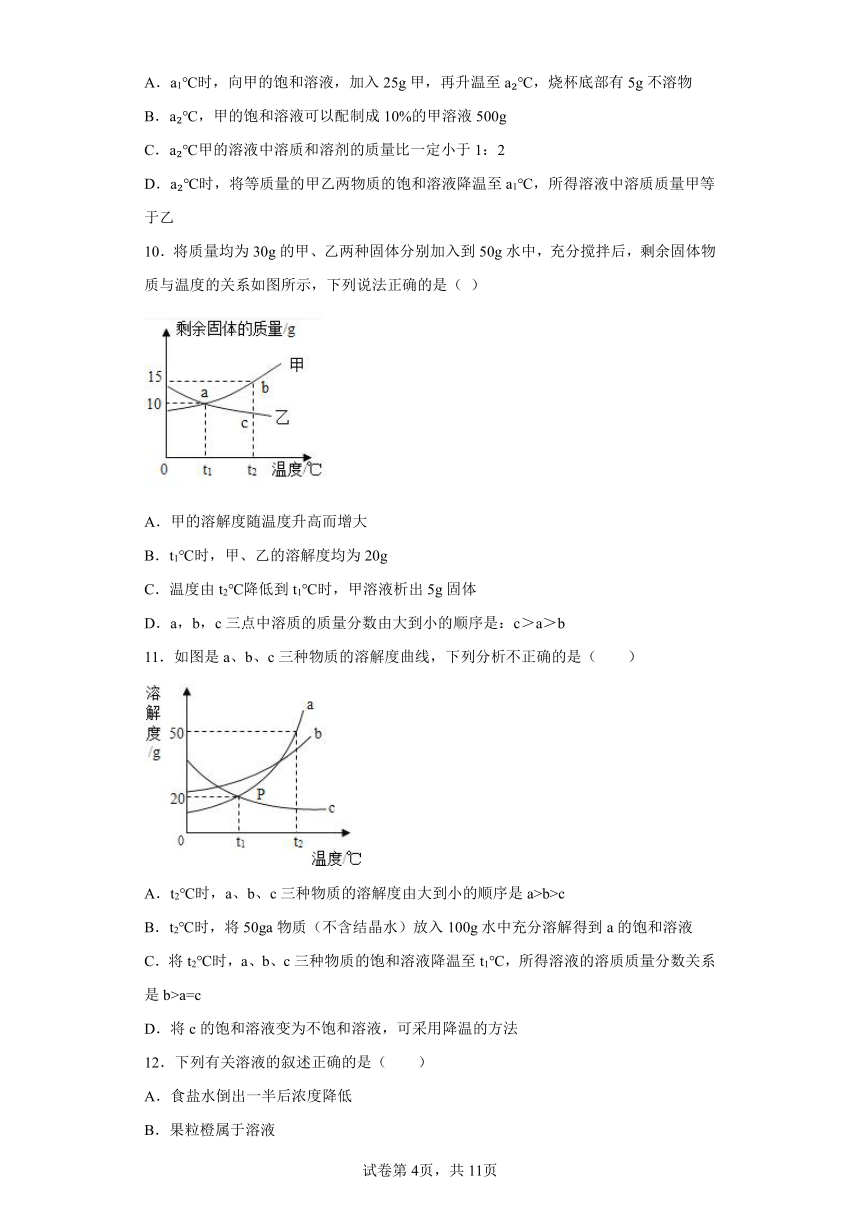
7.曼曼用盛有150g水的烧杯进行如图操作,得到相应的溶液①~③.下列说法正确的是( )
A.固体W的溶解度曲线是图乙中的b
B.①~③溶液中,只有②是饱和溶液
C.①~③溶液中,溶质质量分数的大小关系是③>②>①
D.若将②升温至t2℃,固体不能全部溶解
8.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
9.下图是甲乙两种物质(不考虑结晶水)的溶解度曲线,下列说法正确的是
A.a1℃时,向甲的饱和溶液,加入25g甲,再升温至a ℃,烧杯底部有5g不溶物
B.a ℃,甲的饱和溶液可以配制成10%的甲溶液500g
C.a ℃甲的溶液中溶质和溶剂的质量比一定小于1:2
D.a ℃时,将等质量的甲乙两物质的饱和溶液降温至a1℃,所得溶液中溶质质量甲等于乙
10.将质量均为30g的甲、乙两种固体分别加入到50g水中,充分搅拌后,剩余固体物质与温度的关系如图所示,下列说法正确的是( )
A.甲的溶解度随温度升高而增大
B.t1℃时,甲、乙的溶解度均为20g
C.温度由t2℃降低到t1℃时,甲溶液析出5g固体
D.a,b,c三点中溶质的质量分数由大到小的顺序是:c>a>b
11.如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是( )
A.t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c
B.t2℃时,将50ga物质(不含结晶水)放入100g水中充分溶解得到a的饱和溶液
C.将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是b>a=c
D.将c的饱和溶液变为不饱和溶液,可采用降温的方法
12.下列有关溶液的叙述正确的是( )
A.食盐水倒出一半后浓度降低
B.果粒橙属于溶液
C.升温会降低二氧化碳在水中的溶解度
D.蔗糖可以无限溶解在一定量的水中
13.将200g溶有物质M的溶液从95℃降低到10℃,不同温度时析出溶质M的质量如下表所示。下列说法正确的是( )
温度/℃ 95 90 80 30 10
析出M的质量/g 0 0 15 100 116
A.95℃时该溶液为饱和溶液
B.M的溶解度随温度的升高而减小
C.30℃时析出M后所得溶液中含100g水
D.从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法
14.X、Y、Z三种物质的溶解度曲线如图所示,下列说法正确的是( )
A.Y的溶解度为50 g
B.T2℃时,X、Y两种物质的溶解度相等
C.T1℃时,三种物质的溶解度由大到小的顺序是Y>X>Z
D.T2℃时,50 g H2O与50 g X混合,可得到100 g X的饱和溶液
15.硝酸钾的溶解度曲线如图所示,将100g60℃的KNO3饱和溶液分别进行如下操作后,,所得溶液与原溶液相比,变化结果完全正确的是
选项 操作 溶质质量 溶液质量 溶质的质量分数 KNO3的溶解度
A 升温 变大 变大 不变 变大
B 降温 变小 变小 不变 变小
C 加入KNO3固体 不变 变大 变大 变大
D 恒温蒸发部分水 变小 变小 不变 不变
A.A B.B C.C D.D
16.把 CaCO3、NaCl、MgCl2三种固体物质组成的混合物逐一分离所需要的试剂依次是
A.H2ONaOHHCl
B.H2O KOH HCl
C.H2O NaOH H2SO4
D.H2O KOH H2SO4
二、综合应用题
17.为了增强导电性,实验室用溶质质量分数为的氢氧化钠溶液进行水的电解实验。
实验一:配制溶质质量分数为的氢氧化钠溶液。
①将烧杯放入电子天平上称量时,先要进行 _______ 操作。再将氢氧化钠固体慢慢放入烧杯内,直到电子天平显示出 ____ g数据为止。
②实际配制的溶液中溶质的质量分数小于,其原因不可能是 ____ 。
A氢氧化钠固体不纯 B固体倒入烧杯时洒落到电子天平上
C配制时所用烧杯内残留部分水 D倒入试剂瓶时有少量液体溅出
实验二:水的电解实验
③用如图装置进行水的电解实验
Ⅰ.如图试管1得到的气体是 _____ 。该反应的方程式为 __________________ 。
Ⅱ.电解水实验证明了水由 _________ 组成。
电解水过程中保持不变的微粒是 _____________ (填写微粒名称)。
Ⅲ.时,将等质量的甲、乙固体,分别加入到盛有水的烧杯中,充分搅拌后现象如图1,加热到时现象如图2(不考虑水分蒸发),甲、乙固体溶解度曲线如图3。
下列说法正确的是 ______ (填字母序号)。
A图3中N表示的是甲的溶解度曲线 B图2中甲、乙溶液的溶质质量分数相等
C图2中甲溶液是不饱和溶液 D图1中甲溶液溶质质量分数大于乙溶液溶质质量分数
18.分析处理图表中的信息是学习化学的种重要方法。
(1)下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
KNO3 13.3 20.9 32 45.8 64 85.5 110 138 169 202 246
NaCl 35.7 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39 39.8
①30℃时,KNO3溶液的最大浓度(溶质质量分数)为 ________ (只列计算式,不需要计算结果).
②根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是 _____ 。
(2)根据电解水的实验,回答下列问题:
①从宏观上观察:图示a、b管中产生的体积比约为2:1,则他们的质量比为 ____ 。
②从微观上分析:下列说法错误的是 _________ (填字母)。
a.水是由水分子构成的
b.水是由氢原子和氧原子构成的
c.每个水分子是由2个氢原子和1个氧原子构成的
(3)如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答。
①蒸发前原溶液是 _______ (填“饱和”或“不饱和”)溶液,n的数值是 ______ 。
②依据上述实验,你认为甲的溶解度随温度变化的趋势是 ________ (填序号)。
a.随温度升高而增大 b.随温度升高面减小 c.无法判断。
19.根据下图中甲、乙、丙三种固体物质的溶解度曲线,回答下列向题。
(1)温度为__________℃时,甲、乙物质的溶解度相等。
(2)甲、乙、丙三种物质中,__________的溶解度受温度影响最小。
(3)甲中混有少量的乙,提纯甲的方法是________。
(4)分别将100g甲、丙的饱和溶液从t3℃降温到t1℃时,对所得溶液的叙述正确的 (填序号)
A.甲、丙都是饱和溶液
B.所含溶剂质量:甲=丙
C.溶液的质量:甲>丙
D.溶质的质量分数:甲>丙
20.求某草酸样品中草酸晶体(H2C2O4·2H2O)的质量分数:称取8.75g草酸晶体样品配制50.00g溶液,取10.00g溶液加适量的稀硫酸,然后滴加25.00g3.16%KMnO4溶液,(已知:)则KMnO4溶液由显______色刚好变为无色时,恰好反应完全,25.00g3.16%KMnO4溶液中KMnO4的质量______g。样品中草酸晶体(H2C2O4·2H2O)的质量分数______。
21.水是生命之源,我们应该了解水、爱护水资源。
(1)下列水的净化方法中,净化程度最高的是___________(填字母序号)。
A.静置沉淀 B.吸附沉淀 C.蒸馏 D.过滤
(2)生活中灭除水中细菌、降低自来水的硬度常用方法是___________。
(3)在下图A实验通电时,a试管中液体呈碱性、b试管中液体呈酸性;利用此原理设计的家用电解水器(如图B所示),可得到酸碱性不同的水,其用途见下表C。
pH 水的应用
10.0 浸泡蔬菜
9.5 日常饮用
9.0 烹饪
6.0 洗头发
5.5 洗涤器皿
C 酸碱性不同的水的用途
以下关于上图的说法正确的是___________(填序号)。
①硫酸钠在水中解离出Na+和,可增强水的导电性
②电解过程中化学能转化为电能
③表C中用于“浸泡蔬菜”的水碱性最强
(4)固体物质甲和乙的溶解度曲线如图所示:
①物质甲中含有少量的乙,可采用___________提纯。
②t2°C时,50g水中加入30g物质甲,充分溶解后溶液的质量为___________g。
③若t1°C时,物质甲的饱和溶液m1g和物质乙的饱和溶液m2g,则下列关系成立的是___________(填字母序号)。
A.两种溶液中溶质的质量分数相等
B.分别升温至t2°C,所得溶液中溶质的质量分数可能相等
C.保持t1°C不变,分别加入等质量的水,所得溶液中溶质的质量分数可能相等
22.某化学兴趣小组的同学在老师的指导下,进行如下实验活动。
Ⅰ.某固体粉末可能含有氢氧化钠、氢氧化钙、碳酸钙和碳酸钠中的一种或几种。为探究固体成分,小组同学做了如下实验:
①取固体样品于试管中,加足量水,振荡、静置后有白色沉淀,小明同学认为样品中一定含有碳酸钙,其他同学认为他的结论不准确,原因是___________(用化学方程式表示)。
②从小明的试管中取少量上层清液于另一试管中,向其中滴加过量BaC12溶液,有白色沉淀生成。
③把过程②所得物质过滤,向滤液中滴加无色酚酞溶液,溶液变红色。
根据以上实验可知,样品的组成有___________种情况(填数字)任写出一种组成情况___________(填化学式)。
Ⅱ.烧杯中盛有硫酸铜和硫酸的混合溶液100g,某同学向其中慢慢滴加10%的氢氧化钠溶液,烧杯中溶液的质量与滴加氢氧化钠溶液的质量关系如图所示。
bc段发生反应的化学方程式为___________。
c点时溶液中溶质质量为___________g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.B
4.C
5.D
6.D
7.D
8.D
9.B
10.D
11.C
12.C
13.D
14.B
15.D
16.A
17. 去皮 5 D 或氢气 H、O或氢元素和氧元素 氢原子和氧原子 BC
18. ×100% 36~36.3 1:8 B 不饱和 9 C
19.(1)t2
(2)乙
(3)降温结晶(或冷却热饱和溶液)
(4)D
20. 紫红色 0.79 解:设10.00g溶液中H2C2O4的质量为x
那么50.00g溶液中H2C2O4的质量为1.125g×5=5.625g;
则草酸晶体(H2C2O4·2H2O)的质量为;
样品中草酸晶体(H2C2O4·2H2O)的质量分数。
21. C 煮沸 ①③ 降温结晶 65g AC
22. 三 NaOH,Na2CO3,CaCO3 28.4
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关溶液的说法正确的是
A.饱和溶液一定是浓溶液
B.溶液是均一、稳定的混合物
C.溶液蒸发溶剂,一定会析出晶体
D.不饱和溶液一定是稀溶液
2.根据实验判断下列说法不正确的是
A.溶液①和溶液②中溶质的质量分数相同,但均小于溶液③
B.溶液③可能是饱和溶液
C.溶液④的溶质质量分数大于溶液⑤的溶质质量分数
D.溶液中溶剂质量:①=②=③=④=⑤
3.硝酸钾和氯化钠的溶解度曲线如下图所示。30℃时,分别将30g硝酸钾和氯化钠放入100 g水中,充分溶解。下列结论中,不正确的是
A.两种溶液中溶质的质量分数相等
B.通常情况下,采取降温的方法能将两种溶液都变成饱和溶液
C.若将硝酸钾溶液降温到20℃,溶液中溶质和溶剂的质量比为3∶10
D.若将硝酸钾溶液变为10℃时的饱和溶液,溶液中溶质的质量分数一定减小
4.压强为101kPa下,硝酸钾和氨气在不同温度下的溶解度如下表。下列说法正确的是
温度/℃ 10 20 30 60
溶解度/g KNO3 20.9 31.6 45.8 110
NH3 70 56 44.5 20
A.两种物质的溶解度均随温度升高而增大
B.20℃时, KNO3饱和溶液中溶质的质量分数为31.6%
C.60℃的KNO3饱和溶液降温至30℃,有晶体析出
D.NH3的溶解度与压强大小无关
5.向盛有50mL稀硫酸的烧杯中,缓慢滴加一定溶质质量分数的氢氧化钡溶液至过量。随着氢氧化钡溶液的滴加,某些量变化趋势正确的( )
A. B. C. D.
6.如图表示元素的化合价与物质类别的关系,“→”表示物质之间可以转化,甲、乙、丙、丁、戊是初中化学常见物质,它们均含有X元素。下列有关说法正确的是( )
A.戊代表的物质均易溶于水
B.由X元素形成的不同单质具有相同的性质
C.“甲→乙→丙”的转化都只能通过与O2反应来实现
D.加热丁和紫色石蕊的混合液,溶液颜色由红色变紫色
7.曼曼用盛有150g水的烧杯进行如图操作,得到相应的溶液①~③.下列说法正确的是( )
A.固体W的溶解度曲线是图乙中的b
B.①~③溶液中,只有②是饱和溶液
C.①~③溶液中,溶质质量分数的大小关系是③>②>①
D.若将②升温至t2℃,固体不能全部溶解
8.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
9.下图是甲乙两种物质(不考虑结晶水)的溶解度曲线,下列说法正确的是
A.a1℃时,向甲的饱和溶液,加入25g甲,再升温至a ℃,烧杯底部有5g不溶物
B.a ℃,甲的饱和溶液可以配制成10%的甲溶液500g
C.a ℃甲的溶液中溶质和溶剂的质量比一定小于1:2
D.a ℃时,将等质量的甲乙两物质的饱和溶液降温至a1℃,所得溶液中溶质质量甲等于乙
10.将质量均为30g的甲、乙两种固体分别加入到50g水中,充分搅拌后,剩余固体物质与温度的关系如图所示,下列说法正确的是( )
A.甲的溶解度随温度升高而增大
B.t1℃时,甲、乙的溶解度均为20g
C.温度由t2℃降低到t1℃时,甲溶液析出5g固体
D.a,b,c三点中溶质的质量分数由大到小的顺序是:c>a>b
11.如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是( )
A.t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c
B.t2℃时,将50ga物质(不含结晶水)放入100g水中充分溶解得到a的饱和溶液
C.将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是b>a=c
D.将c的饱和溶液变为不饱和溶液,可采用降温的方法
12.下列有关溶液的叙述正确的是( )
A.食盐水倒出一半后浓度降低
B.果粒橙属于溶液
C.升温会降低二氧化碳在水中的溶解度
D.蔗糖可以无限溶解在一定量的水中
13.将200g溶有物质M的溶液从95℃降低到10℃,不同温度时析出溶质M的质量如下表所示。下列说法正确的是( )
温度/℃ 95 90 80 30 10
析出M的质量/g 0 0 15 100 116
A.95℃时该溶液为饱和溶液
B.M的溶解度随温度的升高而减小
C.30℃时析出M后所得溶液中含100g水
D.从M的不饱和溶液中析出M可采用先蒸发溶剂、再冷却结晶的方法
14.X、Y、Z三种物质的溶解度曲线如图所示,下列说法正确的是( )
A.Y的溶解度为50 g
B.T2℃时,X、Y两种物质的溶解度相等
C.T1℃时,三种物质的溶解度由大到小的顺序是Y>X>Z
D.T2℃时,50 g H2O与50 g X混合,可得到100 g X的饱和溶液
15.硝酸钾的溶解度曲线如图所示,将100g60℃的KNO3饱和溶液分别进行如下操作后,,所得溶液与原溶液相比,变化结果完全正确的是
选项 操作 溶质质量 溶液质量 溶质的质量分数 KNO3的溶解度
A 升温 变大 变大 不变 变大
B 降温 变小 变小 不变 变小
C 加入KNO3固体 不变 变大 变大 变大
D 恒温蒸发部分水 变小 变小 不变 不变
A.A B.B C.C D.D
16.把 CaCO3、NaCl、MgCl2三种固体物质组成的混合物逐一分离所需要的试剂依次是
A.H2ONaOHHCl
B.H2O KOH HCl
C.H2O NaOH H2SO4
D.H2O KOH H2SO4
二、综合应用题
17.为了增强导电性,实验室用溶质质量分数为的氢氧化钠溶液进行水的电解实验。
实验一:配制溶质质量分数为的氢氧化钠溶液。
①将烧杯放入电子天平上称量时,先要进行 _______ 操作。再将氢氧化钠固体慢慢放入烧杯内,直到电子天平显示出 ____ g数据为止。
②实际配制的溶液中溶质的质量分数小于,其原因不可能是 ____ 。
A氢氧化钠固体不纯 B固体倒入烧杯时洒落到电子天平上
C配制时所用烧杯内残留部分水 D倒入试剂瓶时有少量液体溅出
实验二:水的电解实验
③用如图装置进行水的电解实验
Ⅰ.如图试管1得到的气体是 _____ 。该反应的方程式为 __________________ 。
Ⅱ.电解水实验证明了水由 _________ 组成。
电解水过程中保持不变的微粒是 _____________ (填写微粒名称)。
Ⅲ.时,将等质量的甲、乙固体,分别加入到盛有水的烧杯中,充分搅拌后现象如图1,加热到时现象如图2(不考虑水分蒸发),甲、乙固体溶解度曲线如图3。
下列说法正确的是 ______ (填字母序号)。
A图3中N表示的是甲的溶解度曲线 B图2中甲、乙溶液的溶质质量分数相等
C图2中甲溶液是不饱和溶液 D图1中甲溶液溶质质量分数大于乙溶液溶质质量分数
18.分析处理图表中的信息是学习化学的种重要方法。
(1)下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)
温度(℃) 0 10 20 30 40 50 60 70 80 90 100
KNO3 13.3 20.9 32 45.8 64 85.5 110 138 169 202 246
NaCl 35.7 35.8 36 36.3 36.6 37 37.3 37.8 38.4 39 39.8
①30℃时,KNO3溶液的最大浓度(溶质质量分数)为 ________ (只列计算式,不需要计算结果).
②根据表内数据可知,KNO3和NaCl在某一温度时具有相同的溶解度X,则X的取值范围是 _____ 。
(2)根据电解水的实验,回答下列问题:
①从宏观上观察:图示a、b管中产生的体积比约为2:1,则他们的质量比为 ____ 。
②从微观上分析:下列说法错误的是 _________ (填字母)。
a.水是由水分子构成的
b.水是由氢原子和氧原子构成的
c.每个水分子是由2个氢原子和1个氧原子构成的
(3)如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,请回答。
①蒸发前原溶液是 _______ (填“饱和”或“不饱和”)溶液,n的数值是 ______ 。
②依据上述实验,你认为甲的溶解度随温度变化的趋势是 ________ (填序号)。
a.随温度升高而增大 b.随温度升高面减小 c.无法判断。
19.根据下图中甲、乙、丙三种固体物质的溶解度曲线,回答下列向题。
(1)温度为__________℃时,甲、乙物质的溶解度相等。
(2)甲、乙、丙三种物质中,__________的溶解度受温度影响最小。
(3)甲中混有少量的乙,提纯甲的方法是________。
(4)分别将100g甲、丙的饱和溶液从t3℃降温到t1℃时,对所得溶液的叙述正确的 (填序号)
A.甲、丙都是饱和溶液
B.所含溶剂质量:甲=丙
C.溶液的质量:甲>丙
D.溶质的质量分数:甲>丙
20.求某草酸样品中草酸晶体(H2C2O4·2H2O)的质量分数:称取8.75g草酸晶体样品配制50.00g溶液,取10.00g溶液加适量的稀硫酸,然后滴加25.00g3.16%KMnO4溶液,(已知:)则KMnO4溶液由显______色刚好变为无色时,恰好反应完全,25.00g3.16%KMnO4溶液中KMnO4的质量______g。样品中草酸晶体(H2C2O4·2H2O)的质量分数______。
21.水是生命之源,我们应该了解水、爱护水资源。
(1)下列水的净化方法中,净化程度最高的是___________(填字母序号)。
A.静置沉淀 B.吸附沉淀 C.蒸馏 D.过滤
(2)生活中灭除水中细菌、降低自来水的硬度常用方法是___________。
(3)在下图A实验通电时,a试管中液体呈碱性、b试管中液体呈酸性;利用此原理设计的家用电解水器(如图B所示),可得到酸碱性不同的水,其用途见下表C。
pH 水的应用
10.0 浸泡蔬菜
9.5 日常饮用
9.0 烹饪
6.0 洗头发
5.5 洗涤器皿
C 酸碱性不同的水的用途
以下关于上图的说法正确的是___________(填序号)。
①硫酸钠在水中解离出Na+和,可增强水的导电性
②电解过程中化学能转化为电能
③表C中用于“浸泡蔬菜”的水碱性最强
(4)固体物质甲和乙的溶解度曲线如图所示:
①物质甲中含有少量的乙,可采用___________提纯。
②t2°C时,50g水中加入30g物质甲,充分溶解后溶液的质量为___________g。
③若t1°C时,物质甲的饱和溶液m1g和物质乙的饱和溶液m2g,则下列关系成立的是___________(填字母序号)。
A.两种溶液中溶质的质量分数相等
B.分别升温至t2°C,所得溶液中溶质的质量分数可能相等
C.保持t1°C不变,分别加入等质量的水,所得溶液中溶质的质量分数可能相等
22.某化学兴趣小组的同学在老师的指导下,进行如下实验活动。
Ⅰ.某固体粉末可能含有氢氧化钠、氢氧化钙、碳酸钙和碳酸钠中的一种或几种。为探究固体成分,小组同学做了如下实验:
①取固体样品于试管中,加足量水,振荡、静置后有白色沉淀,小明同学认为样品中一定含有碳酸钙,其他同学认为他的结论不准确,原因是___________(用化学方程式表示)。
②从小明的试管中取少量上层清液于另一试管中,向其中滴加过量BaC12溶液,有白色沉淀生成。
③把过程②所得物质过滤,向滤液中滴加无色酚酞溶液,溶液变红色。
根据以上实验可知,样品的组成有___________种情况(填数字)任写出一种组成情况___________(填化学式)。
Ⅱ.烧杯中盛有硫酸铜和硫酸的混合溶液100g,某同学向其中慢慢滴加10%的氢氧化钠溶液,烧杯中溶液的质量与滴加氢氧化钠溶液的质量关系如图所示。
bc段发生反应的化学方程式为___________。
c点时溶液中溶质质量为___________g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.C
3.B
4.C
5.D
6.D
7.D
8.D
9.B
10.D
11.C
12.C
13.D
14.B
15.D
16.A
17. 去皮 5 D 或氢气 H、O或氢元素和氧元素 氢原子和氧原子 BC
18. ×100% 36~36.3 1:8 B 不饱和 9 C
19.(1)t2
(2)乙
(3)降温结晶(或冷却热饱和溶液)
(4)D
20. 紫红色 0.79 解:设10.00g溶液中H2C2O4的质量为x
那么50.00g溶液中H2C2O4的质量为1.125g×5=5.625g;
则草酸晶体(H2C2O4·2H2O)的质量为;
样品中草酸晶体(H2C2O4·2H2O)的质量分数。
21. C 煮沸 ①③ 降温结晶 65g AC
22. 三 NaOH,Na2CO3,CaCO3 28.4
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
