7.3溶液浓稀的表示同步练习-2021-2022学年九年级化学科粤版(2012)下册(word版 含答案)
文档属性
| 名称 | 7.3溶液浓稀的表示同步练习-2021-2022学年九年级化学科粤版(2012)下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 120.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-20 00:00:00 | ||
图片预览


文档简介
7.3 溶液浓稀的表示
一、单选题
1.要使质量分数为10%的氯化钠溶液50g 变成质量分数为20%的氯化钠溶液,可采取的方法是
A.加入5g氯化钠 B.蒸发20g水
C.加入50g的30%氯化钠溶液 D.将溶液取出25g
2.实验室用硝酸钾固体配制100.0 g溶质质量分数为3.0%的硝酸钾溶液,下列说法正确的是
A.用50 mL量筒量水
B.将固体放于托盘天平的右盘称取
C.将固体直接投入量筒中溶解
D.将配好的溶液装入贴有标签(如图)的试剂瓶中,塞好瓶塞
3.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
A.随温度升高,a、b、c三种物质的溶解度均增大
B.t2℃时,把50g a放入50g水中,可得到100g a的饱和溶液
C.将t2℃时等质量的a、b饱和溶液降温到t1℃,析出晶体的质量a大于b
D.t1℃时,a、c的溶解度相等,则两溶液的溶质质量分数也相等
4.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
5.如图为甲、乙两物质的溶解度曲线,下列说法正确的是
A.甲、乙两物质均属于难溶物质
B.甲物质的溶解度大于乙物质的溶解度
C.t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等
D.t2℃时,甲物质饱和溶液的溶质质量分数为50%
6.除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
7.本题有甲、乙两图,图甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。
关于图乙中烧杯内的物质,下列说法正确的是
A.R物质是氯化铵
B.溶液的溶质质量分数是烧杯①小于烧杯②
C.若使烧杯③中的固体溶解,只能采用加水的方法
D.烧杯①②③中,只有烧杯③中上层清液是饱和溶液
8.下列说法正确的是
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
9.溶液的组成变化与浓溶液和稀溶液有着密切的关系。下列有关溶液浓、稀的说法正确的是
①溶质质量增大,溶剂质量不变,则溶液质量增大,溶液会变浓。
②溶质质量减小,溶剂质量不变,则溶液质量减小,溶液会变稀。
③溶质质量不变,溶剂质量增大,则溶液质量增大,溶液会变稀。
④溶质质量不变,溶剂质量减小,则溶液质量减小,溶液会变浓。
A.①②③④ B.①②③ C.②③④ D.①③④
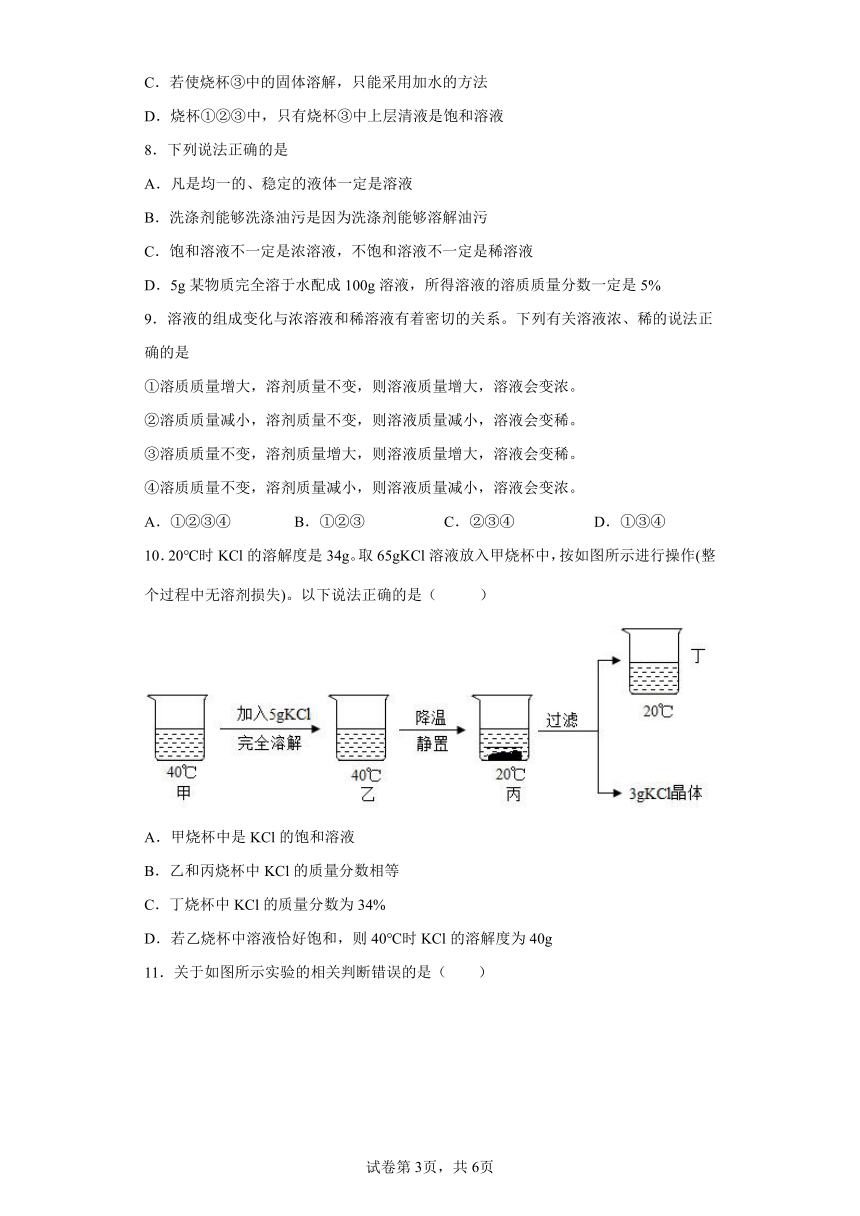
10.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
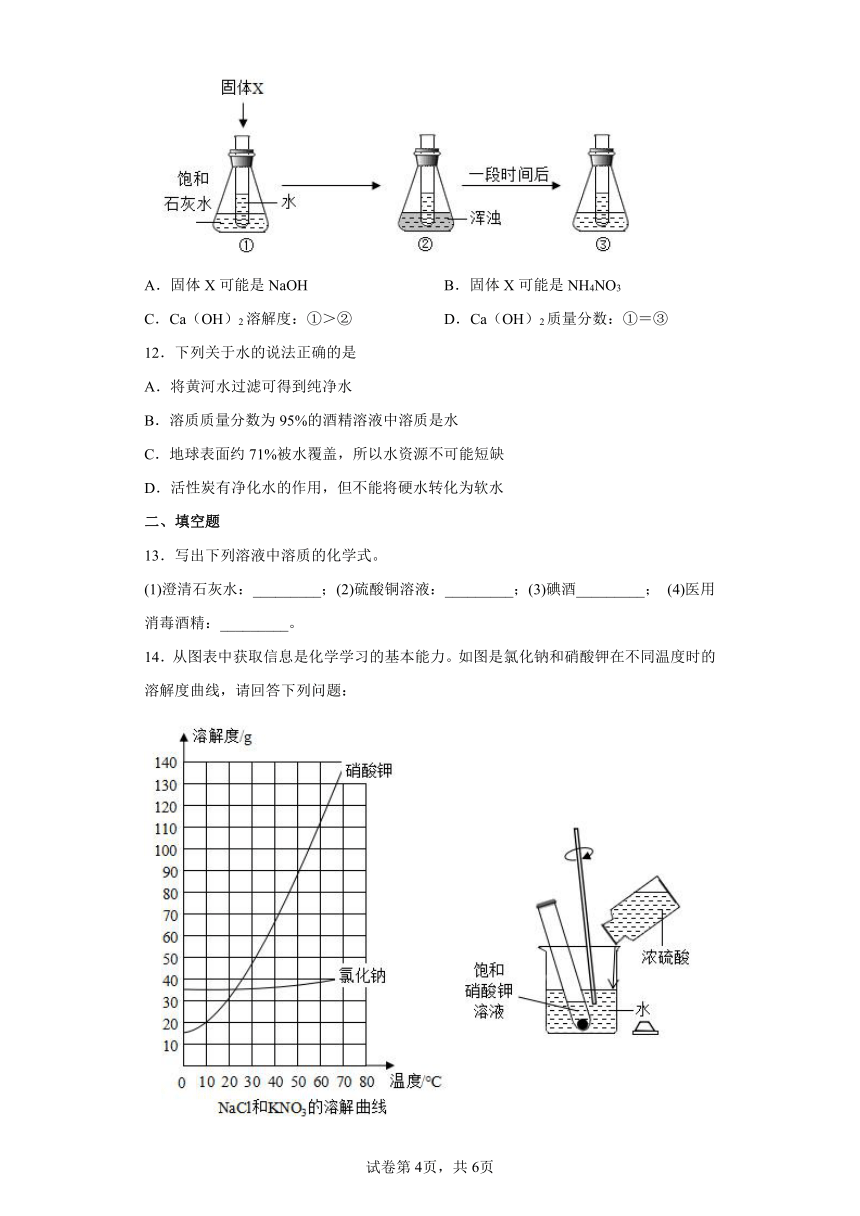
11.关于如图所示实验的相关判断错误的是( )
A.固体X可能是NaOH B.固体X可能是NH4NO3
C.Ca(OH)2溶解度:①>② D.Ca(OH)2质量分数:①=③
12.下列关于水的说法正确的是
A.将黄河水过滤可得到纯净水
B.溶质质量分数为95%的酒精溶液中溶质是水
C.地球表面约71%被水覆盖,所以水资源不可能短缺
D.活性炭有净化水的作用,但不能将硬水转化为软水
二、填空题
13.写出下列溶液中溶质的化学式。
(1)澄清石灰水:_________;(2)硫酸铜溶液:_________;(3)碘酒_________; (4)医用消毒酒精:_________。
14.从图表中获取信息是化学学习的基本能力。如图是氯化钠和硝酸钾在不同温度时的溶解度曲线,请回答下列问题:
(1)20℃时,氯化钠的溶解度是36g,其含义是______________。
(2)60℃时,在50g水中加入70g硝酸钾固体,充分搅拌至固体不再溶解时,此时形成的溶液是_____(填“饱和”或“不饱和”)溶液,溶液中溶质的质量分数为_______(计算结果精确到0.1%)。
(3)图中,当向盛有水的烧杯中缓慢倒入浓硫酸时,试管中观察到的现象是___________。
15.下图为甲、乙两种物质(均不含结晶水)的溶解度曲线图。请回答下列问题。
(1)在10 ℃时,甲的溶解度_____乙的溶解度。(选填“>”“<”或“=”)
(2)在20 ℃时,向盛有50 g水的烧杯中加入25 g甲物质,充分搅拌后溶液质量是____g。
(3)取乙进行如图实验,属于饱和溶液的是_____,溶质质量分数最大的是________。(选填字母序号)
三、综合应用题
16.在做实验时,欣欣需要用到200g溶质质量分数为15%的氯化钠溶液,但实验室只有50g溶质质量分数为30%的氯化钠溶液,于是她便自己动手并利用已有的溶液来配制所需的氯化钠溶液。
(1)在称量时,她需要把氯化钠固体放到天垫有纸片的______(选填“左侧”或“右侧”)托盘中,并且应当称量______g氯化钠固体。
(2)她把称量好的氯化钠和实验室中现有的氯化钠溶液全都转移到一个大烧杯中,并应向其中加入体积为______mL的水,边加水边搅拌。(水的密度为1.0g/mL)
(3)如表是氯化钠在不同温度下的溶解度,假如她想通过升高溶液的温度来得到氯化钠晶体,则你认为她的做法______(选填“可行”或“不可行”)。
温度/℃ 20 40 60 80
溶解度/g 36.0 36.6 37.3 38.4
17.金属及其制品是现代生活中不可缺少的材料和工具。
①某同学在实验室用6.5g粗锌(假设杂质不参与反应)和稀盐酸制取H2。
I.配制稀盐酸需要市售37%的浓盐酸稀释。“37%”的含义是_____;配制中需要用到的仪器除烧杯、胶头滴管、试剂瓶外,还需要_____。
Ⅱ.6.5g粗锌完全反应共产生H20.08mol,该粗锌中锌的质量分数为_____(根据化学方程式计算)
②在“探究金属的性质”实验时,将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。若将所得滤渣放入稀盐酸中,有气泡产生,则滤液中可能含有的溶质是_____,滤渣中一定含有的金属是_____。
18.某实验小组探究了溶质的质量分数对H2O2分解速率的影响。实验装置如图所示,用注射器加入不同浓度的H2O2溶液(见下表),实验中使用传感器装置测算生成O2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图所示。
试验编号 的质量分数(%) 溶液的体积(ml) 对应曲线
Ⅰ 3.4 10.0 a
Ⅱ 2.4 10.0 b
Ⅲ 1.7 10.0 C(待绘制)
(1)实验前需准备不同浓度的H2O2溶液,若要配制100g质量分数为2.4%的H2O2溶液,需质量分数为30%的H2O2溶液______g。
(2)根据实验探究目的,从曲线a、b中,可得出的结论是______
(3)在图中画出曲线c的大致位置及趋势。______
(4)计算实验Ⅰ条件下H2O2完全分解所得氧气的质量,并写出具体计算过程_____(1.5-5.0%H2O2溶液的密度均取值1.0g/ml)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.C
4.B
5.C
6.D
7.B
8.C
9.A
10.D
11.B
12.D
13. Ca(OH)2 CuSO4 I2 CH3CH2OH
14. 20℃时,氯化钠溶于100g水中达到饱和状态的质量为36g 饱和 52.4% 试管中的硝酸钾逐渐溶解
15. > 70 AC B
16. 左侧 15 135 不可行
17. 每100g浓盐酸中含溶质的质量为37g 玻璃棒、量筒 80% Fe(NO3)2 Ag、Fe
18. 8 其他条件相同时,过氧化氢的质量分数越高,化学反应速率越快 题干信息可知,参与反应的过氧化氢质量为:,设生成氧气的质量为,则:
所以实验Ⅰ条件下H2O2完全分解所得氧气的质量0.16g;故填0.16g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.要使质量分数为10%的氯化钠溶液50g 变成质量分数为20%的氯化钠溶液,可采取的方法是
A.加入5g氯化钠 B.蒸发20g水
C.加入50g的30%氯化钠溶液 D.将溶液取出25g
2.实验室用硝酸钾固体配制100.0 g溶质质量分数为3.0%的硝酸钾溶液,下列说法正确的是
A.用50 mL量筒量水
B.将固体放于托盘天平的右盘称取
C.将固体直接投入量筒中溶解
D.将配好的溶液装入贴有标签(如图)的试剂瓶中,塞好瓶塞
3.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
A.随温度升高,a、b、c三种物质的溶解度均增大
B.t2℃时,把50g a放入50g水中,可得到100g a的饱和溶液
C.将t2℃时等质量的a、b饱和溶液降温到t1℃,析出晶体的质量a大于b
D.t1℃时,a、c的溶解度相等,则两溶液的溶质质量分数也相等
4.常温下,对100mL氯化钠饱和溶液进行图示实验。下列分析错误的是( )
A.实验1后,甲、乙中溶液的溶质质量分数相等
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲中溶液为氯化钠的不饱和溶液
D.实验2后,甲、乙中溶液所含溶质质量相等
5.如图为甲、乙两物质的溶解度曲线,下列说法正确的是
A.甲、乙两物质均属于难溶物质
B.甲物质的溶解度大于乙物质的溶解度
C.t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等
D.t2℃时,甲物质饱和溶液的溶质质量分数为50%
6.除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
7.本题有甲、乙两图,图甲为硝酸钾和氯化铵的溶解度曲线,图乙为兴趣小组进行的实验,R物质是硝酸钾或氯化铵中的一种。
关于图乙中烧杯内的物质,下列说法正确的是
A.R物质是氯化铵
B.溶液的溶质质量分数是烧杯①小于烧杯②
C.若使烧杯③中的固体溶解,只能采用加水的方法
D.烧杯①②③中,只有烧杯③中上层清液是饱和溶液
8.下列说法正确的是
A.凡是均一的、稳定的液体一定是溶液
B.洗涤剂能够洗涤油污是因为洗涤剂能够溶解油污
C.饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液
D.5g某物质完全溶于水配成100g溶液,所得溶液的溶质质量分数一定是5%
9.溶液的组成变化与浓溶液和稀溶液有着密切的关系。下列有关溶液浓、稀的说法正确的是
①溶质质量增大,溶剂质量不变,则溶液质量增大,溶液会变浓。
②溶质质量减小,溶剂质量不变,则溶液质量减小,溶液会变稀。
③溶质质量不变,溶剂质量增大,则溶液质量增大,溶液会变稀。
④溶质质量不变,溶剂质量减小,则溶液质量减小,溶液会变浓。
A.①②③④ B.①②③ C.②③④ D.①③④
10.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( )
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KCl的质量分数为34%
D.若乙烧杯中溶液恰好饱和,则40℃时KCl的溶解度为40g
11.关于如图所示实验的相关判断错误的是( )
A.固体X可能是NaOH B.固体X可能是NH4NO3
C.Ca(OH)2溶解度:①>② D.Ca(OH)2质量分数:①=③
12.下列关于水的说法正确的是
A.将黄河水过滤可得到纯净水
B.溶质质量分数为95%的酒精溶液中溶质是水
C.地球表面约71%被水覆盖,所以水资源不可能短缺
D.活性炭有净化水的作用,但不能将硬水转化为软水
二、填空题
13.写出下列溶液中溶质的化学式。
(1)澄清石灰水:_________;(2)硫酸铜溶液:_________;(3)碘酒_________; (4)医用消毒酒精:_________。
14.从图表中获取信息是化学学习的基本能力。如图是氯化钠和硝酸钾在不同温度时的溶解度曲线,请回答下列问题:
(1)20℃时,氯化钠的溶解度是36g,其含义是______________。
(2)60℃时,在50g水中加入70g硝酸钾固体,充分搅拌至固体不再溶解时,此时形成的溶液是_____(填“饱和”或“不饱和”)溶液,溶液中溶质的质量分数为_______(计算结果精确到0.1%)。
(3)图中,当向盛有水的烧杯中缓慢倒入浓硫酸时,试管中观察到的现象是___________。
15.下图为甲、乙两种物质(均不含结晶水)的溶解度曲线图。请回答下列问题。
(1)在10 ℃时,甲的溶解度_____乙的溶解度。(选填“>”“<”或“=”)
(2)在20 ℃时,向盛有50 g水的烧杯中加入25 g甲物质,充分搅拌后溶液质量是____g。
(3)取乙进行如图实验,属于饱和溶液的是_____,溶质质量分数最大的是________。(选填字母序号)
三、综合应用题
16.在做实验时,欣欣需要用到200g溶质质量分数为15%的氯化钠溶液,但实验室只有50g溶质质量分数为30%的氯化钠溶液,于是她便自己动手并利用已有的溶液来配制所需的氯化钠溶液。
(1)在称量时,她需要把氯化钠固体放到天垫有纸片的______(选填“左侧”或“右侧”)托盘中,并且应当称量______g氯化钠固体。
(2)她把称量好的氯化钠和实验室中现有的氯化钠溶液全都转移到一个大烧杯中,并应向其中加入体积为______mL的水,边加水边搅拌。(水的密度为1.0g/mL)
(3)如表是氯化钠在不同温度下的溶解度,假如她想通过升高溶液的温度来得到氯化钠晶体,则你认为她的做法______(选填“可行”或“不可行”)。
温度/℃ 20 40 60 80
溶解度/g 36.0 36.6 37.3 38.4
17.金属及其制品是现代生活中不可缺少的材料和工具。
①某同学在实验室用6.5g粗锌(假设杂质不参与反应)和稀盐酸制取H2。
I.配制稀盐酸需要市售37%的浓盐酸稀释。“37%”的含义是_____;配制中需要用到的仪器除烧杯、胶头滴管、试剂瓶外,还需要_____。
Ⅱ.6.5g粗锌完全反应共产生H20.08mol,该粗锌中锌的质量分数为_____(根据化学方程式计算)
②在“探究金属的性质”实验时,将锌粉和铁粉的混合物加入到盛有一定量硝酸银溶液的烧杯中,充分反应后过滤,得到滤渣和滤液。若将所得滤渣放入稀盐酸中,有气泡产生,则滤液中可能含有的溶质是_____,滤渣中一定含有的金属是_____。
18.某实验小组探究了溶质的质量分数对H2O2分解速率的影响。实验装置如图所示,用注射器加入不同浓度的H2O2溶液(见下表),实验中使用传感器装置测算生成O2的质量(圆底烧瓶内气压变化在安全范围),绘制氧气质量随时间变化的曲线,如图所示。
试验编号 的质量分数(%) 溶液的体积(ml) 对应曲线
Ⅰ 3.4 10.0 a
Ⅱ 2.4 10.0 b
Ⅲ 1.7 10.0 C(待绘制)
(1)实验前需准备不同浓度的H2O2溶液,若要配制100g质量分数为2.4%的H2O2溶液,需质量分数为30%的H2O2溶液______g。
(2)根据实验探究目的,从曲线a、b中,可得出的结论是______
(3)在图中画出曲线c的大致位置及趋势。______
(4)计算实验Ⅰ条件下H2O2完全分解所得氧气的质量,并写出具体计算过程_____(1.5-5.0%H2O2溶液的密度均取值1.0g/ml)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.C
4.B
5.C
6.D
7.B
8.C
9.A
10.D
11.B
12.D
13. Ca(OH)2 CuSO4 I2 CH3CH2OH
14. 20℃时,氯化钠溶于100g水中达到饱和状态的质量为36g 饱和 52.4% 试管中的硝酸钾逐渐溶解
15. > 70 AC B
16. 左侧 15 135 不可行
17. 每100g浓盐酸中含溶质的质量为37g 玻璃棒、量筒 80% Fe(NO3)2 Ag、Fe
18. 8 其他条件相同时,过氧化氢的质量分数越高,化学反应速率越快 题干信息可知,参与反应的过氧化氢质量为:,设生成氧气的质量为,则:
所以实验Ⅰ条件下H2O2完全分解所得氧气的质量0.16g;故填0.16g。
答案第1页,共2页
答案第1页,共2页
