人教版(五四学制)化学八年级全册第六单元碳和碳的氧化物复习教案
文档属性
| 名称 | 人教版(五四学制)化学八年级全册第六单元碳和碳的氧化物复习教案 |

|
|
| 格式 | doc | ||
| 文件大小 | 255.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-21 16:42:28 | ||
图片预览

文档简介
第六单元《碳和碳的氧化物》复习课教学设计
教材分析:
“碳和碳的氧化物”是初中阶段一个全面研究元素及化合物知识的单元,涉及知识内容较广, 本单元知识往往被学生看成是零碎、易懂、难记的内容,而且这部分内容比较多,化学反应方程式繁多,物质之间的联系较为复杂。根据这部分知识内容的特点, 本课力求让学生对知识间的相互联系形成整体的感知,帮助学生建立起有序的知识结构,了解C→CO→CO2→H2CO3→CaCO3之间的转换关系。其中运用的化学知识链的学习模式,其中,对今后的“酸、碱、盐”学习,有着方法指导意义。
教学策略:
(一)、对复习内容进行合理的重组,通过知识的整理突出知识的内在联系,形成知识结构;
(二)、进行必要的例题讲评和训练;
(三)、在重点内容上设置情境,调动兴趣,发展能力。
教学方法:
思考、讨论、讲解、归纳、练习
教学目标:
(一)、知识与技能
1、通过互联网搜索,进一步认识C 、CO 、CO2 、H2CO3 、CaCO3等物质的性质和相互之间的联系。
2、 能正确书写有关的化学方程式。
3、 能正确描述本单元有关实验的现象,并通过网络搜索使语言表述更规范。
4、 能运用所学的知识解决实际问题。
5、 培养学生的归纳总结能力和发散思维能力。
(二)、过程与方法:
1、通过理顺碳和碳的化合物之间的联系的活动,使学生学会把所学的知识系统化、网络化。
2、通过对CO2和CO两种气体的鉴别,使学生掌握物质鉴别的方法
3、通过“除去CO2中混有的少量CO,除去CO中混有的少量CO2” 使学生掌握除杂的方法
(三)、情感态度与价值观
1、通过学生的自主探究,保持持续的化学学习兴趣,严谨求实的科学态度和实践探究能力。
2、进一步认识物质的本质和联系。
3、通过分析日常生活中一些熟悉的现象,使学生感受到人们的生活离不开化学,增强对化学与生活、技术、社会之间关系的理解 。
教学重点:
C、CO 、CO2化学性质的复习
教学难点:
1、使本单元的知识形成知识网络
2、本单元化学方程式的书写
3、利用本单元知识解决实际问题。
教学过程:
复习导入
介绍几种碳的单质和含碳化合物
一、金刚石、石墨
颜色、状态 硬度导电性熔点 用 途
金刚石 无色、透明的正八面体固体 很大;不导电;很高 裁玻璃、制钻头、钻石
金刚石 深灰色、有金属光泽,不透明的细鳞状固体 很小,有滑腻感;导电;很高 用作润滑剂、电极、制铅笔芯
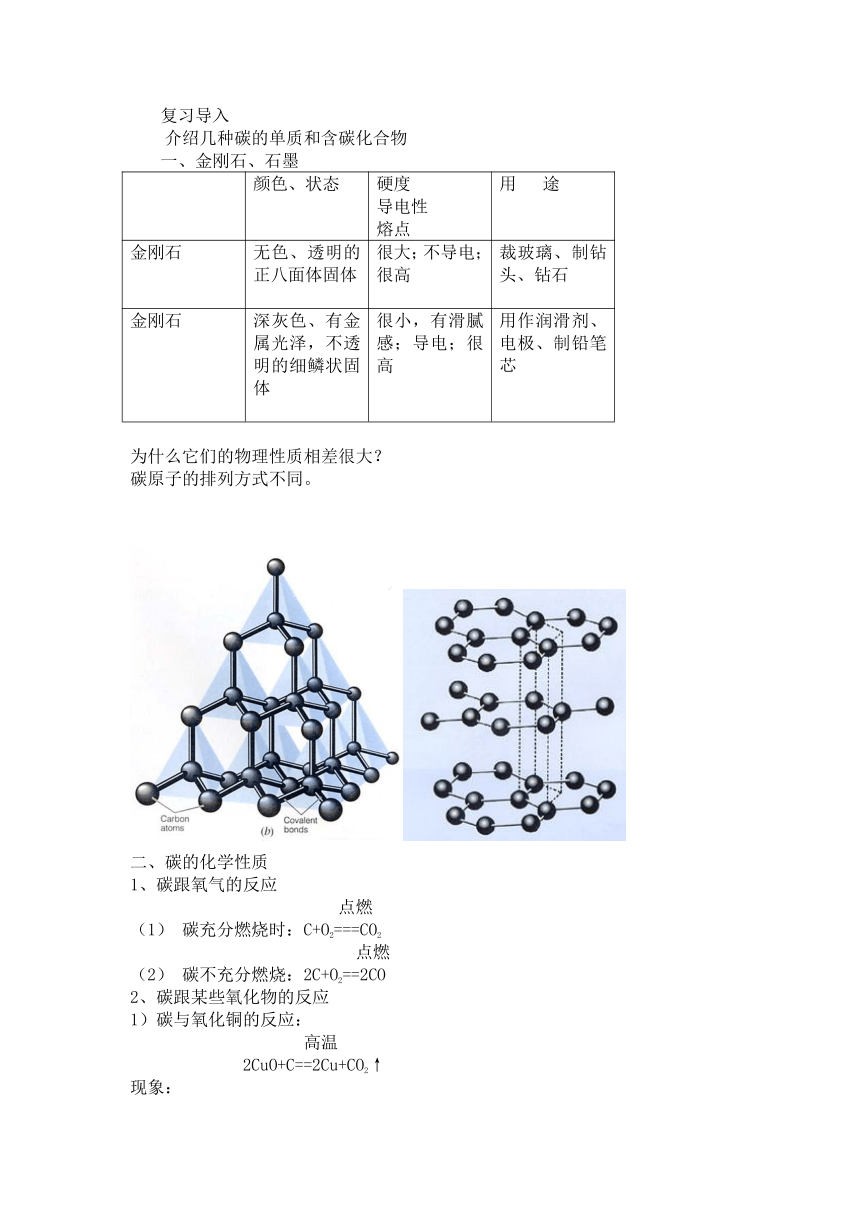
为什么它们的物理性质相差很大?
碳原子的排列方式不同。
二、碳的化学性质
1、碳跟氧气的反应
点燃
(1) 碳充分燃烧时:C+O2===CO2
点燃
(2) 碳不充分燃烧:2C+O2==2CO
2、碳跟某些氧化物的反应
1)碳与氧化铜的反应:
高温
2CuO+C==2Cu+CO2↑
现象:
黑色粉末变成红色,生成的气体使澄清石灰水变浑浊。
(2)碳跟氧化铁的反应:
高温
2Fe2O3+3C==4Fe+3CO2↑
当堂检测:
1.下列说法中,正确的是( )
A.一种元素只能形成一种单质
B.一种元素可能形成几种单质
C.同种元素组成的不同单质性质相同
D.由碳元素形成的单质都是黑色的
2.物质的结构决定着物质的 ;物质的性质决定物质的 。金刚石与石墨的物理性质有很大差异是由于
3.1996年诺贝尔化学奖授予发现C60由重大贡献的三位科学家,现在C70也已制得。以下对C60和C70这两种物质的叙述错误的是( )
A.它们是两种新型化合物 B.它们是由碳元素形成的两种单质 C.它们的性质完全相同 D.它们的相对分子质量之差为120
4.电冰箱里常用活性炭清除异味,这是因为活性炭具有( )
A.可燃性 B .还原性 C.吸附性 D.稳定性
CO2与CO的物理性质比较
二氧化碳 一氧化碳
颜色、气味、状态 无色、无味的气体 无色、无味的气体
密度(与空气比较) 密度大于空气 密度略小于空气
溶解性 能溶于水 难溶于水
CO2与CO的化学性质比较
二氧化碳 一氧化碳
跟水的反应 CO2+H2O==H2CO3 /
跟石灰水反应 CO2+Ca(OH)2==CaCO3↓+H2O /
跟氧气反应 / 点燃2CO+O2==== 2CO2
跟金属氧化物的反应 暂不研究 △CO+CuO===Cu+CO2
毒性 无毒 剧毒
当堂检测:
用化学方程式表示除去下列物质中少量杂质的过程(括号内为杂质)。
(1)CO(CO2) (2)CO2(CO)
(1)使混合气体通过足量NaOH溶液,可除去CO2。NaOH溶液与CO不反应。
CO2+2NaOH==Na2CO3+H2O
(2)将混合气体通过盛有足量灼热氧化铜的玻璃管,经充分反应后CO变成CO2而导出。CO2与氧化铜不反应。
△
CO+CuO===Cu+CO2
讨论:区别CO2和CO两种气体,你能采取多少种方法?
参考答案: (1)利用密度不同可以;
(2)二氧化碳能使澄清的石灰水变浑浊;
(3)二氧化碳能使紫色石蕊试液变红色;
(4)二氧化碳可以灭火,一氧化碳却可以燃烧;
(5)一氧化碳可使深红色的血液变成鲜红色。
3、CO2的制法:
(1)实验室制法:
CaCO3+2HCl==CaCl2+CO2↑+H2O
注意:不用H2SO4,因为H2SO4与大理石反应生成微溶于水的CaSO4覆盖在大理石的表面,阻止了反应的继续进行; 不用纯CaCO3或Na2CO3,是因为反应速率太快,不便于控制;不用浓盐酸,浓盐酸易挥发出HCl使CO2不纯。
(2)工业制法:CaCO3==CaO+CO2↑
实验室制取气体的一般思路和方法是什么?
(1)实验室制取原理——在什么条件下,用什么药品,通过什么反应来制取这种气体;
(2)根据反应物的状态和反应条件确定反应装置——发生装置和收集装置;
(3)验证制得的气体就是所要制得的气体。
练习:写出有二氧化碳生成的化合反应、分解反应、置换反应和复分解反应各一个。
参考答案(答案不止一个):
点燃
C+O2===CO2
H2CO3==CO2↑+H2O
C+2CuO==Cu+CO2↑
CaCO3+2HCl=CaCl2+CO2↑+H2O
4.用途:物质的性质决定物质的用途,物质的用途就是物质性质的科学利用。
物质的性质 用途
CO2不支持燃烧,密度比空气大“干冰”升华后,不使食物潮湿“干冰”使空气中的水蒸气凝结水加压能使CO2在水中溶解度增大光合作用使CO2转变为碳水化合物CO可燃CO具有还原性 灭火剂保存易腐食物人工降雨制汽水温室肥料气体燃料冶金工业作还原剂
小结及布置练习
教学反思:
本单元内容较复杂,是上册的一个重点和难点。为了更好地实施新课标,突出育人为本的理念,在本节课的教学中我根据学科、教材的特点以及学生的实际,采用灵活多样的教学方法,充分利用网络资源,为学生创设生动直观的学习情境。让学生充分动手,动口,动脑,激发他们的学习兴趣培养他们观察、分析、归纳的能力,使课堂充满生机和活力。课后对这一节课进行深入的思考,由于课前准备比较充分,整个教学过程比较顺利,收到了预期的效果。这一堂课也存在一些不足之处:整节课复习的每一个知识点时间过紧。有些问题提得不够深入。这些问题有待在以后教学中改进,努力摸索复习课的基本教学模式,将互联网与化学课堂教学结合起来,把复习课的教学质量提高一个层次。
教材分析:
“碳和碳的氧化物”是初中阶段一个全面研究元素及化合物知识的单元,涉及知识内容较广, 本单元知识往往被学生看成是零碎、易懂、难记的内容,而且这部分内容比较多,化学反应方程式繁多,物质之间的联系较为复杂。根据这部分知识内容的特点, 本课力求让学生对知识间的相互联系形成整体的感知,帮助学生建立起有序的知识结构,了解C→CO→CO2→H2CO3→CaCO3之间的转换关系。其中运用的化学知识链的学习模式,其中,对今后的“酸、碱、盐”学习,有着方法指导意义。
教学策略:
(一)、对复习内容进行合理的重组,通过知识的整理突出知识的内在联系,形成知识结构;
(二)、进行必要的例题讲评和训练;
(三)、在重点内容上设置情境,调动兴趣,发展能力。
教学方法:
思考、讨论、讲解、归纳、练习
教学目标:
(一)、知识与技能
1、通过互联网搜索,进一步认识C 、CO 、CO2 、H2CO3 、CaCO3等物质的性质和相互之间的联系。
2、 能正确书写有关的化学方程式。
3、 能正确描述本单元有关实验的现象,并通过网络搜索使语言表述更规范。
4、 能运用所学的知识解决实际问题。
5、 培养学生的归纳总结能力和发散思维能力。
(二)、过程与方法:
1、通过理顺碳和碳的化合物之间的联系的活动,使学生学会把所学的知识系统化、网络化。
2、通过对CO2和CO两种气体的鉴别,使学生掌握物质鉴别的方法
3、通过“除去CO2中混有的少量CO,除去CO中混有的少量CO2” 使学生掌握除杂的方法
(三)、情感态度与价值观
1、通过学生的自主探究,保持持续的化学学习兴趣,严谨求实的科学态度和实践探究能力。
2、进一步认识物质的本质和联系。
3、通过分析日常生活中一些熟悉的现象,使学生感受到人们的生活离不开化学,增强对化学与生活、技术、社会之间关系的理解 。
教学重点:
C、CO 、CO2化学性质的复习
教学难点:
1、使本单元的知识形成知识网络
2、本单元化学方程式的书写
3、利用本单元知识解决实际问题。
教学过程:
复习导入
介绍几种碳的单质和含碳化合物
一、金刚石、石墨
颜色、状态 硬度导电性熔点 用 途
金刚石 无色、透明的正八面体固体 很大;不导电;很高 裁玻璃、制钻头、钻石
金刚石 深灰色、有金属光泽,不透明的细鳞状固体 很小,有滑腻感;导电;很高 用作润滑剂、电极、制铅笔芯
为什么它们的物理性质相差很大?
碳原子的排列方式不同。
二、碳的化学性质
1、碳跟氧气的反应
点燃
(1) 碳充分燃烧时:C+O2===CO2
点燃
(2) 碳不充分燃烧:2C+O2==2CO
2、碳跟某些氧化物的反应
1)碳与氧化铜的反应:
高温
2CuO+C==2Cu+CO2↑
现象:
黑色粉末变成红色,生成的气体使澄清石灰水变浑浊。
(2)碳跟氧化铁的反应:
高温
2Fe2O3+3C==4Fe+3CO2↑
当堂检测:
1.下列说法中,正确的是( )
A.一种元素只能形成一种单质
B.一种元素可能形成几种单质
C.同种元素组成的不同单质性质相同
D.由碳元素形成的单质都是黑色的
2.物质的结构决定着物质的 ;物质的性质决定物质的 。金刚石与石墨的物理性质有很大差异是由于
3.1996年诺贝尔化学奖授予发现C60由重大贡献的三位科学家,现在C70也已制得。以下对C60和C70这两种物质的叙述错误的是( )
A.它们是两种新型化合物 B.它们是由碳元素形成的两种单质 C.它们的性质完全相同 D.它们的相对分子质量之差为120
4.电冰箱里常用活性炭清除异味,这是因为活性炭具有( )
A.可燃性 B .还原性 C.吸附性 D.稳定性
CO2与CO的物理性质比较
二氧化碳 一氧化碳
颜色、气味、状态 无色、无味的气体 无色、无味的气体
密度(与空气比较) 密度大于空气 密度略小于空气
溶解性 能溶于水 难溶于水
CO2与CO的化学性质比较
二氧化碳 一氧化碳
跟水的反应 CO2+H2O==H2CO3 /
跟石灰水反应 CO2+Ca(OH)2==CaCO3↓+H2O /
跟氧气反应 / 点燃2CO+O2==== 2CO2
跟金属氧化物的反应 暂不研究 △CO+CuO===Cu+CO2
毒性 无毒 剧毒
当堂检测:
用化学方程式表示除去下列物质中少量杂质的过程(括号内为杂质)。
(1)CO(CO2) (2)CO2(CO)
(1)使混合气体通过足量NaOH溶液,可除去CO2。NaOH溶液与CO不反应。
CO2+2NaOH==Na2CO3+H2O
(2)将混合气体通过盛有足量灼热氧化铜的玻璃管,经充分反应后CO变成CO2而导出。CO2与氧化铜不反应。
△
CO+CuO===Cu+CO2
讨论:区别CO2和CO两种气体,你能采取多少种方法?
参考答案: (1)利用密度不同可以;
(2)二氧化碳能使澄清的石灰水变浑浊;
(3)二氧化碳能使紫色石蕊试液变红色;
(4)二氧化碳可以灭火,一氧化碳却可以燃烧;
(5)一氧化碳可使深红色的血液变成鲜红色。
3、CO2的制法:
(1)实验室制法:
CaCO3+2HCl==CaCl2+CO2↑+H2O
注意:不用H2SO4,因为H2SO4与大理石反应生成微溶于水的CaSO4覆盖在大理石的表面,阻止了反应的继续进行; 不用纯CaCO3或Na2CO3,是因为反应速率太快,不便于控制;不用浓盐酸,浓盐酸易挥发出HCl使CO2不纯。
(2)工业制法:CaCO3==CaO+CO2↑
实验室制取气体的一般思路和方法是什么?
(1)实验室制取原理——在什么条件下,用什么药品,通过什么反应来制取这种气体;
(2)根据反应物的状态和反应条件确定反应装置——发生装置和收集装置;
(3)验证制得的气体就是所要制得的气体。
练习:写出有二氧化碳生成的化合反应、分解反应、置换反应和复分解反应各一个。
参考答案(答案不止一个):
点燃
C+O2===CO2
H2CO3==CO2↑+H2O
C+2CuO==Cu+CO2↑
CaCO3+2HCl=CaCl2+CO2↑+H2O
4.用途:物质的性质决定物质的用途,物质的用途就是物质性质的科学利用。
物质的性质 用途
CO2不支持燃烧,密度比空气大“干冰”升华后,不使食物潮湿“干冰”使空气中的水蒸气凝结水加压能使CO2在水中溶解度增大光合作用使CO2转变为碳水化合物CO可燃CO具有还原性 灭火剂保存易腐食物人工降雨制汽水温室肥料气体燃料冶金工业作还原剂
小结及布置练习
教学反思:
本单元内容较复杂,是上册的一个重点和难点。为了更好地实施新课标,突出育人为本的理念,在本节课的教学中我根据学科、教材的特点以及学生的实际,采用灵活多样的教学方法,充分利用网络资源,为学生创设生动直观的学习情境。让学生充分动手,动口,动脑,激发他们的学习兴趣培养他们观察、分析、归纳的能力,使课堂充满生机和活力。课后对这一节课进行深入的思考,由于课前准备比较充分,整个教学过程比较顺利,收到了预期的效果。这一堂课也存在一些不足之处:整节课复习的每一个知识点时间过紧。有些问题提得不够深入。这些问题有待在以后教学中改进,努力摸索复习课的基本教学模式,将互联网与化学课堂教学结合起来,把复习课的教学质量提高一个层次。
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
