第9章溶液检测题-2021-2022学年九年级化学京改版(2013)下册(word版 含答案)
文档属性
| 名称 | 第9章溶液检测题-2021-2022学年九年级化学京改版(2013)下册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 128.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-21 00:00:00 | ||
图片预览



文档简介
第9章《溶液》检测题
一、单选题
1.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
2.向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是
A.氢氧化钠 B.生石灰 C.浓硫酸 D.硝酸铵
3.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是
20 ℃ 40 ℃
水 109 g 129 g
酒精 17.3 g 40 g
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和
D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多
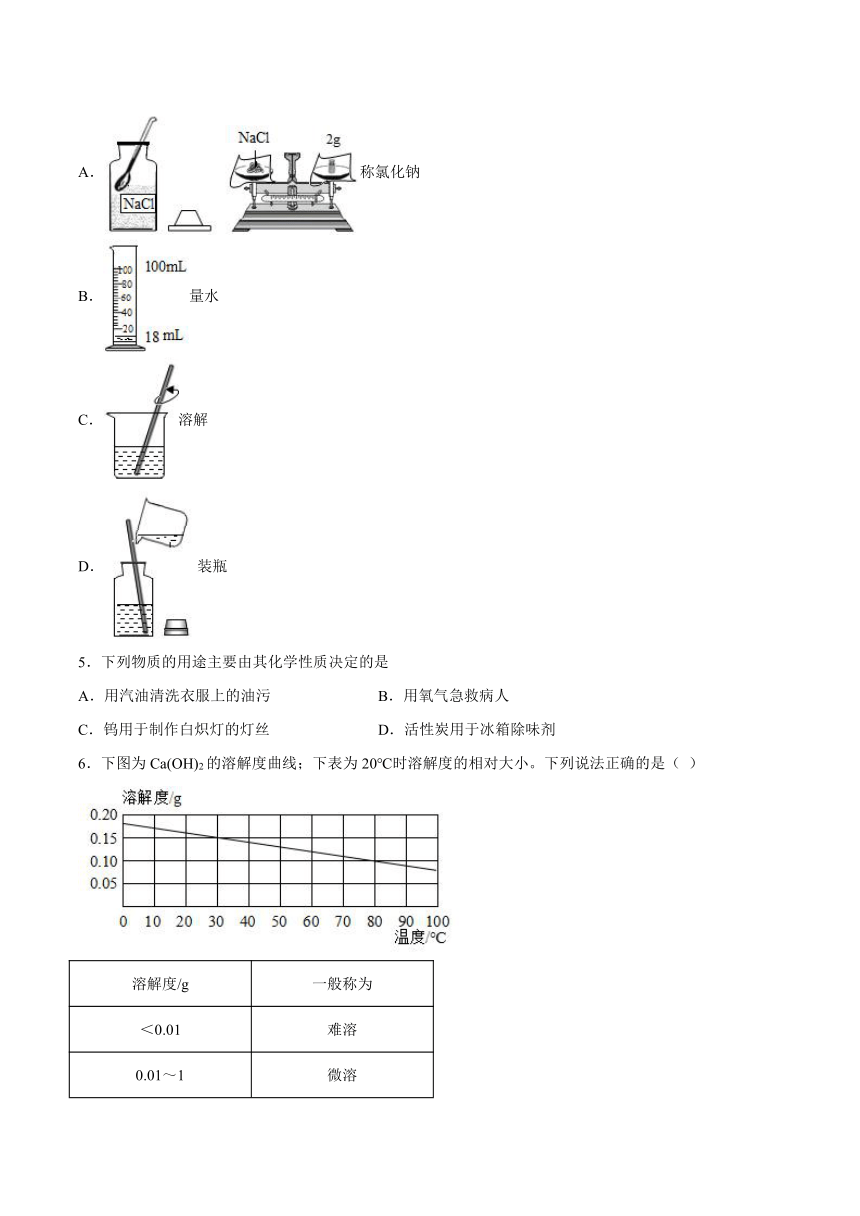
4.规范的实验操作是实验成功的关键。下列配制20g 10%的氯化钠溶液的操作中不规范的是
A.称氯化钠
B.量水
C.溶解
D.装瓶
5.下列物质的用途主要由其化学性质决定的是
A.用汽油清洗衣服上的油污 B.用氧气急救病人
C.钨用于制作白炽灯的灯丝 D.活性炭用于冰箱除味剂
6.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
7.氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。
其中措施正确的是
A.①②④ B.①③④ C.①③⑤ D.①②⑤
8.20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
9.把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
10.厨房中的下列调味品与水混合不能得到溶液的是
A.食醋 B.食盐 C.蔗糖 D.香油
11.在t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。下列说法错误的是
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯①中溶液质量比烧杯②中溶液质量大
D.将温度升高到t2℃,烧杯②中的固体全部溶解
12.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
二、简答题
13.在许多情况下,人们希望能够较快地溶解某些固体物质。请以冰糖晶体溶于水为例,根据你的生活经验,说明哪些方法可以加快冰糖晶体在水中的溶解,并说明理由。
14.病人在医院接受静脉注射或滴注时,常用到生理盐水即氯化钠注射液.下图是某药业公司生产的氯化钠注射液包装标签上的部分文字.请回答:
(1)该注射液里的溶质是 ;
(2)常温下,一瓶合格的氯化钠注射液密封放置一段时间后,是否会出现浑浊现象?为什么?
三、推断题
15.下图中,甲是相对分子质量为16的有机物;乙是最常见的溶剂;丁是白色难溶固体,其中金属元素的质量分数为40%。甲的化学式为____;③的化学方程式为____;丙的一种用途是____。
16.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)A在D中完全燃烧和不完全燃烧时,生成不同的气体。B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是_____(用化学式表示)
(2)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。则E的化学式可能为_____,产生此现象的原因是_____________。
四、实验题
17.泡菜制作在我国历史悠久。制作泡菜是把新鲜蔬菜泡在11%左右的食盐水里,经密封发酵而成。现要配制100克11%的氯化钠溶液。
(1)实验用品如图1,其中还缺少的仪器是_____。
(2)配制过程的实验步骤如下图2,用图中序号表示配制该溶液的正确操作顺序为_____(填序号)。
(3)上述实验中,操作③中玻璃棒的作用是_____。
(4)某同学用如图⑤的方法称取所需食盐,若要保证所配食盐水中溶质质量分数不变,该同学应量取水的体积约为_____mL。
(5)下列操作可能导致氯化钠溶液的溶质质量分数偏小的是_____(填序号)。
①食盐潮湿不干燥
②量取水时仰视读数
③装瓶时,有部分溶液洒出
④量筒量取水前先用蒸馏水润洗
(6)若改用溶质质量分数为22%的氯化钠溶液来配制此溶液,需要加入水的质量为_____。
18.某实验小组用6%的氯化钠溶液(密度约为1.04g/cm3)配制50g质量分数为3%的氯化钠溶液,步骤如下:①计算;②量取;③混匀;④装瓶贴标签。冋答下列问题:
(1)计算需要6%的氯化钠溶液的体积是___________mL(结果取整数);
(2)实验中用到的仪器有25mL的量筒、细口瓶、烧杯、____________;
(3)下列实验操作会导致所配溶液中溶质的质量分数一定偏大的是________________。
A 量取6%的氯化钠溶液时仰视读数
B 向烧杯内加入液体时有液体溅出
C 混匀过程中没有使用玻璃棒搅拌
D 配制好的溶液装入未干燥的细口瓶
五、计算题
19.某品牌补钙剂的主要成分是碳酸钙,实验小组的同学取该补钙剂2.5g,加入溶质质量分数为7.3%的稀盐酸至不再有气泡产生,共收集到二氧化碳0.88g(补钙剂中其他成分均不与稀盐酸反应)。请计算。
(1)该补钙剂中碳酸钙的质量分数。
(2)所用稀盐酸的质量。
20.科学施肥是实现农业增产的主要手段。硝酸铵((NH4NO3)是一种常用的氮肥,其中氮元素、氢元素、氧元素的质量比为_____________。若要配制200g溶质质量分数为5%的硝酸铵溶液,需要硝酸铵的质量为_________g,需要水的质量为_______g.
参考答案:
1.A 2.D 3.D 4.B 5.B 6.D 7.D 8.C 9.C 10.D 11.B 12.C
13.溶解时加热,可以加快溶解速率,因为温度越高,微粒的运动速率越快,溶解越快;
溶解时搅拌,可以加快溶解速率,因为搅拌可加快微粒的运动速率,能加快冰糖与水的接触机会,从而加快了冰糖的溶解速率;
溶解前,将冰糖晶体研碎,可以增大冰糖与水的接触面积,加快溶解速率。
14.(1)NaCl##氯化钠;
(2)不会;因为溶液具有均一性、稳定性。
15. CH4 气体肥料、灭火等
16. H2O2 NaOH或CaO E溶于水放热
17.(1)胶头滴管
(2)②⑤①④③或②⑤⑥①④③
(3)搅拌,加速溶解速率
(4)89
(5)①②④
(6)50g
18. 24 胶头滴管、玻璃棒 A
19.设补钙剂中碳酸钙的质量为x,稀盐酸中溶质的质量为y
解x=2g
y=1.46g
(1)碳酸钙的质量分数=
(2) 稀盐酸的质量=1.46g÷7.3%=20g
答:该补钙剂中碳酸钙的质量分数为80%,稀盐酸的质量为20g。
20.7﹕1﹕12;10;190
一、单选题
1.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
2.向如图装置的试管中加入某种物质后,U形管右边支管的红墨水液面降低,左边支管的红墨水液面上升,则加入的物质是
A.氢氧化钠 B.生石灰 C.浓硫酸 D.硝酸铵
3.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见下表)。通过分析她得出以下结论,其中不正确的是
20 ℃ 40 ℃
水 109 g 129 g
酒精 17.3 g 40 g
A.温度和溶剂种类对NaOH的溶解度都有影响
B.NaOH易溶于水,也易溶于酒精
C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和
D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多
4.规范的实验操作是实验成功的关键。下列配制20g 10%的氯化钠溶液的操作中不规范的是
A.称氯化钠
B.量水
C.溶解
D.装瓶
5.下列物质的用途主要由其化学性质决定的是
A.用汽油清洗衣服上的油污 B.用氧气急救病人
C.钨用于制作白炽灯的灯丝 D.活性炭用于冰箱除味剂
6.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
7.氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。
其中措施正确的是
A.①②④ B.①③④ C.①③⑤ D.①②⑤
8.20℃时,NaCl的溶解度为36g。配制此温度下20g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
9.把少量生活中的物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.面粉 B.牛奶 C.蔗糖 D.植物油
10.厨房中的下列调味品与水混合不能得到溶液的是
A.食醋 B.食盐 C.蔗糖 D.香油
11.在t1℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图甲所示,硝酸钾和氯化钾的溶解度曲线如图乙所示。下列说法错误的是
A.烧杯②中的上层溶液是饱和溶液
B.烧杯①中溶液的溶质是硝酸钾
C.烧杯①中溶液质量比烧杯②中溶液质量大
D.将温度升高到t2℃,烧杯②中的固体全部溶解
12.能使气体物质溶解度增大的操作是
A.增加溶剂 B.振荡溶液 C.增大压强 D.升高温度
二、简答题
13.在许多情况下,人们希望能够较快地溶解某些固体物质。请以冰糖晶体溶于水为例,根据你的生活经验,说明哪些方法可以加快冰糖晶体在水中的溶解,并说明理由。
14.病人在医院接受静脉注射或滴注时,常用到生理盐水即氯化钠注射液.下图是某药业公司生产的氯化钠注射液包装标签上的部分文字.请回答:
(1)该注射液里的溶质是 ;
(2)常温下,一瓶合格的氯化钠注射液密封放置一段时间后,是否会出现浑浊现象?为什么?
三、推断题
15.下图中,甲是相对分子质量为16的有机物;乙是最常见的溶剂;丁是白色难溶固体,其中金属元素的质量分数为40%。甲的化学式为____;③的化学方程式为____;丙的一种用途是____。
16.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)A在D中完全燃烧和不完全燃烧时,生成不同的气体。B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是_____(用化学式表示)
(2)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。则E的化学式可能为_____,产生此现象的原因是_____________。
四、实验题
17.泡菜制作在我国历史悠久。制作泡菜是把新鲜蔬菜泡在11%左右的食盐水里,经密封发酵而成。现要配制100克11%的氯化钠溶液。
(1)实验用品如图1,其中还缺少的仪器是_____。
(2)配制过程的实验步骤如下图2,用图中序号表示配制该溶液的正确操作顺序为_____(填序号)。
(3)上述实验中,操作③中玻璃棒的作用是_____。
(4)某同学用如图⑤的方法称取所需食盐,若要保证所配食盐水中溶质质量分数不变,该同学应量取水的体积约为_____mL。
(5)下列操作可能导致氯化钠溶液的溶质质量分数偏小的是_____(填序号)。
①食盐潮湿不干燥
②量取水时仰视读数
③装瓶时,有部分溶液洒出
④量筒量取水前先用蒸馏水润洗
(6)若改用溶质质量分数为22%的氯化钠溶液来配制此溶液,需要加入水的质量为_____。
18.某实验小组用6%的氯化钠溶液(密度约为1.04g/cm3)配制50g质量分数为3%的氯化钠溶液,步骤如下:①计算;②量取;③混匀;④装瓶贴标签。冋答下列问题:
(1)计算需要6%的氯化钠溶液的体积是___________mL(结果取整数);
(2)实验中用到的仪器有25mL的量筒、细口瓶、烧杯、____________;
(3)下列实验操作会导致所配溶液中溶质的质量分数一定偏大的是________________。
A 量取6%的氯化钠溶液时仰视读数
B 向烧杯内加入液体时有液体溅出
C 混匀过程中没有使用玻璃棒搅拌
D 配制好的溶液装入未干燥的细口瓶
五、计算题
19.某品牌补钙剂的主要成分是碳酸钙,实验小组的同学取该补钙剂2.5g,加入溶质质量分数为7.3%的稀盐酸至不再有气泡产生,共收集到二氧化碳0.88g(补钙剂中其他成分均不与稀盐酸反应)。请计算。
(1)该补钙剂中碳酸钙的质量分数。
(2)所用稀盐酸的质量。
20.科学施肥是实现农业增产的主要手段。硝酸铵((NH4NO3)是一种常用的氮肥,其中氮元素、氢元素、氧元素的质量比为_____________。若要配制200g溶质质量分数为5%的硝酸铵溶液,需要硝酸铵的质量为_________g,需要水的质量为_______g.
参考答案:
1.A 2.D 3.D 4.B 5.B 6.D 7.D 8.C 9.C 10.D 11.B 12.C
13.溶解时加热,可以加快溶解速率,因为温度越高,微粒的运动速率越快,溶解越快;
溶解时搅拌,可以加快溶解速率,因为搅拌可加快微粒的运动速率,能加快冰糖与水的接触机会,从而加快了冰糖的溶解速率;
溶解前,将冰糖晶体研碎,可以增大冰糖与水的接触面积,加快溶解速率。
14.(1)NaCl##氯化钠;
(2)不会;因为溶液具有均一性、稳定性。
15. CH4 气体肥料、灭火等
16. H2O2 NaOH或CaO E溶于水放热
17.(1)胶头滴管
(2)②⑤①④③或②⑤⑥①④③
(3)搅拌,加速溶解速率
(4)89
(5)①②④
(6)50g
18. 24 胶头滴管、玻璃棒 A
19.设补钙剂中碳酸钙的质量为x,稀盐酸中溶质的质量为y
解x=2g
y=1.46g
(1)碳酸钙的质量分数=
(2) 稀盐酸的质量=1.46g÷7.3%=20g
答:该补钙剂中碳酸钙的质量分数为80%,稀盐酸的质量为20g。
20.7﹕1﹕12;10;190
