第七单元常见的酸和碱测试题-2021-2022学年九年级化学鲁教版下册(word版有答案)
文档属性
| 名称 | 第七单元常见的酸和碱测试题-2021-2022学年九年级化学鲁教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 93.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-21 18:43:51 | ||
图片预览


文档简介
第七单元《常见的酸和碱》测试题
一、单选题
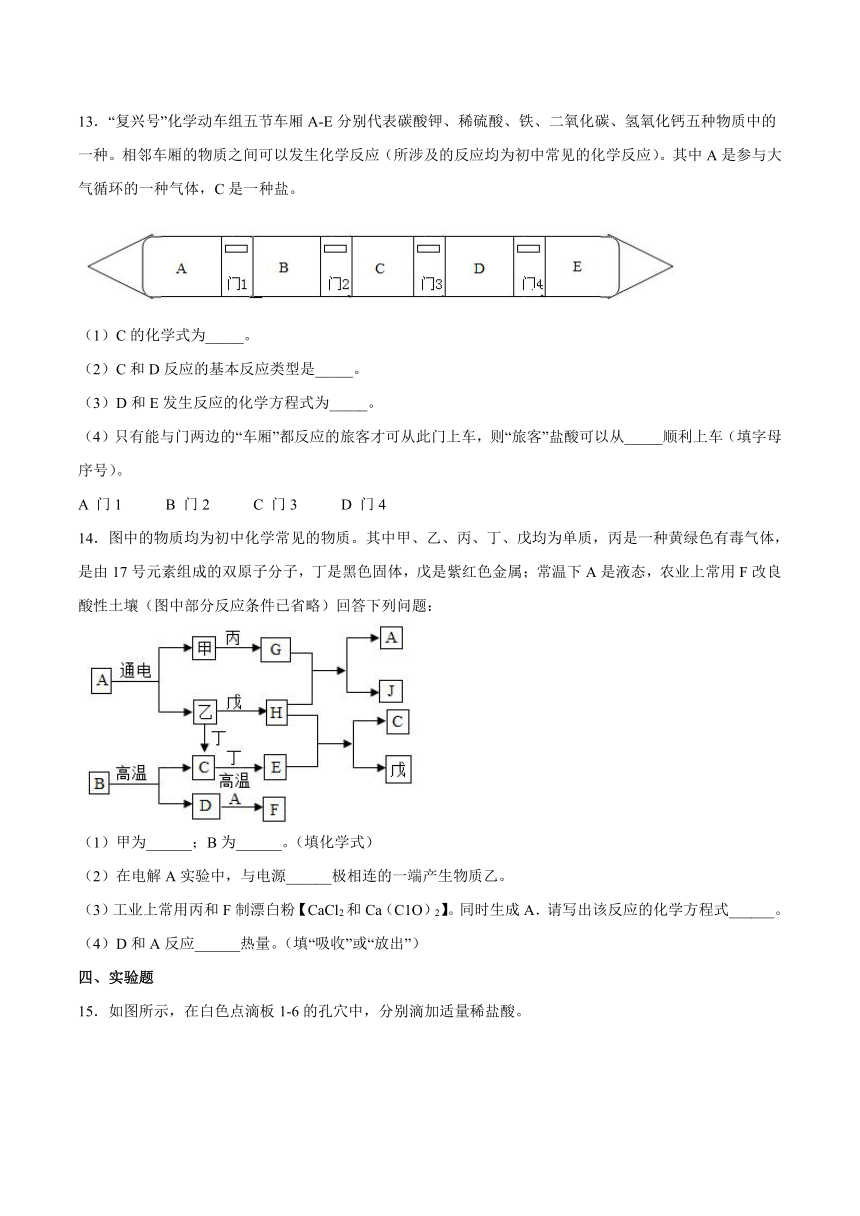
1.下列四组溶液,只用紫色石蕊溶液就能鉴别的一组是
A.NaOH KOH HCl B.NaCl NaOH HCl
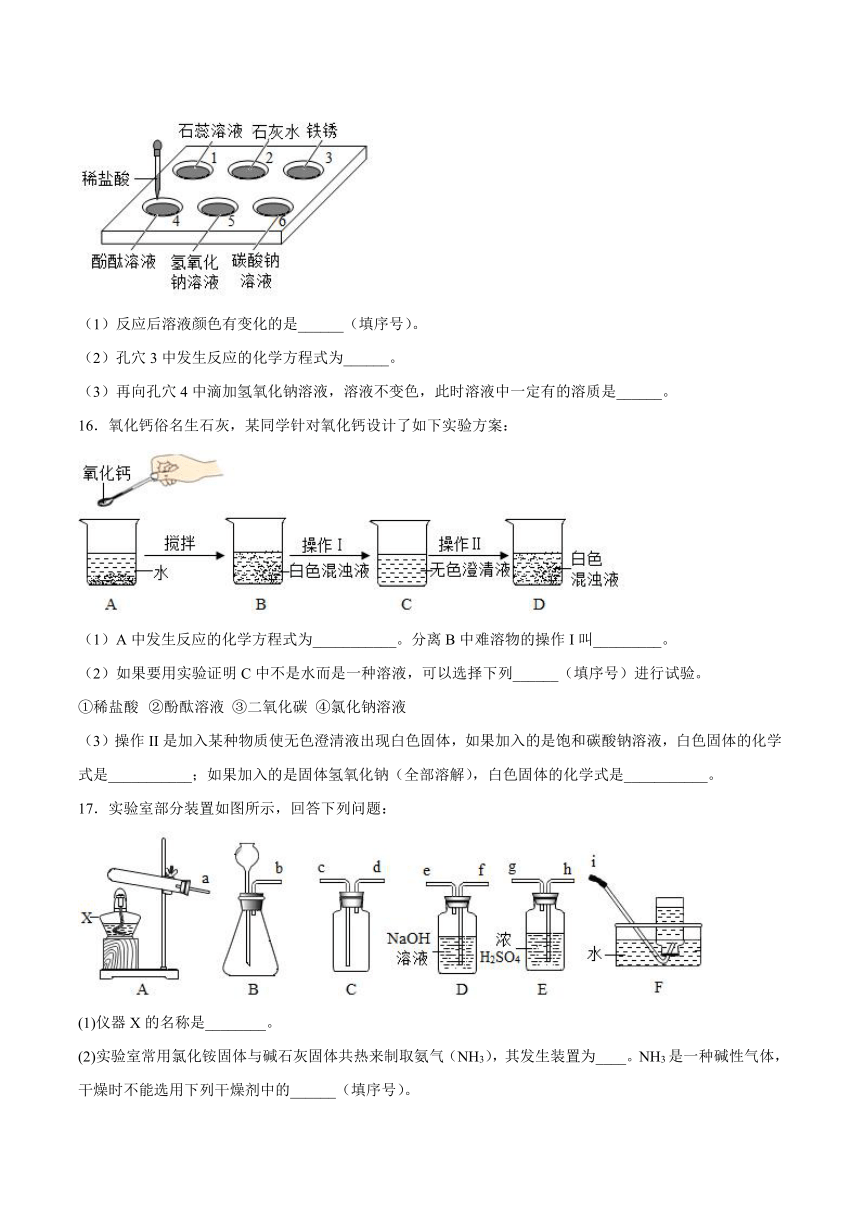
C.H2SO4 HCl NaOH D.NaCl Na2CO3 Na2SO4
2.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
3.如图,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是
①试管内液面上升 ②试管内溶液变红 ③试管内液面不上升 ④试管内溶液变蓝⑤试管内溶液不变色
A.①② B.①④ C.②③ D.③⑤
4.下列“液体“中可能为纯净物的是
A.胃液B.波尔多液C.滤液D.“84”消毒液
5.许多化学反应都是在溶液中进行的,关于溶液理解正确的是( )
A.通过加热蒸发的方法提高75%酒精的浓度
B.将氧化钙溶于水,可以形成氧化钙溶液
C.5gCuSO4·5H2O溶于95g水中配制CuSO4溶液,此溶液溶质的质量分数小于5%
D.将50℃下的饱和KNO3溶液冷却至室温,硝酸钾固体析出,过滤后可得纯水和硝酸钾固体
6.下列关于Ca(OH)2的说法错误的是
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
7.如图所示:甲瓶中盛放的是浓H2SO4,乙瓶中放的是用石蕊溶液染成紫色的干燥小花。若关闭阀门Ⅰ,打开阀门Ⅱ,紫色小花不变色;若关闭阀门Ⅱ,打开阀门Ⅰ,紫色小花
A.变红色 B.变蓝色 C.变白色 D.不变色
8.能用于鉴别氢氧化钠溶液和氢氧化钙溶液的物质是
A.HCl B.KNO3 C.Na2CO3 D.FeCl3
9.氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者的溶液中均含有一种相同的粒子是
A.H+ B.OH- C.H2O D.H
10.下列物质能使紫色石蕊试液变红的是( )
A.胃液 B.氨水 C.蔗糖水 D.pH约为7.8的鸡蛋清
二、简答题
11.如图是浓盐酸试剂上标示的部分内容。请回答:
(1)该浓盐酸的溶质是_________ (填化学式)。
(2)现要配制3%的稀盐酸120 g,需要这种浓盐酸_________。
(3)使用一段时间后,浓盐酸的溶质的质量分数小于36%,原因是_________。
12.在抗击“新冠肺炎”的防护工作中,过氧乙酸(CH3COOOH)是一种常用的消毒剂。过氧乙酸是有刺激性气味的液体,易挥发,具有酸的通性,浓度大于45%就有爆炸性,遇高热等其他条件会引起爆炸。
(1)稀释过氧乙酸溶液时能否用铁制品盛装,原因是什么 __________
(2)过氧乙酸储存时的注意事项是什么 (写出一条)__________
三、推断题
13.“复兴号”化学动车组五节车厢A-E分别代表碳酸钾、稀硫酸、铁、二氧化碳、氢氧化钙五种物质中的一种。相邻车厢的物质之间可以发生化学反应(所涉及的反应均为初中常见的化学反应)。其中A是参与大气循环的一种气体,C是一种盐。
(1)C的化学式为_____。
(2)C和D反应的基本反应类型是_____。
(3)D和E发生反应的化学方程式为_____。
(4)只有能与门两边的“车厢”都反应的旅客才可从此门上车,则“旅客”盐酸可以从_____顺利上车(填字母序号)。
A 门1 B 门2 C 门3 D 门4
14.图中的物质均为初中化学常见的物质。其中甲、乙、丙、丁、戊均为单质,丙是一种黄绿色有毒气体,是由17号元素组成的双原子分子,丁是黑色固体,戊是紫红色金属;常温下A是液态,农业上常用F改良酸性土壤(图中部分反应条件已省略)回答下列问题:
(1)甲为______;B为______。(填化学式)
(2)在电解A实验中,与电源______极相连的一端产生物质乙。
(3)工业上常用丙和F制漂白粉【CaCl2和Ca(C1O)2】。同时生成A.请写出该反应的化学方程式______。
(4)D和A反应______热量。(填“吸收”或“放出”)
四、实验题
15.如图所示,在白色点滴板1-6的孔穴中,分别滴加适量稀盐酸。
(1)反应后溶液颜色有变化的是______(填序号)。
(2)孔穴3中发生反应的化学方程式为______。
(3)再向孔穴4中滴加氢氧化钠溶液,溶液不变色,此时溶液中一定有的溶质是______。
16.氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:
(1)A中发生反应的化学方程式为___________。分离B中难溶物的操作I叫_________。
(2)如果要用实验证明C中不是水而是一种溶液,可以选择下列______(填序号)进行试验。
①稀盐酸 ②酚酞溶液 ③二氧化碳 ④氯化钠溶液
(3)操作II是加入某种物质使无色澄清液出现白色固体,如果加入的是饱和碳酸钠溶液,白色固体的化学式是___________;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是___________。
17.实验室部分装置如图所示,回答下列问题:
(1)仪器X的名称是________。
(2)实验室常用氯化铵固体与碱石灰固体共热来制取氨气(NH3),其发生装置为____。NH3是一种碱性气体,干燥时不能选用下列干燥剂中的______(填序号)。
A.氢氧化钠固体 B.浓硫酸 C.生石灰
(3)实验室用装置B制O2的化学方程式为_______。
(4)某同学欲用活泼金属单质和稀盐酸反应制取纯净干燥的H2,请从这些装置中选择并连接成一套组合装置,按照气流从左到右的流向,写出所选装置接口的连接顺序:______→______→______→______→______→______→______
五、计算题
18.如图是向200g稀盐酸中不断加入5%氢氧化钠溶液时所得溶液pH的变化情况,请回答下列问题:
(1)当稀盐酸恰好完全反应时,消耗氢氧化钠的质量为___________g。
(2)计算该稀盐酸中溶质的质量分数。
19.在实验室中,小明发现了一瓶氢氧化钙粉末试剂瓶盖有破损,取部分粉末作为样品对其变质情况进行分析,实验室温度20℃查阅氢氧化钙的溶解度并进行如下实验。
氢氧化钙溶解度表
温度℃ 0 10 20 30 40 50 60 70
溶解度g 0.185 0.176 0.165 0.153 0.141 0.138 0.116 0.106
(1)取1g样品溶于100g水中,出现浑浊现象。小明认为该固体己经变质。你觉得这种说法是否正确?______(填“正确”或“不正确”)。理由是:______。
(2)小明另取2g样品于大烧杯中,加足量水充分溶解配制成1850g溶液,并通入CO2.溶液的质量与反应的CO2质量关系如图所示。请计算:该样品中氢氧化钙的质量分数。
(3)配制的氢氧化钙溶液浓度为______。
20.某工厂化验室欲测定排放的废水中硫酸的含量(假设废水中只有硫酸与氢氧化钠发生反应)。现取一定量的废水样品,逐滴加入溶质质量分数为10%的氢氧化钠溶液,振荡,当加入氢氧化钠溶液40g时溶液呈中性。求这一定量废水中含H2SO4的质量是多少?(反应的化学方程式:H2SO4+2NaOH=Na2SO4+2H2O )________
参考答案:
1.B 2.C 3.A 4.C 5.C 6.B 7.A 8.C 9.B 10.A
11. HCl 10g 浓盐酸具有挥发性
12. 不能,过氧乙酸具有酸的通性,能与活泼金属铁反应生成盐和氢气,从而腐蚀铁制品 密封低温储存
13. K2CO3 复分解反应 B
14. H2 CaCO3 正 放出
15. 1、3 NaCl
16. CaO + H2O =Ca(OH)2 过滤 ②③ CaCO3 Ca(OH)2
17.(1)酒精灯
(2) A B
(3)
(4) b f e h g d c
18.(1)8
(2)解:设所用稀盐酸中溶质的质量为x
该稀盐酸中溶质的质量分数为。
答:该稀盐酸中溶质的质量分数为3.65%。
19.(1)不正确;因为氢氧化钙的溶解度很小,导致不能完全溶液而浑浊;(2)92.5%;(3)0.1%
20.4.9g
一、单选题
1.下列四组溶液,只用紫色石蕊溶液就能鉴别的一组是
A.NaOH KOH HCl B.NaCl NaOH HCl
C.H2SO4 HCl NaOH D.NaCl Na2CO3 Na2SO4
2.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
3.如图,将充满CO2的试管倒扣在滴有紫色石蕊的蒸馏水中,一段时间后,下列实验现象描述正确的是
①试管内液面上升 ②试管内溶液变红 ③试管内液面不上升 ④试管内溶液变蓝⑤试管内溶液不变色
A.①② B.①④ C.②③ D.③⑤
4.下列“液体“中可能为纯净物的是
A.胃液B.波尔多液C.滤液D.“84”消毒液
5.许多化学反应都是在溶液中进行的,关于溶液理解正确的是( )
A.通过加热蒸发的方法提高75%酒精的浓度
B.将氧化钙溶于水,可以形成氧化钙溶液
C.5gCuSO4·5H2O溶于95g水中配制CuSO4溶液,此溶液溶质的质量分数小于5%
D.将50℃下的饱和KNO3溶液冷却至室温,硝酸钾固体析出,过滤后可得纯水和硝酸钾固体
6.下列关于Ca(OH)2的说法错误的是
A.微溶于水,水溶液呈碱性
B.能与酸反应,可用于治疗胃酸过多
C.与CuSO4溶液按一定比例混合,可配制波尔多液
D.澄清溶液可用来检验CO2
7.如图所示:甲瓶中盛放的是浓H2SO4,乙瓶中放的是用石蕊溶液染成紫色的干燥小花。若关闭阀门Ⅰ,打开阀门Ⅱ,紫色小花不变色;若关闭阀门Ⅱ,打开阀门Ⅰ,紫色小花
A.变红色 B.变蓝色 C.变白色 D.不变色
8.能用于鉴别氢氧化钠溶液和氢氧化钙溶液的物质是
A.HCl B.KNO3 C.Na2CO3 D.FeCl3
9.氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者的溶液中均含有一种相同的粒子是
A.H+ B.OH- C.H2O D.H
10.下列物质能使紫色石蕊试液变红的是( )
A.胃液 B.氨水 C.蔗糖水 D.pH约为7.8的鸡蛋清
二、简答题
11.如图是浓盐酸试剂上标示的部分内容。请回答:
(1)该浓盐酸的溶质是_________ (填化学式)。
(2)现要配制3%的稀盐酸120 g,需要这种浓盐酸_________。
(3)使用一段时间后,浓盐酸的溶质的质量分数小于36%,原因是_________。
12.在抗击“新冠肺炎”的防护工作中,过氧乙酸(CH3COOOH)是一种常用的消毒剂。过氧乙酸是有刺激性气味的液体,易挥发,具有酸的通性,浓度大于45%就有爆炸性,遇高热等其他条件会引起爆炸。
(1)稀释过氧乙酸溶液时能否用铁制品盛装,原因是什么 __________
(2)过氧乙酸储存时的注意事项是什么 (写出一条)__________
三、推断题
13.“复兴号”化学动车组五节车厢A-E分别代表碳酸钾、稀硫酸、铁、二氧化碳、氢氧化钙五种物质中的一种。相邻车厢的物质之间可以发生化学反应(所涉及的反应均为初中常见的化学反应)。其中A是参与大气循环的一种气体,C是一种盐。
(1)C的化学式为_____。
(2)C和D反应的基本反应类型是_____。
(3)D和E发生反应的化学方程式为_____。
(4)只有能与门两边的“车厢”都反应的旅客才可从此门上车,则“旅客”盐酸可以从_____顺利上车(填字母序号)。
A 门1 B 门2 C 门3 D 门4
14.图中的物质均为初中化学常见的物质。其中甲、乙、丙、丁、戊均为单质,丙是一种黄绿色有毒气体,是由17号元素组成的双原子分子,丁是黑色固体,戊是紫红色金属;常温下A是液态,农业上常用F改良酸性土壤(图中部分反应条件已省略)回答下列问题:
(1)甲为______;B为______。(填化学式)
(2)在电解A实验中,与电源______极相连的一端产生物质乙。
(3)工业上常用丙和F制漂白粉【CaCl2和Ca(C1O)2】。同时生成A.请写出该反应的化学方程式______。
(4)D和A反应______热量。(填“吸收”或“放出”)
四、实验题
15.如图所示,在白色点滴板1-6的孔穴中,分别滴加适量稀盐酸。
(1)反应后溶液颜色有变化的是______(填序号)。
(2)孔穴3中发生反应的化学方程式为______。
(3)再向孔穴4中滴加氢氧化钠溶液,溶液不变色,此时溶液中一定有的溶质是______。
16.氧化钙俗名生石灰,某同学针对氧化钙设计了如下实验方案:
(1)A中发生反应的化学方程式为___________。分离B中难溶物的操作I叫_________。
(2)如果要用实验证明C中不是水而是一种溶液,可以选择下列______(填序号)进行试验。
①稀盐酸 ②酚酞溶液 ③二氧化碳 ④氯化钠溶液
(3)操作II是加入某种物质使无色澄清液出现白色固体,如果加入的是饱和碳酸钠溶液,白色固体的化学式是___________;如果加入的是固体氢氧化钠(全部溶解),白色固体的化学式是___________。
17.实验室部分装置如图所示,回答下列问题:
(1)仪器X的名称是________。
(2)实验室常用氯化铵固体与碱石灰固体共热来制取氨气(NH3),其发生装置为____。NH3是一种碱性气体,干燥时不能选用下列干燥剂中的______(填序号)。
A.氢氧化钠固体 B.浓硫酸 C.生石灰
(3)实验室用装置B制O2的化学方程式为_______。
(4)某同学欲用活泼金属单质和稀盐酸反应制取纯净干燥的H2,请从这些装置中选择并连接成一套组合装置,按照气流从左到右的流向,写出所选装置接口的连接顺序:______→______→______→______→______→______→______
五、计算题
18.如图是向200g稀盐酸中不断加入5%氢氧化钠溶液时所得溶液pH的变化情况,请回答下列问题:
(1)当稀盐酸恰好完全反应时,消耗氢氧化钠的质量为___________g。
(2)计算该稀盐酸中溶质的质量分数。
19.在实验室中,小明发现了一瓶氢氧化钙粉末试剂瓶盖有破损,取部分粉末作为样品对其变质情况进行分析,实验室温度20℃查阅氢氧化钙的溶解度并进行如下实验。
氢氧化钙溶解度表
温度℃ 0 10 20 30 40 50 60 70
溶解度g 0.185 0.176 0.165 0.153 0.141 0.138 0.116 0.106
(1)取1g样品溶于100g水中,出现浑浊现象。小明认为该固体己经变质。你觉得这种说法是否正确?______(填“正确”或“不正确”)。理由是:______。
(2)小明另取2g样品于大烧杯中,加足量水充分溶解配制成1850g溶液,并通入CO2.溶液的质量与反应的CO2质量关系如图所示。请计算:该样品中氢氧化钙的质量分数。
(3)配制的氢氧化钙溶液浓度为______。
20.某工厂化验室欲测定排放的废水中硫酸的含量(假设废水中只有硫酸与氢氧化钠发生反应)。现取一定量的废水样品,逐滴加入溶质质量分数为10%的氢氧化钠溶液,振荡,当加入氢氧化钠溶液40g时溶液呈中性。求这一定量废水中含H2SO4的质量是多少?(反应的化学方程式:H2SO4+2NaOH=Na2SO4+2H2O )________
参考答案:
1.B 2.C 3.A 4.C 5.C 6.B 7.A 8.C 9.B 10.A
11. HCl 10g 浓盐酸具有挥发性
12. 不能,过氧乙酸具有酸的通性,能与活泼金属铁反应生成盐和氢气,从而腐蚀铁制品 密封低温储存
13. K2CO3 复分解反应 B
14. H2 CaCO3 正 放出
15. 1、3 NaCl
16. CaO + H2O =Ca(OH)2 过滤 ②③ CaCO3 Ca(OH)2
17.(1)酒精灯
(2) A B
(3)
(4) b f e h g d c
18.(1)8
(2)解:设所用稀盐酸中溶质的质量为x
该稀盐酸中溶质的质量分数为。
答:该稀盐酸中溶质的质量分数为3.65%。
19.(1)不正确;因为氢氧化钙的溶解度很小,导致不能完全溶液而浑浊;(2)92.5%;(3)0.1%
20.4.9g
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
