第12章盐检测题-2021-2022学年九年级化学京改版(2013)下册(word版有答案)
文档属性
| 名称 | 第12章盐检测题-2021-2022学年九年级化学京改版(2013)下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 102.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-21 19:02:59 | ||
图片预览


文档简介
第12章《盐》检测题
一、单选题
1.下列物质的名称或俗名,属同一种物质的是
A.生石灰 熟石灰 消石灰 B.冰 干冰 可燃冰
C.烧碱 苛性钠 火碱 D.石灰石 熟石灰 大理石
2.下列反应的化学方程式与对应的括号内的现象都完全正确的是( )
A.4p+5O22P2O5(产生白雾)
B.2NaOH+CuCl2═Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C.AgNO3+HCl═AgCl↓+HNO3(产生白色沉淀)
D.H2O2H2O+O2↑(冒气泡)
3.可以把盐酸、氯化钙、氯化钠三种无色溶液一次区别开的试剂是 ( )
A.Na2CO3溶液 B.NaOH溶液 C.蒸馏水 D.硫酸溶液
4.在一定条件下,下列物质间的转化能一步实现的是
A.①②③④B.①④C.②③D.①②④
5.下列四种化肥样品中,分别加入熟石灰混合,研磨后能闻到刺激性气味的是( )
A.尿素 B.磷矿粉 C.氯化铵 D.硝酸钾
6.下列化肥,属于磷肥的是( )
A.KNO3 B.NH4NO3 C.CO(NH2)2 D.Ca(H2PO4)2
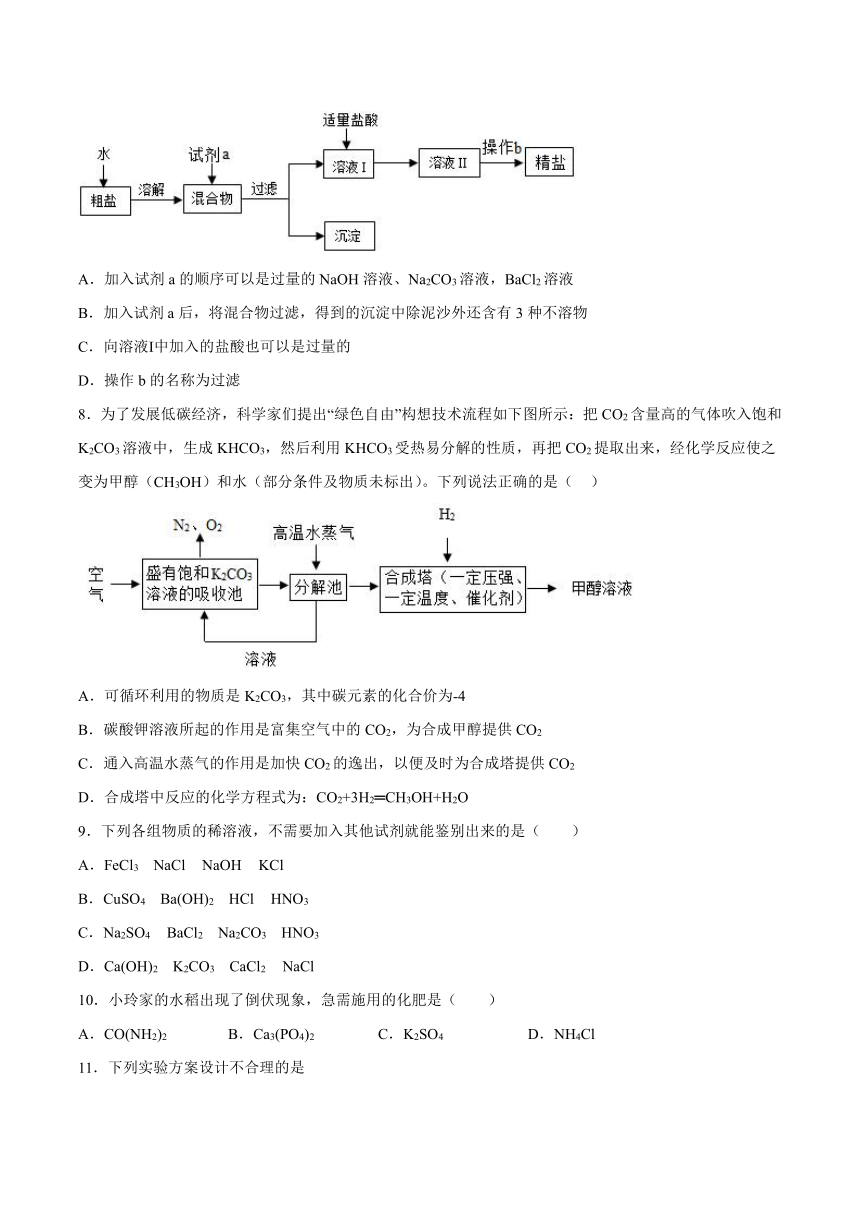
7.粗盐中常含有MgCl2、CaC12、Na2SO4及泥沙等杂质,常用下面的流程进行提纯。下列说法正确的是( )
A.加入试剂a的顺序可以是过量的NaOH溶液、Na2CO3溶液,BaCl2溶液
B.加入试剂a后,将混合物过滤,得到的沉淀中除泥沙外还含有3种不溶物
C.向溶液Ⅰ中加入的盐酸也可以是过量的
D.操作b的名称为过滤
8.为了发展低碳经济,科学家们提出“绿色自由”构想技术流程如下图所示:把CO2含量高的气体吹入饱和K2CO3溶液中,生成KHCO3,然后利用KHCO3受热易分解的性质,再把CO2提取出来,经化学反应使之变为甲醇(CH3OH)和水(部分条件及物质未标出)。下列说法正确的是( )
A.可循环利用的物质是K2CO3,其中碳元素的化合价为-4
B.碳酸钾溶液所起的作用是富集空气中的CO2,为合成甲醇提供CO2
C.通入高温水蒸气的作用是加快CO2的逸出,以便及时为合成塔提供CO2
D.合成塔中反应的化学方程式为:CO2+3H2═CH3OH+H2O
9.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
10.小玲家的水稻出现了倒伏现象,急需施用的化肥是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.K2SO4 D.NH4Cl
11.下列实验方案设计不合理的是
选项 实验内容 操作或所用试剂
A 鉴别铁粉和木炭粉 观察颜色
B 鉴别氯化铵和氯化钾 加熟石灰,混合研磨
C 除去铜中混有的氧化铜 加过量稀硫酸,过滤
D 除去氧化钙中混有的碳酸钙 高温煅烧
A.A B.B C.C D.D
12.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
二、简答题
13.某碳酸钾固体样品,可能含有硫酸钾、碳酸钙、硫酸铜、氯化钾、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验:
①取少量样品溶于水得到无色溶液,然后滴加过量的氯化钡溶液,出现白色沉淀A,过滤。
②沉淀A中加入过量的稀硝酸,沉淀部分消失并放出气体。往步骤①所得的滤液中加入适量硝酸银溶液和稀硝酸,生成白色沉淀B,过滤。回答下列问题:
(1)白色沉淀B是_____,步骤②中放出的气体是_____。
(2)杂质中一定含有_____,一定没有_____。
(3)最终所得滤液中含有的阳离子是_____。
14.请回答生活中的化学问题:
(1)长期饮用硬水对健康不利,生活中常用_____的方法将硬水转化为软水。
(2)把磨好的豆浆倒在纱布袋中将渣和浆分离,相当于化学实验中的_____操作。
(3)干粉灭火器主要用来扑灭油、气等燃烧引起的失火,干粉主要成分是碳酸氢钠,干粉受热后生成一种碳酸盐和两种氧化物,请写出该反应的化学方程式_____。
三、推断题
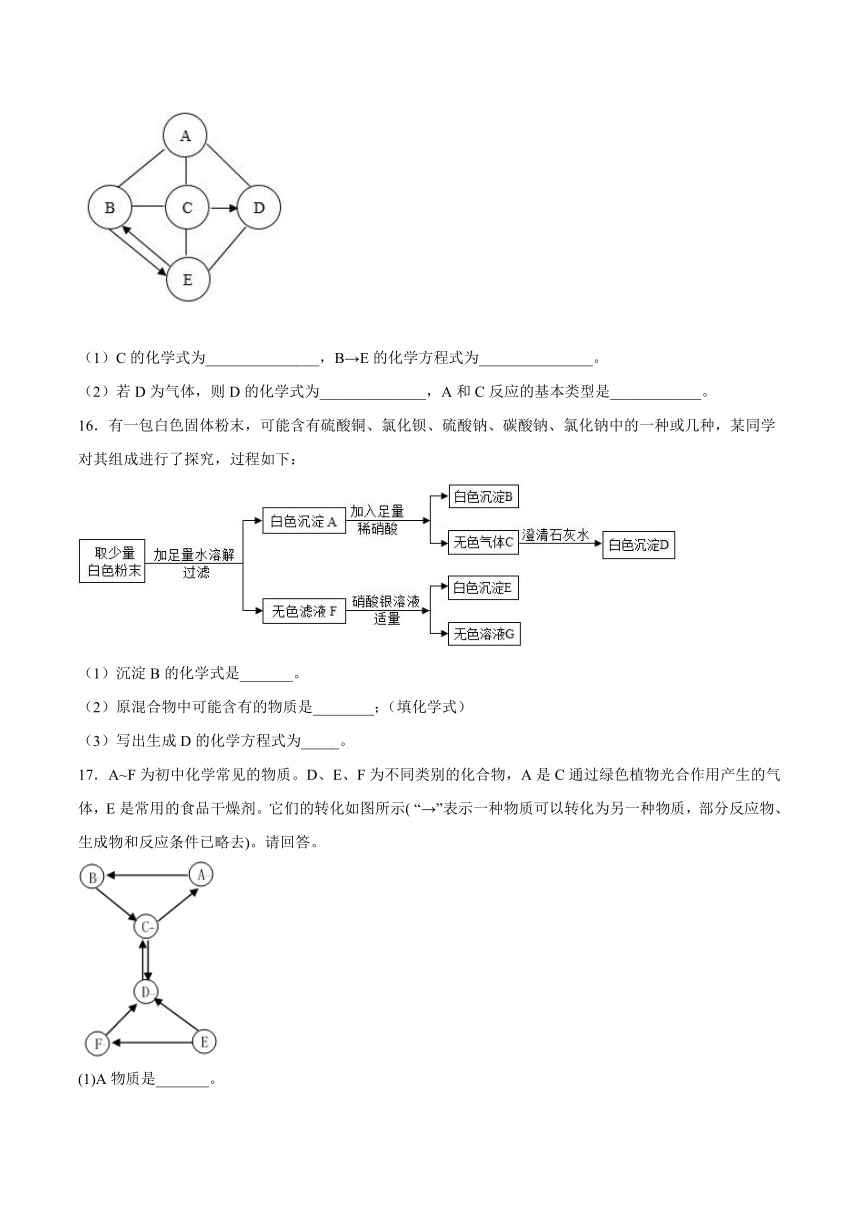
15.已知A-E为初中化学常见的物质,B是一种钠盐,C是胃酸的主要成分,B、C、E为不同类别的物质。他们之间有如图所示的转化关系(“一”表示相连的两种物质之间可以发生反应,“→”表示前一种物质经一步反应可转化为后一种物质,部分反应物、生成物及反应条件已略去)。请回答下列问题:
(1)C的化学式为_______________,B→E的化学方程式为_______________。
(2)若D为气体,则D的化学式为______________,A和C反应的基本类型是____________。
16.有一包白色固体粉末,可能含有硫酸铜、氯化钡、硫酸钠、碳酸钠、氯化钠中的一种或几种,某同学对其组成进行了探究,过程如下:
(1)沉淀B的化学式是_______。
(2)原混合物中可能含有的物质是________;(填化学式)
(3)写出生成D的化学方程式为_____。
17.A~F为初中化学常见的物质。D、E、F为不同类别的化合物,A是C通过绿色植物光合作用产生的气体,E是常用的食品干燥剂。它们的转化如图所示( “→”表示一种物质可以转化为另一种物质,部分反应物、生成物和反应条件已略去)。请回答。
(1)A物质是_______。
(2)B物质所属的类别是_______。(填“单质”、“氧化物”、“酸”、“碱”或“盐”)。
(3)E→F的反应_______(填“吸收”或“放出”)热量。
(4)F→D发生复分解反应的化学方程式为_______。
四、实验题
18.为探究碱的性质,进行如下实验。
(1)如甲图所示,加入一定量的盐酸后,溶液红色褪去,反应过程中溶液温度是____________ (填“升高”或“降低”),反应的化学方程式为______________。
(2)乙图所示,在NaOH溶液中通入CO2,然后滴加氯化钡溶液(呈中性)如丙图。有白色沉淀产生。说明NaOH与CO2发生了反应,则乙中反应的化学方程式为____________________;丙中反应的化学方程式为______________。
(3)实验结束后废液处理。实验结束后将试管丙内所有物质全部倒入一大烧杯中,再将甲烧杯所得溶液缓慢加入,全部加入充分搅拌后测得溶液pH为3。在将甲烧杯所得溶液缓慢加入的过程中,大烧杯内可观察到的现象是_________________。最终大烧杯中除了酚外,还含有的溶质是_________________。最后,调节pH接近7,达到排放标准。
五、计算题
19.图为某钙片的商品标签,为测定钙片中钙元素的质量分数(假设钙片中其他物质不含钙元素,且不溶于水,也不与任何物质发生反应),某化学兴趣小组取20片钙片,进行如下实验:
(1)上述实验过程中发生反应的化学方程式为___________。
(2)根据已知条件列出求解所加的稀盐酸中溶质质量(x)的比例式_________。
(3)用36.5%的浓盐酸配制100g上述稀盐酸,所需浓盐酸的质量为_________。
(4)钙片中钙元素的质量分数为_______。
(5)若向滤液中加入5.4g水,所得溶液中溶质的质量分数为_____。
(6)工厂生产钙片时若需碳酸钙120t,理论上需含氧化钙84%的生石灰的质量为_____。
20.巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数,他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g。
计算:
(1)生成二氧化碳 g。
(2)样品中纯碱的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
参考答案:
1.C 2.C 3.A 4.B 5.C 6.D 7.C 8.B 9.C 10.C 11.A 12.D
13. 氯化银 二氧化碳气体 硫酸钾 碳酸钙、硫酸铜、氯化钙 K+、Ba2+、H+
14. 加热煮沸 过滤 2NaHCO3Na2CO3+CO2↑+H2O 。
15. HCl CO2 复分解反应
16. BaSO4 NaCl
17. 氧气 氧化物 放出 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
18. 升高 白色沉淀逐渐溶解, 有气泡产生 NaCl、BaCl2、HC1
19.(1)(2)(3)20g(4)20%(5)10%(6)80t
20.(1)4.4
(2)设样品中纯碱的质量为x
x=10.6g
所以样品中纯碱的质量分数是。
答:样品中纯碱的质量分数是88.3%。
一、单选题
1.下列物质的名称或俗名,属同一种物质的是
A.生石灰 熟石灰 消石灰 B.冰 干冰 可燃冰
C.烧碱 苛性钠 火碱 D.石灰石 熟石灰 大理石
2.下列反应的化学方程式与对应的括号内的现象都完全正确的是( )
A.4p+5O22P2O5(产生白雾)
B.2NaOH+CuCl2═Cu(OH)2↓+2NaCl(产生红褐色沉淀)
C.AgNO3+HCl═AgCl↓+HNO3(产生白色沉淀)
D.H2O2H2O+O2↑(冒气泡)
3.可以把盐酸、氯化钙、氯化钠三种无色溶液一次区别开的试剂是 ( )
A.Na2CO3溶液 B.NaOH溶液 C.蒸馏水 D.硫酸溶液
4.在一定条件下,下列物质间的转化能一步实现的是
A.①②③④B.①④C.②③D.①②④
5.下列四种化肥样品中,分别加入熟石灰混合,研磨后能闻到刺激性气味的是( )
A.尿素 B.磷矿粉 C.氯化铵 D.硝酸钾
6.下列化肥,属于磷肥的是( )
A.KNO3 B.NH4NO3 C.CO(NH2)2 D.Ca(H2PO4)2
7.粗盐中常含有MgCl2、CaC12、Na2SO4及泥沙等杂质,常用下面的流程进行提纯。下列说法正确的是( )
A.加入试剂a的顺序可以是过量的NaOH溶液、Na2CO3溶液,BaCl2溶液
B.加入试剂a后,将混合物过滤,得到的沉淀中除泥沙外还含有3种不溶物
C.向溶液Ⅰ中加入的盐酸也可以是过量的
D.操作b的名称为过滤
8.为了发展低碳经济,科学家们提出“绿色自由”构想技术流程如下图所示:把CO2含量高的气体吹入饱和K2CO3溶液中,生成KHCO3,然后利用KHCO3受热易分解的性质,再把CO2提取出来,经化学反应使之变为甲醇(CH3OH)和水(部分条件及物质未标出)。下列说法正确的是( )
A.可循环利用的物质是K2CO3,其中碳元素的化合价为-4
B.碳酸钾溶液所起的作用是富集空气中的CO2,为合成甲醇提供CO2
C.通入高温水蒸气的作用是加快CO2的逸出,以便及时为合成塔提供CO2
D.合成塔中反应的化学方程式为:CO2+3H2═CH3OH+H2O
9.下列各组物质的稀溶液,不需要加入其他试剂就能鉴别出来的是( )
A.FeCl3 NaCl NaOH KCl
B.CuSO4 Ba(OH)2 HCl HNO3
C.Na2SO4 BaCl2 Na2CO3 HNO3
D.Ca(OH)2 K2CO3 CaCl2 NaCl
10.小玲家的水稻出现了倒伏现象,急需施用的化肥是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.K2SO4 D.NH4Cl
11.下列实验方案设计不合理的是
选项 实验内容 操作或所用试剂
A 鉴别铁粉和木炭粉 观察颜色
B 鉴别氯化铵和氯化钾 加熟石灰,混合研磨
C 除去铜中混有的氧化铜 加过量稀硫酸,过滤
D 除去氧化钙中混有的碳酸钙 高温煅烧
A.A B.B C.C D.D
12.关于复分解反应说法一定正确的是( )
A.反应物为酸和碱 B.伴随有明显现象
C.生成物为盐和水 D.元素化合价不变
二、简答题
13.某碳酸钾固体样品,可能含有硫酸钾、碳酸钙、硫酸铜、氯化钾、氯化钙中的一种或几种杂质,为了确定杂质的成分,进行以下实验:
①取少量样品溶于水得到无色溶液,然后滴加过量的氯化钡溶液,出现白色沉淀A,过滤。
②沉淀A中加入过量的稀硝酸,沉淀部分消失并放出气体。往步骤①所得的滤液中加入适量硝酸银溶液和稀硝酸,生成白色沉淀B,过滤。回答下列问题:
(1)白色沉淀B是_____,步骤②中放出的气体是_____。
(2)杂质中一定含有_____,一定没有_____。
(3)最终所得滤液中含有的阳离子是_____。
14.请回答生活中的化学问题:
(1)长期饮用硬水对健康不利,生活中常用_____的方法将硬水转化为软水。
(2)把磨好的豆浆倒在纱布袋中将渣和浆分离,相当于化学实验中的_____操作。
(3)干粉灭火器主要用来扑灭油、气等燃烧引起的失火,干粉主要成分是碳酸氢钠,干粉受热后生成一种碳酸盐和两种氧化物,请写出该反应的化学方程式_____。
三、推断题
15.已知A-E为初中化学常见的物质,B是一种钠盐,C是胃酸的主要成分,B、C、E为不同类别的物质。他们之间有如图所示的转化关系(“一”表示相连的两种物质之间可以发生反应,“→”表示前一种物质经一步反应可转化为后一种物质,部分反应物、生成物及反应条件已略去)。请回答下列问题:
(1)C的化学式为_______________,B→E的化学方程式为_______________。
(2)若D为气体,则D的化学式为______________,A和C反应的基本类型是____________。
16.有一包白色固体粉末,可能含有硫酸铜、氯化钡、硫酸钠、碳酸钠、氯化钠中的一种或几种,某同学对其组成进行了探究,过程如下:
(1)沉淀B的化学式是_______。
(2)原混合物中可能含有的物质是________;(填化学式)
(3)写出生成D的化学方程式为_____。
17.A~F为初中化学常见的物质。D、E、F为不同类别的化合物,A是C通过绿色植物光合作用产生的气体,E是常用的食品干燥剂。它们的转化如图所示( “→”表示一种物质可以转化为另一种物质,部分反应物、生成物和反应条件已略去)。请回答。
(1)A物质是_______。
(2)B物质所属的类别是_______。(填“单质”、“氧化物”、“酸”、“碱”或“盐”)。
(3)E→F的反应_______(填“吸收”或“放出”)热量。
(4)F→D发生复分解反应的化学方程式为_______。
四、实验题
18.为探究碱的性质,进行如下实验。
(1)如甲图所示,加入一定量的盐酸后,溶液红色褪去,反应过程中溶液温度是____________ (填“升高”或“降低”),反应的化学方程式为______________。
(2)乙图所示,在NaOH溶液中通入CO2,然后滴加氯化钡溶液(呈中性)如丙图。有白色沉淀产生。说明NaOH与CO2发生了反应,则乙中反应的化学方程式为____________________;丙中反应的化学方程式为______________。
(3)实验结束后废液处理。实验结束后将试管丙内所有物质全部倒入一大烧杯中,再将甲烧杯所得溶液缓慢加入,全部加入充分搅拌后测得溶液pH为3。在将甲烧杯所得溶液缓慢加入的过程中,大烧杯内可观察到的现象是_________________。最终大烧杯中除了酚外,还含有的溶质是_________________。最后,调节pH接近7,达到排放标准。
五、计算题
19.图为某钙片的商品标签,为测定钙片中钙元素的质量分数(假设钙片中其他物质不含钙元素,且不溶于水,也不与任何物质发生反应),某化学兴趣小组取20片钙片,进行如下实验:
(1)上述实验过程中发生反应的化学方程式为___________。
(2)根据已知条件列出求解所加的稀盐酸中溶质质量(x)的比例式_________。
(3)用36.5%的浓盐酸配制100g上述稀盐酸,所需浓盐酸的质量为_________。
(4)钙片中钙元素的质量分数为_______。
(5)若向滤液中加入5.4g水,所得溶液中溶质的质量分数为_____。
(6)工厂生产钙片时若需碳酸钙120t,理论上需含氧化钙84%的生石灰的质量为_____。
20.巴中某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数,他们取12g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100g,烧杯中没有残留不溶物,称得反应后溶液的质量为107.6g。
计算:
(1)生成二氧化碳 g。
(2)样品中纯碱的质量分数是多少?(要求写出计算过程,结果精确到0.1%)
参考答案:
1.C 2.C 3.A 4.B 5.C 6.D 7.C 8.B 9.C 10.C 11.A 12.D
13. 氯化银 二氧化碳气体 硫酸钾 碳酸钙、硫酸铜、氯化钙 K+、Ba2+、H+
14. 加热煮沸 过滤 2NaHCO3Na2CO3+CO2↑+H2O 。
15. HCl CO2 复分解反应
16. BaSO4 NaCl
17. 氧气 氧化物 放出 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
18. 升高 白色沉淀逐渐溶解, 有气泡产生 NaCl、BaCl2、HC1
19.(1)(2)(3)20g(4)20%(5)10%(6)80t
20.(1)4.4
(2)设样品中纯碱的质量为x
x=10.6g
所以样品中纯碱的质量分数是。
答:样品中纯碱的质量分数是88.3%。
