第八章 常见的酸碱盐练习—2021—2022学年九年级化学科粤版(2012)下册(word版 含答案)
文档属性
| 名称 | 第八章 常见的酸碱盐练习—2021—2022学年九年级化学科粤版(2012)下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 95.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-22 08:41:46 | ||
图片预览


文档简介
第八章《常见的酸碱盐》练习—2021—2022学年九年级化学科粤版(2012)下册
一、单选题
1.农作物生长需要含较多氮、磷、钾元素的化肥,下列化肥属于含磷复合肥料的是
A.NH4NO3 B.Ca(H2PO4)2 C.(NH4)2HPO4 D.KNO3
2.头发油腻是因为油脂的分泌,清洗时碱性溶液效果更好。从pH角度考虑效果最好的洗发水的pH为( )
A.8 B.7 C.6 D.4
3.下列关于化肥的说法正确的是
A.过磷酸钙[Ca(H2PO4)2和CaSO4的混合物]属于氮肥
B.凡施用过化肥的蔬菜都会危害健康
C.硫酸钾与熟石灰混合、研磨,能闻到刺激性的气味
D.合理施用化肥能提高农作物的产量
4.下列实验现象的描述,正确的是
A.铜绿中加入盐酸,生成气泡,溶液最终变成无色
B.燃着的蜡烛熄灭时产生白雾
C.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
D.红磷在空气中燃烧产生大量白烟,放热
5.鉴别下列各组物质采用的方法或使用的试剂不正确的是
A.硬水和软水:肥皂水
B.氧气和二氧化碳:带火星的木条
C.氢氧化钠与硝酸铵:加水溶解测温度
D.蔗糖溶液与酒精溶液:测导电性
6.下列有关氢氧化钠的说法,错误的是( )
A.氢氧化钠俗称烧碱
B.氢氧化钠有强烈的腐蚀性
C.氢氧化钠固体可用于干燥二氧化碳气体
D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等
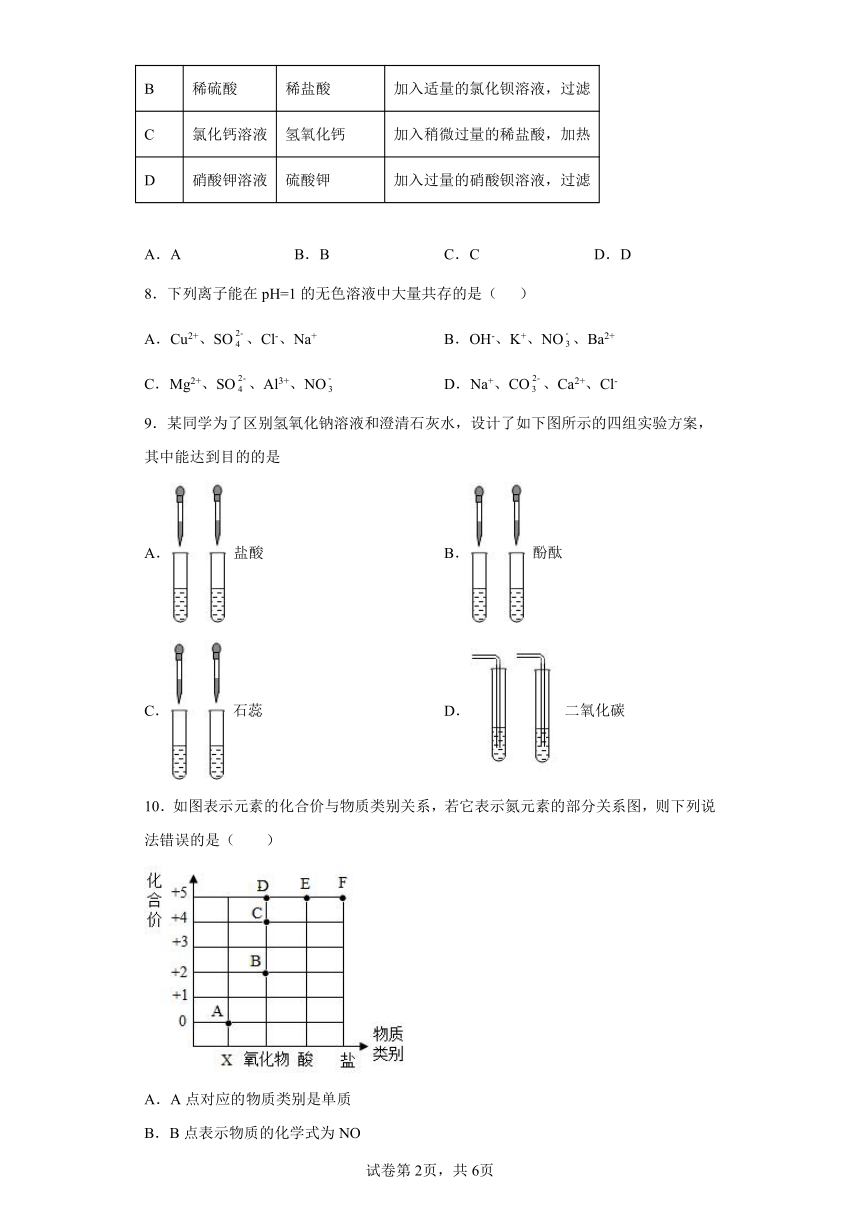
7.除去下列物质中的杂质,选用试剂和方法均正确的是
选项 物质 杂质(少量) 试剂和方法
A 氯化钾 氯酸钾 加入少量二氧化锰粉末,加热
B 稀硫酸 稀盐酸 加入适量的氯化钡溶液,过滤
C 氯化钙溶液 氢氧化钙 加入稍微过量的稀盐酸,加热
D 硝酸钾溶液 硫酸钾 加入过量的硝酸钡溶液,过滤
A.A B.B C.C D.D
8.下列离子能在pH=1的无色溶液中大量共存的是( )
A.Cu2+、SO、Cl-、Na+ B.OH-、K+、NO、Ba2+
C.Mg2+、SO、Al3+、NO D.Na+、CO、Ca2+、Cl-
9.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是
A. 盐酸 B. 酚酞
C. 石蕊 D. 二氧化碳
10.如图表示元素的化合价与物质类别关系,若它表示氮元素的部分关系图,则下列说法错误的是( )
A.A点对应的物质类别是单质
B.B点表示物质的化学式为NO
C.某化合物的化学式为KNO3,它代表的点是F
D.写出由D点表示的物质与水发生反应生成E的化学方程式:3NO2+H2O=2HNO3+NO
11.下列图象不能正确反映其对应关系的是
A.常温下向装有澄清石灰水的烧杯中逐渐加水
B.某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
C.向装有氢氧化钠和碳酸钠混合溶液的烧杯中滴加稀硫酸
D.向装有等质量锌、铁的两只烧杯中分别滴加足量等浓度的稀盐酸
二、简答题
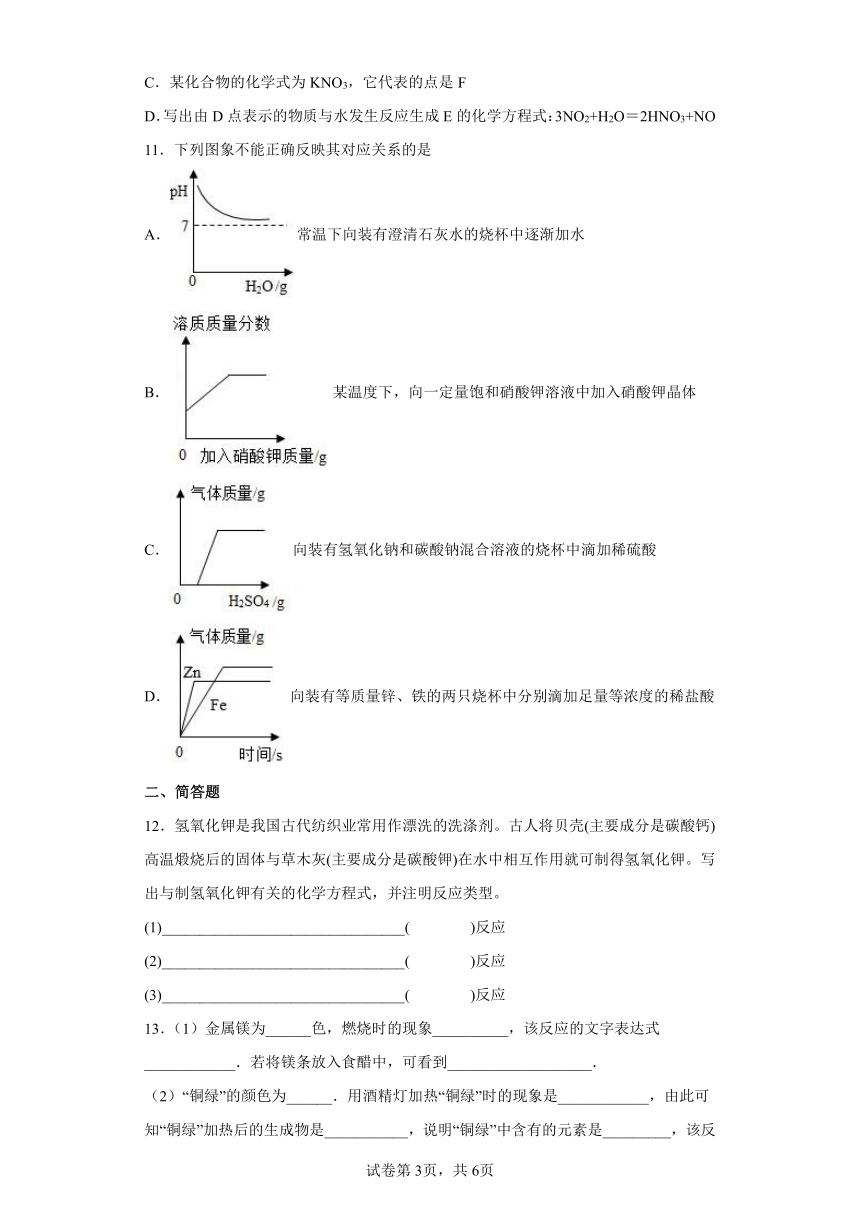
12.氢氧化钾是我国古代纺织业常用作漂洗的洗涤剂。古人将贝壳(主要成分是碳酸钙)高温煅烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用就可制得氢氧化钾。写出与制氢氧化钾有关的化学方程式,并注明反应类型。
(1)________________________________( )反应
(2)________________________________( )反应
(3)________________________________( )反应
13.(1)金属镁为______色,燃烧时的现象__________,该反应的文字表达式____________.若将镁条放入食醋中,可看到___________________.
(2)“铜绿”的颜色为______.用酒精灯加热“铜绿”时的现象是____________,由此可知“铜绿”加热后的生成物是___________,说明“铜绿”中含有的元素是_________,该反应的文字表达式_______;“铜绿”与盐酸作用时的现象_________.
三、推断题
14.A、B、C、D是初中化学常见的物质,这四种物质中均含有同一种元素。其中A为无色气体单质,B、C均为含有2种元素的化合物,且B为有毒气体,D是大理石的主要成分。它们之间的部分转化关系如下图所示(图中反应条件及部分反应物、生成物已省略)
回答下列问题;
(1)写出下列物质的化学式A_____________;
(2)写出由物质C转化为物质D的化学方程式_____________;物质A转化为物质B的化学方程式______________。
(3)写出物质C的一种用途__________________。
15.A~H为初中化学常见物质。已知A属于盐,常用作建筑材料,E是赤铁矿石的主要成分,它们的转换关系如图所示(反应条件未完全标出)。
(1)写出A的化学式:A_______。
(2)F的作用__________。
(3)写出反应②的化学方程式___________,其中反应④属于_______(填基本反应类型)。
四、实验题
16.2004年2月中旬,福州市茶亭街东西河下游七公里长的内河,河面上漂浮着大量死鱼。小亮闻讯后,取回水样与同学们一起探究。
(1)观察水质的能见度,然后过滤。过滤时不需要用到以下仪器中的_____(用序号表示);
A 漏斗 B 烧杯 C 玻璃棒 D 铁架台 E 酒精灯
(2)取过滤后的水样,用两种方法检验该水样是否呈酸性,他们采用的方法可能是:_____。
请任选一种方法进行实验,并完成下列实验报告_____
实验步骤 实验现象 实验结论
(3)面对内河严重污染,有人建议:①对排入内河的污水预先进行处理;②将闽江水引入,把内河的污水及污泥冲走,使死水变活;③用不产生二次污染的生物酶技术治理内河。以上建议中你不同意的是_____(填序号),理由是:_____。
17.化学实验课上,同学们利用下列实验探究碱的化学性质:
(1)A实验中酚酞的作用是______。
(2)有同学认为B实验现象“塑料瓶变瘪”无法证明CO2确实与NaOH溶液反应了,其理由是______。
(3)C实验中反应的化学方程式为______。
18.根据图中的实验装置回答:
查阅资料:i.CaCl2溶液呈中性;
ii.
实验步骤如下:
①检查装置的气密性,往装置中加入药品;
②关闭K1、K2,将注射器中的NaOH溶液缓缓推入A中;
③A中物质充分作用后,打开K1,B中无色溶液倒吸入A中,A中产生沉淀且溶液显红色;
④关闭K1,打开K2,将注射器活塞向上拉,C中溶液倒吸入A中。
(1)步骤③“产生沉淀”的现象仍不足以证明CO2与NaOH发生了化学反应,理由是_____。
(2)步骤④中,若观察到_______(填现象),证明CO2与NaOH发生了化学反应。CO2与NaOH反应的化学方程式为__________。
五、计算题
19.某化验室用20%的氢氧化钠溶液洗涤一定量工业产品中残余的H2SO4(工业产品及其他杂质都不与氢氧化钠溶液反应),当恰好完全反应时,共消耗氢氧化钠溶液80g,求产品中残余的H2SO4质量和生成硫酸钠的质量。
20.某化学研究性学习小组为测定市场出售的食醋的总酸量(国家规定食醋中总酸量为3.5 g/100 mL~5 g/100 mL),拟配制一定质量分数的氢氧化钠溶液,然后进行测定。
请你参与该小组的实验研究,并回答相关问题。
(1)配制100 g质量分数为5%的氢氧化钠溶液,需要水多少mL。(水的密度为1 g/cm3)
(2)若食醋中的酸均看成是醋酸,醋酸与氢氧化钠反应的化学方程式为CH3COOH+NaOH=CH3COONa+H2O。现有食醋500 mL,甲同学从中取出10 mL,加入5%的氢氧化钠溶液4.8 g,恰好完全反应。请通过计算判断该食醋是否合格。(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.D
4.D
5.D
6.C
7.C
8.C
9.D
10.D
11.B
12. CaCO3CaO+CO2↑ 分解 CaO+H2O=Ca(OH)2 化合 Ca(OH)2+K2CO3=CaCO3↓+2KOH 复分解
13. 银白色 发出耀眼的白光、放热、生成白色粉末 镁+氧气氧化镁 镁条逐渐减少,表面产生气泡 绿色 绿色固体变成黑色固体,试管壁有小水珠,生成了能使澄清石灰水变浑浊的气体 氧化铜、二氧化碳、水 碳元素、铜元素、氧元素、氢元素 碱式碳酸铜氧化铜+二氧化碳+水 “铜绿”逐渐减少,产生气泡,溶液变成蓝色
14. O2 灭火(合理即可)
15. CaCO3 改良酸性土壤 置换反应
16. E 用紫色石蕊溶液检验,用pH试纸测定溶液的pH 取少量水样于试管中,向试管中滴加几滴紫色石蕊试液 溶液变红色 水样显酸性 ② 会产生二次污染
17.(1)通过颜色变化,判断稀盐酸和氢氧化钠反应
(2)二氧化碳能溶于水
(3)
18.(1)氢氧化钠与氯化钙反应也能生成沉淀
(2) 产生气泡
19.解:80g该氢氧化钠溶液中溶质的质量为80g×20%=16g,
设石油产品中含H2SO4的质量为x,生成硫酸钠的质量为y
解得:x=19.6g y=28.4g
答:产品中残余的H2SO4质量为19.6g,生成硫酸钠的质量为28.4g。
20.(1) 95
(2)该食醋合格
NaOH的质量=4.8g×5%=0.24g
设10ml食醋中醋酸的质量为x
x=0.36g
则该食醋中总酸量为3.6g/100mL,该食醋合格。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.农作物生长需要含较多氮、磷、钾元素的化肥,下列化肥属于含磷复合肥料的是
A.NH4NO3 B.Ca(H2PO4)2 C.(NH4)2HPO4 D.KNO3
2.头发油腻是因为油脂的分泌,清洗时碱性溶液效果更好。从pH角度考虑效果最好的洗发水的pH为( )
A.8 B.7 C.6 D.4
3.下列关于化肥的说法正确的是
A.过磷酸钙[Ca(H2PO4)2和CaSO4的混合物]属于氮肥
B.凡施用过化肥的蔬菜都会危害健康
C.硫酸钾与熟石灰混合、研磨,能闻到刺激性的气味
D.合理施用化肥能提高农作物的产量
4.下列实验现象的描述,正确的是
A.铜绿中加入盐酸,生成气泡,溶液最终变成无色
B.燃着的蜡烛熄灭时产生白雾
C.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
D.红磷在空气中燃烧产生大量白烟,放热
5.鉴别下列各组物质采用的方法或使用的试剂不正确的是
A.硬水和软水:肥皂水
B.氧气和二氧化碳:带火星的木条
C.氢氧化钠与硝酸铵:加水溶解测温度
D.蔗糖溶液与酒精溶液:测导电性
6.下列有关氢氧化钠的说法,错误的是( )
A.氢氧化钠俗称烧碱
B.氢氧化钠有强烈的腐蚀性
C.氢氧化钠固体可用于干燥二氧化碳气体
D.氢氧化钠可用于制肥皂、洗涤剂、造纸、纺织工业等
7.除去下列物质中的杂质,选用试剂和方法均正确的是
选项 物质 杂质(少量) 试剂和方法
A 氯化钾 氯酸钾 加入少量二氧化锰粉末,加热
B 稀硫酸 稀盐酸 加入适量的氯化钡溶液,过滤
C 氯化钙溶液 氢氧化钙 加入稍微过量的稀盐酸,加热
D 硝酸钾溶液 硫酸钾 加入过量的硝酸钡溶液,过滤
A.A B.B C.C D.D
8.下列离子能在pH=1的无色溶液中大量共存的是( )
A.Cu2+、SO、Cl-、Na+ B.OH-、K+、NO、Ba2+
C.Mg2+、SO、Al3+、NO D.Na+、CO、Ca2+、Cl-
9.某同学为了区别氢氧化钠溶液和澄清石灰水,设计了如下图所示的四组实验方案,其中能达到目的的是
A. 盐酸 B. 酚酞
C. 石蕊 D. 二氧化碳
10.如图表示元素的化合价与物质类别关系,若它表示氮元素的部分关系图,则下列说法错误的是( )
A.A点对应的物质类别是单质
B.B点表示物质的化学式为NO
C.某化合物的化学式为KNO3,它代表的点是F
D.写出由D点表示的物质与水发生反应生成E的化学方程式:3NO2+H2O=2HNO3+NO
11.下列图象不能正确反映其对应关系的是
A.常温下向装有澄清石灰水的烧杯中逐渐加水
B.某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
C.向装有氢氧化钠和碳酸钠混合溶液的烧杯中滴加稀硫酸
D.向装有等质量锌、铁的两只烧杯中分别滴加足量等浓度的稀盐酸
二、简答题
12.氢氧化钾是我国古代纺织业常用作漂洗的洗涤剂。古人将贝壳(主要成分是碳酸钙)高温煅烧后的固体与草木灰(主要成分是碳酸钾)在水中相互作用就可制得氢氧化钾。写出与制氢氧化钾有关的化学方程式,并注明反应类型。
(1)________________________________( )反应
(2)________________________________( )反应
(3)________________________________( )反应
13.(1)金属镁为______色,燃烧时的现象__________,该反应的文字表达式____________.若将镁条放入食醋中,可看到___________________.
(2)“铜绿”的颜色为______.用酒精灯加热“铜绿”时的现象是____________,由此可知“铜绿”加热后的生成物是___________,说明“铜绿”中含有的元素是_________,该反应的文字表达式_______;“铜绿”与盐酸作用时的现象_________.
三、推断题
14.A、B、C、D是初中化学常见的物质,这四种物质中均含有同一种元素。其中A为无色气体单质,B、C均为含有2种元素的化合物,且B为有毒气体,D是大理石的主要成分。它们之间的部分转化关系如下图所示(图中反应条件及部分反应物、生成物已省略)
回答下列问题;
(1)写出下列物质的化学式A_____________;
(2)写出由物质C转化为物质D的化学方程式_____________;物质A转化为物质B的化学方程式______________。
(3)写出物质C的一种用途__________________。
15.A~H为初中化学常见物质。已知A属于盐,常用作建筑材料,E是赤铁矿石的主要成分,它们的转换关系如图所示(反应条件未完全标出)。
(1)写出A的化学式:A_______。
(2)F的作用__________。
(3)写出反应②的化学方程式___________,其中反应④属于_______(填基本反应类型)。
四、实验题
16.2004年2月中旬,福州市茶亭街东西河下游七公里长的内河,河面上漂浮着大量死鱼。小亮闻讯后,取回水样与同学们一起探究。
(1)观察水质的能见度,然后过滤。过滤时不需要用到以下仪器中的_____(用序号表示);
A 漏斗 B 烧杯 C 玻璃棒 D 铁架台 E 酒精灯
(2)取过滤后的水样,用两种方法检验该水样是否呈酸性,他们采用的方法可能是:_____。
请任选一种方法进行实验,并完成下列实验报告_____
实验步骤 实验现象 实验结论
(3)面对内河严重污染,有人建议:①对排入内河的污水预先进行处理;②将闽江水引入,把内河的污水及污泥冲走,使死水变活;③用不产生二次污染的生物酶技术治理内河。以上建议中你不同意的是_____(填序号),理由是:_____。
17.化学实验课上,同学们利用下列实验探究碱的化学性质:
(1)A实验中酚酞的作用是______。
(2)有同学认为B实验现象“塑料瓶变瘪”无法证明CO2确实与NaOH溶液反应了,其理由是______。
(3)C实验中反应的化学方程式为______。
18.根据图中的实验装置回答:
查阅资料:i.CaCl2溶液呈中性;
ii.
实验步骤如下:
①检查装置的气密性,往装置中加入药品;
②关闭K1、K2,将注射器中的NaOH溶液缓缓推入A中;
③A中物质充分作用后,打开K1,B中无色溶液倒吸入A中,A中产生沉淀且溶液显红色;
④关闭K1,打开K2,将注射器活塞向上拉,C中溶液倒吸入A中。
(1)步骤③“产生沉淀”的现象仍不足以证明CO2与NaOH发生了化学反应,理由是_____。
(2)步骤④中,若观察到_______(填现象),证明CO2与NaOH发生了化学反应。CO2与NaOH反应的化学方程式为__________。
五、计算题
19.某化验室用20%的氢氧化钠溶液洗涤一定量工业产品中残余的H2SO4(工业产品及其他杂质都不与氢氧化钠溶液反应),当恰好完全反应时,共消耗氢氧化钠溶液80g,求产品中残余的H2SO4质量和生成硫酸钠的质量。
20.某化学研究性学习小组为测定市场出售的食醋的总酸量(国家规定食醋中总酸量为3.5 g/100 mL~5 g/100 mL),拟配制一定质量分数的氢氧化钠溶液,然后进行测定。
请你参与该小组的实验研究,并回答相关问题。
(1)配制100 g质量分数为5%的氢氧化钠溶液,需要水多少mL。(水的密度为1 g/cm3)
(2)若食醋中的酸均看成是醋酸,醋酸与氢氧化钠反应的化学方程式为CH3COOH+NaOH=CH3COONa+H2O。现有食醋500 mL,甲同学从中取出10 mL,加入5%的氢氧化钠溶液4.8 g,恰好完全反应。请通过计算判断该食醋是否合格。(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.D
4.D
5.D
6.C
7.C
8.C
9.D
10.D
11.B
12. CaCO3CaO+CO2↑ 分解 CaO+H2O=Ca(OH)2 化合 Ca(OH)2+K2CO3=CaCO3↓+2KOH 复分解
13. 银白色 发出耀眼的白光、放热、生成白色粉末 镁+氧气氧化镁 镁条逐渐减少,表面产生气泡 绿色 绿色固体变成黑色固体,试管壁有小水珠,生成了能使澄清石灰水变浑浊的气体 氧化铜、二氧化碳、水 碳元素、铜元素、氧元素、氢元素 碱式碳酸铜氧化铜+二氧化碳+水 “铜绿”逐渐减少,产生气泡,溶液变成蓝色
14. O2 灭火(合理即可)
15. CaCO3 改良酸性土壤 置换反应
16. E 用紫色石蕊溶液检验,用pH试纸测定溶液的pH 取少量水样于试管中,向试管中滴加几滴紫色石蕊试液 溶液变红色 水样显酸性 ② 会产生二次污染
17.(1)通过颜色变化,判断稀盐酸和氢氧化钠反应
(2)二氧化碳能溶于水
(3)
18.(1)氢氧化钠与氯化钙反应也能生成沉淀
(2) 产生气泡
19.解:80g该氢氧化钠溶液中溶质的质量为80g×20%=16g,
设石油产品中含H2SO4的质量为x,生成硫酸钠的质量为y
解得:x=19.6g y=28.4g
答:产品中残余的H2SO4质量为19.6g,生成硫酸钠的质量为28.4g。
20.(1) 95
(2)该食醋合格
NaOH的质量=4.8g×5%=0.24g
设10ml食醋中醋酸的质量为x
x=0.36g
则该食醋中总酸量为3.6g/100mL,该食醋合格。
答案第1页,共2页
答案第1页,共2页
