第九单元溶液测试题-2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 第九单元溶液测试题-2021-2022学年九年级化学人教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 118.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-22 10:08:06 | ||
图片预览


文档简介
第九单元《溶液》测试题
一、单选题
1.下列少量物质分散到水中,能形成无色透明溶液的是
A.冰块 B.芝麻油 C.酒精 D.硫酸铜
2.下列说法正确的是
A.恒温蒸发可使接近饱和的硝酸钾溶液变为饱和
B.双氧水在二氧化锰催化下才能产生氧气
C.可燃物的温度达到其着火点即可燃烧
D.汽油在清洗油污过程中起乳化作用
3.下列有关水与溶液的说法错误的是
A.电解水实验说明水是由氢元素和氧元素组成的
B.农药、化肥不合理使用,会造成水体污染
C.饱和溶液就是不能再溶解任何物质的溶液
D.天然淡水生产自来水需要经过沉降、过滤、吸附、杀菌消毒等净化过程
4.下列关于氧气的说法中错误的是
A.氧气可以支持燃烧,说明氧气具有可燃性
B.工业上可以利用分离液态空气法制氧气
C.氧气能供给呼吸,它和体内物质反应,维持生命活动
D.鱼池内开启增氧泵,是因为温度升高,氧气在水中溶解量减少
5.下列有关水的认识正确的是
A.氢气在氧气中点燃生成水,可知水是由氢气和氧气组成
B.生活中用过滤的方法可以降低水的硬度
C.净化水的方法有沉降、过滤、吸附、蒸馏
D.氯化钠、泥沙、汽油加入一定量水中都能形成溶液
6.唐代刘禹锡撰于公元818年的《传信方》中有这样一段描述“治气痢巴石丸,取白矾一大斤,以炭火净地烧令汁尽,则其色如雪,谓之巴石”据此推测,用于治气痢的巴石丸,其主要原料的化学成分为
A.CuSO4 B.FeSO4·7H2O
C.KAl(SO4)2·12H2O D.Fe2(SO4)3·9H2O
7.区别下列各组物质,试剂或操作选择不当的是
物质 试剂或操作
A CO和CH4 点燃,观察火焰颜色
B NaOH和NH4NO3 水
C 硬水和软水 肥皂水
D 黄铜和铜 相互刻画,比较硬度
A.A B.B C.C D.D
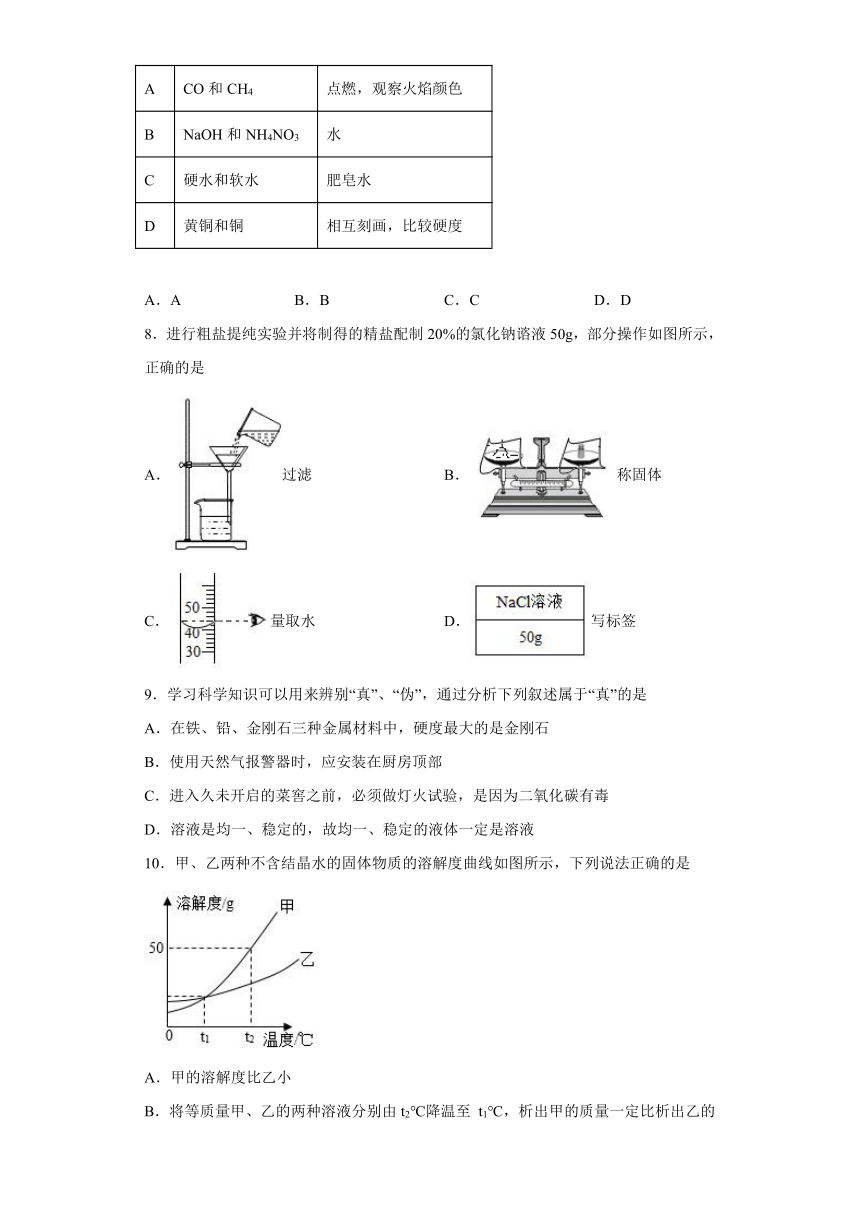
8.进行粗盐提纯实验并将制得的精盐配制20%的氯化钠谘液50g,部分操作如图所示,正确的是
A.过滤 B.称固体
C.量取水 D.写标签
9.学习科学知识可以用来辨别“真”、“伪”,通过分析下列叙述属于“真”的是
A.在铁、铅、金刚石三种金属材料中,硬度最大的是金刚石
B.使用天然气报警器时,应安装在厨房顶部
C.进入久未开启的菜窖之前,必须做灯火试验,是因为二氧化碳有毒
D.溶液是均一、稳定的,故均一、稳定的液体一定是溶液
10.甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度比乙小
B.将等质量甲、乙的两种溶液分别由t2℃降温至 t1℃,析出甲的质量一定比析出乙的质量大
C.t2℃时,甲的饱和溶液中溶质与溶液的质量比为1∶2
D.甲中混有少量乙时,可以采用冷却热的饱和溶液的方法提纯甲
11.下列物质的性质与用途对应关系不正确的是:
A.甲烷具有可燃性——作燃料 B.氮气无色味——食品保护气
C.金刚石硬度大——切割玻璃 D.洗洁精具有乳化作用——清洗油污
12.市场上有一种俗称“摇摇冰”的罐装饮料。在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动使它们混合,罐内饮料的温度就会降低。这种固体物质可能是
A.硝酸铵 B.氢氧化钠 C.食盐 D.白糖
13.控制变量是实验探究的重要方法。下列实验设计不能达到实验目的的是
A.探究锌、铁金属活动性强弱 B.探究可燃物燃烧的条件 C.探究物质在水中溶解时的能量变化 D.探究温度对分子 运动快慢的影响
A.A B.B C.C D.D
14.如图是氯化钠和硝酸钾的溶解度曲线,下列说法正确的是
A.KNO3的溶解度等于NaCl 的溶解度
B.t1℃时,100gKNO3的饱和溶液中含有溶质20g
C.t2℃时,将NaCl和KNO3的饱和溶液降温到t1℃,析出晶体的质量KNO3多
D.t1℃时,将等质量的KNO3和NaCl固体加水溶解配成饱和溶液,所得溶液的质量KNO3大
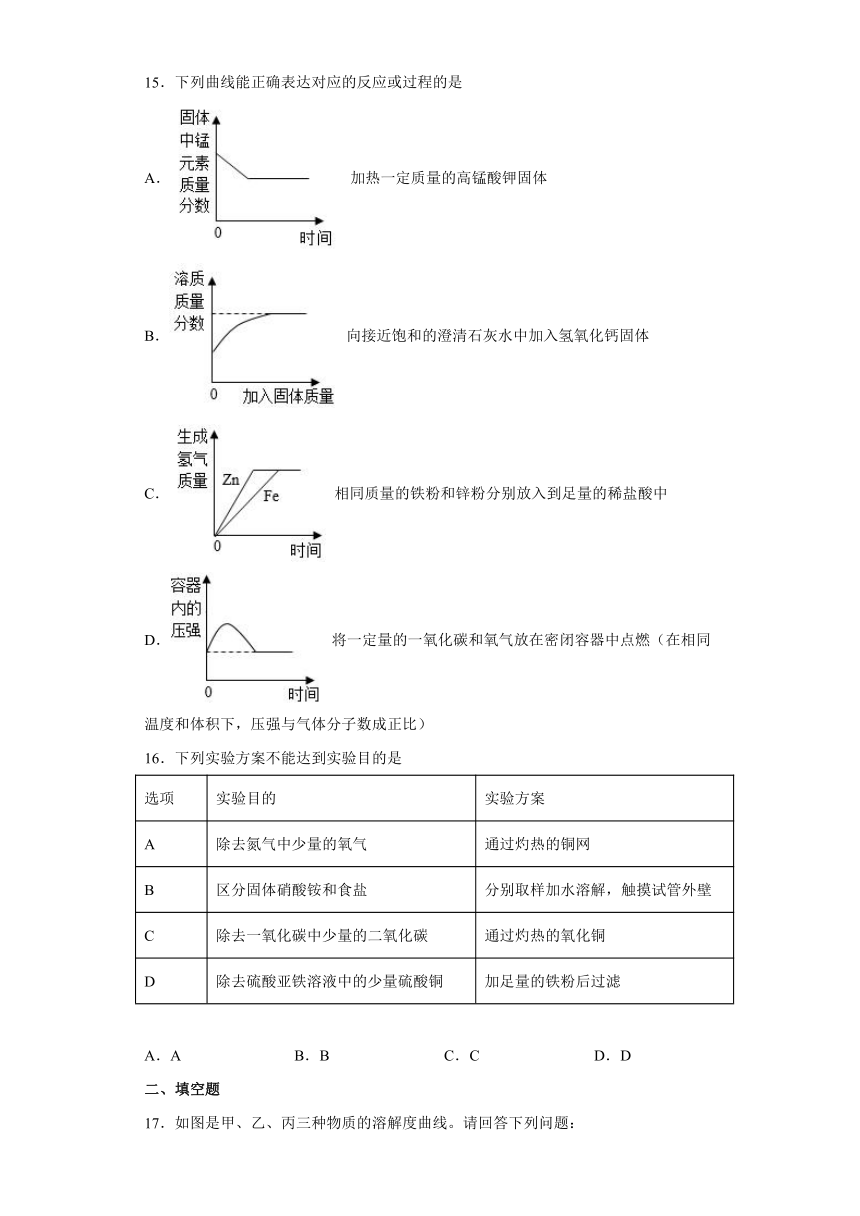
15.下列曲线能正确表达对应的反应或过程的是
A. 加热一定质量的高锰酸钾固体
B. 向接近饱和的澄清石灰水中加入氢氧化钙固体
C. 相同质量的铁粉和锌粉分别放入到足量的稀盐酸中
D. 将一定量的一氧化碳和氧气放在密闭容器中点燃(在相同温度和体积下,压强与气体分子数成正比)
16.下列实验方案不能达到实验目的是
选项 实验目的 实验方案
A 除去氮气中少量的氧气 通过灼热的铜网
B 区分固体硝酸铵和食盐 分别取样加水溶解,触摸试管外壁
C 除去一氧化碳中少量的二氧化碳 通过灼热的氧化铜
D 除去硫酸亚铁溶液中的少量硫酸铜 加足量的铁粉后过滤
A.A B.B C.C D.D
二、填空题
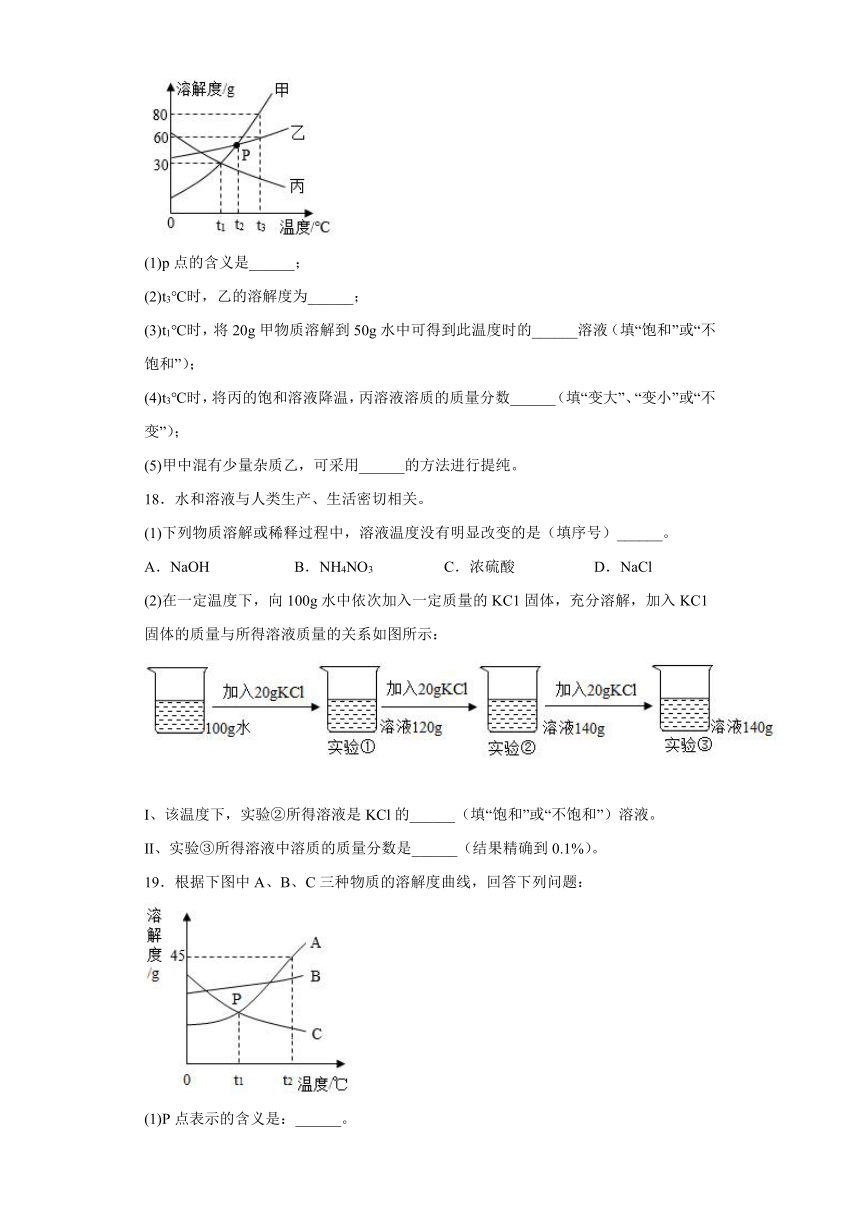
17.如图是甲、乙、丙三种物质的溶解度曲线。请回答下列问题:
(1)p点的含义是______;
(2)t3℃时,乙的溶解度为______;
(3)t1℃时,将20g甲物质溶解到50g水中可得到此温度时的______溶液(填“饱和”或“不饱和”);
(4)t3℃时,将丙的饱和溶液降温,丙溶液溶质的质量分数______(填“变大”、“变小”或“不变”);
(5)甲中混有少量杂质乙,可采用______的方法进行提纯。
18.水和溶液与人类生产、生活密切相关。
(1)下列物质溶解或稀释过程中,溶液温度没有明显改变的是(填序号)______。
A.NaOH B.NH4NO3 C.浓硫酸 D.NaCl
(2)在一定温度下,向100g水中依次加入一定质量的KC1固体,充分溶解,加入KC1固体的质量与所得溶液质量的关系如图所示:
Ⅰ、该温度下,实验②所得溶液是KCl的______(填“饱和”或“不饱和”)溶液。
Ⅱ、实验③所得溶液中溶质的质量分数是______(结果精确到0.1%)。
19.根据下图中A、B、C三种物质的溶解度曲线,回答下列问题:
(1)P点表示的含义是:______。
(2)t2℃时相同质量A、B、C三种物质的饱和溶液中溶剂质量大小顺序为______。
(3)将相同质量A、B两种饱和溶液分别从t2℃降温到t1℃时,析出晶体质量最多的是______。
(4)在t2℃时,把60gA物质加入100g水中,得到的溶液的总质量是______克。
(5)A物质中含有少量的B物质、要想提纯A物质、用什么方法______。
20.请用所学的化学知识回答下列问题:
(1)水稻种植前选种需用16%的氯化钠溶液,配制该溶液的步骤为:①计算;②称量;③____;④装瓶贴标签。配制200g溶质质量分数为16%的氯化钠溶液,需氯化钠____g,水______g;
(2)生活处处是学问,请从下列物质中选择相应的字母填空:A 氖气 B 干冰 C 氢气。这其中可用于人工降雨的是_______;可用作电光源的是_____;最理想的清洁能源是_______。
三、推断题
21.A~F是初中化学常见的物质,A是空气的主要成分,B常温下是液体,C是年产量最多的金属。它们之间的存在如图的转化关系。
(1)B的化学式为__________。
(2)E的一种用途是__________。
(3)反应①的基本反应类型为______________。
(4)反应①的化学方程式为______________。
22.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
23.以下是初中化学学习过程中的基本实验,请回答下列问题。
(1)实验Ⅰ,该实验的目的是__________;
(2)实验Ⅱ,过滤操作后,滤液仍浑浊的原因可能是__________(写一种即可);
(3)实验Ⅲ,水的作用是________(选填字母编号)
A.作反应物 B.隔绝空气 C.提供热量
(4)实验Ⅳ,称量一定质量氯化钠的过程中,若发现天平指针偏右,此时应该________(填字母编号),至指针指向标尺中央。
A.调节游码和砝码 B.调节平衡螺母 C.减少氯化钠固体 D.增加氯化钠固体
24.学生在开放实验室进行“配制70g20%的氯化钠溶液”的实验操作。该实验的部分操作如下图所示。
(1)需要称取氯化钠的质量是________,称量时A出现了右盘低的现象,接下来的操作应该是________。
①左边的平衡螺丝向左调②右边的平衡螺丝向右调③右盘中减少砝码④左盘中增加食盐
(2)B中仪器a的名称是________。量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数________ (填“偏大”或“偏小)。
(3)C中用玻璃棒搅拌的作用是________。
(4)D中所贴标签有不妥之处,请在方框中写出适合的内容________。
五、计算题
25.某同学配制50g溶质质量分数为10%的氯化钠溶液,请计算:
(1)需要固体氯化钠的质量为___________g;
(2)将50g溶质质量分数为10%的氯化钠溶液,稀释成5%的氯化钠溶液,需要加水的质量为___________g。
26.徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 剩余固体的质量
第一次加入10g 3.0g
第二次加入10g 2.0g
第三次加入10g 1.0g
第四次加入10g 0.4g
(1)4.0g石灰石样品中碳酸钙的质量是__________g。
(2)求稀盐酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
参考答案:
1.C 2.A 3.C 4.A 5.C 6.C 7.A 8.B 9.B 10.D 11.B 12.A 13.A 14.D 15.B 16.C 17.(1)t2℃时,甲、乙的溶解度相等
(2)60g(不带单位不给分)
(3)饱和
(4)不变
(5)降温结晶
18.(1)D
(2) 饱和 28.6%
实验③所得溶液中溶质质量为40g,溶液质量为140g,故实验③所得溶液中溶质的质量分数是:。
19.(1)在t1℃时,A、C两种物质的溶解度相等
(2) C>B> A
(3)A
(4)145
(5)冷却热饱和溶液
20.(1) 溶解 32 168
(2) B A C
21. H2O 灭火等 置换反应 Fe+2HCl=FeCl2+H2↑
22. CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
23.(1)测定空气里氧气含量
(2)滤纸破损、液面高于滤纸边缘
(3)BC
(4)D
24.(1) 14g ④
(2) 量筒 偏小
(3)加速溶解
(4)
25.(1)5
需要固体氯化钠的质量为:50g×10%=5g;
(2)50
解:设需要水的质量为x,稀释前后溶质质量不变
50g×10%=(50g+x)×5%,解得x=50g。
26.(1)3.6g
(2)设10g盐酸中HCl的质量为x
x=0.73g
稀盐酸的溶质质量分数为
答:稀盐酸的溶质质量分数为7.3%。
一、单选题
1.下列少量物质分散到水中,能形成无色透明溶液的是
A.冰块 B.芝麻油 C.酒精 D.硫酸铜
2.下列说法正确的是
A.恒温蒸发可使接近饱和的硝酸钾溶液变为饱和
B.双氧水在二氧化锰催化下才能产生氧气
C.可燃物的温度达到其着火点即可燃烧
D.汽油在清洗油污过程中起乳化作用
3.下列有关水与溶液的说法错误的是
A.电解水实验说明水是由氢元素和氧元素组成的
B.农药、化肥不合理使用,会造成水体污染
C.饱和溶液就是不能再溶解任何物质的溶液
D.天然淡水生产自来水需要经过沉降、过滤、吸附、杀菌消毒等净化过程
4.下列关于氧气的说法中错误的是
A.氧气可以支持燃烧,说明氧气具有可燃性
B.工业上可以利用分离液态空气法制氧气
C.氧气能供给呼吸,它和体内物质反应,维持生命活动
D.鱼池内开启增氧泵,是因为温度升高,氧气在水中溶解量减少
5.下列有关水的认识正确的是
A.氢气在氧气中点燃生成水,可知水是由氢气和氧气组成
B.生活中用过滤的方法可以降低水的硬度
C.净化水的方法有沉降、过滤、吸附、蒸馏
D.氯化钠、泥沙、汽油加入一定量水中都能形成溶液
6.唐代刘禹锡撰于公元818年的《传信方》中有这样一段描述“治气痢巴石丸,取白矾一大斤,以炭火净地烧令汁尽,则其色如雪,谓之巴石”据此推测,用于治气痢的巴石丸,其主要原料的化学成分为
A.CuSO4 B.FeSO4·7H2O
C.KAl(SO4)2·12H2O D.Fe2(SO4)3·9H2O
7.区别下列各组物质,试剂或操作选择不当的是
物质 试剂或操作
A CO和CH4 点燃,观察火焰颜色
B NaOH和NH4NO3 水
C 硬水和软水 肥皂水
D 黄铜和铜 相互刻画,比较硬度
A.A B.B C.C D.D
8.进行粗盐提纯实验并将制得的精盐配制20%的氯化钠谘液50g,部分操作如图所示,正确的是
A.过滤 B.称固体
C.量取水 D.写标签
9.学习科学知识可以用来辨别“真”、“伪”,通过分析下列叙述属于“真”的是
A.在铁、铅、金刚石三种金属材料中,硬度最大的是金刚石
B.使用天然气报警器时,应安装在厨房顶部
C.进入久未开启的菜窖之前,必须做灯火试验,是因为二氧化碳有毒
D.溶液是均一、稳定的,故均一、稳定的液体一定是溶液
10.甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度比乙小
B.将等质量甲、乙的两种溶液分别由t2℃降温至 t1℃,析出甲的质量一定比析出乙的质量大
C.t2℃时,甲的饱和溶液中溶质与溶液的质量比为1∶2
D.甲中混有少量乙时,可以采用冷却热的饱和溶液的方法提纯甲
11.下列物质的性质与用途对应关系不正确的是:
A.甲烷具有可燃性——作燃料 B.氮气无色味——食品保护气
C.金刚石硬度大——切割玻璃 D.洗洁精具有乳化作用——清洗油污
12.市场上有一种俗称“摇摇冰”的罐装饮料。在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动使它们混合,罐内饮料的温度就会降低。这种固体物质可能是
A.硝酸铵 B.氢氧化钠 C.食盐 D.白糖
13.控制变量是实验探究的重要方法。下列实验设计不能达到实验目的的是
A.探究锌、铁金属活动性强弱 B.探究可燃物燃烧的条件 C.探究物质在水中溶解时的能量变化 D.探究温度对分子 运动快慢的影响
A.A B.B C.C D.D
14.如图是氯化钠和硝酸钾的溶解度曲线,下列说法正确的是
A.KNO3的溶解度等于NaCl 的溶解度
B.t1℃时,100gKNO3的饱和溶液中含有溶质20g
C.t2℃时,将NaCl和KNO3的饱和溶液降温到t1℃,析出晶体的质量KNO3多
D.t1℃时,将等质量的KNO3和NaCl固体加水溶解配成饱和溶液,所得溶液的质量KNO3大
15.下列曲线能正确表达对应的反应或过程的是
A. 加热一定质量的高锰酸钾固体
B. 向接近饱和的澄清石灰水中加入氢氧化钙固体
C. 相同质量的铁粉和锌粉分别放入到足量的稀盐酸中
D. 将一定量的一氧化碳和氧气放在密闭容器中点燃(在相同温度和体积下,压强与气体分子数成正比)
16.下列实验方案不能达到实验目的是
选项 实验目的 实验方案
A 除去氮气中少量的氧气 通过灼热的铜网
B 区分固体硝酸铵和食盐 分别取样加水溶解,触摸试管外壁
C 除去一氧化碳中少量的二氧化碳 通过灼热的氧化铜
D 除去硫酸亚铁溶液中的少量硫酸铜 加足量的铁粉后过滤
A.A B.B C.C D.D
二、填空题
17.如图是甲、乙、丙三种物质的溶解度曲线。请回答下列问题:
(1)p点的含义是______;
(2)t3℃时,乙的溶解度为______;
(3)t1℃时,将20g甲物质溶解到50g水中可得到此温度时的______溶液(填“饱和”或“不饱和”);
(4)t3℃时,将丙的饱和溶液降温,丙溶液溶质的质量分数______(填“变大”、“变小”或“不变”);
(5)甲中混有少量杂质乙,可采用______的方法进行提纯。
18.水和溶液与人类生产、生活密切相关。
(1)下列物质溶解或稀释过程中,溶液温度没有明显改变的是(填序号)______。
A.NaOH B.NH4NO3 C.浓硫酸 D.NaCl
(2)在一定温度下,向100g水中依次加入一定质量的KC1固体,充分溶解,加入KC1固体的质量与所得溶液质量的关系如图所示:
Ⅰ、该温度下,实验②所得溶液是KCl的______(填“饱和”或“不饱和”)溶液。
Ⅱ、实验③所得溶液中溶质的质量分数是______(结果精确到0.1%)。
19.根据下图中A、B、C三种物质的溶解度曲线,回答下列问题:
(1)P点表示的含义是:______。
(2)t2℃时相同质量A、B、C三种物质的饱和溶液中溶剂质量大小顺序为______。
(3)将相同质量A、B两种饱和溶液分别从t2℃降温到t1℃时,析出晶体质量最多的是______。
(4)在t2℃时,把60gA物质加入100g水中,得到的溶液的总质量是______克。
(5)A物质中含有少量的B物质、要想提纯A物质、用什么方法______。
20.请用所学的化学知识回答下列问题:
(1)水稻种植前选种需用16%的氯化钠溶液,配制该溶液的步骤为:①计算;②称量;③____;④装瓶贴标签。配制200g溶质质量分数为16%的氯化钠溶液,需氯化钠____g,水______g;
(2)生活处处是学问,请从下列物质中选择相应的字母填空:A 氖气 B 干冰 C 氢气。这其中可用于人工降雨的是_______;可用作电光源的是_____;最理想的清洁能源是_______。
三、推断题
21.A~F是初中化学常见的物质,A是空气的主要成分,B常温下是液体,C是年产量最多的金属。它们之间的存在如图的转化关系。
(1)B的化学式为__________。
(2)E的一种用途是__________。
(3)反应①的基本反应类型为______________。
(4)反应①的化学方程式为______________。
22.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
23.以下是初中化学学习过程中的基本实验,请回答下列问题。
(1)实验Ⅰ,该实验的目的是__________;
(2)实验Ⅱ,过滤操作后,滤液仍浑浊的原因可能是__________(写一种即可);
(3)实验Ⅲ,水的作用是________(选填字母编号)
A.作反应物 B.隔绝空气 C.提供热量
(4)实验Ⅳ,称量一定质量氯化钠的过程中,若发现天平指针偏右,此时应该________(填字母编号),至指针指向标尺中央。
A.调节游码和砝码 B.调节平衡螺母 C.减少氯化钠固体 D.增加氯化钠固体
24.学生在开放实验室进行“配制70g20%的氯化钠溶液”的实验操作。该实验的部分操作如下图所示。
(1)需要称取氯化钠的质量是________,称量时A出现了右盘低的现象,接下来的操作应该是________。
①左边的平衡螺丝向左调②右边的平衡螺丝向右调③右盘中减少砝码④左盘中增加食盐
(2)B中仪器a的名称是________。量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数________ (填“偏大”或“偏小)。
(3)C中用玻璃棒搅拌的作用是________。
(4)D中所贴标签有不妥之处,请在方框中写出适合的内容________。
五、计算题
25.某同学配制50g溶质质量分数为10%的氯化钠溶液,请计算:
(1)需要固体氯化钠的质量为___________g;
(2)将50g溶质质量分数为10%的氯化钠溶液,稀释成5%的氯化钠溶液,需要加水的质量为___________g。
26.徐州地区石灰石资源丰富。某化学兴趣小组称取4.0g石灰石样品,把40g稀盐酸分4次加入样品中(假设杂质不反应也不溶解),得实验数据如下:
稀盐酸的用量 剩余固体的质量
第一次加入10g 3.0g
第二次加入10g 2.0g
第三次加入10g 1.0g
第四次加入10g 0.4g
(1)4.0g石灰石样品中碳酸钙的质量是__________g。
(2)求稀盐酸的溶质质量分数。(写出计算过程,结果精确到0.1%)
参考答案:
1.C 2.A 3.C 4.A 5.C 6.C 7.A 8.B 9.B 10.D 11.B 12.A 13.A 14.D 15.B 16.C 17.(1)t2℃时,甲、乙的溶解度相等
(2)60g(不带单位不给分)
(3)饱和
(4)不变
(5)降温结晶
18.(1)D
(2) 饱和 28.6%
实验③所得溶液中溶质质量为40g,溶液质量为140g,故实验③所得溶液中溶质的质量分数是:。
19.(1)在t1℃时,A、C两种物质的溶解度相等
(2) C>B> A
(3)A
(4)145
(5)冷却热饱和溶液
20.(1) 溶解 32 168
(2) B A C
21. H2O 灭火等 置换反应 Fe+2HCl=FeCl2+H2↑
22. CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
23.(1)测定空气里氧气含量
(2)滤纸破损、液面高于滤纸边缘
(3)BC
(4)D
24.(1) 14g ④
(2) 量筒 偏小
(3)加速溶解
(4)
25.(1)5
需要固体氯化钠的质量为:50g×10%=5g;
(2)50
解:设需要水的质量为x,稀释前后溶质质量不变
50g×10%=(50g+x)×5%,解得x=50g。
26.(1)3.6g
(2)设10g盐酸中HCl的质量为x
x=0.73g
稀盐酸的溶质质量分数为
答:稀盐酸的溶质质量分数为7.3%。
同课章节目录
