第十一单元课题1第3课时复分解反应的条件-2020-2021学年九年级化学人教版下册(32张PPT)
文档属性
| 名称 | 第十一单元课题1第3课时复分解反应的条件-2020-2021学年九年级化学人教版下册(32张PPT) |
|
|
| 格式 | pptx | ||
| 文件大小 | 9.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-22 11:23:16 | ||
图片预览




文档简介
(共32张PPT)
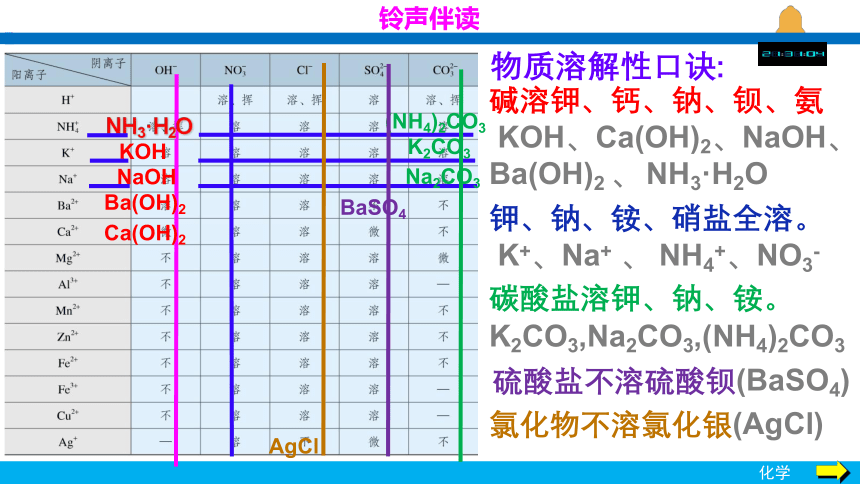
铃声伴读
NaOH
Ba(OH)2
Ca(OH)2
NH3·H2O
KOH
K2CO3
Na2CO3
(NH4)2CO3
BaSO4
AgCl
物质溶解性口诀:
氯化物不溶氯化银(AgCl)
碱溶钾、钙、钠、钡、氨
KOH、Ca(OH)2、NaOH、Ba(OH)2 、 NH3·H2O
钾、钠、铵、硝盐全溶。
K+、Na+ 、 NH4+、NO3-
碳酸盐溶钾、钠、铵。
K2CO3,Na2CO3,(NH4)2CO3
硫酸盐不溶硫酸钡(BaSO4)
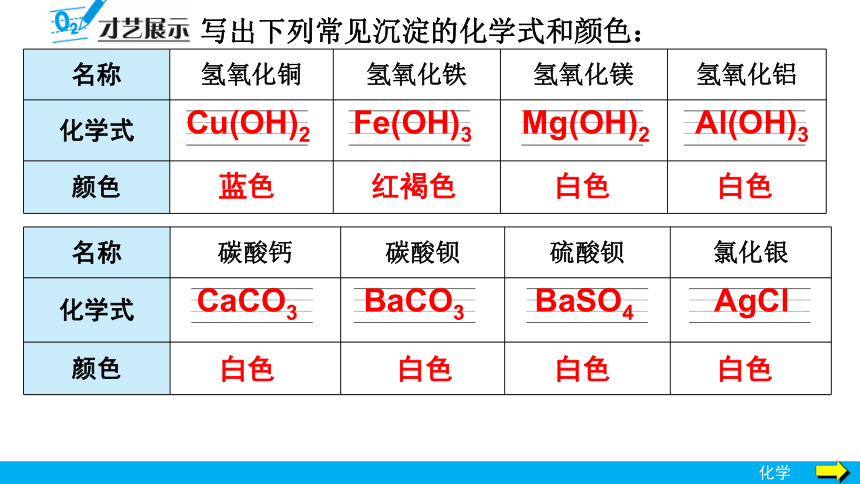
写出下列常见沉淀的化学式和颜色:
名称 氢氧化铜 氢氧化铁 氢氧化镁 氢氧化铝
化学式
颜色
名称 碳酸钙 碳酸钡 硫酸钡 氯化银
化学式
颜色
Cu(OH)2
Fe(OH)3
Mg(OH)2
Al(OH)3
CaCO3
BaCO3
BaSO4
AgCl
蓝色
红褐色
白色
白色
白色
白色
白色
白色
第十一单元 盐 化肥
课题1 生活中常见的盐
第3课时 复分解反应发生的条件
1.了解复分解反应发生的条件,会运用复分解反应的条件判断
反应是否发生;
2.理解复分解反应的微观实质,会根据离子判断物质是否能
共存。
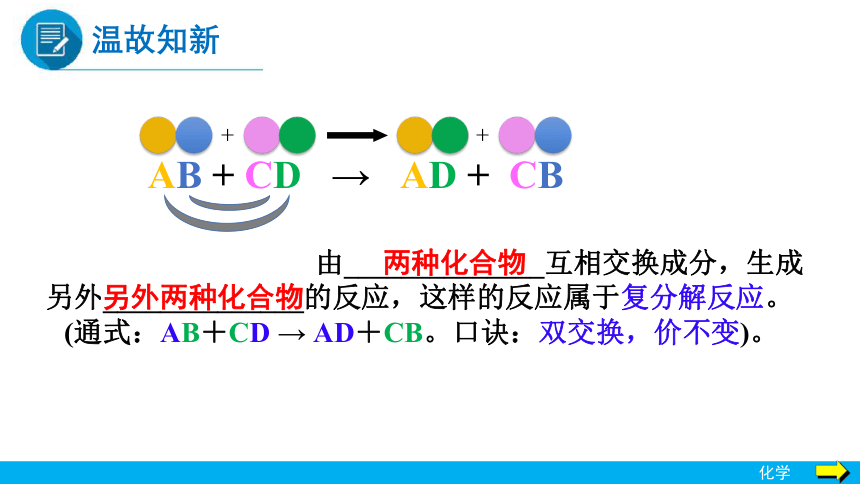
+
+
AB + CD → AD + CB
由______________互相交换成分,生成另外______________的反应,这样的反应属于复分解反应。
(通式:AB+CD → AD+CB。口诀:双交换,价不变)。
另外两种化合物
两种化合物
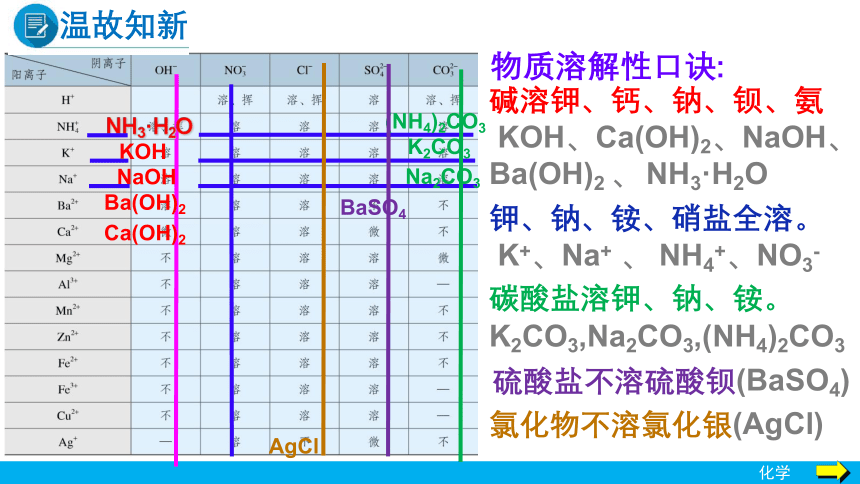
温故知新
NaOH
Ba(OH)2
Ca(OH)2
NH3·H2O
KOH
K2CO3
Na2CO3
(NH4)2CO3
BaSO4
AgCl
物质溶解性口诀:
氯化物不溶氯化银(AgCl)
碱溶钾、钙、钠、钡、氨
KOH、Ca(OH)2、NaOH、Ba(OH)2 、 NH3·H2O
钾、钠、铵、硝盐全溶。
K+、Na+ 、 NH4+、NO3-
碳酸盐溶钾、钠、铵。
K2CO3,Na2CO3,(NH4)2CO3
硫酸盐不溶硫酸钡(BaSO4)
温故知新
各学习小组任务:
交流学习
小组长随机抽取卡片,组员由学号从小到大,先判断物质是否溶于水,再从口诀中说出判断的依据,每个组员要回答3张,有错误的,其它组员纠正。
蓝色为组长
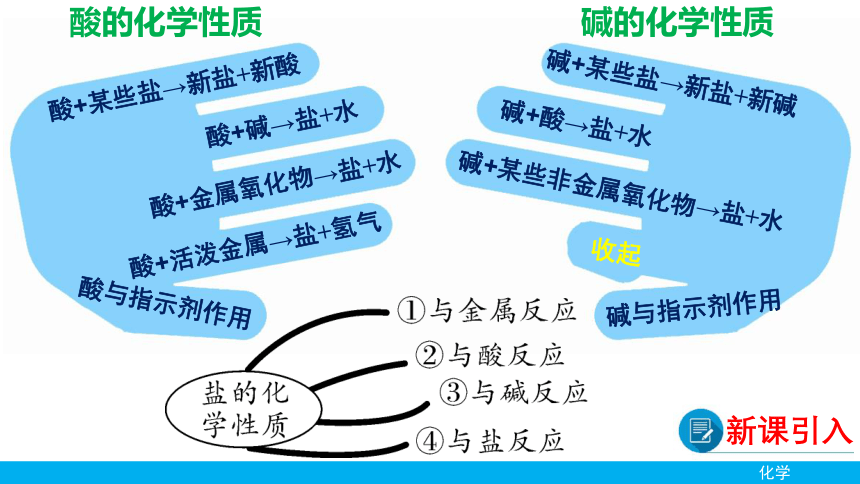
酸与指示剂作用
酸+活泼金属→盐+氢气
酸+金属氧化物→盐+水
酸+碱→盐+水
酸+某些盐→新盐+新酸
碱与指示剂作用
收起
碱+某些非金属氧化物→盐+水
碱+酸→盐+水
碱+某些盐→新盐+新碱
酸的化学性质
碱的化学性质
新课引入
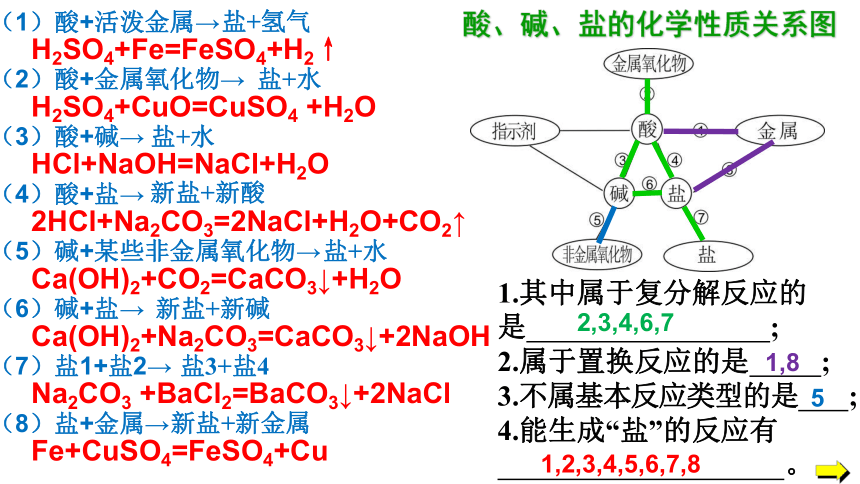
2HCl+Na2CO3=2NaCl+H2O+CO2↑
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Na2CO3 +BaCl2=BaCO3↓+2NaCl
H2SO4+Fe=FeSO4+H2↑
Fe+CuSO4=FeSO4+Cu
Ca(OH)2+CO2=CaCO3↓+H2O
(1)酸+活泼金属→
(2)酸+金属氧化物→
(3)酸+碱→
(4)酸+盐→
(5)碱+某些非金属氧化物→
(6)碱+盐→
(7)盐1+盐2→
(8)盐+金属→
H2SO4+CuO=CuSO4 +H2O
HCl+NaOH=NaCl+H2O
1.其中属于复分解反应的
是 ;
2.属于置换反应的是 ;
3.不属基本反应类型的是 ;
4.能生成“盐”的反应有
。
酸、碱、盐的化学性质关系图
盐+氢气
盐+水
盐+水
新盐+新酸
盐+水
新盐+新碱
盐3+盐4
新盐+新金属
2,3,4,6,7
1,8
5
1,2,3,4,5,6,7,8
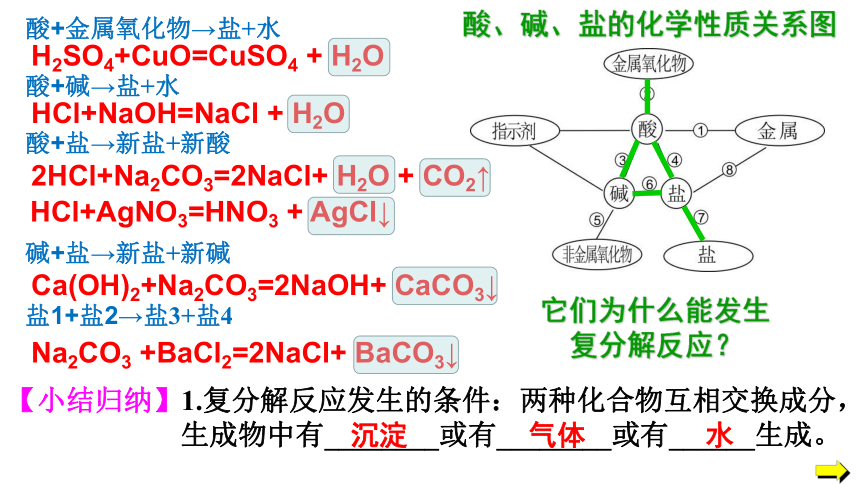
2HCl+Na2CO3=2NaCl+ H2O + CO2↑
Ca(OH)2+Na2CO3=2NaOH+ CaCO3↓
Na2CO3 +BaCl2=2NaCl+ BaCO3↓
酸+金属氧化物→盐+水
酸+碱→盐+水
酸+盐→新盐+新酸
碱+盐→新盐+新碱
盐1+盐2→盐3+盐4
H2SO4+CuO=CuSO4 + H2O
HCl+NaOH=NaCl + H2O
酸、碱、盐的化学性质关系图
HCl+AgNO3=HNO3 + AgCl↓
【小结归纳】1.复分解反应发生的条件:两种化合物互相交换成分,
生成物中有________或有________或有______生成。
水
沉淀
气体
它们为什么能发生
复分解反应?
2.复分解反应的其他规律和附加条件
(1)酸和碱、酸和金属氧化物、酸和碳酸盐或碳酸氢盐,必发生复
分解反应。
(2)酸+金属氧化物→盐+水
(1)酸+碱→盐+水
(3)酸+碳酸盐(碳酸氢盐)→CO2↑
发生复分解反应
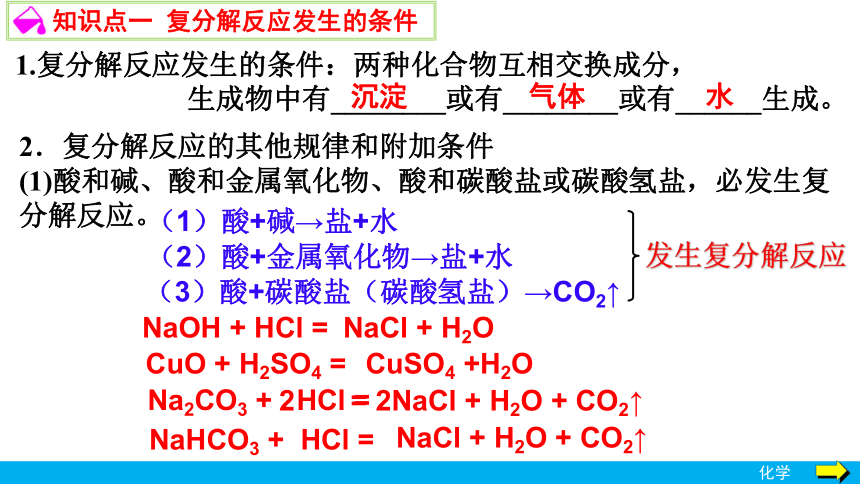
NaOH + HCl =
NaCl + H2O
CuO + H2SO4 =
CuSO4 +H2O
Na2CO3 + HCl =
2 = 2NaCl + H2O + CO2↑
NaHCO3 + HCl =
NaCl + H2O + CO2↑
知识点一 复分解反应发生的条件
1.复分解反应发生的条件:两种化合物互相交换成分,
生成物中有________或有________或有______生成。
水
沉淀
气体
2.复分解反应的其他规律和附加条件
(1)酸和碱、酸和金属氧化物、酸和碳酸盐或碳酸氢盐,必发生复
分解反应。
(2)酸+金属氧化物→盐+水
(1)酸+碱→盐+水
(3)酸+碳酸盐(碳酸氢盐)→CO2↑
(2)AgCl、BaSO4不溶于水,也不溶于酸,不能发生复分解反应。
(3)附加条件:盐和碱反应、盐和盐反应,还需要满足两者都要
溶于水的条件(口诀:无酸参加都要可溶)。
BaCO3+Ca(OH)2 → CaCO3 ↓+Ba(OH)2
×
不溶
发生复分解反应
判断稀硫酸和表中的四种化合物溶液之间是否能发生反应,并说明你判断的依据。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸 H2SO4
判断 依据
反应
不反应
反应
反应
有水生成
交换成分,没有沉淀或气体或水生成
有气体和水生成
有沉淀生成
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+ NaOH:
H2SO4+NaCl:
H2SO4+K2CO3:
H2SO4+Ba(NO3)2:
不反应
H2SO4+K2CO3=K2SO4+H2O+CO2 ↑
H2SO4+Ba(NO3)2=BaSO4 ↓+2HNO3
依 据 口 头 表 达 即 可
判断稀硫酸和表中的四种化合物溶液之间是否能发生反应,并说明你判断的依据。
【思考】其中能反应,但无明显现象的是___________________。设计实验证明你的判断:___________________________________
_______________________________________________________。
稀硫酸和NaOH溶液
向滴有酚酞溶液的氢氧化钠溶液中逐
滴加入稀硫酸,溶液由红色变为无色,证明能发生反应
H2SO4+2NaOH=Na2SO4+2H2O
不反应
H2SO4+K2CO3=K2SO4+H2O+CO2 ↑
H2SO4+Ba(NO3)2=BaSO4 ↓+2HNO3
1.判断下列物质间能否发生复分解反应。若能,写出化学方程式,若不能,说明理由。
(1)HNO3+Ca(OH)2:__________________________________。
(2)BaCO3+HCl:_____________________________________。
(3)Al2O3+H2SO4:____________________________________。
(4)CaCO3+Ba(OH)2:_________________________________。
(5)Na2SO4+Ba(NO3)2:____________________________________。
2HNO3+Ca(OH)2= Ca(NO3)2+2H2O
BaCO3+2HCl = BaCl2+CO2↑+H2O
Al2O3+3H2SO4 = Al2(SO4)3+3H2O
不能反应,因为CaCO3不溶于水
Na2SO4+Ba(NO3)2 = BaSO4↓+2NaNO3
H2SO4+NaCl→Na2SO4+HCl
稀硫酸和氯化钠溶液为何不能发生复分解反应呢?
混合前的离子:
H+、SO42-、
混合后的离子:
Na+、Cl-
+
H+、SO42-、
Na+、Cl-
微观角度:混合前后离子的种类、数目都没有改变,
即没有成功交换成分。
宏观角度:假设交换成分,但没有沉淀或气体或水生成,
所以,不能发生复分解反应。
×
知识点二 从微观角度看复分解反应的实质
完成下列反应的有关问题。
举例 稀盐酸和氢氧化钠反应 稀盐酸与碳酸钠反应 硫酸铜和氢氧化钠反应
化学方程式
反应过程的 微观示意图
反应的实质
“旁观”离子
HCl+NaOH
=NaCl+H2O
Na2CO3+2HCl
=2NaCl+H2O+CO2↑
CuSO4+2NaOH
=Cu(OH)2↓+Na2SO4
H++OH-=H2O
CO32-+2H+
= CO2↑+H2O
Cu2++2OH-
= Cu(OH)2↓
Na+、Cl-
Na+、Cl-
Na+、SO42-
举例 稀盐酸和氢氧化钠反应 稀盐酸与碳酸钠反应 硫酸铜和氢氧化钠反应
反应的化学 方程式
反应过程的 微观图
反应的实质
HCl+NaOH
=NaCl+H2O
Na2CO3+2HCl
=2NaCl+H2O+CO2↑
CuSO4+2NaOH
=Cu(OH)2↓+Na2SO4
H++OH-=H2O
CO32-+2H+
= CO2↑+H2O
Cu2++2OH-
= Cu(OH)2↓
【小结归纳】酸碱盐之间发生的复分解反应的实质是________之
间的反应,两种离子之间如果能结合生成________或放出
________或生成的________,反应就能发生。
水
离子
沉淀
气体
教师点拨 初中阶段常见的不能共存的离子:(即发生反应)
H++OH-=H2O
CO32-+2H+= CO2↑+H2O
Cu2++2OH-= Cu(OH)2↓
(2)生成气体(CO2或NH3)的离子对:
OH-
(1)生成水的离子对:
CO2↑+H2O
CO2↑+H2O
H+
CO32-
HCO3-
→ NH3 ↑ +H2O
OH-
NH4+
H+
H2O
→
→
→
教师点拨 初中阶段常见的不能共存的离子:(即发生反应)
CaCO3↓
OH-
Mg2+
Cu2+
Al3+
Fe3+
→Cu(OH)2↓
BaSO4↓
AgCl↓
BaCO3↓
Ba2+
SO42-
Ca2+
CO32-
Ba2+
Ag+
Cl-
→Fe(OH)3 ↓
→Al(OH)3 ↓
→Mg(OH)2↓
→
→
→
→
(3)生成沉淀的离子对:(八大沉淀)
离子之间的反应
(1)生成水:H++OH-= (中和反应)
(2)生成气体:2H++CO32-=___________
H++HCO3-=___________ NH4++OH- =___________
(3)生成沉淀:Ag++Cl- = AgCl↓
Ba2++SO42-=___________
Ca2++CO32- =___________
Ba2++CO32-=___________ Mg2++2OH- =___________
Al3++3OH- = ___________
Fe3++3OH- = ( 色沉淀)
Cu2++2OH- = ( 色沉淀)
BaSO4↓
BaCO3↓
CaCO3↓
Cu(OH)2↓
Fe(OH)3↓
Mg(OH)2↓
H2O+CO2↑
H2O+NH3↑
H2O
蓝
红褐
H2O+CO2↑
Al(OH)3↓
2.下列各组离子能够在水溶液中共存的是( )
A.Ca2+ K+ NO3- CO32-
B.Na+ Ba2+ OH- Cl-
C.Na+ H+ CO32- SO42-
D.H+ Na+ OH- NO3-
B
导学案P193 对点训练第3题
3.能在同一溶液中大量共存,且溶液无色透明的一组物质
是( )
A.Fe2(SO4)3、NaCl、Zn(NO3)2
B.MgCl2、Na2SO4、NaOH
C.CaCl2、NaNO3、Ba(NO3)2
D.H2SO4、NaNO3、NaHCO3
C
导学案P193 自我提升 第3题
复分解反应
复分解反应的概念、特点、发生条件及类型。
物质(或离子)的共存。
复分解反应的微观实质。
学习完酸、碱、盐后每个人都有的梦想
学习完酸、碱、盐后每个人都有的梦想
学习完酸、碱、盐后每个人都有的梦想
学习完酸、碱、盐后每个人都有的梦想
学习完酸、碱、盐后我的梦想设计是什么?
1.下列各组物质的溶液混合后,能发生反应,但无明显现象
的是( )
A.CuCl2和KOH B.NaOH和HCl
C.NaNO3和KCl D.Ca(OH)2和Na2CO3
2.向某溶液中先滴加稀盐酸,无现象,再滴加氯化钡溶液,有白色沉淀产生,则该溶液中( )
A.一定含有SO42- B.一定含有Ag+
C.一定含有CO32- D.一定含有Ag+或SO42-
B
A
自我提升
3.有四瓶溶液,分别是Na2CO3溶液、BaCl2溶液、稀硫酸、
K2SO4溶液,其中有一种溶液与其他三种溶液都能反应,
这种溶液是( )
A.Na2CO3溶液 B.BaCl2溶液
C.稀硫酸 D.K2SO4溶液
4.现有Fe、CuO、稀H2SO4、NaOH溶液、CuSO4溶液、MgSO4溶液六种物质,两两混合后常温下共能发生______个反应,其中属于复分解反应的有____个。
B
6
4
铃声伴读
NaOH
Ba(OH)2
Ca(OH)2
NH3·H2O
KOH
K2CO3
Na2CO3
(NH4)2CO3
BaSO4
AgCl
物质溶解性口诀:
氯化物不溶氯化银(AgCl)
碱溶钾、钙、钠、钡、氨
KOH、Ca(OH)2、NaOH、Ba(OH)2 、 NH3·H2O
钾、钠、铵、硝盐全溶。
K+、Na+ 、 NH4+、NO3-
碳酸盐溶钾、钠、铵。
K2CO3,Na2CO3,(NH4)2CO3
硫酸盐不溶硫酸钡(BaSO4)
写出下列常见沉淀的化学式和颜色:
名称 氢氧化铜 氢氧化铁 氢氧化镁 氢氧化铝
化学式
颜色
名称 碳酸钙 碳酸钡 硫酸钡 氯化银
化学式
颜色
Cu(OH)2
Fe(OH)3
Mg(OH)2
Al(OH)3
CaCO3
BaCO3
BaSO4
AgCl
蓝色
红褐色
白色
白色
白色
白色
白色
白色
第十一单元 盐 化肥
课题1 生活中常见的盐
第3课时 复分解反应发生的条件
1.了解复分解反应发生的条件,会运用复分解反应的条件判断
反应是否发生;
2.理解复分解反应的微观实质,会根据离子判断物质是否能
共存。
+
+
AB + CD → AD + CB
由______________互相交换成分,生成另外______________的反应,这样的反应属于复分解反应。
(通式:AB+CD → AD+CB。口诀:双交换,价不变)。
另外两种化合物
两种化合物
温故知新
NaOH
Ba(OH)2
Ca(OH)2
NH3·H2O
KOH
K2CO3
Na2CO3
(NH4)2CO3
BaSO4
AgCl
物质溶解性口诀:
氯化物不溶氯化银(AgCl)
碱溶钾、钙、钠、钡、氨
KOH、Ca(OH)2、NaOH、Ba(OH)2 、 NH3·H2O
钾、钠、铵、硝盐全溶。
K+、Na+ 、 NH4+、NO3-
碳酸盐溶钾、钠、铵。
K2CO3,Na2CO3,(NH4)2CO3
硫酸盐不溶硫酸钡(BaSO4)
温故知新
各学习小组任务:
交流学习
小组长随机抽取卡片,组员由学号从小到大,先判断物质是否溶于水,再从口诀中说出判断的依据,每个组员要回答3张,有错误的,其它组员纠正。
蓝色为组长
酸与指示剂作用
酸+活泼金属→盐+氢气
酸+金属氧化物→盐+水
酸+碱→盐+水
酸+某些盐→新盐+新酸
碱与指示剂作用
收起
碱+某些非金属氧化物→盐+水
碱+酸→盐+水
碱+某些盐→新盐+新碱
酸的化学性质
碱的化学性质
新课引入
2HCl+Na2CO3=2NaCl+H2O+CO2↑
Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
Na2CO3 +BaCl2=BaCO3↓+2NaCl
H2SO4+Fe=FeSO4+H2↑
Fe+CuSO4=FeSO4+Cu
Ca(OH)2+CO2=CaCO3↓+H2O
(1)酸+活泼金属→
(2)酸+金属氧化物→
(3)酸+碱→
(4)酸+盐→
(5)碱+某些非金属氧化物→
(6)碱+盐→
(7)盐1+盐2→
(8)盐+金属→
H2SO4+CuO=CuSO4 +H2O
HCl+NaOH=NaCl+H2O
1.其中属于复分解反应的
是 ;
2.属于置换反应的是 ;
3.不属基本反应类型的是 ;
4.能生成“盐”的反应有
。
酸、碱、盐的化学性质关系图
盐+氢气
盐+水
盐+水
新盐+新酸
盐+水
新盐+新碱
盐3+盐4
新盐+新金属
2,3,4,6,7
1,8
5
1,2,3,4,5,6,7,8
2HCl+Na2CO3=2NaCl+ H2O + CO2↑
Ca(OH)2+Na2CO3=2NaOH+ CaCO3↓
Na2CO3 +BaCl2=2NaCl+ BaCO3↓
酸+金属氧化物→盐+水
酸+碱→盐+水
酸+盐→新盐+新酸
碱+盐→新盐+新碱
盐1+盐2→盐3+盐4
H2SO4+CuO=CuSO4 + H2O
HCl+NaOH=NaCl + H2O
酸、碱、盐的化学性质关系图
HCl+AgNO3=HNO3 + AgCl↓
【小结归纳】1.复分解反应发生的条件:两种化合物互相交换成分,
生成物中有________或有________或有______生成。
水
沉淀
气体
它们为什么能发生
复分解反应?
2.复分解反应的其他规律和附加条件
(1)酸和碱、酸和金属氧化物、酸和碳酸盐或碳酸氢盐,必发生复
分解反应。
(2)酸+金属氧化物→盐+水
(1)酸+碱→盐+水
(3)酸+碳酸盐(碳酸氢盐)→CO2↑
发生复分解反应
NaOH + HCl =
NaCl + H2O
CuO + H2SO4 =
CuSO4 +H2O
Na2CO3 + HCl =
2 = 2NaCl + H2O + CO2↑
NaHCO3 + HCl =
NaCl + H2O + CO2↑
知识点一 复分解反应发生的条件
1.复分解反应发生的条件:两种化合物互相交换成分,
生成物中有________或有________或有______生成。
水
沉淀
气体
2.复分解反应的其他规律和附加条件
(1)酸和碱、酸和金属氧化物、酸和碳酸盐或碳酸氢盐,必发生复
分解反应。
(2)酸+金属氧化物→盐+水
(1)酸+碱→盐+水
(3)酸+碳酸盐(碳酸氢盐)→CO2↑
(2)AgCl、BaSO4不溶于水,也不溶于酸,不能发生复分解反应。
(3)附加条件:盐和碱反应、盐和盐反应,还需要满足两者都要
溶于水的条件(口诀:无酸参加都要可溶)。
BaCO3+Ca(OH)2 → CaCO3 ↓+Ba(OH)2
×
不溶
发生复分解反应
判断稀硫酸和表中的四种化合物溶液之间是否能发生反应,并说明你判断的依据。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
稀硫酸 H2SO4
判断 依据
反应
不反应
反应
反应
有水生成
交换成分,没有沉淀或气体或水生成
有气体和水生成
有沉淀生成
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4+ NaOH:
H2SO4+NaCl:
H2SO4+K2CO3:
H2SO4+Ba(NO3)2:
不反应
H2SO4+K2CO3=K2SO4+H2O+CO2 ↑
H2SO4+Ba(NO3)2=BaSO4 ↓+2HNO3
依 据 口 头 表 达 即 可
判断稀硫酸和表中的四种化合物溶液之间是否能发生反应,并说明你判断的依据。
【思考】其中能反应,但无明显现象的是___________________。设计实验证明你的判断:___________________________________
_______________________________________________________。
稀硫酸和NaOH溶液
向滴有酚酞溶液的氢氧化钠溶液中逐
滴加入稀硫酸,溶液由红色变为无色,证明能发生反应
H2SO4+2NaOH=Na2SO4+2H2O
不反应
H2SO4+K2CO3=K2SO4+H2O+CO2 ↑
H2SO4+Ba(NO3)2=BaSO4 ↓+2HNO3
1.判断下列物质间能否发生复分解反应。若能,写出化学方程式,若不能,说明理由。
(1)HNO3+Ca(OH)2:__________________________________。
(2)BaCO3+HCl:_____________________________________。
(3)Al2O3+H2SO4:____________________________________。
(4)CaCO3+Ba(OH)2:_________________________________。
(5)Na2SO4+Ba(NO3)2:____________________________________。
2HNO3+Ca(OH)2= Ca(NO3)2+2H2O
BaCO3+2HCl = BaCl2+CO2↑+H2O
Al2O3+3H2SO4 = Al2(SO4)3+3H2O
不能反应,因为CaCO3不溶于水
Na2SO4+Ba(NO3)2 = BaSO4↓+2NaNO3
H2SO4+NaCl→Na2SO4+HCl
稀硫酸和氯化钠溶液为何不能发生复分解反应呢?
混合前的离子:
H+、SO42-、
混合后的离子:
Na+、Cl-
+
H+、SO42-、
Na+、Cl-
微观角度:混合前后离子的种类、数目都没有改变,
即没有成功交换成分。
宏观角度:假设交换成分,但没有沉淀或气体或水生成,
所以,不能发生复分解反应。
×
知识点二 从微观角度看复分解反应的实质
完成下列反应的有关问题。
举例 稀盐酸和氢氧化钠反应 稀盐酸与碳酸钠反应 硫酸铜和氢氧化钠反应
化学方程式
反应过程的 微观示意图
反应的实质
“旁观”离子
HCl+NaOH
=NaCl+H2O
Na2CO3+2HCl
=2NaCl+H2O+CO2↑
CuSO4+2NaOH
=Cu(OH)2↓+Na2SO4
H++OH-=H2O
CO32-+2H+
= CO2↑+H2O
Cu2++2OH-
= Cu(OH)2↓
Na+、Cl-
Na+、Cl-
Na+、SO42-
举例 稀盐酸和氢氧化钠反应 稀盐酸与碳酸钠反应 硫酸铜和氢氧化钠反应
反应的化学 方程式
反应过程的 微观图
反应的实质
HCl+NaOH
=NaCl+H2O
Na2CO3+2HCl
=2NaCl+H2O+CO2↑
CuSO4+2NaOH
=Cu(OH)2↓+Na2SO4
H++OH-=H2O
CO32-+2H+
= CO2↑+H2O
Cu2++2OH-
= Cu(OH)2↓
【小结归纳】酸碱盐之间发生的复分解反应的实质是________之
间的反应,两种离子之间如果能结合生成________或放出
________或生成的________,反应就能发生。
水
离子
沉淀
气体
教师点拨 初中阶段常见的不能共存的离子:(即发生反应)
H++OH-=H2O
CO32-+2H+= CO2↑+H2O
Cu2++2OH-= Cu(OH)2↓
(2)生成气体(CO2或NH3)的离子对:
OH-
(1)生成水的离子对:
CO2↑+H2O
CO2↑+H2O
H+
CO32-
HCO3-
→ NH3 ↑ +H2O
OH-
NH4+
H+
H2O
→
→
→
教师点拨 初中阶段常见的不能共存的离子:(即发生反应)
CaCO3↓
OH-
Mg2+
Cu2+
Al3+
Fe3+
→Cu(OH)2↓
BaSO4↓
AgCl↓
BaCO3↓
Ba2+
SO42-
Ca2+
CO32-
Ba2+
Ag+
Cl-
→Fe(OH)3 ↓
→Al(OH)3 ↓
→Mg(OH)2↓
→
→
→
→
(3)生成沉淀的离子对:(八大沉淀)
离子之间的反应
(1)生成水:H++OH-= (中和反应)
(2)生成气体:2H++CO32-=___________
H++HCO3-=___________ NH4++OH- =___________
(3)生成沉淀:Ag++Cl- = AgCl↓
Ba2++SO42-=___________
Ca2++CO32- =___________
Ba2++CO32-=___________ Mg2++2OH- =___________
Al3++3OH- = ___________
Fe3++3OH- = ( 色沉淀)
Cu2++2OH- = ( 色沉淀)
BaSO4↓
BaCO3↓
CaCO3↓
Cu(OH)2↓
Fe(OH)3↓
Mg(OH)2↓
H2O+CO2↑
H2O+NH3↑
H2O
蓝
红褐
H2O+CO2↑
Al(OH)3↓
2.下列各组离子能够在水溶液中共存的是( )
A.Ca2+ K+ NO3- CO32-
B.Na+ Ba2+ OH- Cl-
C.Na+ H+ CO32- SO42-
D.H+ Na+ OH- NO3-
B
导学案P193 对点训练第3题
3.能在同一溶液中大量共存,且溶液无色透明的一组物质
是( )
A.Fe2(SO4)3、NaCl、Zn(NO3)2
B.MgCl2、Na2SO4、NaOH
C.CaCl2、NaNO3、Ba(NO3)2
D.H2SO4、NaNO3、NaHCO3
C
导学案P193 自我提升 第3题
复分解反应
复分解反应的概念、特点、发生条件及类型。
物质(或离子)的共存。
复分解反应的微观实质。
学习完酸、碱、盐后每个人都有的梦想
学习完酸、碱、盐后每个人都有的梦想
学习完酸、碱、盐后每个人都有的梦想
学习完酸、碱、盐后每个人都有的梦想
学习完酸、碱、盐后我的梦想设计是什么?
1.下列各组物质的溶液混合后,能发生反应,但无明显现象
的是( )
A.CuCl2和KOH B.NaOH和HCl
C.NaNO3和KCl D.Ca(OH)2和Na2CO3
2.向某溶液中先滴加稀盐酸,无现象,再滴加氯化钡溶液,有白色沉淀产生,则该溶液中( )
A.一定含有SO42- B.一定含有Ag+
C.一定含有CO32- D.一定含有Ag+或SO42-
B
A
自我提升
3.有四瓶溶液,分别是Na2CO3溶液、BaCl2溶液、稀硫酸、
K2SO4溶液,其中有一种溶液与其他三种溶液都能反应,
这种溶液是( )
A.Na2CO3溶液 B.BaCl2溶液
C.稀硫酸 D.K2SO4溶液
4.现有Fe、CuO、稀H2SO4、NaOH溶液、CuSO4溶液、MgSO4溶液六种物质,两两混合后常温下共能发生______个反应,其中属于复分解反应的有____个。
B
6
4
同课章节目录
