7.3溶液浓稀的表示同步练习—2021—2022学年九年级化学科粤版下册(word版有答案)
文档属性
| 名称 | 7.3溶液浓稀的表示同步练习—2021—2022学年九年级化学科粤版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 137.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-22 15:28:06 | ||
图片预览



文档简介
科粤版九年级下册 7.3 溶液浓稀的表示 同步练习
一、单选题
1.将等质量的氧化钙和氢氧化钙固体,分别加入盛有等质量水的甲、乙两只烧杯中,搅拌后恢复至室温均全部溶解。对甲、乙烧杯中溶液的分析正确的是
A.溶液的状态:乙一定是不饱和溶液 B.溶质的质量:甲小于乙
C.溶剂的质量:甲大于乙 D.溶质质量分数:甲乙可能相等
2.下列有关水和溶液的说法错误的是
A.水是由氢元素和氧元素组成
B.生活中可用煮沸的方法降低水的硬度
C.外界条件不改变,溶质不会从溶液中分离出来
D.饱和溶液溶质的质量分数一定大于不饱和溶液溶质的质量分数
3.下列条件下的氢氧化钙溶液最浓的是( )
A.80℃时的不饱和溶液 B.20℃时的不饱和溶液
C.80℃时的饱和溶液 D.20℃时的饱和溶液
4.根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成如图中斜线.下列说法正确是( )
A.该物质的溶解度随温度的升高而增大
B.t℃时该物质的溶解度为40
C.G点表示溶液中溶质的质量分数为20%
D.图中4个点表示的溶液中溶质质量分数的关系是:G<m<w=z
5.新鲜的冬瓜内盛有的氯化钠溶液,现将一木块放入此溶液中,木块处于漂浮状态,木块露出水面的部分高为,如图所示。问过一天后的值与原来相比(不考虑水的蒸发现象)( )
A.变大 B.变小
C.不变 D.不能确定
6.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是
A.t1 ℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲
B.t2 ℃时,20 g丙溶解于50 g水中能形成70 g溶液
C.分别将三种物质的饱和溶液从t3 ℃降温至t2 ℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
7.潍坊有丰富的海洋资源,氯化钠占整个海洋盐类的80%以上。下列有关氯化钠的说法正确的是
A.室温下的氯化钠饱和溶液不能再溶解氯化钾
B.取出部分上层清液,可将接近饱和的氯化钠溶液变为饱和
C.可用硝酸银溶液鉴别氯化钠和氯化镁溶液
D.将100g质量分数为20%的氯化钠溶液稀释为10%,所用的仪器有:烧杯、量筒、玻璃棒和胶头滴管
8.医用酒精中乙醇的体积分数为75%,它常用于皮肤和物体表面的杀菌消毒,可有效杀灭新型冠状病毒。下列关于乙醇溶液说法错误的是
A.乙醇溶液的溶剂是水
B.乙醇溶液是均一的、稳定的
C.乙醇溶液都是浓溶液
D.医用酒精中乙醇的质量分数小于75%
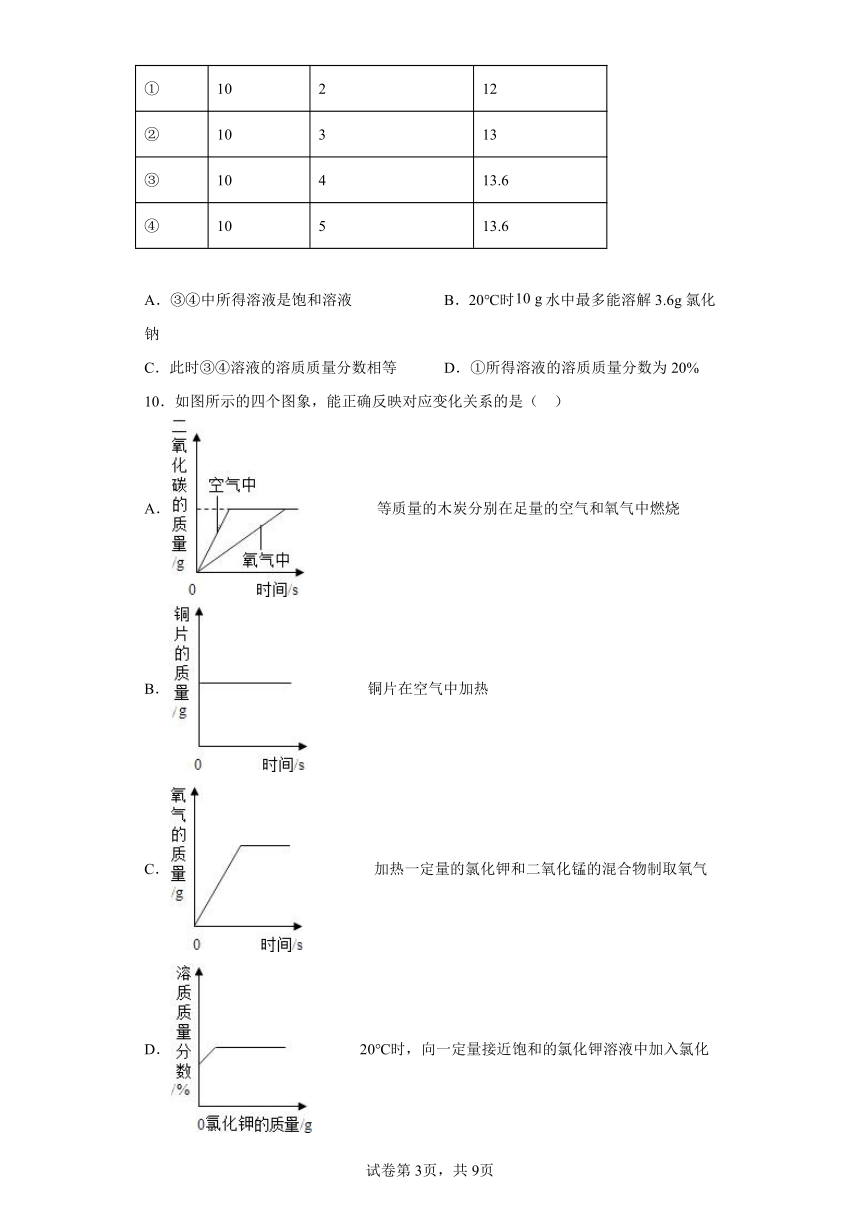
9.20℃时,氯化钠溶于水的实验数据如下表。则下列叙述不正确的是( )
实验序号 水的质量/g 加入氯化钠的质量/g 溶液的质量/g
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.③④中所得溶液是饱和溶液 B.20℃时水中最多能溶解3.6g氯化钠
C.此时③④溶液的溶质质量分数相等 D.①所得溶液的溶质质量分数为20%
10.如图所示的四个图象,能正确反映对应变化关系的是( )
A. 等质量的木炭分别在足量的空气和氧气中燃烧
B. 铜片在空气中加热
C. 加热一定量的氯化钾和二氧化锰的混合物制取氧气
D. 20℃时,向一定量接近饱和的氯化钾溶液中加入氯化钾固体
11.甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.a1℃时甲的饱和溶液,升温至a2℃时仍是饱和溶液
B.乙的溶解度随温度的升高而增大
C.相同温度时,甲的溶解度一定大于乙的溶解度
D.分别将甲、乙的饱和溶液从a2℃将至a1℃时,所得溶液中溶质的质量分数相等
12.小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是
温度/℃ 0 10 20 40 60 80 100
溶解度/g 182 191 204 238 287 362 487
A.配制的蔗糖溶液下层比上层甜
B.降温,糖水中一定有晶体析出
C.20℃时,蔗糖饱和溶液质量一定为304g
D.升温,糖水中蔗糖的质量分数不变
13.甲、乙两种物质的溶解度曲线如图。t1℃时,在两支试管中分别加入等质量的两种物质,再分别加入等量的蒸馏水,充分振荡后,试管底部均有未溶解的固体。再将两支试管升温到t2℃(不考虑溶剂质量变化)。由t1℃到t2℃的过程中,下列说法正确的是
A.甲溶液中溶质的质量分数减小
B.装有乙物质的试管中剩余的固体增多
C.甲、乙两种物质的溶解度都增大
D.两支试管里剩余的固体质量相同
14.下面所示的四个图像,能正确反映对应变化关系的是
A.镁在氧气中燃烧
B.向二氧化锰中加入过氧化氢溶液
C.向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液
D.等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
15.某温度下,甲、乙两个烧杯中各盛有100g相同浓度的氯化钾溶液,现将甲烧杯中的溶液蒸发掉35g水,析出5g晶体;乙烧杯中的溶液蒸发掉45g水,析出10g晶体.则原溶液的质量分数为 ( )
A.10% B.25% C.20% D.15%
二、综合应用题
16.大庆市某中学化学兴趣小组利用以下装置制备氢气,并验证氢气的性质,按要求回答以下问题:
(1)化学实验室现有质量分数为98%的浓硫酸,需配制245g质量分数10%的稀硫酸,配制步骤如下:
①计算:所需质量分数98%的浓硫酸______g;②量取;③稀释。量取和稀释浓硫酸所用的玻璃仪器有____。简要描述浓硫酸的稀释方法___________。
(2)该兴趣小组制备氢气的原理为___________(化学方程式)。
(3)装置B的作用__________________。
(4)下列有关实验操作或现象描述不正确的是____
A.实验开始时,应先通入氢气,然后再点燃C处酒精灯
B.点燃C处酒精灯后,D处硫酸铜固体由白色逐渐变为蓝色
C.E处酒精灯的作用是点燃未反应的氢气
D.实验结束时,应先停止通入氢气,然后熄灭C处酒精灯
(5)实验结束后,发现部分氧化铜未被还原,已知反应前氧化铜质量为a克,反应结束后混合固体质量为b克,则被氢气还原的氧化铜的质量为___________g。
17.溶液在生命活动和生产、生活中都起到十分重要的作用.
(1)将少量下列调味品加入水中,不能形成溶液的是__________________ .
a.食盐 b.蔗糖 c.味精 d.芝麻油
(2)碘酒中的溶剂为_________________________________ .
(3)在一定温度下,向质量均为50g的4份水中分别加入一定量的KNO3固体,搅拌至充分溶解得到溶液.加入KNO3固体的质量与所得溶液的质量如下表:
实验编号 a b c d
加入KNO3固体的质量/g 45 50 55 60
所得溶液的质量/g 95 100 105 105
①实验a、b、c、d中,所得溶液一定饱和的是____________(填写实验编号).
②该温度下,KNO3的溶解度是___________g.
③取实验b所得溶液,若使其溶质质量分数变为20%,需加水___________g.
(4)在氯化亚铁和氯化铜的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,有气泡产生,则滤出的固体一定有______________ , 滤液中一定含有的溶质是_________________ .
18.水在生产、生活中有着十分重要的作用。
①科学家在不断研究水的开发和利用技术。下图是水在一定条件下的转化过程。
Ⅰ.写出电解水装置反应的化学方程式_______________。
Ⅱ.燃料电池反应的微观模拟图如下图所示
“ ”表示的微粒名称是____________;反应后的容器中成分判断正确的是________。(选填编号)
A 是混合物 B 氧元素只存在化合态
C 原子总数减少 D 分子总数减少
Ⅲ.该转化过程中,可循环利用的甲物质是________。该技术的优点是_______。(选填编号)
A 开发使用新能源 B 减少生产过程对环境的污染
C 可以彻底替代化石燃料 D 主要用于证明水的组成
②净化水有多种方法。
Ⅰ.活性炭去除异味,活性炭主要起_____________作用。消毒水时常用二氧化氯,ClO2中氯元素的化合价是_________。
Ⅱ.应急净水器可以将海水淡化。如用此装置将2000 g含氯化钠3%的海水暴晒4小时,可收集到500 g可饮用水,此时剩余海水中氯化钠的质量分数为________。
19.如图给出了在实验室中制取气体时常用的部分仪器。
(1)实验室中用稀HCl和石灰石制取二氧化碳。
①反应原理可用化学方程式表示为_____;
②若用排水法收集CO2,则所需仪器有A、D、H、L、M、N、O和_____;
③配制73g 10%的稀盐酸,需20%的盐酸溶液的质量为_____,配制的主要操作步骤是:计算,_____,混溶。
(2)小明使用如图所示装置,在实验室中用过氧化氢溶液和二氧化锰制取氧气。
①实验前,小明先向分液漏斗中加入水,打开分液漏斗的活塞使水流入A瓶中,同时观察B瓶口处短导管口是否有气泡出现。他这样操作的目的是_____;
②小明将2.5gMnO2放入A瓶中,并通过分液漏斗向其中加入100g过氧化氢溶液,反应完全后,共收集到1.6g氧气。将A瓶中的剩余物过滤、洗涤并干燥后,所得滤渣的质量为_____;所用过氧化氢溶液中溶质的质量分数为_____。
20.下图是实验室制取气体的部分装置,请回答下列问题:
(1)写出仪器的名称:a 是_____,b 是_____。
(2)选择 A 装置制氧气的化学方程式_____,收集比较干燥的氧气,选择的收集装置是_____(填写编号)。
(3)实验室制 CO2 常选 C 作为发生装置,该装置的优点是_____。收集了一定量的气体后夹紧止水夹,C 装置中固体与液体无法分开,可能的原因是_____。若用 F 装置收集 CO2,气体应该从_____(填“c”或“d”)端通入,验满的方法为_____。
(4)某同学欲对当地的石灰石矿石样品进行检验,取用 50.0g 这种石灰石样品,把 200.0g 稀盐酸分 4 次加入, 实验过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。
序号 加入稀盐酸质量(g) 剩余固体质量(g)
第 1 次 50.0 40.0
第 2 次 50.0 M
第 3 次 50.0 20.0
第 4 次 50.0 12.0
请计算:
Ⅰ. 表中 m 的数值应该为_____。
Ⅱ. 石灰石样品中碳酸钙的质量是_____g。
Ⅲ. 参加反应的稀盐酸的溶质质量分数_____ (根据化学方程式列式计算)(精确到 0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.D
4.D
5.B
6.D
7.D
8.C
9.D
10.D
11.D
12.D
13.B
14.B
15.B
16. 25 量筒、胶头滴管、烧杯、玻璃棒 将浓硫酸沿烧杯壁缓慢地注入水中,用玻璃棒不断搅动 Zn+H2SO4=ZnSO4+H2↑ 吸收气体中的水蒸气 D 5(a-b)
17. d 酒精(或C2H5OH) cd 110 150 铜和铁(或Cu和Fe) 氯化镁(或MgCl2)
18. 一个氢分子/氢分子 ABD H2O或水 AB 吸附 +4 4%或1/25或0.04
19. CaCO3+2HCl═CaCl2+H2O+CO2↑ C 36.5g 称量 检查装置气密性 2.5g 3.4%
20. 酒精灯 长颈漏斗 2KClO32KCl+3O2↑ E或F 可以控制反应的发生和停止 气密性不好等 d 将带火星的木条置于c处,木条熄灭则已集满 30.0 38 14.6%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.将等质量的氧化钙和氢氧化钙固体,分别加入盛有等质量水的甲、乙两只烧杯中,搅拌后恢复至室温均全部溶解。对甲、乙烧杯中溶液的分析正确的是
A.溶液的状态:乙一定是不饱和溶液 B.溶质的质量:甲小于乙
C.溶剂的质量:甲大于乙 D.溶质质量分数:甲乙可能相等
2.下列有关水和溶液的说法错误的是
A.水是由氢元素和氧元素组成
B.生活中可用煮沸的方法降低水的硬度
C.外界条件不改变,溶质不会从溶液中分离出来
D.饱和溶液溶质的质量分数一定大于不饱和溶液溶质的质量分数
3.下列条件下的氢氧化钙溶液最浓的是( )
A.80℃时的不饱和溶液 B.20℃时的不饱和溶液
C.80℃时的饱和溶液 D.20℃时的饱和溶液
4.根据某物质在不同质量的水中达到饱和状态时所溶解物质的质量,绘制成如图中斜线.下列说法正确是( )
A.该物质的溶解度随温度的升高而增大
B.t℃时该物质的溶解度为40
C.G点表示溶液中溶质的质量分数为20%
D.图中4个点表示的溶液中溶质质量分数的关系是:G<m<w=z
5.新鲜的冬瓜内盛有的氯化钠溶液,现将一木块放入此溶液中,木块处于漂浮状态,木块露出水面的部分高为,如图所示。问过一天后的值与原来相比(不考虑水的蒸发现象)( )
A.变大 B.变小
C.不变 D.不能确定
6.如图是甲、乙、丙三种物质的溶解度曲线,下列叙述正确的是
A.t1 ℃时,等质量的甲、丙溶液中所含溶质的质量分数为丙>甲
B.t2 ℃时,20 g丙溶解于50 g水中能形成70 g溶液
C.分别将三种物质的饱和溶液从t3 ℃降温至t2 ℃时,所得溶液溶质质量分数的大小关系为乙>甲=丙
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
7.潍坊有丰富的海洋资源,氯化钠占整个海洋盐类的80%以上。下列有关氯化钠的说法正确的是
A.室温下的氯化钠饱和溶液不能再溶解氯化钾
B.取出部分上层清液,可将接近饱和的氯化钠溶液变为饱和
C.可用硝酸银溶液鉴别氯化钠和氯化镁溶液
D.将100g质量分数为20%的氯化钠溶液稀释为10%,所用的仪器有:烧杯、量筒、玻璃棒和胶头滴管
8.医用酒精中乙醇的体积分数为75%,它常用于皮肤和物体表面的杀菌消毒,可有效杀灭新型冠状病毒。下列关于乙醇溶液说法错误的是
A.乙醇溶液的溶剂是水
B.乙醇溶液是均一的、稳定的
C.乙醇溶液都是浓溶液
D.医用酒精中乙醇的质量分数小于75%
9.20℃时,氯化钠溶于水的实验数据如下表。则下列叙述不正确的是( )
实验序号 水的质量/g 加入氯化钠的质量/g 溶液的质量/g
① 10 2 12
② 10 3 13
③ 10 4 13.6
④ 10 5 13.6
A.③④中所得溶液是饱和溶液 B.20℃时水中最多能溶解3.6g氯化钠
C.此时③④溶液的溶质质量分数相等 D.①所得溶液的溶质质量分数为20%
10.如图所示的四个图象,能正确反映对应变化关系的是( )
A. 等质量的木炭分别在足量的空气和氧气中燃烧
B. 铜片在空气中加热
C. 加热一定量的氯化钾和二氧化锰的混合物制取氧气
D. 20℃时,向一定量接近饱和的氯化钾溶液中加入氯化钾固体
11.甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.a1℃时甲的饱和溶液,升温至a2℃时仍是饱和溶液
B.乙的溶解度随温度的升高而增大
C.相同温度时,甲的溶解度一定大于乙的溶解度
D.分别将甲、乙的饱和溶液从a2℃将至a1℃时,所得溶液中溶质的质量分数相等
12.小明自制了一杯蔗糖水(无固体剩余),用于缓解运动后出现的低血糖症状,之后他结合下表蔗糖的溶解度数据,归纳出以下问题,其中正确的是
温度/℃ 0 10 20 40 60 80 100
溶解度/g 182 191 204 238 287 362 487
A.配制的蔗糖溶液下层比上层甜
B.降温,糖水中一定有晶体析出
C.20℃时,蔗糖饱和溶液质量一定为304g
D.升温,糖水中蔗糖的质量分数不变
13.甲、乙两种物质的溶解度曲线如图。t1℃时,在两支试管中分别加入等质量的两种物质,再分别加入等量的蒸馏水,充分振荡后,试管底部均有未溶解的固体。再将两支试管升温到t2℃(不考虑溶剂质量变化)。由t1℃到t2℃的过程中,下列说法正确的是
A.甲溶液中溶质的质量分数减小
B.装有乙物质的试管中剩余的固体增多
C.甲、乙两种物质的溶解度都增大
D.两支试管里剩余的固体质量相同
14.下面所示的四个图像,能正确反映对应变化关系的是
A.镁在氧气中燃烧
B.向二氧化锰中加入过氧化氢溶液
C.向一定量的铁粉和铜粉的混合物中加入硫酸铜溶液
D.等质量的镁、铝分别与质量分数相等且足量的稀硫酸反应
15.某温度下,甲、乙两个烧杯中各盛有100g相同浓度的氯化钾溶液,现将甲烧杯中的溶液蒸发掉35g水,析出5g晶体;乙烧杯中的溶液蒸发掉45g水,析出10g晶体.则原溶液的质量分数为 ( )
A.10% B.25% C.20% D.15%
二、综合应用题
16.大庆市某中学化学兴趣小组利用以下装置制备氢气,并验证氢气的性质,按要求回答以下问题:
(1)化学实验室现有质量分数为98%的浓硫酸,需配制245g质量分数10%的稀硫酸,配制步骤如下:
①计算:所需质量分数98%的浓硫酸______g;②量取;③稀释。量取和稀释浓硫酸所用的玻璃仪器有____。简要描述浓硫酸的稀释方法___________。
(2)该兴趣小组制备氢气的原理为___________(化学方程式)。
(3)装置B的作用__________________。
(4)下列有关实验操作或现象描述不正确的是____
A.实验开始时,应先通入氢气,然后再点燃C处酒精灯
B.点燃C处酒精灯后,D处硫酸铜固体由白色逐渐变为蓝色
C.E处酒精灯的作用是点燃未反应的氢气
D.实验结束时,应先停止通入氢气,然后熄灭C处酒精灯
(5)实验结束后,发现部分氧化铜未被还原,已知反应前氧化铜质量为a克,反应结束后混合固体质量为b克,则被氢气还原的氧化铜的质量为___________g。
17.溶液在生命活动和生产、生活中都起到十分重要的作用.
(1)将少量下列调味品加入水中,不能形成溶液的是__________________ .
a.食盐 b.蔗糖 c.味精 d.芝麻油
(2)碘酒中的溶剂为_________________________________ .
(3)在一定温度下,向质量均为50g的4份水中分别加入一定量的KNO3固体,搅拌至充分溶解得到溶液.加入KNO3固体的质量与所得溶液的质量如下表:
实验编号 a b c d
加入KNO3固体的质量/g 45 50 55 60
所得溶液的质量/g 95 100 105 105
①实验a、b、c、d中,所得溶液一定饱和的是____________(填写实验编号).
②该温度下,KNO3的溶解度是___________g.
③取实验b所得溶液,若使其溶质质量分数变为20%,需加水___________g.
(4)在氯化亚铁和氯化铜的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀盐酸,有气泡产生,则滤出的固体一定有______________ , 滤液中一定含有的溶质是_________________ .
18.水在生产、生活中有着十分重要的作用。
①科学家在不断研究水的开发和利用技术。下图是水在一定条件下的转化过程。
Ⅰ.写出电解水装置反应的化学方程式_______________。
Ⅱ.燃料电池反应的微观模拟图如下图所示
“ ”表示的微粒名称是____________;反应后的容器中成分判断正确的是________。(选填编号)
A 是混合物 B 氧元素只存在化合态
C 原子总数减少 D 分子总数减少
Ⅲ.该转化过程中,可循环利用的甲物质是________。该技术的优点是_______。(选填编号)
A 开发使用新能源 B 减少生产过程对环境的污染
C 可以彻底替代化石燃料 D 主要用于证明水的组成
②净化水有多种方法。
Ⅰ.活性炭去除异味,活性炭主要起_____________作用。消毒水时常用二氧化氯,ClO2中氯元素的化合价是_________。
Ⅱ.应急净水器可以将海水淡化。如用此装置将2000 g含氯化钠3%的海水暴晒4小时,可收集到500 g可饮用水,此时剩余海水中氯化钠的质量分数为________。
19.如图给出了在实验室中制取气体时常用的部分仪器。
(1)实验室中用稀HCl和石灰石制取二氧化碳。
①反应原理可用化学方程式表示为_____;
②若用排水法收集CO2,则所需仪器有A、D、H、L、M、N、O和_____;
③配制73g 10%的稀盐酸,需20%的盐酸溶液的质量为_____,配制的主要操作步骤是:计算,_____,混溶。
(2)小明使用如图所示装置,在实验室中用过氧化氢溶液和二氧化锰制取氧气。
①实验前,小明先向分液漏斗中加入水,打开分液漏斗的活塞使水流入A瓶中,同时观察B瓶口处短导管口是否有气泡出现。他这样操作的目的是_____;
②小明将2.5gMnO2放入A瓶中,并通过分液漏斗向其中加入100g过氧化氢溶液,反应完全后,共收集到1.6g氧气。将A瓶中的剩余物过滤、洗涤并干燥后,所得滤渣的质量为_____;所用过氧化氢溶液中溶质的质量分数为_____。
20.下图是实验室制取气体的部分装置,请回答下列问题:
(1)写出仪器的名称:a 是_____,b 是_____。
(2)选择 A 装置制氧气的化学方程式_____,收集比较干燥的氧气,选择的收集装置是_____(填写编号)。
(3)实验室制 CO2 常选 C 作为发生装置,该装置的优点是_____。收集了一定量的气体后夹紧止水夹,C 装置中固体与液体无法分开,可能的原因是_____。若用 F 装置收集 CO2,气体应该从_____(填“c”或“d”)端通入,验满的方法为_____。
(4)某同学欲对当地的石灰石矿石样品进行检验,取用 50.0g 这种石灰石样品,把 200.0g 稀盐酸分 4 次加入, 实验过程所得数据见下表(已知石灰石样品中含的杂质不溶于水,不与盐酸反应)。
序号 加入稀盐酸质量(g) 剩余固体质量(g)
第 1 次 50.0 40.0
第 2 次 50.0 M
第 3 次 50.0 20.0
第 4 次 50.0 12.0
请计算:
Ⅰ. 表中 m 的数值应该为_____。
Ⅱ. 石灰石样品中碳酸钙的质量是_____g。
Ⅲ. 参加反应的稀盐酸的溶质质量分数_____ (根据化学方程式列式计算)(精确到 0.1%)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.D
3.D
4.D
5.B
6.D
7.D
8.C
9.D
10.D
11.D
12.D
13.B
14.B
15.B
16. 25 量筒、胶头滴管、烧杯、玻璃棒 将浓硫酸沿烧杯壁缓慢地注入水中,用玻璃棒不断搅动 Zn+H2SO4=ZnSO4+H2↑ 吸收气体中的水蒸气 D 5(a-b)
17. d 酒精(或C2H5OH) cd 110 150 铜和铁(或Cu和Fe) 氯化镁(或MgCl2)
18. 一个氢分子/氢分子 ABD H2O或水 AB 吸附 +4 4%或1/25或0.04
19. CaCO3+2HCl═CaCl2+H2O+CO2↑ C 36.5g 称量 检查装置气密性 2.5g 3.4%
20. 酒精灯 长颈漏斗 2KClO32KCl+3O2↑ E或F 可以控制反应的发生和停止 气密性不好等 d 将带火星的木条置于c处,木条熄灭则已集满 30.0 38 14.6%
答案第1页,共2页
答案第1页,共2页
