8.4常见的盐同步练习—2021-2022学年九年级化学科粤版下册(word版有答案)
文档属性
| 名称 | 8.4常见的盐同步练习—2021-2022学年九年级化学科粤版下册(word版有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 194.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-22 15:37:40 | ||
图片预览




文档简介
科粤版九年级下册 8.4 常见的盐
一、单选题
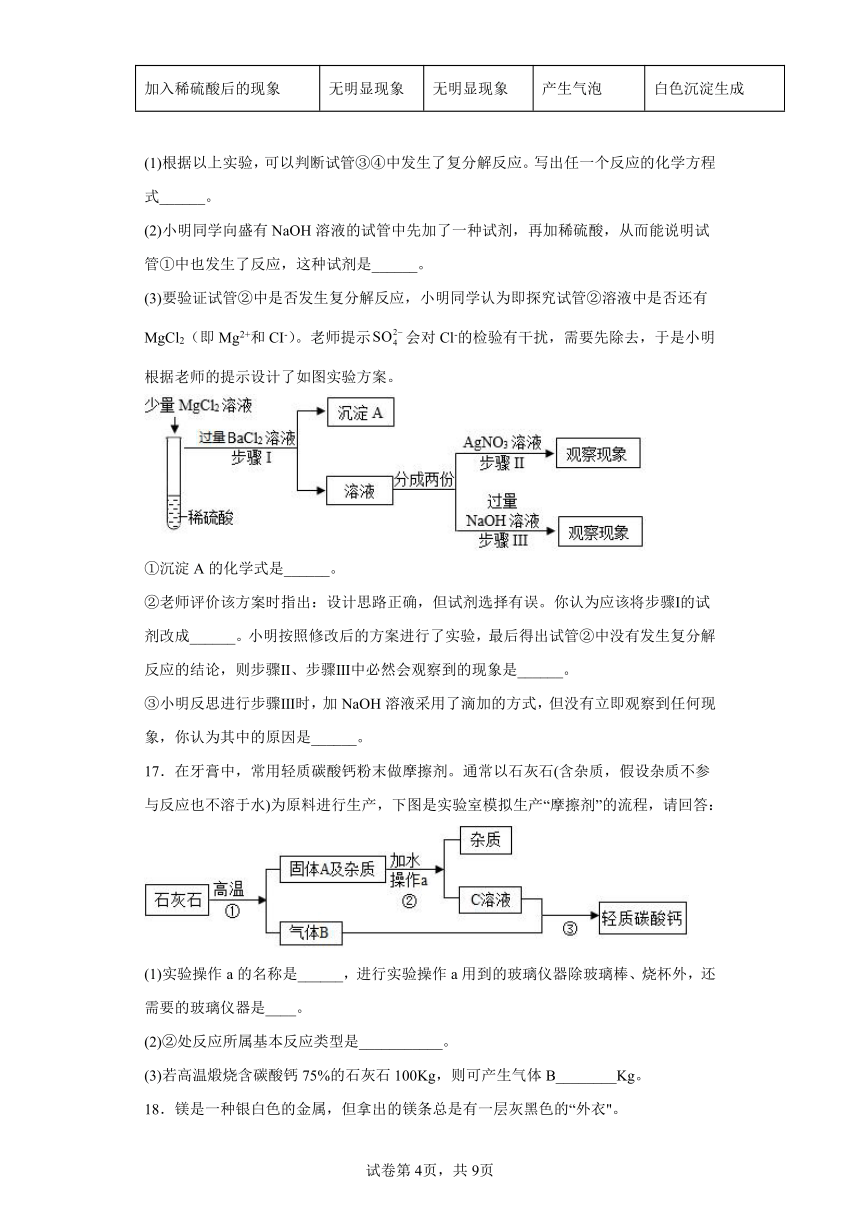
1.盐酸先生闯迷宫(见图),请你帮他选择行进路线(不发生化学反应)。( )
A.A B.B C.C D.D
2.下列除去杂质的方法不正确的是( )
A.FeSO4溶液(CuSO4):过量的铁粉过滤 B.H2(H2O):浓硫酸
C.CO2(CO):通过灼热的氧化铜粉末 D.CaO(CaCO3):稀盐酸
3.利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有
A.盐酸 B.碳酸钠 C.硫酸钠 D.氯化钠
4.下列化学反应属于置换反应的是( )
A.H2O+CaO═Ca(OH)2
B.Na2SO4+BaCl2═2NaCl+BaSO4↓
C.H2+CuOCu+H2O
D.3CO+Fe2O32Fe+3CO2
5.2020年世界水日的主题是“水与气候变化”。下列关于水的说法正确的是
A.生活中硬水转化为软水的方法是煮沸
B.电解水实验中产生氢气和氧气的体积比为1:8
C.化合物之间有水生成的反应一定是复分解反应
D.过滤后的河水为纯净水
6.下列实验现象的描述,正确的是
A.铜绿中加入盐酸,生成气泡,溶液最终变成无色
B.燃着的蜡烛熄灭时产生白雾
C.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
D.红磷在空气中燃烧产生大量白烟,放热
7.关于碳酸钠的说法错误的是
A.易溶于水 B.可用于洗涤油污 C.受热易分解 D.可用于制造普通玻璃
8.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 除去氯化镁溶液中少量的硫酸镁 滴加过量的氯化钡溶液,过滤
B 比较Zn、Cu、Ag的金属活动性 将Zn和Ag分别放入CuSO4溶液中
C 检验二氧化碳 将燃着的木条伸入集气瓶内
D 除去CuO中Cu 加足量稀硫酸溶液、过滤
A.A B.B C.C D.D
9.下列化学方程式中符合题意且书写正确的是
A.正常雨水偏弱酸性原因:SO3+H2O=H2SO4
B.生活中用天然气作燃料:C2H5OH+3O22CO2+3H2O
C.用小苏打治疗胃酸过多症:NaHCO3+HCl=NaCl+CO2↑+H2O
D.工业上用熟石灰制烧碱:Ca(OH)2+2NaNO3=Ca(NO3)2+2NaOH
10.下列各组离子能在指定溶液中大量共存的一组是
A.在稀硫酸中:Ba2+、CO3 2—、Zn2+ B.在氢氧化钙溶液中:H+、Mg2+、Cl—
C.在氯化钠溶液中:K+、Ca2+、NO3— D.在氯化铵溶液中:Na+、Cu2+、OH—
11.下列物质属于盐的是
A.Fe B.CuO C.Na2CO3 DH2SO4
12.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
13.下列除杂所选用试剂与操作方法均正确的是
选项 物质(括号内 为杂质) 除杂试剂 实验操作
A CaO(CaCO3) 水 溶解、过滤
B H2(CO) 灼热CuO 洗气
C NaCl(Na2SO4) 过量BaCl2溶液 过滤
D NaCl(Na2CO3) 足量稀盐酸 蒸发结晶
A.A B.B C.C D.D
14.十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
二、综合应用题
15.我国食盐价格放开,促进盐业改革。食盐氯化钠食盐是日常生活的必需品,图一是家用环保型消毒液发生器示意图,图二是发生反应原理的流程图。
(1)实验室里做溶解实验时,要用玻璃棒不断搅拌,其目的是_____。
(2)根据图二中的反应原理,电解氯化钠稀溶液的化学方程式为_____,从能量变化角度看,该反应将___能转化为化学能。
(3)电解含氯化钠2.34 g的饱和食盐水,则可制得氢气的质量是多少______?
16.学习复分解反应发生条件时,小红同学做了如下表中的四个实验。
试管编号 ① ② ③ ④
试管内试剂 NaOH 溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入稀硫酸后的现象 无明显现象 无明显现象 产生气泡 白色沉淀生成
(1)根据以上实验,可以判断试管③④中发生了复分解反应。写出任一个反应的化学方程式______。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是______。
(3)要验证试管②中是否发生复分解反应,小明同学认为即探究试管②溶液中是否还有MgCl2(即Mg2+和CI-)。老师提示会对Cl-的检验有干扰,需要先除去,于是小明根据老师的提示设计了如图实验方案。
①沉淀A的化学式是______。
②老师评价该方案时指出:设计思路正确,但试剂选择有误。你认为应该将步骤Ⅰ的试剂改成______。小明按照修改后的方案进行了实验,最后得出试管②中没有发生复分解反应的结论,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是______。
③小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是______。
17.在牙膏中,常用轻质碳酸钙粉末做摩擦剂。通常以石灰石(含杂质,假设杂质不参与反应也不溶于水)为原料进行生产,下图是实验室模拟生产“摩擦剂”的流程,请回答:
(1)实验操作a的名称是______,进行实验操作a用到的玻璃仪器除玻璃棒、烧杯外,还需要的玻璃仪器是____。
(2)②处反应所属基本反应类型是___________。
(3)若高温煅烧含碳酸钙75%的石灰石100Kg,则可产生气体B________Kg。
18.镁是一种银白色的金属,但拿出的镁条总是有一层灰黑色的“外衣"。
【提出问题】这层灰黑色的“外衣”是什么物质呢?
【提出猜想】小组同学认为该固体不可能是MgO,他们的理由是______;由铜生锈会产生Cu2(OH)2CO3,联想到灰黑色的物质可能是Mg2(OH)2CO3。
【查阅资料】Mg2(OH)2CO32MgO + H2O + CO2↑
【实验分析】按图所示装置进行实验:
观察到如下现象:______,证明灰黑色的“外衣”是Mg2(OH)2CO3。
由此可知:灰黑色的“外衣”是镁与空气中氧气、______等物质作用,发生一系列化学反应形成的。
【组成测定】小组同学称取2.5g有“外衣”的样品,按如下装置进行实验:
装置A中发生的的化学方程式为:
反应I:Mg2(OH)2CO3 + 2H2SO4=2MgSO4 +3H2O + CO2↑
反应II:Mg + H2SO4=MgSO4+ H2↑
实验结束后,装置D内生成氢气体积为2.24L。请回答:(该条件下氢气密度为0.09g/L)
(1)装置B中发生反应的化学方程式为______。
(2)装置C的作用是______。
(3)装置D内所得氢气的质量=______。(结果精确到0.1g)
(4)“样品”中金属单质镁的质量分数。______(列式计算)。
19.“鱼浮灵”俗称固体双氧水,主要成分是过碳酸钠(xNa2CO3·yH2O2),为深入了解其相关知识进行如下探究。
查阅资料
①工业上可利用Na2CO3溶液与H2O2反应制备过碳酸钠
②工业Na2CO3中常常含有少量Fe3+、Mn2+等金属离子,这些金属离子会促进H2O2分解,造成H2O2的损失,需加入絮凝剂对Na2CO3进一步精制除杂
③浓硫酸具有吸水性,常用作干燥剂
④过碳酸钠与稀硫酸反应放出CO2和O2
⑤碱石灰为氧化钙和氢氧化钠的固体混合物,可吸收H2O、CO2,不能吸收O2
回答下列问题
Ⅰ工业制备
(1)流程中加絮凝剂的目的是_______________,该步骤所发生的变化属于______(填“物理”或“化学”)变化;操作Ⅰ、Ⅱ都要使用玻璃棒,其作用是_______________。
(2)加入过氧化氢溶液制备过碳酸钠的过程中,测得过碳酸钠的产率与反应温度的关系如下表:
温度范围/℃ 5~10 10~15 15~20 20~25
过碳酸钠的产率/% 84.49 85.78 88.38 83.01
分析数据,制备过碳酸钠的最佳温度范围是________℃。温度过高,产率反而降低,从制备过碳酸钠原料的性质分析产率降低的原因是______________________(用化学方程式表示)。
Ⅱ性质探究
(3)取少量过碳酸钠样品于试管中加水,观察到样品表面有气泡缓慢冒出:再向该试管中加入少量MnO2粉末,迅速有大量气泡产生;将带火星的木条伸入试管中部,观察到___________________,说明有O2生成,取反应后的上层清液于另一支试管,如入过量硫酸,又有大量气泡产生;将该气体通入澄清石灰水,观察到石灰水变浑浊,该气体为__________(写化学式)。
实验结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质。
Ⅲ组成测定
(4)为测定过碳酸钠(xNa2CO3·yH2O2)中x:y的值。称取相等质量的两份过碳酸钠样品,利用图甲、图乙两装置分别进行相应实验
①利用图甲进行实验时,共收集到V升气体,欲计算该气体的质量,须查阅的数据为相同温度和压强下该气体的__________________。
②图乙中装置B的作用是__________________。
③利用图乙进行实验时,先打开弹簧夹K1、K2,关闭弹簧夹K3,缓慢通入一段时间N2的目的是_____________。再关闭K1、K2,打开K3,缓慢滴加稀硫酸且过量的目的是______________。当过碳酸钠完全反应后,需打开K1继续缓慢通入一段时间的N2。若此时不继续通入N2会导致x:y的值__________(填“偏大”或“偏小”)。
(5)数据处理:利用图甲实验所得数据,结合查阅数据计算所得气体质量为1.2g利用图乙进行实验中,装置C增重2.2g,则x:y=_______________。
20.CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。
(1)以CO2为原料制取炭黑的太阳能工艺如图所示。
①反应1的基本类型为_______________。
②反应2中碳元素的化合价_______________(填“升高”“不变”或“降低”)。
(2)利用NaOH溶液吸收CO2,部分转化关系见图。
反应①的化学方程式为_________,该转化中循环使用的物质是________。
(3)利用Na2CO3或K2CO3溶液吸收低浓度的CO2,将其转化为NaHCO3或KHCO3,NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。
吸收剂 Na2CO3 K2CO3
20℃最高浓度(g/L) 212 1104
价格(元/Kg) 1.25 9.80
根据表中信息,选择K2CO3溶液作吸收液的优点是_______________。
(4)利用一种新型“人造树叶”将CO2转化为乙醇(C2H5OH)的反应如下:,研究显示,1L“人造树叶”每天能从空气中吸收968gCO2,计算1L“人造树叶”工作1天可得到乙醇的质量(写出计算过程)。_____
(5)某研究小组设计如下图所示实验,探究CO2和H2在一定条件下反应的产物。
查阅资料:①CO2和H2在合适催化剂和一定温度下反应转化为CO和H2O;
②白色无水硫酸铜吸水后变为蓝色。
实验过程中观察到的主要现象有:B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是_______________。
②C装置中发生的反应的化学方程式为_______________。
③研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是_____________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.C
4.C
5.A
6.D
7.C
8.B
9.C
10.C
11.D
12.B
13.D
14.C
15. 加快溶解速率 2NaCl+2H2O2NaOH + Cl2↑+H2↑ 电 0.04g
16.(1)或
(2)酚酞试液
(3) 硝酸钡 产生白色沉淀 经过步骤Ⅰ后溶液中有硝酸,会先和氢氧化钠发生反应
17.(1) 过滤 漏斗
(2)化合反应
(3)33
18. 氧化镁是白色固体 灰黑色固体变白色,试管内壁出现水珠,澄清石灰水变浑浊 水、二氧化碳 吸收混合气体中的水蒸气,排除水蒸气对实验造成影响 0.2g 设2.5g有“外衣”的样品含有镁的质量为
“样品”中金属单质镁的质量分数=
答:“样品”中金属单质镁的质量分数96%。
19. 除去Na2CO3中的Fe3+、Mn2+ 化学 引流 15℃~20℃ 2H2O22H2O+O2↑ 木条复燃 CO2 密度 除去气体中的水蒸气、便于观察和控制气流速度 排尽装置内的空气(二氧化碳),避免产生实验误差 使过碳酸钠完全分解 偏小 2:3
20. 分解反应 降低 氢氧化钠 吸收二氧化碳的能力较强 506g 检验反应是否有水生成 氢气和氧化铜加热生成铜和二氧化碳,不能确定是否是一氧化碳和氧化铜反应
答案第1页,共2页
答案第1页,共2页
一、单选题
1.盐酸先生闯迷宫(见图),请你帮他选择行进路线(不发生化学反应)。( )
A.A B.B C.C D.D
2.下列除去杂质的方法不正确的是( )
A.FeSO4溶液(CuSO4):过量的铁粉过滤 B.H2(H2O):浓硫酸
C.CO2(CO):通过灼热的氧化铜粉末 D.CaO(CaCO3):稀盐酸
3.利用饱和碳酸钠溶液与酸反应,小科同学制作了如图甲所示的简易酸碱灭火器装置,并进行操作。操作结束后,对瓶中残留液进行如图乙所示的实验。实验现象:A试管溶液变红色,B试管中有白色沉淀生成。则残留液中含有的溶质有
A.盐酸 B.碳酸钠 C.硫酸钠 D.氯化钠
4.下列化学反应属于置换反应的是( )
A.H2O+CaO═Ca(OH)2
B.Na2SO4+BaCl2═2NaCl+BaSO4↓
C.H2+CuOCu+H2O
D.3CO+Fe2O32Fe+3CO2
5.2020年世界水日的主题是“水与气候变化”。下列关于水的说法正确的是
A.生活中硬水转化为软水的方法是煮沸
B.电解水实验中产生氢气和氧气的体积比为1:8
C.化合物之间有水生成的反应一定是复分解反应
D.过滤后的河水为纯净水
6.下列实验现象的描述,正确的是
A.铜绿中加入盐酸,生成气泡,溶液最终变成无色
B.燃着的蜡烛熄灭时产生白雾
C.铁丝在空气中剧烈燃烧,火星四射,生成黑色固体
D.红磷在空气中燃烧产生大量白烟,放热
7.关于碳酸钠的说法错误的是
A.易溶于水 B.可用于洗涤油污 C.受热易分解 D.可用于制造普通玻璃
8.下列实验设计能达到实验目的是( )
选项 实验目的 实验设计
A 除去氯化镁溶液中少量的硫酸镁 滴加过量的氯化钡溶液,过滤
B 比较Zn、Cu、Ag的金属活动性 将Zn和Ag分别放入CuSO4溶液中
C 检验二氧化碳 将燃着的木条伸入集气瓶内
D 除去CuO中Cu 加足量稀硫酸溶液、过滤
A.A B.B C.C D.D
9.下列化学方程式中符合题意且书写正确的是
A.正常雨水偏弱酸性原因:SO3+H2O=H2SO4
B.生活中用天然气作燃料:C2H5OH+3O22CO2+3H2O
C.用小苏打治疗胃酸过多症:NaHCO3+HCl=NaCl+CO2↑+H2O
D.工业上用熟石灰制烧碱:Ca(OH)2+2NaNO3=Ca(NO3)2+2NaOH
10.下列各组离子能在指定溶液中大量共存的一组是
A.在稀硫酸中:Ba2+、CO3 2—、Zn2+ B.在氢氧化钙溶液中:H+、Mg2+、Cl—
C.在氯化钠溶液中:K+、Ca2+、NO3— D.在氯化铵溶液中:Na+、Cu2+、OH—
11.下列物质属于盐的是
A.Fe B.CuO C.Na2CO3 DH2SO4
12.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
13.下列除杂所选用试剂与操作方法均正确的是
选项 物质(括号内 为杂质) 除杂试剂 实验操作
A CaO(CaCO3) 水 溶解、过滤
B H2(CO) 灼热CuO 洗气
C NaCl(Na2SO4) 过量BaCl2溶液 过滤
D NaCl(Na2CO3) 足量稀盐酸 蒸发结晶
A.A B.B C.C D.D
14.十一世纪,中国就用“卓筒井”凿井技术获取食盐。食盐的主要成分是( )
A.NaHCO3 B.Na2CO3 C.NaCl D.NaOH
二、综合应用题
15.我国食盐价格放开,促进盐业改革。食盐氯化钠食盐是日常生活的必需品,图一是家用环保型消毒液发生器示意图,图二是发生反应原理的流程图。
(1)实验室里做溶解实验时,要用玻璃棒不断搅拌,其目的是_____。
(2)根据图二中的反应原理,电解氯化钠稀溶液的化学方程式为_____,从能量变化角度看,该反应将___能转化为化学能。
(3)电解含氯化钠2.34 g的饱和食盐水,则可制得氢气的质量是多少______?
16.学习复分解反应发生条件时,小红同学做了如下表中的四个实验。
试管编号 ① ② ③ ④
试管内试剂 NaOH 溶液 MgCl2溶液 Na2CO3溶液 Ba(NO3)2溶液
加入稀硫酸后的现象 无明显现象 无明显现象 产生气泡 白色沉淀生成
(1)根据以上实验,可以判断试管③④中发生了复分解反应。写出任一个反应的化学方程式______。
(2)小明同学向盛有NaOH溶液的试管中先加了一种试剂,再加稀硫酸,从而能说明试管①中也发生了反应,这种试剂是______。
(3)要验证试管②中是否发生复分解反应,小明同学认为即探究试管②溶液中是否还有MgCl2(即Mg2+和CI-)。老师提示会对Cl-的检验有干扰,需要先除去,于是小明根据老师的提示设计了如图实验方案。
①沉淀A的化学式是______。
②老师评价该方案时指出:设计思路正确,但试剂选择有误。你认为应该将步骤Ⅰ的试剂改成______。小明按照修改后的方案进行了实验,最后得出试管②中没有发生复分解反应的结论,则步骤Ⅱ、步骤Ⅲ中必然会观察到的现象是______。
③小明反思进行步骤Ⅲ时,加NaOH溶液采用了滴加的方式,但没有立即观察到任何现象,你认为其中的原因是______。
17.在牙膏中,常用轻质碳酸钙粉末做摩擦剂。通常以石灰石(含杂质,假设杂质不参与反应也不溶于水)为原料进行生产,下图是实验室模拟生产“摩擦剂”的流程,请回答:
(1)实验操作a的名称是______,进行实验操作a用到的玻璃仪器除玻璃棒、烧杯外,还需要的玻璃仪器是____。
(2)②处反应所属基本反应类型是___________。
(3)若高温煅烧含碳酸钙75%的石灰石100Kg,则可产生气体B________Kg。
18.镁是一种银白色的金属,但拿出的镁条总是有一层灰黑色的“外衣"。
【提出问题】这层灰黑色的“外衣”是什么物质呢?
【提出猜想】小组同学认为该固体不可能是MgO,他们的理由是______;由铜生锈会产生Cu2(OH)2CO3,联想到灰黑色的物质可能是Mg2(OH)2CO3。
【查阅资料】Mg2(OH)2CO32MgO + H2O + CO2↑
【实验分析】按图所示装置进行实验:
观察到如下现象:______,证明灰黑色的“外衣”是Mg2(OH)2CO3。
由此可知:灰黑色的“外衣”是镁与空气中氧气、______等物质作用,发生一系列化学反应形成的。
【组成测定】小组同学称取2.5g有“外衣”的样品,按如下装置进行实验:
装置A中发生的的化学方程式为:
反应I:Mg2(OH)2CO3 + 2H2SO4=2MgSO4 +3H2O + CO2↑
反应II:Mg + H2SO4=MgSO4+ H2↑
实验结束后,装置D内生成氢气体积为2.24L。请回答:(该条件下氢气密度为0.09g/L)
(1)装置B中发生反应的化学方程式为______。
(2)装置C的作用是______。
(3)装置D内所得氢气的质量=______。(结果精确到0.1g)
(4)“样品”中金属单质镁的质量分数。______(列式计算)。
19.“鱼浮灵”俗称固体双氧水,主要成分是过碳酸钠(xNa2CO3·yH2O2),为深入了解其相关知识进行如下探究。
查阅资料
①工业上可利用Na2CO3溶液与H2O2反应制备过碳酸钠
②工业Na2CO3中常常含有少量Fe3+、Mn2+等金属离子,这些金属离子会促进H2O2分解,造成H2O2的损失,需加入絮凝剂对Na2CO3进一步精制除杂
③浓硫酸具有吸水性,常用作干燥剂
④过碳酸钠与稀硫酸反应放出CO2和O2
⑤碱石灰为氧化钙和氢氧化钠的固体混合物,可吸收H2O、CO2,不能吸收O2
回答下列问题
Ⅰ工业制备
(1)流程中加絮凝剂的目的是_______________,该步骤所发生的变化属于______(填“物理”或“化学”)变化;操作Ⅰ、Ⅱ都要使用玻璃棒,其作用是_______________。
(2)加入过氧化氢溶液制备过碳酸钠的过程中,测得过碳酸钠的产率与反应温度的关系如下表:
温度范围/℃ 5~10 10~15 15~20 20~25
过碳酸钠的产率/% 84.49 85.78 88.38 83.01
分析数据,制备过碳酸钠的最佳温度范围是________℃。温度过高,产率反而降低,从制备过碳酸钠原料的性质分析产率降低的原因是______________________(用化学方程式表示)。
Ⅱ性质探究
(3)取少量过碳酸钠样品于试管中加水,观察到样品表面有气泡缓慢冒出:再向该试管中加入少量MnO2粉末,迅速有大量气泡产生;将带火星的木条伸入试管中部,观察到___________________,说明有O2生成,取反应后的上层清液于另一支试管,如入过量硫酸,又有大量气泡产生;将该气体通入澄清石灰水,观察到石灰水变浑浊,该气体为__________(写化学式)。
实验结论:过碳酸钠具有Na2CO3和H2O2的双重化学性质。
Ⅲ组成测定
(4)为测定过碳酸钠(xNa2CO3·yH2O2)中x:y的值。称取相等质量的两份过碳酸钠样品,利用图甲、图乙两装置分别进行相应实验
①利用图甲进行实验时,共收集到V升气体,欲计算该气体的质量,须查阅的数据为相同温度和压强下该气体的__________________。
②图乙中装置B的作用是__________________。
③利用图乙进行实验时,先打开弹簧夹K1、K2,关闭弹簧夹K3,缓慢通入一段时间N2的目的是_____________。再关闭K1、K2,打开K3,缓慢滴加稀硫酸且过量的目的是______________。当过碳酸钠完全反应后,需打开K1继续缓慢通入一段时间的N2。若此时不继续通入N2会导致x:y的值__________(填“偏大”或“偏小”)。
(5)数据处理:利用图甲实验所得数据,结合查阅数据计算所得气体质量为1.2g利用图乙进行实验中,装置C增重2.2g,则x:y=_______________。
20.CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。
(1)以CO2为原料制取炭黑的太阳能工艺如图所示。
①反应1的基本类型为_______________。
②反应2中碳元素的化合价_______________(填“升高”“不变”或“降低”)。
(2)利用NaOH溶液吸收CO2,部分转化关系见图。
反应①的化学方程式为_________,该转化中循环使用的物质是________。
(3)利用Na2CO3或K2CO3溶液吸收低浓度的CO2,将其转化为NaHCO3或KHCO3,NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。
吸收剂 Na2CO3 K2CO3
20℃最高浓度(g/L) 212 1104
价格(元/Kg) 1.25 9.80
根据表中信息,选择K2CO3溶液作吸收液的优点是_______________。
(4)利用一种新型“人造树叶”将CO2转化为乙醇(C2H5OH)的反应如下:,研究显示,1L“人造树叶”每天能从空气中吸收968gCO2,计算1L“人造树叶”工作1天可得到乙醇的质量(写出计算过程)。_____
(5)某研究小组设计如下图所示实验,探究CO2和H2在一定条件下反应的产物。
查阅资料:①CO2和H2在合适催化剂和一定温度下反应转化为CO和H2O;
②白色无水硫酸铜吸水后变为蓝色。
实验过程中观察到的主要现象有:B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是_______________。
②C装置中发生的反应的化学方程式为_______________。
③研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是_____________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.D
3.C
4.C
5.A
6.D
7.C
8.B
9.C
10.C
11.D
12.B
13.D
14.C
15. 加快溶解速率 2NaCl+2H2O2NaOH + Cl2↑+H2↑ 电 0.04g
16.(1)或
(2)酚酞试液
(3) 硝酸钡 产生白色沉淀 经过步骤Ⅰ后溶液中有硝酸,会先和氢氧化钠发生反应
17.(1) 过滤 漏斗
(2)化合反应
(3)33
18. 氧化镁是白色固体 灰黑色固体变白色,试管内壁出现水珠,澄清石灰水变浑浊 水、二氧化碳 吸收混合气体中的水蒸气,排除水蒸气对实验造成影响 0.2g 设2.5g有“外衣”的样品含有镁的质量为
“样品”中金属单质镁的质量分数=
答:“样品”中金属单质镁的质量分数96%。
19. 除去Na2CO3中的Fe3+、Mn2+ 化学 引流 15℃~20℃ 2H2O22H2O+O2↑ 木条复燃 CO2 密度 除去气体中的水蒸气、便于观察和控制气流速度 排尽装置内的空气(二氧化碳),避免产生实验误差 使过碳酸钠完全分解 偏小 2:3
20. 分解反应 降低 氢氧化钠 吸收二氧化碳的能力较强 506g 检验反应是否有水生成 氢气和氧化铜加热生成铜和二氧化碳,不能确定是否是一氧化碳和氧化铜反应
答案第1页,共2页
答案第1页,共2页
