【新教材】高中物理选择性必修三--4.4氢原子光谱和玻尔的原子模型 同步精选课件(23页ppt)
文档属性
| 名称 | 【新教材】高中物理选择性必修三--4.4氢原子光谱和玻尔的原子模型 同步精选课件(23页ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 640.9KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2022-03-23 09:22:47 | ||
图片预览







文档简介
(共23张PPT)
第
节
4
氢原子光谱和玻尔的原子模型
高中物理 选择性必修第三册
第四章
1.了解光谱、连续谱和线状谱等概念。知道氢原子光谱的实验规律。
2.知道经典理论的困难在于无法解释原子的稳定性和光谱的分立特性。
3.了解玻尔原子理论的基本假设的主要内容。能用玻尔原子理论解释氢原子能级图及光谱。
4.认识玻尔的原子理论和卢瑟福的核式结构模型之间的继承和发展关系。了解玻尔模型的不足之处及其原因。
学习目标
引入
把食盐放在火中灼烧,会发出黄色的光。食盐为什么发黄光而不发生其他颜色的光呢?
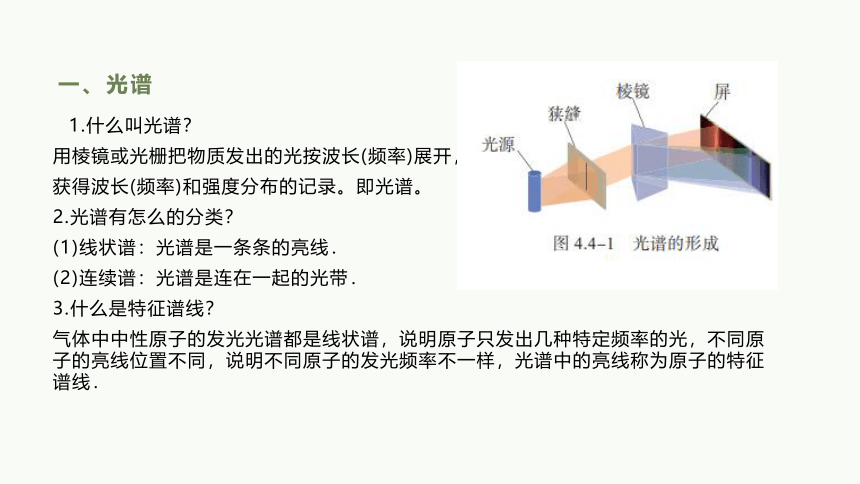
一、光谱
1.什么叫光谱?
用棱镜或光栅把物质发出的光按波长(频率)展开,
获得波长(频率)和强度分布的记录。即光谱。
2.光谱有怎么的分类?
(1)线状谱:光谱是一条条的亮线.
(2)连续谱:光谱是连在一起的光带.
3.什么是特征谱线?
气体中中性原子的发光光谱都是线状谱,说明原子只发出几种特定频率的光,不同原子的亮线位置不同,说明不同原子的发光频率不一样,光谱中的亮线称为原子的特征谱线.
太阳光谱
连续光谱
H的发射光谱
Na的辐射光谱
Na的吸收光谱
鉴别物质和确定物质的组成成分,发现新元素.
含量达到10-10g就可检测到
4.光谱分析:
几种常见的光谱
二、氢原子光谱的实验规律
氢原子的光谱的结果显示氢原子只能发出一系列特定的波长的光。
1885年,瑞士科学及巴尔末对当时已知的氢原子在可见光区的四条谱线
说明
2)n只能取整数.
1)里德伯常数R∞=1.10×10-7m-1
红外区:
紫外区:
莱曼系
可见光区:
巴耳末系
普丰德系
帕邢系
布喇开系
4)氢光谱在红外和紫外区的其他谱线也都满足与巴耳末公式类似的关系式.
3)意义:以简洁的形式反映了氢原子的线状光谱的特征。
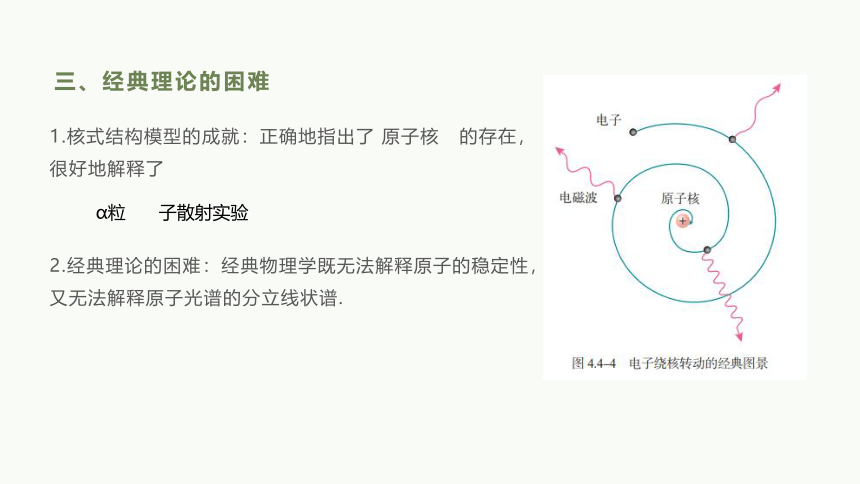
三、经典理论的困难
1.核式结构模型的成就:正确地指出了 原子核 的存在,很好地解释了
2.经典理论的困难:经典物理学既无法解释原子的稳定性,又无法解释原子光谱的分立线状谱.
α粒
子散射实验
四、波尔原子理论的基本假设
这些量子化的能量值叫作能级。原子中这些具有确定能量的稳定状态,称为定态。能量最低的状态叫作基态,其他的状态叫作激发态。
1.轨道量子化与定态
(1)电子的轨道是量子化的.
电子在这些轨道上绕核的运动是稳定的,不产生电磁辐射。
(2)原子的能量只能取一系列特定的值.
玻尔,丹麦物理学家1885年10月7日—1962年11月18日,1922获得诺贝尔物理学奖
+
n=1
n=2
n=3
-
电子
原子核
量子数
基态原子最稳定,激发态原子不稳定,会向低能级跃迁,辐射出光子,且光子能量为
3)能级跃迁:
频率条件:
处于基态或低能级的原子也会吸收光子,跃迁到高能级,吸收的光子的能量为
原子由一个能量状态变为另一个能量状态的过程叫做跃迁.
使原子能级跃迁的两种粒子——光子与实物粒子
a.原子吸收光子跃迁:
光子能量E=En-Em
b.原子吸收外来实物粒子(自由电子)跃迁:
入射粒子的能量E≥En-Em
五、波尔理论对氢光谱的解释
1.轨道量子化
(1)轨道半径只能够是一些不连续的、某些分立的数值.
(2)氢原子的电子轨道最小半径为r1=0.053 nm,其余轨道半径满足rn=n2r1,式中n称为量子数,对应不同的轨道,只能取正整数.
2.能量量子化
(1)不同轨道对应不同的状态,在这些状态中,尽管电子做变速运动,却不辐射能量,因此这些状态是稳定的,原子在不同状态有不同的能量,所以原子的能量也是量子化的.
(2)基态:原子最低的能量状态称为基态,对应的电子在离核最近的轨道上运动,氢原子基态能量E1=-13.6 eV.
(3)激发态:除基态之外的其他能量状态称为激发态,对应的电子在离核较远的轨道上运动.
氢原子各能级的关系为:En=E1(E1=-13.6 eV,n=1,2,3,…)
3.跃迁
原子从一种定态跃迁到另一种定态时,它辐射或吸收一定频率的光子,光子的能量由这两种定态的能量差决定,即高能级Em低能级En.
五、波尔理论的局限性
电子云
量子力学
本课小结
一、氢原子光谱
光谱
线状谱 连续谱
特征谱线 光谱分析
氢原子光谱实验规律
无法解释原子的稳定及光谱的不连续问题
二、经典理论困难
三、玻尔的氢原子模型
1.玻尔理论的基本假设
轨道假设
能级假设
跃迁假设
2.对氢原子光谱的解释
3.玻尔理论的困难
当堂检测
C
1. 下列关于光谱的说法正确的是( )
A.太阳光谱是连续光谱
B.日光灯产生的光谱是连续光谱
C.钠盐在酒精灯火焰上汽化后所产生的光谱是线状光谱
D.白光通过钠蒸气,所产生的光谱是线状光谱
解析:A错:太阳发出的白光本来是连续光谱,但在穿过太阳表面温度比较低的太阳大气层时,被大气层内存在着的从太阳蒸发出来的多种元素的气体吸收,到达地球时形成吸收光谱。
B错:日光灯是低压蒸气发光,所以产生的是线状光谱。
C对:钠盐在酒精灯火焰上汽化后产生线状光谱。
D错:白光通过钠蒸气产生的光谱是钠的吸收光谱。
2. 根据玻尔理论,氢原子的电子由外层轨道跃迁到内层轨道后( )
A.原子的能量增加,电子的动能减少
B.原子的能量增加,电子的动能增加
C.原子的能量减少,电子的动能减少
D.原子的能量减少,电子的动能增加
解析:电子由外层轨道跃迁到内层轨道时,放出光子,总能量减少;由可知半径越小,动能越大。
D
B
3.下列对氢原子光谱实验规律的认识中,正确的是( )
A.因为氢原子核外只有一个电子,所以氢原子只能产生一种波长的光
B.氢原子产生的光谱是一系列波长不连续的谱线
C.氢原子产生的光谱是一系列亮度不连续的谱线
D.氢原子产生的光的波长大小与氢气放电管放电强弱有关
解析:A、C错,B对:氢原子光谱是线状谱,其波长是一系列不连续的、分立的特征谱线,并不是只含有一种波长的光,也不是亮度不连续的谱线。
D错:氢原子光谱是氢原子的特征谱线,氢原子发出的光的波长与放电管的放电强弱无关。
4.[多选]关于经典电磁理论与原子的核式结构模型之间的关系,下列说法正确的是( )
A.经典电磁理论很容易解释原子的稳定性
B.根据经典电磁理论,电子绕原子核转动时,电子会不断释放能量,最后被吸附到原子核上
C.根据经典电磁理论,原子光谱应该是连续的
D.原子的核式结构模型彻底否定了结典电磁理论
BC
解析:A错,B、C对:根据经典电磁理论,电子绕原子核转动时,电子会不断释放能量,最后被吸附到原子核上,原子不应该是稳定的,并且发射的光谱应该是连续的。
D错:原子的核式结构模型并没有彻底否定经典电磁理论。
AB
5.[多选]根据玻尔理论,下列说法正确的是( )
A.原子处于定态时,虽然电子做变速运动,但并不向外辐射能量
B.氢原子的核外电子由较高能级跃迁到较低能级时,要释放一定频率的光子,电势能的减少量大于动能的增加量
C.氢原子可以吸收小于使氢原子电离能量的任意能量的光子,因而轨道半径可以连续增大
D.电子没有确定轨道,只存在电子云
解析:A对:氢原子具有稳定能量的状态称为定态,此时电子绕核运动,但它并不向外辐射能量。
B对:氢原子的核外电子由较高能级跃迁到较低能级时,要释放一定频率的光子,电势能的减少量大于动能的增加量。
C错:原子的不同能量状态与电子沿不同的圆轨道绕核运动相对应,而电子的可能轨道的分布是不连续的。
D错:玻尔理论中,电子有确定轨道。
6.如图所示,氢原子从n>2的某一能级跃迁到n=2的能级,辐射出能量为2. 55eV.问最少要给基态的氢原子提供多少电子伏特的能量,才能使它辐射上述能力的光子?
解:氢原子从n>2的某一能级跃迁到n=2的能级,满足
hν=En-E2=2. 55eV
En=hν+E2=-0.85eV,所以n=4
基态氢原子要跃迁到n=4的能级,应提供
ΔE=E4-E1=12.75eV
∞
1
2
3
4
5
n
-13.6
-3.4
-1.51
-0.85
-0.54
0
E/eV
谢 谢!
第
节
4
氢原子光谱和玻尔的原子模型
高中物理 选择性必修第三册
第四章
1.了解光谱、连续谱和线状谱等概念。知道氢原子光谱的实验规律。
2.知道经典理论的困难在于无法解释原子的稳定性和光谱的分立特性。
3.了解玻尔原子理论的基本假设的主要内容。能用玻尔原子理论解释氢原子能级图及光谱。
4.认识玻尔的原子理论和卢瑟福的核式结构模型之间的继承和发展关系。了解玻尔模型的不足之处及其原因。
学习目标
引入
把食盐放在火中灼烧,会发出黄色的光。食盐为什么发黄光而不发生其他颜色的光呢?
一、光谱
1.什么叫光谱?
用棱镜或光栅把物质发出的光按波长(频率)展开,
获得波长(频率)和强度分布的记录。即光谱。
2.光谱有怎么的分类?
(1)线状谱:光谱是一条条的亮线.
(2)连续谱:光谱是连在一起的光带.
3.什么是特征谱线?
气体中中性原子的发光光谱都是线状谱,说明原子只发出几种特定频率的光,不同原子的亮线位置不同,说明不同原子的发光频率不一样,光谱中的亮线称为原子的特征谱线.
太阳光谱
连续光谱
H的发射光谱
Na的辐射光谱
Na的吸收光谱
鉴别物质和确定物质的组成成分,发现新元素.
含量达到10-10g就可检测到
4.光谱分析:
几种常见的光谱
二、氢原子光谱的实验规律
氢原子的光谱的结果显示氢原子只能发出一系列特定的波长的光。
1885年,瑞士科学及巴尔末对当时已知的氢原子在可见光区的四条谱线
说明
2)n只能取整数.
1)里德伯常数R∞=1.10×10-7m-1
红外区:
紫外区:
莱曼系
可见光区:
巴耳末系
普丰德系
帕邢系
布喇开系
4)氢光谱在红外和紫外区的其他谱线也都满足与巴耳末公式类似的关系式.
3)意义:以简洁的形式反映了氢原子的线状光谱的特征。
三、经典理论的困难
1.核式结构模型的成就:正确地指出了 原子核 的存在,很好地解释了
2.经典理论的困难:经典物理学既无法解释原子的稳定性,又无法解释原子光谱的分立线状谱.
α粒
子散射实验
四、波尔原子理论的基本假设
这些量子化的能量值叫作能级。原子中这些具有确定能量的稳定状态,称为定态。能量最低的状态叫作基态,其他的状态叫作激发态。
1.轨道量子化与定态
(1)电子的轨道是量子化的.
电子在这些轨道上绕核的运动是稳定的,不产生电磁辐射。
(2)原子的能量只能取一系列特定的值.
玻尔,丹麦物理学家1885年10月7日—1962年11月18日,1922获得诺贝尔物理学奖
+
n=1
n=2
n=3
-
电子
原子核
量子数
基态原子最稳定,激发态原子不稳定,会向低能级跃迁,辐射出光子,且光子能量为
3)能级跃迁:
频率条件:
处于基态或低能级的原子也会吸收光子,跃迁到高能级,吸收的光子的能量为
原子由一个能量状态变为另一个能量状态的过程叫做跃迁.
使原子能级跃迁的两种粒子——光子与实物粒子
a.原子吸收光子跃迁:
光子能量E=En-Em
b.原子吸收外来实物粒子(自由电子)跃迁:
入射粒子的能量E≥En-Em
五、波尔理论对氢光谱的解释
1.轨道量子化
(1)轨道半径只能够是一些不连续的、某些分立的数值.
(2)氢原子的电子轨道最小半径为r1=0.053 nm,其余轨道半径满足rn=n2r1,式中n称为量子数,对应不同的轨道,只能取正整数.
2.能量量子化
(1)不同轨道对应不同的状态,在这些状态中,尽管电子做变速运动,却不辐射能量,因此这些状态是稳定的,原子在不同状态有不同的能量,所以原子的能量也是量子化的.
(2)基态:原子最低的能量状态称为基态,对应的电子在离核最近的轨道上运动,氢原子基态能量E1=-13.6 eV.
(3)激发态:除基态之外的其他能量状态称为激发态,对应的电子在离核较远的轨道上运动.
氢原子各能级的关系为:En=E1(E1=-13.6 eV,n=1,2,3,…)
3.跃迁
原子从一种定态跃迁到另一种定态时,它辐射或吸收一定频率的光子,光子的能量由这两种定态的能量差决定,即高能级Em低能级En.
五、波尔理论的局限性
电子云
量子力学
本课小结
一、氢原子光谱
光谱
线状谱 连续谱
特征谱线 光谱分析
氢原子光谱实验规律
无法解释原子的稳定及光谱的不连续问题
二、经典理论困难
三、玻尔的氢原子模型
1.玻尔理论的基本假设
轨道假设
能级假设
跃迁假设
2.对氢原子光谱的解释
3.玻尔理论的困难
当堂检测
C
1. 下列关于光谱的说法正确的是( )
A.太阳光谱是连续光谱
B.日光灯产生的光谱是连续光谱
C.钠盐在酒精灯火焰上汽化后所产生的光谱是线状光谱
D.白光通过钠蒸气,所产生的光谱是线状光谱
解析:A错:太阳发出的白光本来是连续光谱,但在穿过太阳表面温度比较低的太阳大气层时,被大气层内存在着的从太阳蒸发出来的多种元素的气体吸收,到达地球时形成吸收光谱。
B错:日光灯是低压蒸气发光,所以产生的是线状光谱。
C对:钠盐在酒精灯火焰上汽化后产生线状光谱。
D错:白光通过钠蒸气产生的光谱是钠的吸收光谱。
2. 根据玻尔理论,氢原子的电子由外层轨道跃迁到内层轨道后( )
A.原子的能量增加,电子的动能减少
B.原子的能量增加,电子的动能增加
C.原子的能量减少,电子的动能减少
D.原子的能量减少,电子的动能增加
解析:电子由外层轨道跃迁到内层轨道时,放出光子,总能量减少;由可知半径越小,动能越大。
D
B
3.下列对氢原子光谱实验规律的认识中,正确的是( )
A.因为氢原子核外只有一个电子,所以氢原子只能产生一种波长的光
B.氢原子产生的光谱是一系列波长不连续的谱线
C.氢原子产生的光谱是一系列亮度不连续的谱线
D.氢原子产生的光的波长大小与氢气放电管放电强弱有关
解析:A、C错,B对:氢原子光谱是线状谱,其波长是一系列不连续的、分立的特征谱线,并不是只含有一种波长的光,也不是亮度不连续的谱线。
D错:氢原子光谱是氢原子的特征谱线,氢原子发出的光的波长与放电管的放电强弱无关。
4.[多选]关于经典电磁理论与原子的核式结构模型之间的关系,下列说法正确的是( )
A.经典电磁理论很容易解释原子的稳定性
B.根据经典电磁理论,电子绕原子核转动时,电子会不断释放能量,最后被吸附到原子核上
C.根据经典电磁理论,原子光谱应该是连续的
D.原子的核式结构模型彻底否定了结典电磁理论
BC
解析:A错,B、C对:根据经典电磁理论,电子绕原子核转动时,电子会不断释放能量,最后被吸附到原子核上,原子不应该是稳定的,并且发射的光谱应该是连续的。
D错:原子的核式结构模型并没有彻底否定经典电磁理论。
AB
5.[多选]根据玻尔理论,下列说法正确的是( )
A.原子处于定态时,虽然电子做变速运动,但并不向外辐射能量
B.氢原子的核外电子由较高能级跃迁到较低能级时,要释放一定频率的光子,电势能的减少量大于动能的增加量
C.氢原子可以吸收小于使氢原子电离能量的任意能量的光子,因而轨道半径可以连续增大
D.电子没有确定轨道,只存在电子云
解析:A对:氢原子具有稳定能量的状态称为定态,此时电子绕核运动,但它并不向外辐射能量。
B对:氢原子的核外电子由较高能级跃迁到较低能级时,要释放一定频率的光子,电势能的减少量大于动能的增加量。
C错:原子的不同能量状态与电子沿不同的圆轨道绕核运动相对应,而电子的可能轨道的分布是不连续的。
D错:玻尔理论中,电子有确定轨道。
6.如图所示,氢原子从n>2的某一能级跃迁到n=2的能级,辐射出能量为2. 55eV.问最少要给基态的氢原子提供多少电子伏特的能量,才能使它辐射上述能力的光子?
解:氢原子从n>2的某一能级跃迁到n=2的能级,满足
hν=En-E2=2. 55eV
En=hν+E2=-0.85eV,所以n=4
基态氢原子要跃迁到n=4的能级,应提供
ΔE=E4-E1=12.75eV
∞
1
2
3
4
5
n
-13.6
-3.4
-1.51
-0.85
-0.54
0
E/eV
谢 谢!
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
