【新教材】高中物理选择性必修三--2.3气体的等压变化和等容变化 同步精选课件(26页ppt)
文档属性
| 名称 | 【新教材】高中物理选择性必修三--2.3气体的等压变化和等容变化 同步精选课件(26页ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 749.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2022-03-23 10:05:16 | ||
图片预览





文档简介
(共26张PPT)
第
节
3
气体的等压变化和等容变化
高中物理 选择性必修第三册
第二章
知道气体的等压变化,了解盖吕萨克定律并能应用于简单问题。
知道气体的等容变化,了解查理定律并能应用于简单问题。
了解理想气体模型,知道实际气体在什么情况下可以看成理想气体。
能用分子动理论和统计观点解释气体实验定律。
学习目标
引入
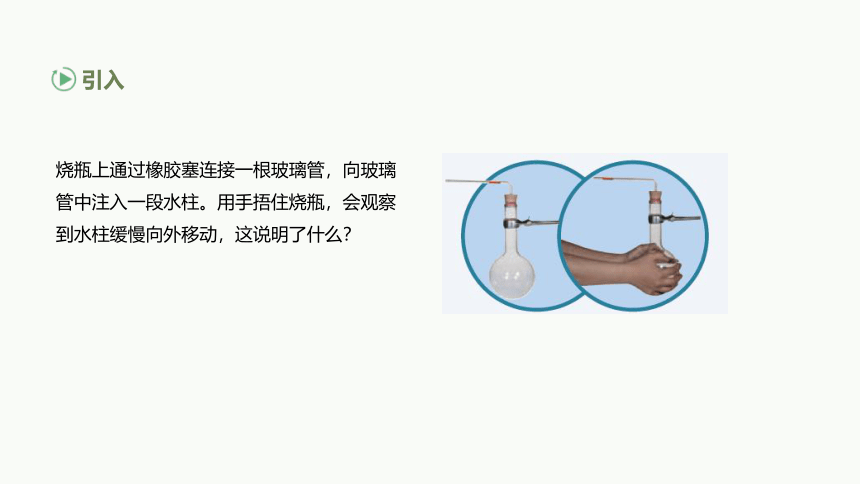
烧瓶上通过橡胶塞连接一根玻璃管,向玻璃管中注入一段水柱。用手捂住烧瓶,会观察到水柱缓慢向外移动,这说明了什么?
一、气体的等压变化
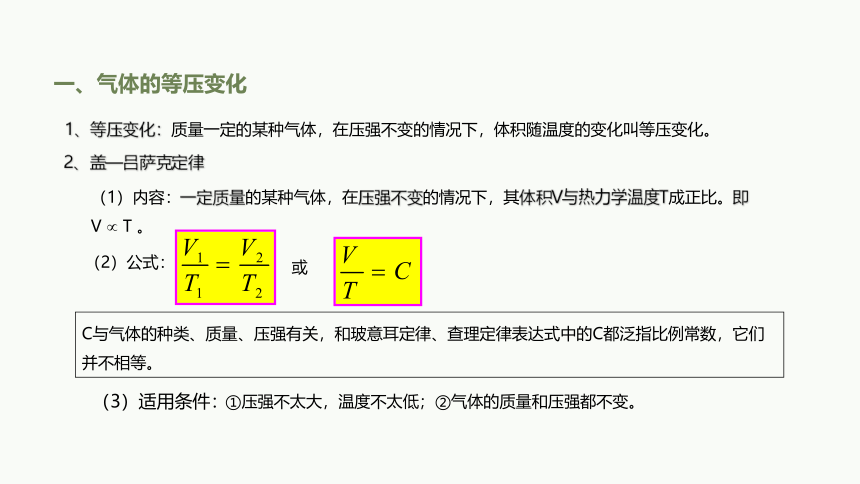
1、等压变化:质量一定的某种气体,在压强不变的情况下,体积随温度的变化叫等压变化。
2、盖—吕萨克定律
(1)内容:一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比。即 V T 。
(2)公式:
或
C与气体的种类、质量、压强有关,和玻意耳定律、查理定律表达式中的C都泛指比例常数,它们并不相等。
(3)适用条件:
①压强不太大,温度不太低;②气体的质量和压强都不变。
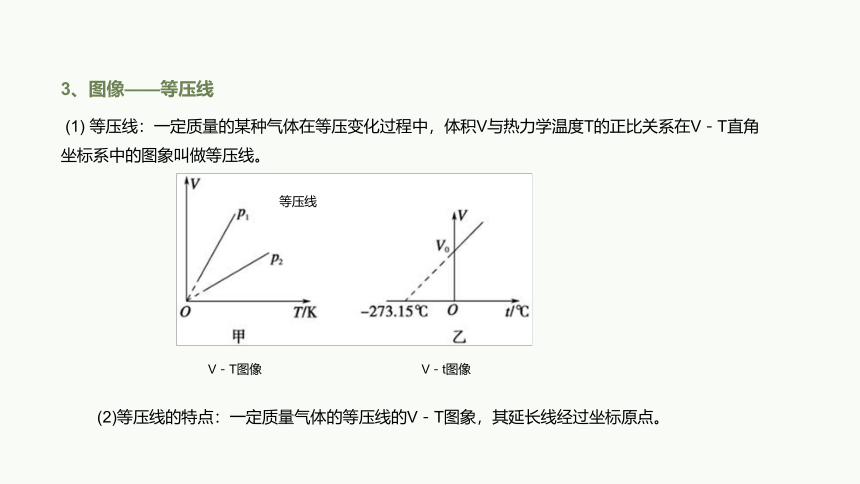
3、图像——等压线
(1) 等压线:一定质量的某种气体在等压变化过程中,体积V与热力学温度T的正比关系在V-T直角坐标系中的图象叫做等压线。
V-t图像
V-T图像
(2)等压线的特点:一定质量气体的等压线的V-T图象,其延长线经过坐标原点。
等压线
③压强越大,斜率越小。如图2:p1>p2>p3>p4。
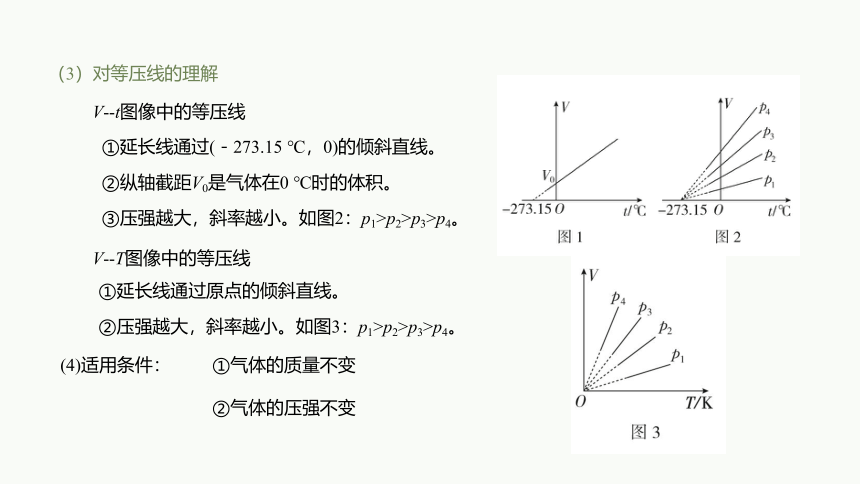
(3)对等压线的理解
V -t图像中的等压线
①延长线通过(-273.15 ℃,0)的倾斜直线。
②纵轴截距V0是气体在0 ℃时的体积。
V -T图像中的等压线
①延长线通过原点的倾斜直线。
②压强越大,斜率越小。如图3:p1>p2>p3>p4。
(4)适用条件:
①气体的质量不变
②气体的压强不变
4、盖—吕萨克定律的分比形式
即一定质量的气体在压强不变的条件下,体积的变化量ΔV与热力学温度的变化量ΔT (等于摄氏温度变化量)成正比。
注意:V与热力学温度T成正比,不与摄氏温度t成正比,但压强的变化 V与摄氏温度 t的变化成正比。
△V
△T
T1
V1
例 如图所示,一导热性能良好、内壁光滑的汽缸竖直放置,在距汽缸底部l=36 cm处有一与汽缸固定连接的卡环,活塞与汽缸底部之间封闭了一定质量的气体,当气体的温度T0=300 K、大气压强p0=1.0×105 Pa时,活塞与汽缸底部之间的距离l0=30 cm,不计活塞的质量和厚度,现对汽缸加热,使活塞缓慢上升,求:
(1)活塞刚到卡环处时封闭气体的温度T1;
(2)封闭气体温度升高到T2=540 K时的压强p2。
【解】(1)活塞从开始至刚到卡环的过程做等压变化,设汽缸的横截面积为S
由盖-吕萨克定律得 代入数据得。
(2)活塞到达卡环后做等容变化,由查理定律得
代入数据得。
二、气体的等容变化
1、等容变化:一定质量的某种气体,在体积不变的情况下,压强随温度的变化叫等容变化。
2、查理定律
(1)内容:一定质量的某种气体,在体积不变的情况下,它的压强p与热力学温度T成正比,即p T 。
(2)公式:
或
C与气体的种类、质量、体积有关,和玻意耳定律表达式中的C都泛指比例常数,它们并不相等。
(3)适用条件:
①压强不太大,温度不太低;②气体的质量和体积都不变。
3、图像——等容线
(1)等容线:一定质量的某种气体在等容变化过程中,压强p跟热力学温度T的正比关系,p-T在直角坐标系中的图象叫做等容线。
p0
P-t图像
P-T图像
等容线
(2)等容线的特点:一定质量的气体的p—T图线其延长线过坐标原点。
③体积越大,斜率越小。如图2:V1>V2>V3>V4。
(3)对等容线的理解
p- t图像中的等压线
①延长线通过(-273.15 ℃,0)的倾斜直线。
②纵轴截距p0是气体在0 ℃时的压强。
V -T图像中的等压线
①延长线通过原点的倾斜直线。
②体积越大,斜率越小。如图3:V1>V2>V3>V4。
(4)适用条件:
①气体的质量不变
②气体的体积不变
4、查理定律的分比形式
△p
△T
T1
p1
即一定质量的气体在体积不变的条件下,压强的变化量Δp与热力学温度的变化量ΔT(等于摄氏温度变化量)成正比。
注意:p与热力学温度T成正比,不与摄氏温度t成正比,但压强的变化 P与摄氏温度 t的变化成正比。
5、应用
(1)高压锅内的食物易熟;
(2)打足了气的车胎在阳光下曝晒会胀破;
(3)使凹进的乒乓球恢复原状。
描述气体状态的三个参量:
T不变,p、V变化:玻意耳定律
V不变,p、T变化:查理定律
p不变,V、T变化:盖-吕萨克定律
若,p、V、T 都变化,会遵循什么样的规律?
适用条件:压强不太大,温度不太低
p、V、T
例 某种气体的压强为2×105Pa,体积为1m3,温度为200K。它经过等温过程后体积变为2m3。随后,又经过等容变化,温度变为300K,求此时气体的压强.
解:
根据查理定律,有
状态1:p1=2×105Pa,V1=1m3,T1=200K
根据玻意耳定律,有p1V1=p2V2
等温后状态2:p2= ,V2=2m3,T2=200K
等容后状态3:p3= ,V3=2m3,T3=300K
可得
可得
T1=T2
V1=V2
三、理想气体
假设有这样一种气体,它在任何温度和任何压强下都能严格地遵从气体实验定律,我们把这样的气体叫做“理想气体”。
理想气体具有那些特点呢?
1、理想气体是不存在的,是一种理想模型。
2、在温度不太低,压强不太大时实际气体都可看成是理想气体。
一定质量的理想气体的内能仅由温度决定 ,与气体的体积无关.
4、从能量上说:理想气体的微观本质是忽略了分子力,没有分子势能,理想气体的内能只有分子动能。
3、从微观上说:分子间以及分子和器壁间,除碰撞外无其他作用力,分子本身没有体积,即它所占据的空间认为都是可以被压缩的空间。
理想气体的状态方程
1、内容:一定质量的某种理想气体在从一个状态变化到另一个状态时,尽管p、V、T都
可能改变,但是压强跟体积的乘积与热力学温度的比值保持不变。
2、公式:
或
3、使用条件:
一定质量的某种理想气体.
注:恒量C由理想气体的质量和种类决定,即由理想气体的物质的量决定
①当T1=T2时,p1V1=p2V2 (玻意耳定律)
②当V1=V2时, (查理定律)
③当 p1=p2时, (盖-铝萨克定律)
(4)气体的三个实验定律是理想气体状态方程的特例:
3.理想气体状态方程的应用
(1)解题步骤
①确定研究对象,即某一定质量的理想气体,分析它的变化过程;
②确定初、末两状态,准确找出初、末两状态的六个状态参量,特别是压强;
③用理想气体状态方程列式,并求解。
(2)注意:
①气体质量保持不变
②T必须是热力学温度,公式两边p和V单位统一,可不是国际单位。
四、气体实验定律的微观解释
1、玻意耳定律:
一定质量的某种理想气体,温度保持不变时,分子的平均动能是一定的。在这种情况下,体积减小时,分子的分子密集程度增大,气体的压强就增大。
3、查理定律:
一定质量的某种理想气体,体积保持不变时,分子的密集程度保持不变。在这种情况下,温度升高时,分子的平均动能增大,气体的压强就增大。
2、盖-吕萨克定律:
一定质量的某种理想气体,温度升高时,分子的平均动能增大;只有气体的体积同时增大,使分子的密集程度减少,才能保持压强不变。
T 不变
V 不变
p 不变
本课小结
一、气体等压变化,
二、气体等容变化
三、理想气体状态方程
1、三个实验定律是理想气体状态方程的特例
2、适用条件
3、应用步骤
当堂检测
1.对于一定质量的理想气体,下列状态变化可能的是 ( )
A.使气体体积增大,温度降低,压强减小
B.使气体温度升高,体积不变,压强减小
C.使气体温度不变,压强、体积同时增大
D.使气体温度升高,压强减小,体积减小
解析:根据=C,若V增大,T减小,则p减小;若V不变,T增大,则p增大;若T不变,p增大,则V减小;若T增大,p减小,则V增大。
A
2.对一定质量的理想气体,下列说法正确的是( )
A.体积不变,压强增大时,气体分子的平均动能一定增大
B.温度不变,压强减小时,单位时间内撞击单位面积器壁的分子数增多
C.压强不变,温度降低时,单位时间内撞击单位面积器壁的分子数减少
D.温度升高,压强和体积都可能不变
【解析】A对:理想气体的质量一定,分子的总数是一定的,体积不变,分子的密集程度不变,故要使压强增大,单位时间内与器壁碰撞的分子数增多,气体分子的平均动能一定增大。
B错:当温度不变时,分子的平均动能不变,要使压强减小,则分子的密集程度一定减小,即单位时间内撞击单位面积器壁的分子数减少。
C错:当温度降低时,分子的平均动能减小,要保持压强不变,则分子的密集程度一定增大,即单位时间内撞击单位面积器壁的分子数增多。
D错:温度升高,压强和体积至少有一个要发生变化,不可能都不变。
A
3.一定质量的理想气体,由状态a经状态b变化到状态c,p-T图像如图所示,x下图中p-V图像能正确反映出这种变化过程的是 ( )
A B C D
提示:由题图可知,理想气体由a到b经历了等容变化,压强增大,温度升高;由b到c经历了等温变化,压强减小,体积变大。
C
4.如图所示,是一定质量的气体从状态A经状态B、C到状态D的p-T图像,已知气体在状态B时的体积是8 L,求VA、VC和VD,并画出此过程的V-T图像。
解:A→B为等温过程,由玻意耳定律得pAVA=pBVB,
所以VA=VB=×8 L=4 L。
B→C为等容过程,所以VC=VB=8 L。
C→D为等压过程,有=,
则VD==×8 L= L≈10.7 L。
此过程的V-T图像如图所示。
谢 谢!
第
节
3
气体的等压变化和等容变化
高中物理 选择性必修第三册
第二章
知道气体的等压变化,了解盖吕萨克定律并能应用于简单问题。
知道气体的等容变化,了解查理定律并能应用于简单问题。
了解理想气体模型,知道实际气体在什么情况下可以看成理想气体。
能用分子动理论和统计观点解释气体实验定律。
学习目标
引入
烧瓶上通过橡胶塞连接一根玻璃管,向玻璃管中注入一段水柱。用手捂住烧瓶,会观察到水柱缓慢向外移动,这说明了什么?
一、气体的等压变化
1、等压变化:质量一定的某种气体,在压强不变的情况下,体积随温度的变化叫等压变化。
2、盖—吕萨克定律
(1)内容:一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比。即 V T 。
(2)公式:
或
C与气体的种类、质量、压强有关,和玻意耳定律、查理定律表达式中的C都泛指比例常数,它们并不相等。
(3)适用条件:
①压强不太大,温度不太低;②气体的质量和压强都不变。
3、图像——等压线
(1) 等压线:一定质量的某种气体在等压变化过程中,体积V与热力学温度T的正比关系在V-T直角坐标系中的图象叫做等压线。
V-t图像
V-T图像
(2)等压线的特点:一定质量气体的等压线的V-T图象,其延长线经过坐标原点。
等压线
③压强越大,斜率越小。如图2:p1>p2>p3>p4。
(3)对等压线的理解
V -t图像中的等压线
①延长线通过(-273.15 ℃,0)的倾斜直线。
②纵轴截距V0是气体在0 ℃时的体积。
V -T图像中的等压线
①延长线通过原点的倾斜直线。
②压强越大,斜率越小。如图3:p1>p2>p3>p4。
(4)适用条件:
①气体的质量不变
②气体的压强不变
4、盖—吕萨克定律的分比形式
即一定质量的气体在压强不变的条件下,体积的变化量ΔV与热力学温度的变化量ΔT (等于摄氏温度变化量)成正比。
注意:V与热力学温度T成正比,不与摄氏温度t成正比,但压强的变化 V与摄氏温度 t的变化成正比。
△V
△T
T1
V1
例 如图所示,一导热性能良好、内壁光滑的汽缸竖直放置,在距汽缸底部l=36 cm处有一与汽缸固定连接的卡环,活塞与汽缸底部之间封闭了一定质量的气体,当气体的温度T0=300 K、大气压强p0=1.0×105 Pa时,活塞与汽缸底部之间的距离l0=30 cm,不计活塞的质量和厚度,现对汽缸加热,使活塞缓慢上升,求:
(1)活塞刚到卡环处时封闭气体的温度T1;
(2)封闭气体温度升高到T2=540 K时的压强p2。
【解】(1)活塞从开始至刚到卡环的过程做等压变化,设汽缸的横截面积为S
由盖-吕萨克定律得 代入数据得。
(2)活塞到达卡环后做等容变化,由查理定律得
代入数据得。
二、气体的等容变化
1、等容变化:一定质量的某种气体,在体积不变的情况下,压强随温度的变化叫等容变化。
2、查理定律
(1)内容:一定质量的某种气体,在体积不变的情况下,它的压强p与热力学温度T成正比,即p T 。
(2)公式:
或
C与气体的种类、质量、体积有关,和玻意耳定律表达式中的C都泛指比例常数,它们并不相等。
(3)适用条件:
①压强不太大,温度不太低;②气体的质量和体积都不变。
3、图像——等容线
(1)等容线:一定质量的某种气体在等容变化过程中,压强p跟热力学温度T的正比关系,p-T在直角坐标系中的图象叫做等容线。
p0
P-t图像
P-T图像
等容线
(2)等容线的特点:一定质量的气体的p—T图线其延长线过坐标原点。
③体积越大,斜率越小。如图2:V1>V2>V3>V4。
(3)对等容线的理解
p- t图像中的等压线
①延长线通过(-273.15 ℃,0)的倾斜直线。
②纵轴截距p0是气体在0 ℃时的压强。
V -T图像中的等压线
①延长线通过原点的倾斜直线。
②体积越大,斜率越小。如图3:V1>V2>V3>V4。
(4)适用条件:
①气体的质量不变
②气体的体积不变
4、查理定律的分比形式
△p
△T
T1
p1
即一定质量的气体在体积不变的条件下,压强的变化量Δp与热力学温度的变化量ΔT(等于摄氏温度变化量)成正比。
注意:p与热力学温度T成正比,不与摄氏温度t成正比,但压强的变化 P与摄氏温度 t的变化成正比。
5、应用
(1)高压锅内的食物易熟;
(2)打足了气的车胎在阳光下曝晒会胀破;
(3)使凹进的乒乓球恢复原状。
描述气体状态的三个参量:
T不变,p、V变化:玻意耳定律
V不变,p、T变化:查理定律
p不变,V、T变化:盖-吕萨克定律
若,p、V、T 都变化,会遵循什么样的规律?
适用条件:压强不太大,温度不太低
p、V、T
例 某种气体的压强为2×105Pa,体积为1m3,温度为200K。它经过等温过程后体积变为2m3。随后,又经过等容变化,温度变为300K,求此时气体的压强.
解:
根据查理定律,有
状态1:p1=2×105Pa,V1=1m3,T1=200K
根据玻意耳定律,有p1V1=p2V2
等温后状态2:p2= ,V2=2m3,T2=200K
等容后状态3:p3= ,V3=2m3,T3=300K
可得
可得
T1=T2
V1=V2
三、理想气体
假设有这样一种气体,它在任何温度和任何压强下都能严格地遵从气体实验定律,我们把这样的气体叫做“理想气体”。
理想气体具有那些特点呢?
1、理想气体是不存在的,是一种理想模型。
2、在温度不太低,压强不太大时实际气体都可看成是理想气体。
一定质量的理想气体的内能仅由温度决定 ,与气体的体积无关.
4、从能量上说:理想气体的微观本质是忽略了分子力,没有分子势能,理想气体的内能只有分子动能。
3、从微观上说:分子间以及分子和器壁间,除碰撞外无其他作用力,分子本身没有体积,即它所占据的空间认为都是可以被压缩的空间。
理想气体的状态方程
1、内容:一定质量的某种理想气体在从一个状态变化到另一个状态时,尽管p、V、T都
可能改变,但是压强跟体积的乘积与热力学温度的比值保持不变。
2、公式:
或
3、使用条件:
一定质量的某种理想气体.
注:恒量C由理想气体的质量和种类决定,即由理想气体的物质的量决定
①当T1=T2时,p1V1=p2V2 (玻意耳定律)
②当V1=V2时, (查理定律)
③当 p1=p2时, (盖-铝萨克定律)
(4)气体的三个实验定律是理想气体状态方程的特例:
3.理想气体状态方程的应用
(1)解题步骤
①确定研究对象,即某一定质量的理想气体,分析它的变化过程;
②确定初、末两状态,准确找出初、末两状态的六个状态参量,特别是压强;
③用理想气体状态方程列式,并求解。
(2)注意:
①气体质量保持不变
②T必须是热力学温度,公式两边p和V单位统一,可不是国际单位。
四、气体实验定律的微观解释
1、玻意耳定律:
一定质量的某种理想气体,温度保持不变时,分子的平均动能是一定的。在这种情况下,体积减小时,分子的分子密集程度增大,气体的压强就增大。
3、查理定律:
一定质量的某种理想气体,体积保持不变时,分子的密集程度保持不变。在这种情况下,温度升高时,分子的平均动能增大,气体的压强就增大。
2、盖-吕萨克定律:
一定质量的某种理想气体,温度升高时,分子的平均动能增大;只有气体的体积同时增大,使分子的密集程度减少,才能保持压强不变。
T 不变
V 不变
p 不变
本课小结
一、气体等压变化,
二、气体等容变化
三、理想气体状态方程
1、三个实验定律是理想气体状态方程的特例
2、适用条件
3、应用步骤
当堂检测
1.对于一定质量的理想气体,下列状态变化可能的是 ( )
A.使气体体积增大,温度降低,压强减小
B.使气体温度升高,体积不变,压强减小
C.使气体温度不变,压强、体积同时增大
D.使气体温度升高,压强减小,体积减小
解析:根据=C,若V增大,T减小,则p减小;若V不变,T增大,则p增大;若T不变,p增大,则V减小;若T增大,p减小,则V增大。
A
2.对一定质量的理想气体,下列说法正确的是( )
A.体积不变,压强增大时,气体分子的平均动能一定增大
B.温度不变,压强减小时,单位时间内撞击单位面积器壁的分子数增多
C.压强不变,温度降低时,单位时间内撞击单位面积器壁的分子数减少
D.温度升高,压强和体积都可能不变
【解析】A对:理想气体的质量一定,分子的总数是一定的,体积不变,分子的密集程度不变,故要使压强增大,单位时间内与器壁碰撞的分子数增多,气体分子的平均动能一定增大。
B错:当温度不变时,分子的平均动能不变,要使压强减小,则分子的密集程度一定减小,即单位时间内撞击单位面积器壁的分子数减少。
C错:当温度降低时,分子的平均动能减小,要保持压强不变,则分子的密集程度一定增大,即单位时间内撞击单位面积器壁的分子数增多。
D错:温度升高,压强和体积至少有一个要发生变化,不可能都不变。
A
3.一定质量的理想气体,由状态a经状态b变化到状态c,p-T图像如图所示,x下图中p-V图像能正确反映出这种变化过程的是 ( )
A B C D
提示:由题图可知,理想气体由a到b经历了等容变化,压强增大,温度升高;由b到c经历了等温变化,压强减小,体积变大。
C
4.如图所示,是一定质量的气体从状态A经状态B、C到状态D的p-T图像,已知气体在状态B时的体积是8 L,求VA、VC和VD,并画出此过程的V-T图像。
解:A→B为等温过程,由玻意耳定律得pAVA=pBVB,
所以VA=VB=×8 L=4 L。
B→C为等容过程,所以VC=VB=8 L。
C→D为等压过程,有=,
则VD==×8 L= L≈10.7 L。
此过程的V-T图像如图所示。
谢 谢!
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
