第6章常用的金属和盐训练-2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案)
文档属性
| 名称 | 第6章常用的金属和盐训练-2021-2022学年九年级化学沪教版(上海)第二学期(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 179.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-23 08:20:45 | ||
图片预览


文档简介
第6章常用的金属和盐训练2021-2022学年九年级化学沪教版(上海)第二学期
一、单选题
1.《吕氏春秋》记载“金(铜单质)柔锡(锡单质)柔,合两柔则刚(坚硬)”。这句话说明合金具有的特性是
A.熔点一般比其组成金属低
B.抗腐蚀性一般比其组成金属强
C.硬度一般比其组成金属大
D.耐磨性一般比其组成金属耐磨
2.下列物质的名称、俗名和化学式均正确的是( )
A.碳酸钠 纯碱 NaCO3 B.碳酸氢钠 小苏打 NaHCO3
C.水 干冰 H2O D.氢氧化钙 烧碱 Ca(OH)2
3.银是一种银白色金属,密度较大,具有良好的导电性,长期放置会被氧化而发黑。其中属于银的化学性质的是
A.银白色 B.密度较大 C.导电性良好 D.能被氧化
4.科学家发现一种新金属。根据下表信息推测该金属不适合的用途是( )
熔点 密度 强度 导电性 导热性 抗腐蚀性
2500℃[ 3g/cm3 与钢相似 良好 良好 优异
A.焊接金属 B.用于通讯设备 C.制造外科手术刀 D.制造航天飞机
5.垃圾分类投放已成为新时尚。某同学清理教室时收集到如下垃圾:
①废纸 ②铝制易拉罐 ③废口罩 ④矿泉水瓶 ⑤废电池,应投入图1所示标志垃圾箱的是
A.①②④
B.①②③④
C.①②③⑤
D.①②③④⑤
6.X、R表示两种金属,在溶液中发生反应:X+3RNO3=3R+X(NO3)3。下列说法不正确的是
A.该反应是置换反应
B.若X是Al,R是Ag,则反应后溶液质量减少
C.X可能是Fe,R可能是Cu
D.X的金属活动性比R强
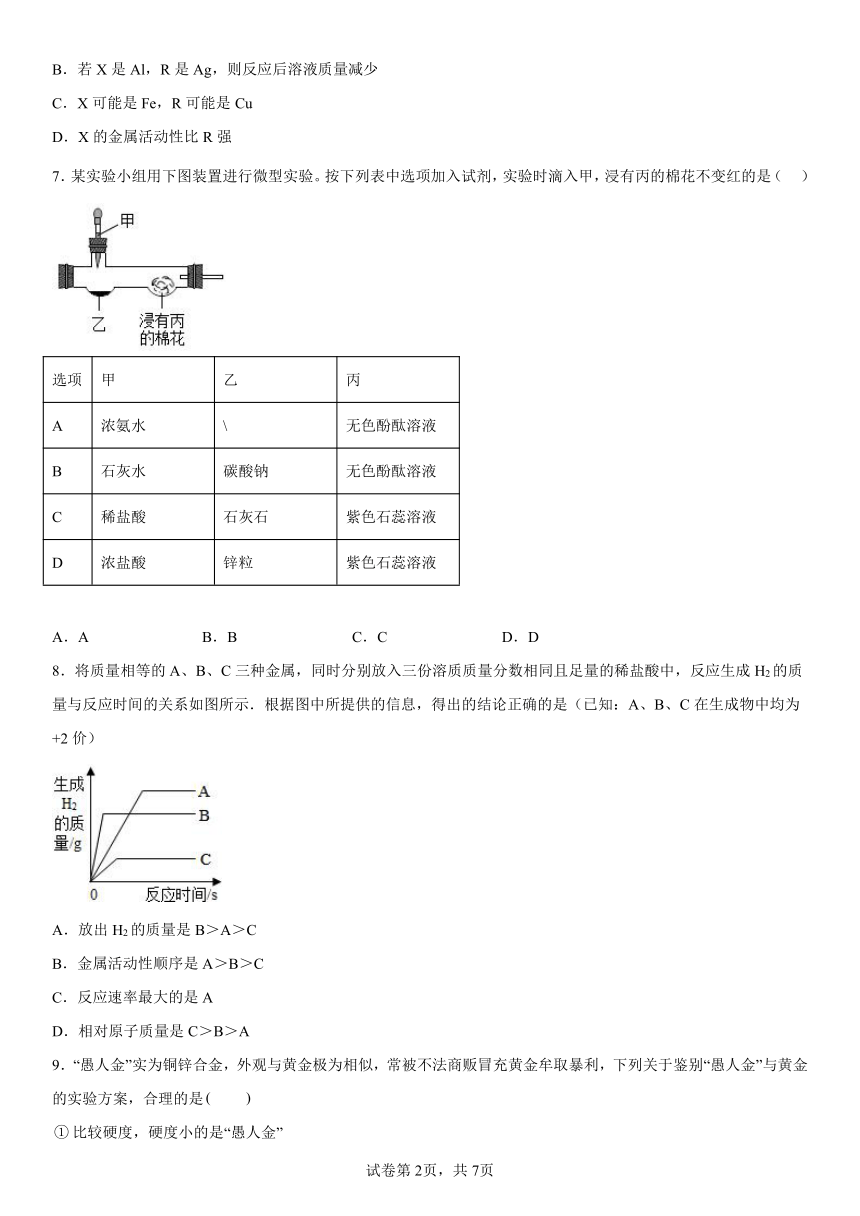
7.某实验小组用下图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 \ 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 锌粒 紫色石蕊溶液
A.A B.B C.C D.D
8.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,得出的结论正确的是(已知:A、B、C在生成物中均为+2价)
A.放出H2的质量是B>A>C
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是C>B>A
9.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是
比较硬度,硬度小的是“愚人金”
灼烧,表面变色的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A. B. C. D.
10.下列关于金属的说法中,不正确的是
A.铜有良好的导电性,常用于制作导线
B.所有的金属都能与稀盐酸反应
C.铁制品在干燥的空气中不易生锈
D.不锈钢具有较强的耐腐蚀性,可用于制作医疗器械
11.碳酸钠俗称纯碱、苏打,广泛用于玻璃、造纸、防治和洗涤剂的生产等,纯碱工业的发展对于促进国民经济发展发挥了重要的作用。下列有关纯碱碳酸钠的叙述不正确的是( )
A.用纯碱可除去面团发酵时产生的有机酸
B.可用纯碱代替洗涤灵,用于洗涤餐具表面的油污
C.纯碱溶液的pH>7呈碱性,但不属于碱,而是盐类
D.“冬天捞碱”可说明纯碱的溶解度随温度的变化不大
二、简答题
12.请用学过的知识回答下列关于燃烧与灭火的相关问题。
(1)酒精灯内的酒精不小心洒出,在桌面上燃烧起来,应采取的灭火方法是______。
(2)用嘴吹灭燃着的蜡烛,其灭火原理是______。
(3)请写一个氧化产物和还原产物相同的化学方程式______。
(4)将煤制成蜂窝状,其目的是______。
13.中国考古专家在三星堆遗址的发现与研究,证明了中华文明起源的多元性。
(1)三星堆考古发掘中,出土的青铜面具锈迹斑斑,黄金面具仍金光灿灿,从物质性质的角度解释其原因是_______。
(2)研究人员用碳14年代检测方法进行分析,初步判断三星堆4号坑属于商代晚期。已知碳14原子中的质子数为6,中子数为8,则该原子的核外电子数为_______。
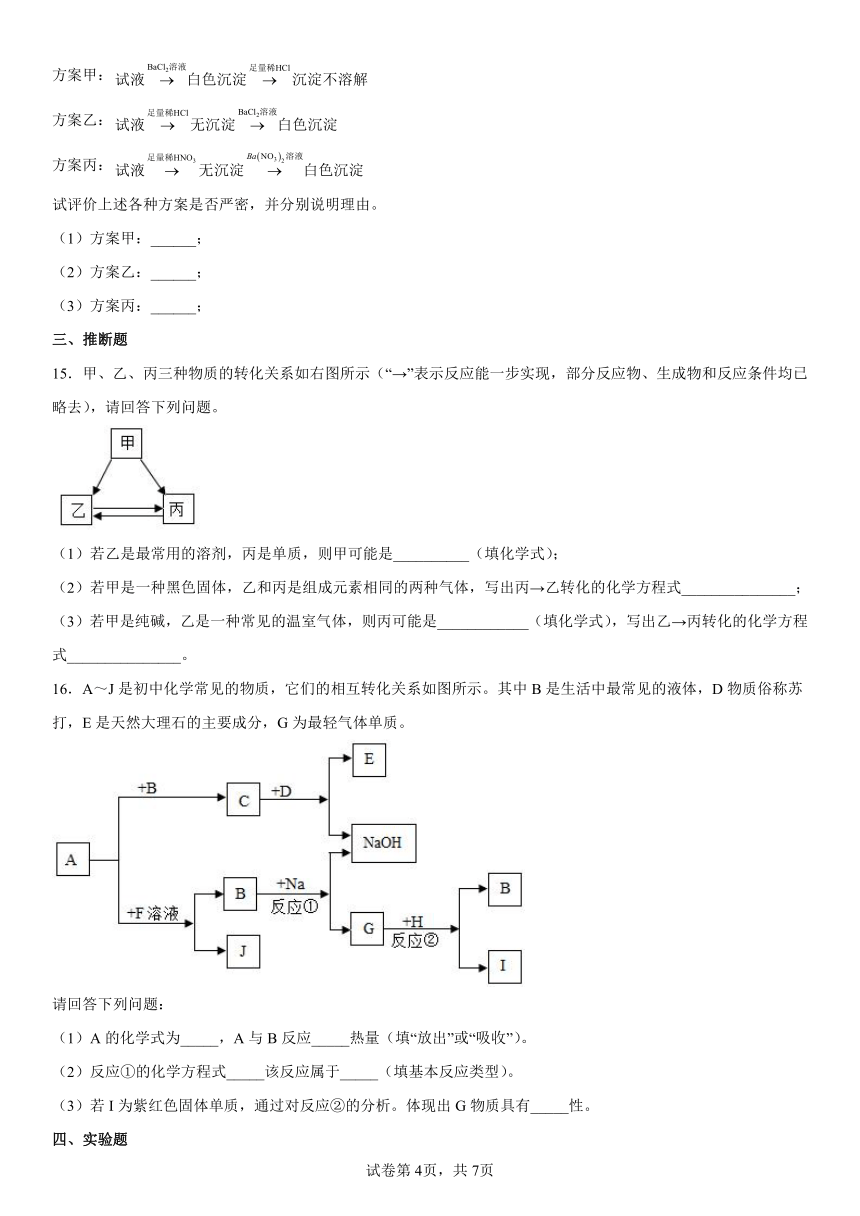
14.三位学生设计了下述三个方案,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试液中有。
(已知:)
方案甲:
方案乙:
方案丙:
试评价上述各种方案是否严密,并分别说明理由。
(1)方案甲:______;
(2)方案乙:______;
(3)方案丙:______;
三、推断题
15.甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应能一步实现,部分反应物、生成物和反应条件均已略去),请回答下列问题。
(1)若乙是最常用的溶剂,丙是单质,则甲可能是__________(填化学式);
(2)若甲是一种黑色固体,乙和丙是组成元素相同的两种气体,写出丙→乙转化的化学方程式_______________;
(3)若甲是纯碱,乙是一种常见的温室气体,则丙可能是____________(填化学式),写出乙→丙转化的化学方程式_______________。
16.A~J是初中化学常见的物质,它们的相互转化关系如图所示。其中B是生活中最常见的液体,D物质俗称苏打,E是天然大理石的主要成分,G为最轻气体单质。
请回答下列问题:
(1)A的化学式为_____,A与B反应_____热量(填“放出”或“吸收”)。
(2)反应①的化学方程式_____该反应属于_____(填基本反应类型)。
(3)若I为紫红色固体单质,通过对反应②的分析。体现出G物质具有_____性。
四、实验题
17.根据图回答问题:
(1)由实验1得到的结论是 ______________________________ 。为确保实验成功,操作时需注意的问题是 ________________________________________________ 。
(2)实验2的目的是 _________________________________ 。
(3)实验3中发生反应的化学方程式为 ____________________________ ,当观察到溶液由红色变为无色后,小明想知道反应后溶液中除NaCl外,是否还含有其它溶质(不考虑酚酞),于是他向反应后的溶液中加入一种试剂,从而得出了结论。小明加入的试剂可能是 _____________________ 。
18.一氧化碳还原氧化铁的装置如图(B中盛有澄清的石灰水),回答问题.
(1)写出A中发生反应的化学方程式.________
(2)C装置的作用是________
(3)为探究锌、铁、铜的活动性顺序,某同学设计了一组实验:
①锌片浸入稀硫酸中
②铜片浸入稀硫酸中
③锌片浸入硫酸亚铁溶液
请补充一个实验来证明三种金属活动性顺序(写出实验步骤、现象)________.
结论:锌、铁、铜的活泼性顺序为.
19.金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)铜可用来制作导线,是因为其具有良好的延展性和________。
(2)在空气中,铝表面易生成一层致密的氧化膜,氧化膜的主要成分是________。
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行以下实验:
实验序号 实验过程 实验现象
a 锌粉和铁粉分别与5%的盐酸反应 锌粉产生气体快
b 铁粉和铁片分别与15%的盐酸反应 铁粉产生气体快
c 铁片分别与5%的盐酸和15%的盐酸反应 15%的盐酸产生气体快
由此得出影响金属与酸反应快慢的因素有:
a.__________________________________;
b.______________________________________;
c.________________________________________。
(4)小明将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液。(提示:金属活动性顺序:锌>铜>银)
①锌和硝酸银溶液反应的化学方程式是______________________________________。
②若滤液为蓝色,则滤液中一定含有的金属离子是______________(写离子符号)。
五、计算题
20.某同学发现张大爷家菜园中的蔬菜生长迟缓,便帮他购买施用了一包化肥,如图为该包化肥的外包装标签上的部分说明,请仔细阅读标签并回答下列问题(商品的标签或说明书上常常用质量分数来表示某物质的成分或纯度):
(1)硝酸铵中氮元素和氢元素的质量比为 (填最简整数比)。
(2)硝酸铵中氮元素的质量分数为 ,因此证明这包氮肥包装标签的说明 (填“有”或“没有” )虚假之处。
(3)经化验证明这包化肥的纯度为96%(其余成分中无氮元素),则这包化肥中共含有多少kg的氮元素。(写出计算过程)
21.赤铁矿的主要成分是Fe2O3,可用于冶炼铁(3CO+Fe2O32Fe+3CO2)。某地出产一种赤铁矿,其中Fe2O3的质量分数为64%,试计算:用100 t该赤铁矿经过充分冶炼,最多可以生产出含铁96%的生铁多少吨?(计算结果保留两位小数)
22.某化学兴趣小组的同学为测定假黄金(铜锌合金)中锌的质量,取20克假黄金置于烧杯中,取120克稀盐酸,分6次加入,充分反应,实验数据如下:
实验次序 1 2 3 4 5 6
加入稀盐酸的质量/g 20 20 20 20 20 20
剩余固体的质量/g 18.7 17.4 m 14.8 13.5 13.5
请回答:
(1)表中m=______。
(2)假黄金(铜锌合金)中锌的质量是______g。
(3)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)
23.为测定某CuSO4溶液中溶质的质量分数,取150gCuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50gCuSO4溶液完全反应时,所得沉淀的质量为______________g。
(2)CuSO4溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.D
4.A
5.A
6.C
7.B
8.D
9.D
10.B
11.D
12. 用湿抹布盖灭 降温至蜡烛的着火点以下 2H2+O22H2O 增大可燃物与氧气的接触面积,促进燃烧
13. 黄金金属活动性弱,不容易发生化学反应,青铜中金属活动性强,容易发生化学反应 6
14. 不严密,因为含有而不含的无色溶液也会出现此方案的现象 严密,因为只有含有的无色溶液才会出现此方案的现象 不严密,因为含有而不含的无色溶液也会出现此方案的现象
15. H2O2或H2SO4、HCl其它合理答案也给分 CO2+C 2CO或2CO+O2 2CO2 CaCO3或BaCO3其它合理答案可给分 CO2+Ca (OH)2=CaCO3+H2O
16. CaO 放出 置换反应 还原
17. 二氧化碳不燃烧也不支持燃烧,密度比空气大 沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳 探究反应物的状态对反应速率的影响 紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)
18. 点燃尾气,防止污染空气 将铁片浸入硫酸铜溶液中,铁片表面有红色固体析出(或将铁片浸入稀硫酸中,有气泡产生,但产生气泡的速度比锌片慢)
19. 导电性 氧化铝(或Al2O3) a.金属活动性(金属活动性越强,反应速率越快) b.金属与酸的接触面积(接触面积越大,反应速率越快) c.酸的浓度(酸的浓度越大,反应速率越快) Zn+2AgNO3===Zn(NO3)2+2Ag Zn2+、Cu2+
20.(1)7:1;(2)35% ;有;(3)50kg×96%×35%=16.8kg
21.设最多可以炼出含铁96%的生铁质量为x
x≈46.67t
答:最多可以炼出含铁96%的生铁46.67t。
22.(1)16.1
(2)6.5
(3)解:设所用稀盐酸中溶质的质量分数是x
x=7.3%
答:所用稀盐酸中溶质的质量分数是7.3%。
23.(1)9.8g (2)32%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.《吕氏春秋》记载“金(铜单质)柔锡(锡单质)柔,合两柔则刚(坚硬)”。这句话说明合金具有的特性是
A.熔点一般比其组成金属低
B.抗腐蚀性一般比其组成金属强
C.硬度一般比其组成金属大
D.耐磨性一般比其组成金属耐磨
2.下列物质的名称、俗名和化学式均正确的是( )
A.碳酸钠 纯碱 NaCO3 B.碳酸氢钠 小苏打 NaHCO3
C.水 干冰 H2O D.氢氧化钙 烧碱 Ca(OH)2
3.银是一种银白色金属,密度较大,具有良好的导电性,长期放置会被氧化而发黑。其中属于银的化学性质的是
A.银白色 B.密度较大 C.导电性良好 D.能被氧化
4.科学家发现一种新金属。根据下表信息推测该金属不适合的用途是( )
熔点 密度 强度 导电性 导热性 抗腐蚀性
2500℃[ 3g/cm3 与钢相似 良好 良好 优异
A.焊接金属 B.用于通讯设备 C.制造外科手术刀 D.制造航天飞机
5.垃圾分类投放已成为新时尚。某同学清理教室时收集到如下垃圾:
①废纸 ②铝制易拉罐 ③废口罩 ④矿泉水瓶 ⑤废电池,应投入图1所示标志垃圾箱的是
A.①②④
B.①②③④
C.①②③⑤
D.①②③④⑤
6.X、R表示两种金属,在溶液中发生反应:X+3RNO3=3R+X(NO3)3。下列说法不正确的是
A.该反应是置换反应
B.若X是Al,R是Ag,则反应后溶液质量减少
C.X可能是Fe,R可能是Cu
D.X的金属活动性比R强
7.某实验小组用下图装置进行微型实验。按下列表中选项加入试剂,实验时滴入甲,浸有丙的棉花不变红的是( )
选项 甲 乙 丙
A 浓氨水 \ 无色酚酞溶液
B 石灰水 碳酸钠 无色酚酞溶液
C 稀盐酸 石灰石 紫色石蕊溶液
D 浓盐酸 锌粒 紫色石蕊溶液
A.A B.B C.C D.D
8.将质量相等的A、B、C三种金属,同时分别放入三份溶质质量分数相同且足量的稀盐酸中,反应生成H2的质量与反应时间的关系如图所示.根据图中所提供的信息,得出的结论正确的是(已知:A、B、C在生成物中均为+2价)
A.放出H2的质量是B>A>C
B.金属活动性顺序是A>B>C
C.反应速率最大的是A
D.相对原子质量是C>B>A
9.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是
比较硬度,硬度小的是“愚人金”
灼烧,表面变色的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A. B. C. D.
10.下列关于金属的说法中,不正确的是
A.铜有良好的导电性,常用于制作导线
B.所有的金属都能与稀盐酸反应
C.铁制品在干燥的空气中不易生锈
D.不锈钢具有较强的耐腐蚀性,可用于制作医疗器械
11.碳酸钠俗称纯碱、苏打,广泛用于玻璃、造纸、防治和洗涤剂的生产等,纯碱工业的发展对于促进国民经济发展发挥了重要的作用。下列有关纯碱碳酸钠的叙述不正确的是( )
A.用纯碱可除去面团发酵时产生的有机酸
B.可用纯碱代替洗涤灵,用于洗涤餐具表面的油污
C.纯碱溶液的pH>7呈碱性,但不属于碱,而是盐类
D.“冬天捞碱”可说明纯碱的溶解度随温度的变化不大
二、简答题
12.请用学过的知识回答下列关于燃烧与灭火的相关问题。
(1)酒精灯内的酒精不小心洒出,在桌面上燃烧起来,应采取的灭火方法是______。
(2)用嘴吹灭燃着的蜡烛,其灭火原理是______。
(3)请写一个氧化产物和还原产物相同的化学方程式______。
(4)将煤制成蜂窝状,其目的是______。
13.中国考古专家在三星堆遗址的发现与研究,证明了中华文明起源的多元性。
(1)三星堆考古发掘中,出土的青铜面具锈迹斑斑,黄金面具仍金光灿灿,从物质性质的角度解释其原因是_______。
(2)研究人员用碳14年代检测方法进行分析,初步判断三星堆4号坑属于商代晚期。已知碳14原子中的质子数为6,中子数为8,则该原子的核外电子数为_______。
14.三位学生设计了下述三个方案,并都认为,如果观察到的现象和自己设计的方案一致,即可确证试液中有。
(已知:)
方案甲:
方案乙:
方案丙:
试评价上述各种方案是否严密,并分别说明理由。
(1)方案甲:______;
(2)方案乙:______;
(3)方案丙:______;
三、推断题
15.甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应能一步实现,部分反应物、生成物和反应条件均已略去),请回答下列问题。
(1)若乙是最常用的溶剂,丙是单质,则甲可能是__________(填化学式);
(2)若甲是一种黑色固体,乙和丙是组成元素相同的两种气体,写出丙→乙转化的化学方程式_______________;
(3)若甲是纯碱,乙是一种常见的温室气体,则丙可能是____________(填化学式),写出乙→丙转化的化学方程式_______________。
16.A~J是初中化学常见的物质,它们的相互转化关系如图所示。其中B是生活中最常见的液体,D物质俗称苏打,E是天然大理石的主要成分,G为最轻气体单质。
请回答下列问题:
(1)A的化学式为_____,A与B反应_____热量(填“放出”或“吸收”)。
(2)反应①的化学方程式_____该反应属于_____(填基本反应类型)。
(3)若I为紫红色固体单质,通过对反应②的分析。体现出G物质具有_____性。
四、实验题
17.根据图回答问题:
(1)由实验1得到的结论是 ______________________________ 。为确保实验成功,操作时需注意的问题是 ________________________________________________ 。
(2)实验2的目的是 _________________________________ 。
(3)实验3中发生反应的化学方程式为 ____________________________ ,当观察到溶液由红色变为无色后,小明想知道反应后溶液中除NaCl外,是否还含有其它溶质(不考虑酚酞),于是他向反应后的溶液中加入一种试剂,从而得出了结论。小明加入的试剂可能是 _____________________ 。
18.一氧化碳还原氧化铁的装置如图(B中盛有澄清的石灰水),回答问题.
(1)写出A中发生反应的化学方程式.________
(2)C装置的作用是________
(3)为探究锌、铁、铜的活动性顺序,某同学设计了一组实验:
①锌片浸入稀硫酸中
②铜片浸入稀硫酸中
③锌片浸入硫酸亚铁溶液
请补充一个实验来证明三种金属活动性顺序(写出实验步骤、现象)________.
结论:锌、铁、铜的活泼性顺序为.
19.金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)铜可用来制作导线,是因为其具有良好的延展性和________。
(2)在空气中,铝表面易生成一层致密的氧化膜,氧化膜的主要成分是________。
(3)某实验小组为了探究影响金属与酸反应快慢的因素,进行以下实验:
实验序号 实验过程 实验现象
a 锌粉和铁粉分别与5%的盐酸反应 锌粉产生气体快
b 铁粉和铁片分别与15%的盐酸反应 铁粉产生气体快
c 铁片分别与5%的盐酸和15%的盐酸反应 15%的盐酸产生气体快
由此得出影响金属与酸反应快慢的因素有:
a.__________________________________;
b.______________________________________;
c.________________________________________。
(4)小明将一小包铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液。(提示:金属活动性顺序:锌>铜>银)
①锌和硝酸银溶液反应的化学方程式是______________________________________。
②若滤液为蓝色,则滤液中一定含有的金属离子是______________(写离子符号)。
五、计算题
20.某同学发现张大爷家菜园中的蔬菜生长迟缓,便帮他购买施用了一包化肥,如图为该包化肥的外包装标签上的部分说明,请仔细阅读标签并回答下列问题(商品的标签或说明书上常常用质量分数来表示某物质的成分或纯度):
(1)硝酸铵中氮元素和氢元素的质量比为 (填最简整数比)。
(2)硝酸铵中氮元素的质量分数为 ,因此证明这包氮肥包装标签的说明 (填“有”或“没有” )虚假之处。
(3)经化验证明这包化肥的纯度为96%(其余成分中无氮元素),则这包化肥中共含有多少kg的氮元素。(写出计算过程)
21.赤铁矿的主要成分是Fe2O3,可用于冶炼铁(3CO+Fe2O32Fe+3CO2)。某地出产一种赤铁矿,其中Fe2O3的质量分数为64%,试计算:用100 t该赤铁矿经过充分冶炼,最多可以生产出含铁96%的生铁多少吨?(计算结果保留两位小数)
22.某化学兴趣小组的同学为测定假黄金(铜锌合金)中锌的质量,取20克假黄金置于烧杯中,取120克稀盐酸,分6次加入,充分反应,实验数据如下:
实验次序 1 2 3 4 5 6
加入稀盐酸的质量/g 20 20 20 20 20 20
剩余固体的质量/g 18.7 17.4 m 14.8 13.5 13.5
请回答:
(1)表中m=______。
(2)假黄金(铜锌合金)中锌的质量是______g。
(3)所用稀盐酸中溶质的质量分数是多少?(写出计算过程)
23.为测定某CuSO4溶液中溶质的质量分数,取150gCuSO4溶液,平均分为三份,每一份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 实验2 实验3
样品质量/g 50 50 50
NaOH溶液质量/g 20 40 60
m/g 44.9 49.8 49.8
(1)50gCuSO4溶液完全反应时,所得沉淀的质量为______________g。
(2)CuSO4溶液中溶质的质量分数。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.D
4.A
5.A
6.C
7.B
8.D
9.D
10.B
11.D
12. 用湿抹布盖灭 降温至蜡烛的着火点以下 2H2+O22H2O 增大可燃物与氧气的接触面积,促进燃烧
13. 黄金金属活动性弱,不容易发生化学反应,青铜中金属活动性强,容易发生化学反应 6
14. 不严密,因为含有而不含的无色溶液也会出现此方案的现象 严密,因为只有含有的无色溶液才会出现此方案的现象 不严密,因为含有而不含的无色溶液也会出现此方案的现象
15. H2O2或H2SO4、HCl其它合理答案也给分 CO2+C 2CO或2CO+O2 2CO2 CaCO3或BaCO3其它合理答案可给分 CO2+Ca (OH)2=CaCO3+H2O
16. CaO 放出 置换反应 还原
17. 二氧化碳不燃烧也不支持燃烧,密度比空气大 沿蜡烛对面一侧烧杯内壁缓缓倾倒二氧化碳 探究反应物的状态对反应速率的影响 紫色石蕊溶液(或锌等活泼金属或碳酸钠溶液等)
18. 点燃尾气,防止污染空气 将铁片浸入硫酸铜溶液中,铁片表面有红色固体析出(或将铁片浸入稀硫酸中,有气泡产生,但产生气泡的速度比锌片慢)
19. 导电性 氧化铝(或Al2O3) a.金属活动性(金属活动性越强,反应速率越快) b.金属与酸的接触面积(接触面积越大,反应速率越快) c.酸的浓度(酸的浓度越大,反应速率越快) Zn+2AgNO3===Zn(NO3)2+2Ag Zn2+、Cu2+
20.(1)7:1;(2)35% ;有;(3)50kg×96%×35%=16.8kg
21.设最多可以炼出含铁96%的生铁质量为x
x≈46.67t
答:最多可以炼出含铁96%的生铁46.67t。
22.(1)16.1
(2)6.5
(3)解:设所用稀盐酸中溶质的质量分数是x
x=7.3%
答:所用稀盐酸中溶质的质量分数是7.3%。
23.(1)9.8g (2)32%
答案第1页,共2页
答案第1页,共2页
