第九单元溶液测试题 -2021-2022学年九年级化学人教版下册(word版有答案)
文档属性
| 名称 | 第九单元溶液测试题 -2021-2022学年九年级化学人教版下册(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 183.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-23 11:10:51 | ||
图片预览



文档简介
第九单元《溶液》测试题
一、单选题
1.溶液在日常生活中应用广泛。下列对溶液的有关说法不正确的是
A.溶液都是无色、透明的液体 B.一种溶液中只能有一种溶剂
C.溶液都是混合物 D.溶液中各部分性质相同
2.溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是
A.白酒 B.蒸馏水 C.医用酒精 D.生理盐水
3.下列物质的用途主要利用其化学性质的是
A.氧气用于医疗急救 B.干冰用于人工降雨
C.铜、铝用于制作导线 D.汽油用于衣物除油
4.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
5.向液体X中加入固体Y,观察到U形管内红墨水左侧液面上升。下列液体X和固体Y的组合,符合题意的是
A.X是水,Y是氧化钙
B.X是水,Y是氢氧化钠
C.X是水,Y是硝酸铵
D.X是水,Y是氯化钠
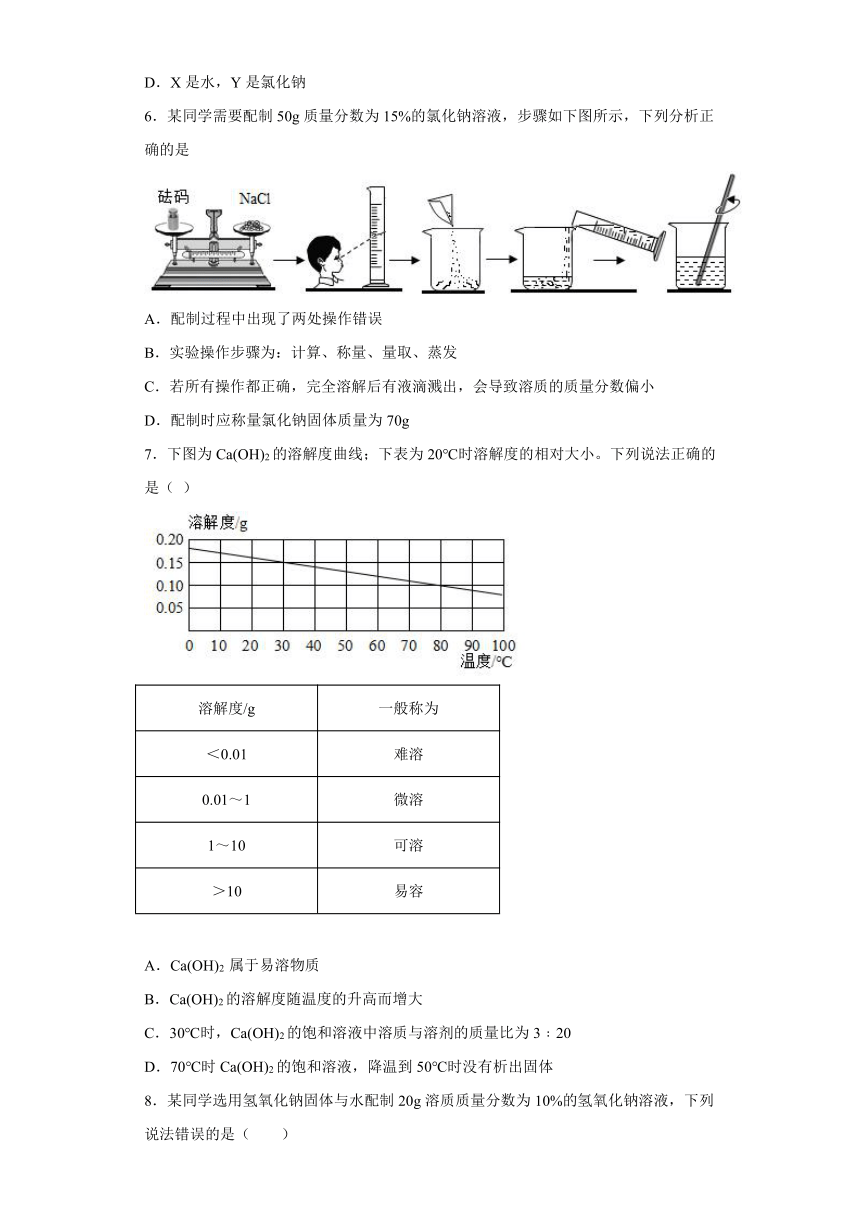
6.某同学需要配制50g质量分数为15%的氯化钠溶液,步骤如下图所示,下列分析正确的是
A.配制过程中出现了两处操作错误
B.实验操作步骤为:计算、称量、量取、蒸发
C.若所有操作都正确,完全溶解后有液滴溅出,会导致溶质的质量分数偏小
D.配制时应称量氯化钠固体质量为70g
7.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
8.某同学选用氢氧化钠固体与水配制20g溶质质量分数为10%的氢氧化钠溶液,下列说法错误的是( )
①需称取氢氧化钠固体2.0g
②称量前托盘天平应先检查游码是否归零,并调节平衡
③用托盘天平称量氢氧化钠固体时,为防止污染托盘,可将氢氧化钠放在纸上称量
④选用250mL量筒量取18mL的水
⑤存放溶液时,为确保数据准确,将试剂瓶用蒸馏水清洗后,立即倒入所配溶液封存
A. B. C. D.
9.t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的 pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2 的溶解度随温度升高而减小;②Ca(OH)2 与空气中的 CO2 反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冷水冷却,恢复至 t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入 Na2CO3 溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
10.在“一定溶质质量分数的氯化钠溶液的配制”实验活动中,可能导致氯化钠溶液溶质质量分数偏大的是( )
A.量取水时量筒内事先有少量水
B.所用氯化钠固体不纯
C.称量时砝码和药品的位置放反
D.将量筒中的水倒入烧杯时有水溅出
11.如图是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.40℃时,甲的饱和溶液的溶质质量分数为 50%
C.甲中混有少量的乙,可以采用蒸发结晶的方法提纯甲
D.40℃时,将等质量的甲、乙饱和溶液降温至20℃,溶质的质量乙>甲
12.下列涉及学科观点的有关说法正确的是
A.根据微粒观:水是由氢原子和氧原子构成的
B.根据转化观:一氧化碳和二氧化碳在一定条件下可相互转化
C.根据结构观:氩原子和氯离子最外层电子数相同,化学性质相同
D.根据守恒观:10mL质量分数40%的硫酸,加10mL水后质量分数变为20%
13.下列所示的图像与选项所描述的变化关系一致的是
A. 电解水实验中,产生的氢气和氧气的质量关系
B. 向一定量的过氧化氢溶液中加入二氧化锰
C. 在一定温度下,向饱和的KNO3溶液中加入KNO3固体
D. 分别向等质量的块状和粉末状大理石中加入过量的完全相同的稀盐酸
14.某温度下,甲、乙两个烧杯中各盛有100g相同浓度的氯化钾溶液,现将甲烧杯中的溶液蒸发掉35g水,析出5g晶体;乙烧杯中的溶液蒸发掉45g水,析出10g晶体.则原溶液的质量分数为 ( )
A.10% B.25% C.20% D.15%
15.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
二、填空题
16.如图所示的四个圆分别表示浓溶液、稀溶液、饱和溶液、不饱和溶液的集合。
(1)、集合分别表示:______;______,从图可以看出,饱和溶液与浓、稀溶液的关系是______。
(2)的医用生理盐水可归于上图中的______(选填“”、“”、“”或“”)区域,现有一瓶接近饱和的溶液,要使它变成饱和溶液,一般采用的方法是______或______。
17.如图1是A、B、C三种物质的溶解度曲线,请回答。
(1)t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为________。
(2)A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是_______。
(3)t1℃时,取等质量的A、C饱和溶液分别置于甲,乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A、C溶液的溶质质量分数的大小关系是______
18.溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
①下表是KNO3、KNO3在不同温度下的溶解度(单位:g/100g水)。
温度(℃) 0 20 40 60 80 100
KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
I.上表中的两种物质在40℃时,______的溶解度较大;请用相应的数据列式表示该温度是KNO3饱和溶液的质量分数________(不要求计算)。
II.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法_____________________。
III.20℃时,将20gNaCl放入50g水中,所得溶液的质量是_____g。
IV. ①从NaCl溶液中得到NaCl晶体的方法是_______。
②用硫酸铜进行如下图所示的实验,完成下列填空_______(用编号表示)。
所得三个溶液中:一定属于饱和溶液的是______,溶液中溶剂质量的大小关系是________。
19.根据图中a、b、c三种固体的溶解度曲线,回答问题。
(1)N点的意义是_____。
(2)t1℃时,a,b,c三种物质的溶解度从大到小的顺序是_____。
(3)将t3℃时,将50g a物质放入50g水中充分溶解得到溶液的溶质质量分数为_____。(保留至0.1%)
(4)要使a的不饱和溶液变为饱和溶液,其方法是_____(写一种)。
(5)将100g 10%的a溶液稀释到4%,需加入_____g水。
三、推断题
20.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____ (填离子符号), 流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3的溶解度曲线“消失”了,其原因可能是_____。
21.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
22.如图是某同学配制100克质量分数为5%的盐水的过程
(1)请改正图中的两处错误:__________________;__________________。
(2)操作步骤:
a计算:所称取氯化钠的质量、水的体积;
b称量:用托盘天平称量氯化钠;用量筒来量取所需的水,量筒应该选择的规格是________________(从下列中选用:10mL、50mL、100mL);
c溶解:溶解氯化钠要用到玻璃棒,其起到搅拌的作用;
d装瓶贴签
(3)如果配制的盐水中,NaC1的质量分数小于5%,则可能造成误差的原因有________、___________;(至少举出两条)。
23.实验室配制50g溶质质量分数为6%的氯化钠溶液,其操作如图所示。请回答下列问题:(已知水的密度为1g/cm3)
(1)实验操作的正确顺序为 ________(用字母序号表示)。
(2)选用 ________(填“10”、“50”或“500”)mL量筒量取所需水的体积。
(3)操作C中玻璃棒的作用是 ________。
(4)若用量筒量取水时仰视读数,其他操作均正确,则所配制溶液的溶质质量分数 ________(填“偏大”、“偏小”或“不变”)。
五、计算题
24.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份进行实验,结果如下:
实 验 一 二 三 四
加入样品的质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
(1)上表中m的数值是_____;
(2)反应中矿石有剩余是第_____次实验;
(3)这种石灰石矿中碳酸钙的质量分数是_____;
(4)稀盐酸中溶质的质量分数是多少?_____。
25.化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢的质量分数。现称量68g 过氧化氢溶液和 0.1g 二氧化锰进行实验,反应前后质量随时间变化关系如图.
计算:
(1)制得氧气的质量是__g;
(2)过氧化氢质量分数是____________?
试卷第1页,共3页
参考答案:
1.A2.B3.A4.D5.C6.A7.D8.B9.C10.D11.D12.B13.A14.B15.D
16.(1) 饱和浓溶液 不饱和浓溶液 饱和溶液可能是浓溶液,也可能是稀溶液
(2) C 加入氯化钠 蒸发溶剂
17. 2:5 降温结晶 A18. 硝酸钾, 降低温度 68g 蒸发结晶 68g A B>C>A
19. t2℃时,a、c物质的溶解度相等 c>b>a 33.3% 降低温度或加溶质或蒸发溶剂 150
20. 过滤 此温度下碳酸氢钠的溶解度较小 氯化铵的溶解度受温度的影响较大 Na+、NH4+ CO2 温度高于60℃时,碳酸氢钠开始分解
21. CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
22. 应将瓶塞倒放在桌面上 应将氯化钠放在左盘,砝码放在右盘 100mL 将氯化钠倒入烧杯时有少量撒落到烧杯外 量取水时采用仰视的方法读取水的体积数
23.(1)DBAEC
(2)50
(3)加快氯化钠溶解速率
(4)偏小
24.(1)4.4(2)三、四(3)80%(4)14.6%
25.(1)0.8;(2)2.5%
答案第1页,共2页
一、单选题
1.溶液在日常生活中应用广泛。下列对溶液的有关说法不正确的是
A.溶液都是无色、透明的液体 B.一种溶液中只能有一种溶剂
C.溶液都是混合物 D.溶液中各部分性质相同
2.溶液在我们生活中有着广泛的用途。下列物质不属于溶液的是
A.白酒 B.蒸馏水 C.医用酒精 D.生理盐水
3.下列物质的用途主要利用其化学性质的是
A.氧气用于医疗急救 B.干冰用于人工降雨
C.铜、铝用于制作导线 D.汽油用于衣物除油
4.小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 温度/℃ 水的质量/克 加入硝酸钾的质量/克 所得溶液的质量/克
① 10 100 40 120.9
② 60 100 40 140
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
5.向液体X中加入固体Y,观察到U形管内红墨水左侧液面上升。下列液体X和固体Y的组合,符合题意的是
A.X是水,Y是氧化钙
B.X是水,Y是氢氧化钠
C.X是水,Y是硝酸铵
D.X是水,Y是氯化钠
6.某同学需要配制50g质量分数为15%的氯化钠溶液,步骤如下图所示,下列分析正确的是
A.配制过程中出现了两处操作错误
B.实验操作步骤为:计算、称量、量取、蒸发
C.若所有操作都正确,完全溶解后有液滴溅出,会导致溶质的质量分数偏小
D.配制时应称量氯化钠固体质量为70g
7.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
8.某同学选用氢氧化钠固体与水配制20g溶质质量分数为10%的氢氧化钠溶液,下列说法错误的是( )
①需称取氢氧化钠固体2.0g
②称量前托盘天平应先检查游码是否归零,并调节平衡
③用托盘天平称量氢氧化钠固体时,为防止污染托盘,可将氢氧化钠放在纸上称量
④选用250mL量筒量取18mL的水
⑤存放溶液时,为确保数据准确,将试剂瓶用蒸馏水清洗后,立即倒入所配溶液封存
A. B. C. D.
9.t℃时,加热烧杯中的石灰水,发现溶液变浑浊,测得此时溶液的 pH>7。关于溶液变浑浊的原因,同学们有两种观点:①Ca(OH)2 的溶解度随温度升高而减小;②Ca(OH)2 与空气中的 CO2 反应。他们设计以下方案进行探究,其中没有意义的是( )
A.将装有浊液的烧杯,用冷水冷却,恢复至 t℃,观察浑浊是否消失
B.取适量浊液,过滤,往滤渣中加入盐酸,观察是否有气泡产生
C.取适量浊液,过滤,往滤液中加入 Na2CO3 溶液,观察是否有沉淀生成
D.其他条件不变,隔绝空气,再做一个加热石灰水的对比实验
10.在“一定溶质质量分数的氯化钠溶液的配制”实验活动中,可能导致氯化钠溶液溶质质量分数偏大的是( )
A.量取水时量筒内事先有少量水
B.所用氯化钠固体不纯
C.称量时砝码和药品的位置放反
D.将量筒中的水倒入烧杯时有水溅出
11.如图是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.40℃时,甲的饱和溶液的溶质质量分数为 50%
C.甲中混有少量的乙,可以采用蒸发结晶的方法提纯甲
D.40℃时,将等质量的甲、乙饱和溶液降温至20℃,溶质的质量乙>甲
12.下列涉及学科观点的有关说法正确的是
A.根据微粒观:水是由氢原子和氧原子构成的
B.根据转化观:一氧化碳和二氧化碳在一定条件下可相互转化
C.根据结构观:氩原子和氯离子最外层电子数相同,化学性质相同
D.根据守恒观:10mL质量分数40%的硫酸,加10mL水后质量分数变为20%
13.下列所示的图像与选项所描述的变化关系一致的是
A. 电解水实验中,产生的氢气和氧气的质量关系
B. 向一定量的过氧化氢溶液中加入二氧化锰
C. 在一定温度下,向饱和的KNO3溶液中加入KNO3固体
D. 分别向等质量的块状和粉末状大理石中加入过量的完全相同的稀盐酸
14.某温度下,甲、乙两个烧杯中各盛有100g相同浓度的氯化钾溶液,现将甲烧杯中的溶液蒸发掉35g水,析出5g晶体;乙烧杯中的溶液蒸发掉45g水,析出10g晶体.则原溶液的质量分数为 ( )
A.10% B.25% C.20% D.15%
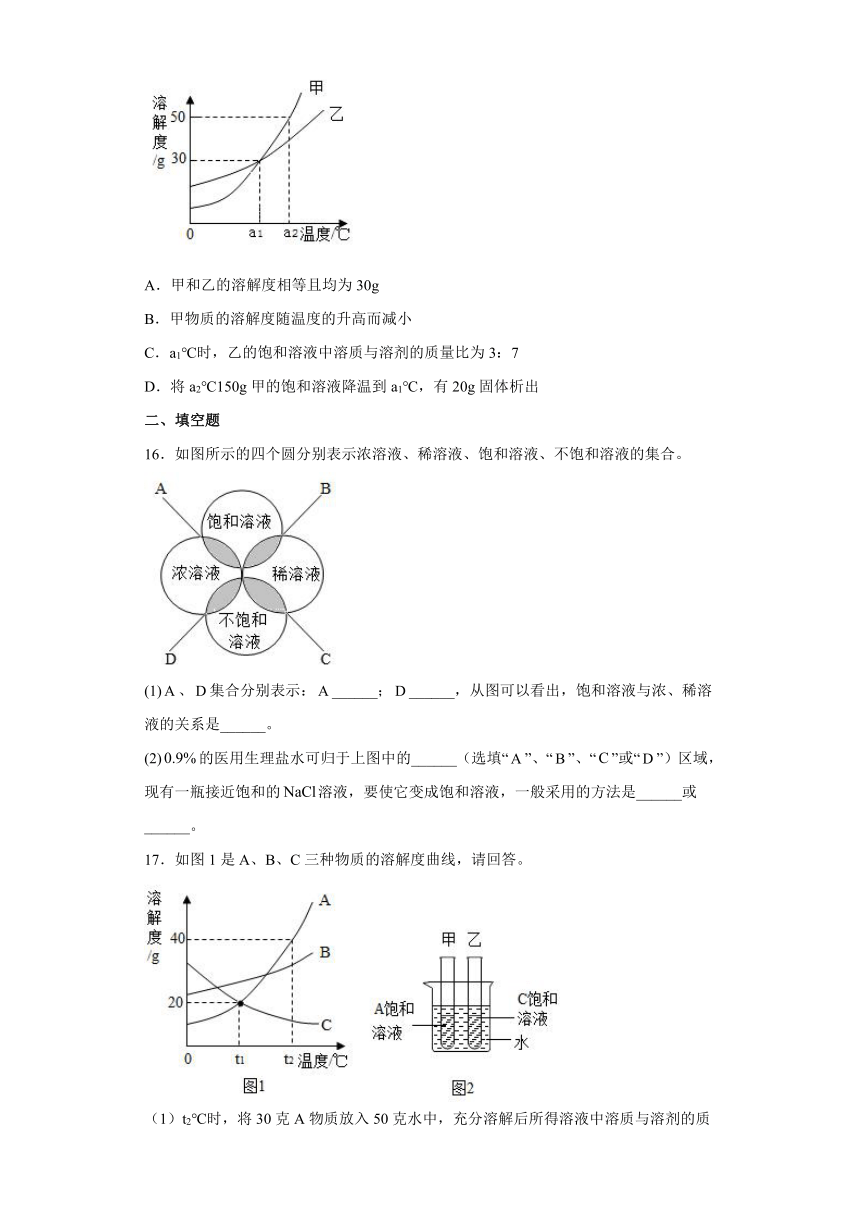
15.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
二、填空题
16.如图所示的四个圆分别表示浓溶液、稀溶液、饱和溶液、不饱和溶液的集合。
(1)、集合分别表示:______;______,从图可以看出,饱和溶液与浓、稀溶液的关系是______。
(2)的医用生理盐水可归于上图中的______(选填“”、“”、“”或“”)区域,现有一瓶接近饱和的溶液,要使它变成饱和溶液,一般采用的方法是______或______。
17.如图1是A、B、C三种物质的溶解度曲线,请回答。
(1)t2℃时,将30克A物质放入50克水中,充分溶解后所得溶液中溶质与溶剂的质量比为________。
(2)A物质中混有少量B物质,若提纯A物质,可采取的结晶方法是_______。
(3)t1℃时,取等质量的A、C饱和溶液分别置于甲,乙两支试管中,如图2所示。在大烧杯中加入一定质量的硝酸铵固体溶解后,A、C溶液的溶质质量分数的大小关系是______
18.溶解是生活中常见的现象,不同物质在水中的溶解能力不同。
①下表是KNO3、KNO3在不同温度下的溶解度(单位:g/100g水)。
温度(℃) 0 20 40 60 80 100
KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
I.上表中的两种物质在40℃时,______的溶解度较大;请用相应的数据列式表示该温度是KNO3饱和溶液的质量分数________(不要求计算)。
II.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法_____________________。
III.20℃时,将20gNaCl放入50g水中,所得溶液的质量是_____g。
IV. ①从NaCl溶液中得到NaCl晶体的方法是_______。
②用硫酸铜进行如下图所示的实验,完成下列填空_______(用编号表示)。
所得三个溶液中:一定属于饱和溶液的是______,溶液中溶剂质量的大小关系是________。
19.根据图中a、b、c三种固体的溶解度曲线,回答问题。
(1)N点的意义是_____。
(2)t1℃时,a,b,c三种物质的溶解度从大到小的顺序是_____。
(3)将t3℃时,将50g a物质放入50g水中充分溶解得到溶液的溶质质量分数为_____。(保留至0.1%)
(4)要使a的不饱和溶液变为饱和溶液,其方法是_____(写一种)。
(5)将100g 10%的a溶液稀释到4%,需加入_____g水。
三、推断题
20.我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。其流程简图和部分物质的溶解度曲线如下:
已知:①母液中有一种铵态氮肥
②
请回答下列问题:
(1)操作a的名称是_____。
(2)结合图2分析,图1反应1中NaHCO3作为晶体析出的原因是_____,从图2中还能获得的一条信息是_____。
(3)图1中得到的母液中一定含有的阳离子是_____ (填离子符号), 流程中可以循环使用的物质是_____。
(4)从图2可以看出温度高于60°C,NaHCO3的溶解度曲线“消失”了,其原因可能是_____。
21.图中,甲是相对分子质量为16的有机物,乙是最常见的溶剂,丁是白色难溶固体,其中金属元素的质量分数为40%.甲的化学式 ________ .②的化学方程式为 ________ .丙的一种用途是 ________ .
四、实验题
22.如图是某同学配制100克质量分数为5%的盐水的过程
(1)请改正图中的两处错误:__________________;__________________。
(2)操作步骤:
a计算:所称取氯化钠的质量、水的体积;
b称量:用托盘天平称量氯化钠;用量筒来量取所需的水,量筒应该选择的规格是________________(从下列中选用:10mL、50mL、100mL);
c溶解:溶解氯化钠要用到玻璃棒,其起到搅拌的作用;
d装瓶贴签
(3)如果配制的盐水中,NaC1的质量分数小于5%,则可能造成误差的原因有________、___________;(至少举出两条)。
23.实验室配制50g溶质质量分数为6%的氯化钠溶液,其操作如图所示。请回答下列问题:(已知水的密度为1g/cm3)
(1)实验操作的正确顺序为 ________(用字母序号表示)。
(2)选用 ________(填“10”、“50”或“500”)mL量筒量取所需水的体积。
(3)操作C中玻璃棒的作用是 ________。
(4)若用量筒量取水时仰视读数,其他操作均正确,则所配制溶液的溶质质量分数 ________(填“偏大”、“偏小”或“不变”)。
五、计算题
24.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份进行实验,结果如下:
实 验 一 二 三 四
加入样品的质量/g 5 10 15 20
生成CO2的质量/g 1.76 3.52 4.4 m
(1)上表中m的数值是_____;
(2)反应中矿石有剩余是第_____次实验;
(3)这种石灰石矿中碳酸钙的质量分数是_____;
(4)稀盐酸中溶质的质量分数是多少?_____。
25.化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢的质量分数。现称量68g 过氧化氢溶液和 0.1g 二氧化锰进行实验,反应前后质量随时间变化关系如图.
计算:
(1)制得氧气的质量是__g;
(2)过氧化氢质量分数是____________?
试卷第1页,共3页
参考答案:
1.A2.B3.A4.D5.C6.A7.D8.B9.C10.D11.D12.B13.A14.B15.D
16.(1) 饱和浓溶液 不饱和浓溶液 饱和溶液可能是浓溶液,也可能是稀溶液
(2) C 加入氯化钠 蒸发溶剂
17. 2:5 降温结晶 A
19. t2℃时,a、c物质的溶解度相等 c>b>a 33.3% 降低温度或加溶质或蒸发溶剂 150
20. 过滤 此温度下碳酸氢钠的溶解度较小 氯化铵的溶解度受温度的影响较大 Na+、NH4+ CO2 温度高于60℃时,碳酸氢钠开始分解
21. CH4 CO2+Ca(OH)2=CaCO3↓+H2O 灭火
22. 应将瓶塞倒放在桌面上 应将氯化钠放在左盘,砝码放在右盘 100mL 将氯化钠倒入烧杯时有少量撒落到烧杯外 量取水时采用仰视的方法读取水的体积数
23.(1)DBAEC
(2)50
(3)加快氯化钠溶解速率
(4)偏小
24.(1)4.4(2)三、四(3)80%(4)14.6%
25.(1)0.8;(2)2.5%
答案第1页,共2页
同课章节目录
