7.2物质溶解的量跟踪训练--2021-2022学年九年级化学科粤版(2012)下册(word版 含答案)
文档属性
| 名称 | 7.2物质溶解的量跟踪训练--2021-2022学年九年级化学科粤版(2012)下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 65.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-23 14:42:28 | ||
图片预览


文档简介
7.2物质溶解的量
一、单选题
1.经测定Na2 SO4 在不同温度时的溶解度数据如下表:
温度/℃ 40 60 80 100
溶解度/g 48.8 45.3 43.7 42.5
下图是表示随温度变化饱和溶液溶质质量分数的变化曲线,其中能表示随温度变化饱和溶液中溶质质量分数变化曲线的是( )
A. B. C. D.
2.20℃时,取甲、乙、丙、丁四种纯净物各20g,分别加入到四个各盛有50g水的烧杯中,充分溶解,其溶解情况如下表:
下列说法正确的是( )
A. 所得四杯溶液都是饱和溶液 B. 丁溶液中溶质的质量最大
C. 20℃时四种物质溶解度的关系为:丙>乙>甲>丁 D. 四杯溶液中溶剂的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液
3. 可乐是一种常见的碳酸饮料,近日,一段“可乐灭火”的视频在网上流传,视频中,消防员手持一瓶可乐,拧开瓶盖,捂住瓶口使劲摇晃后将喷溅而出的可乐泡沫对准火焰进行喷射,很快火就被扑灭,下列对可乐及“可乐灭火”分析错误的是( )
A.“可乐泡沫”使可燃物隔绝了氧气
B.可乐能“喷溅而出”是由于压强改变所致
C.可乐瓶中如果装水也能产生“可乐灭火”的效果
D.消防员“使劲摇晃”的目的是为了加快二氧化碳逸出
4. t℃时,向一支盛有0.15g熟石灰的烧杯中加入50g水,充分振荡后静置,烧杯底部仍有未溶解的白色固体.下列相关叙述正确的是( )
A.升高温度上层清液变为不饱和溶液 B.t℃时,熟石灰的溶解度为0.3g
C.烧杯中溶液的质量小于50.15g D.上层清液中溶质质量分数大于0.3%
5.20℃时,向100g未知浓度KCI溶液中加入5g KCl后,正确的是( )
A. 溶液质量变为105g B. 溶剂质量不变 C. 溶液浓度一定变大 D. 溶质质量一定发生变化
6.某温度下有一杯饱和的硝酸钾溶液,欲使其溶质的质量分数发生改变,下列操作可行的是( )
A. 加入一定质量的硝酸钾晶体 B. 加入少量的水 C. 升高温度 D. 恒温蒸发溶剂
7.木糖醇是目前市场上一种理想的蔗糖替代品,在某些温度下其溶解度分别为:30℃时70g、50℃时84g,、60℃时90g。右图表示的是木糖醇等固体的溶解度曲线。根据曲线判断下列说法错误的是
A. X为木糖醇的溶解度曲线
B. 随着温度的升高,Z物质的溶解度逐渐减小
C. 30℃时,X、Y、Z三种物质的饱和溶液中溶质质量分数最大的是Y
D. 50℃时,Y、Z两物质的溶解度相等
8. 60℃时,50g水中溶解10.48gM恰好达到饱和,则M属于( )
A.易溶物质 B.可溶物质 C.微溶物质 D.无法确定
9. 天热的时候把半杯糖水(蔗糖已全部溶解)放进冰箱的冷藏室,过一段时间后发现杯底出现了部分蔗糖晶体.对于这一现象的认识不正确的是( )
A.未放入冰箱前的糖水一定是饱和溶液 B.降低温度可从糖水中获得蔗糖晶体
C.放入冰箱前糖水中蔗糖的质量分数比放入冰箱后大
D.温度降低后蔗糖的溶解度随之变小
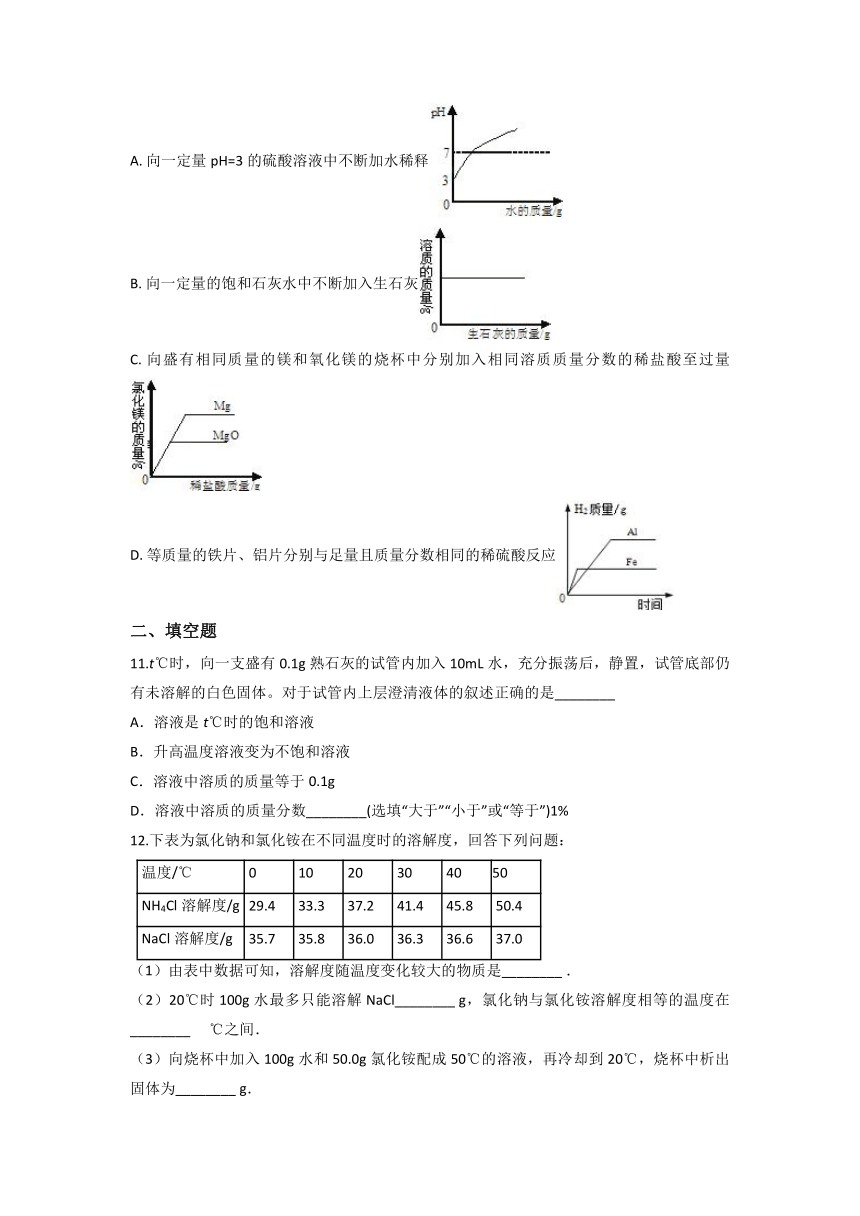
10.下列图象能正确反映其对应关系的是( )
A. 向一定量pH=3的硫酸溶液中不断加水稀释
B. 向一定量的饱和石灰水中不断加入生石灰
C. 向盛有相同质量的镁和氧化镁的烧杯中分别加入相同溶质质量分数的稀盐酸至过量
D. 等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应
二、填空题
11.t℃时,向一支盛有0.1g熟石灰的试管内加入10mL水,充分振荡后,静置,试管底部仍有未溶解的白色固体。对于试管内上层澄清液体的叙述正确的是________
A.溶液是t℃时的饱和溶液
B.升高温度溶液变为不饱和溶液
C.溶液中溶质的质量等于0.1g
D.溶液中溶质的质量分数________(选填“大于”“小于”或“等于”)1%
12.下表为氯化钠和氯化铵在不同温度时的溶解度,回答下列问题:
温度/℃ 0 10 20 30 40 50
NH4Cl溶解度/g 29.4 33.3 37.2 41.4 45.8 50.4
NaCl溶解度/g 35.7 35.8 36.0 36.3 36.6 37.0
(1)由表中数据可知,溶解度随温度变化较大的物质是________ .
(2)20℃时100g水最多只能溶解NaCl________ g,氯化钠与氯化铵溶解度相等的温度在 ________ ℃之间.
(3)向烧杯中加入100g水和50.0g氯化铵配成50℃的溶液,再冷却到20℃,烧杯中析出固体为________ g.
13.下图是甲、乙两种固体物质的溶解度曲线。
(1)40℃时,甲的溶解度________乙的溶解度(填“>”、“<”或“=”);
(2)要使饱和的甲溶液变为不饱和溶液,可采取的方法是________(只填一种);
(3)在20℃时,把甲、乙各15g固体分别加入到两个盛有50g水的烧杯中,充分搅拌,所得乙溶液为________溶液(填饱和或不饱和);若将温度都升高到50℃,甲溶液中溶质的质量分数________乙溶液中溶质的质量分数 (填“>”、“<”或“=”)。
(4)10℃时,向12%的100g甲溶液中加水140g,此时溶质的质量分数为________ %。
三、解答题
14.60℃时,某同学在盛有硝酸钾饱和溶液的烧杯中,漂浮一个木块(如图),然后将溶液冷却到室温 .请你说出观察到的两个现象,并运用你学过的化学知识和物理知识分别解释这些现象产生的原因.
四、综合题
15.溶液在生产和科研中具有广泛的用途,与人们的生活密不可分.
(1)碘酒是家庭常备药,碘酒中的溶剂是________(写化学式)
(2)喝了冰镇汽水以后,常常会打嗝.这种现象说明气体的溶解度与________有关.
16. 控制变量法是科学探究中常用的方法之一。(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类;②溶剂的种类;③溶质最多被溶解的质量;④溶剂的质量;⑤温度。如测定“某物质在不同温度下的溶解度”,研究的是________(填序号)受温度的影响,这就需要控制其他因素保持不变。(2)下表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
①从上表可知,两种物质的溶解度受温度变化影响较大的是________。②20 ℃时,将等质量的NaCl、KNO 3 分别放入盛有100 g水的两个烧杯中,充分溶解后如图K-9-6中(Ⅰ)所示,升温到50 ℃时如图(Ⅱ)所示。试判断:50 ℃时甲烧杯中的溶液一定是___________(填“饱和溶液”“不饱和溶液”或“不能确定”)。
图K-9-6
一、单选题
1、C 2、D3、C4、C 5、B 6、B7、C 8、D9、A 10、C
二、填空题
11.A;小于
12.NH4Cl;36.0;0~20;12.8
13.(1)﹥
(2)加水(或升高温度)
(3)不饱和;=
(4)5%
三、解答题
14.(1)现象1:烧杯底部有硝酸钾晶体析出;原因:硝酸钾溶解度随温度降低而减小;(2)现象2:木块会下沉一些;原因:降温后,饱和硝酸钾溶液会有晶体析出,溶液的密度减少,由浮力公式可知V排增大.
四、综合题
15.(1)C2H5OH
(2)温度
16、(1)③ (2)①硝酸钾(或KNO 3 ) ②不饱和溶液
(1)测定“某物质在不同温度下的溶解度”,研究的是溶质最多被溶解的质量受温度的影响。(2)①根据表格中的数据可知:KNO 3 的溶解度受温度的影响较大;②根据20 ℃时KNO 3 和NaCl的溶解度和图(Ⅰ)可知,甲烧杯中为KNO 3 的饱和溶液,乙烧杯中的NaCl完全溶解,说明图(Ⅰ)中NaCl、KNO 3 的质量小于或等于 36 g,且50 ℃时KNO 3 的溶解度为85.5 g,所以将温度从20 ℃升高到50 ℃时,甲烧杯中的溶液一定是不饱和溶液。
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
一、单选题
1.经测定Na2 SO4 在不同温度时的溶解度数据如下表:
温度/℃ 40 60 80 100
溶解度/g 48.8 45.3 43.7 42.5
下图是表示随温度变化饱和溶液溶质质量分数的变化曲线,其中能表示随温度变化饱和溶液中溶质质量分数变化曲线的是( )
A. B. C. D.
2.20℃时,取甲、乙、丙、丁四种纯净物各20g,分别加入到四个各盛有50g水的烧杯中,充分溶解,其溶解情况如下表:
下列说法正确的是( )
A. 所得四杯溶液都是饱和溶液 B. 丁溶液中溶质的质量最大
C. 20℃时四种物质溶解度的关系为:丙>乙>甲>丁 D. 四杯溶液中溶剂的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液
3. 可乐是一种常见的碳酸饮料,近日,一段“可乐灭火”的视频在网上流传,视频中,消防员手持一瓶可乐,拧开瓶盖,捂住瓶口使劲摇晃后将喷溅而出的可乐泡沫对准火焰进行喷射,很快火就被扑灭,下列对可乐及“可乐灭火”分析错误的是( )
A.“可乐泡沫”使可燃物隔绝了氧气
B.可乐能“喷溅而出”是由于压强改变所致
C.可乐瓶中如果装水也能产生“可乐灭火”的效果
D.消防员“使劲摇晃”的目的是为了加快二氧化碳逸出
4. t℃时,向一支盛有0.15g熟石灰的烧杯中加入50g水,充分振荡后静置,烧杯底部仍有未溶解的白色固体.下列相关叙述正确的是( )
A.升高温度上层清液变为不饱和溶液 B.t℃时,熟石灰的溶解度为0.3g
C.烧杯中溶液的质量小于50.15g D.上层清液中溶质质量分数大于0.3%
5.20℃时,向100g未知浓度KCI溶液中加入5g KCl后,正确的是( )
A. 溶液质量变为105g B. 溶剂质量不变 C. 溶液浓度一定变大 D. 溶质质量一定发生变化
6.某温度下有一杯饱和的硝酸钾溶液,欲使其溶质的质量分数发生改变,下列操作可行的是( )
A. 加入一定质量的硝酸钾晶体 B. 加入少量的水 C. 升高温度 D. 恒温蒸发溶剂
7.木糖醇是目前市场上一种理想的蔗糖替代品,在某些温度下其溶解度分别为:30℃时70g、50℃时84g,、60℃时90g。右图表示的是木糖醇等固体的溶解度曲线。根据曲线判断下列说法错误的是
A. X为木糖醇的溶解度曲线
B. 随着温度的升高,Z物质的溶解度逐渐减小
C. 30℃时,X、Y、Z三种物质的饱和溶液中溶质质量分数最大的是Y
D. 50℃时,Y、Z两物质的溶解度相等
8. 60℃时,50g水中溶解10.48gM恰好达到饱和,则M属于( )
A.易溶物质 B.可溶物质 C.微溶物质 D.无法确定
9. 天热的时候把半杯糖水(蔗糖已全部溶解)放进冰箱的冷藏室,过一段时间后发现杯底出现了部分蔗糖晶体.对于这一现象的认识不正确的是( )
A.未放入冰箱前的糖水一定是饱和溶液 B.降低温度可从糖水中获得蔗糖晶体
C.放入冰箱前糖水中蔗糖的质量分数比放入冰箱后大
D.温度降低后蔗糖的溶解度随之变小
10.下列图象能正确反映其对应关系的是( )
A. 向一定量pH=3的硫酸溶液中不断加水稀释
B. 向一定量的饱和石灰水中不断加入生石灰
C. 向盛有相同质量的镁和氧化镁的烧杯中分别加入相同溶质质量分数的稀盐酸至过量
D. 等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应
二、填空题
11.t℃时,向一支盛有0.1g熟石灰的试管内加入10mL水,充分振荡后,静置,试管底部仍有未溶解的白色固体。对于试管内上层澄清液体的叙述正确的是________
A.溶液是t℃时的饱和溶液
B.升高温度溶液变为不饱和溶液
C.溶液中溶质的质量等于0.1g
D.溶液中溶质的质量分数________(选填“大于”“小于”或“等于”)1%
12.下表为氯化钠和氯化铵在不同温度时的溶解度,回答下列问题:
温度/℃ 0 10 20 30 40 50
NH4Cl溶解度/g 29.4 33.3 37.2 41.4 45.8 50.4
NaCl溶解度/g 35.7 35.8 36.0 36.3 36.6 37.0
(1)由表中数据可知,溶解度随温度变化较大的物质是________ .
(2)20℃时100g水最多只能溶解NaCl________ g,氯化钠与氯化铵溶解度相等的温度在 ________ ℃之间.
(3)向烧杯中加入100g水和50.0g氯化铵配成50℃的溶液,再冷却到20℃,烧杯中析出固体为________ g.
13.下图是甲、乙两种固体物质的溶解度曲线。
(1)40℃时,甲的溶解度________乙的溶解度(填“>”、“<”或“=”);
(2)要使饱和的甲溶液变为不饱和溶液,可采取的方法是________(只填一种);
(3)在20℃时,把甲、乙各15g固体分别加入到两个盛有50g水的烧杯中,充分搅拌,所得乙溶液为________溶液(填饱和或不饱和);若将温度都升高到50℃,甲溶液中溶质的质量分数________乙溶液中溶质的质量分数 (填“>”、“<”或“=”)。
(4)10℃时,向12%的100g甲溶液中加水140g,此时溶质的质量分数为________ %。
三、解答题
14.60℃时,某同学在盛有硝酸钾饱和溶液的烧杯中,漂浮一个木块(如图),然后将溶液冷却到室温 .请你说出观察到的两个现象,并运用你学过的化学知识和物理知识分别解释这些现象产生的原因.
四、综合题
15.溶液在生产和科研中具有广泛的用途,与人们的生活密不可分.
(1)碘酒是家庭常备药,碘酒中的溶剂是________(写化学式)
(2)喝了冰镇汽水以后,常常会打嗝.这种现象说明气体的溶解度与________有关.
16. 控制变量法是科学探究中常用的方法之一。(1)在探究固体物质的溶解度时,需要考虑的因素有:①溶质的种类;②溶剂的种类;③溶质最多被溶解的质量;④溶剂的质量;⑤温度。如测定“某物质在不同温度下的溶解度”,研究的是________(填序号)受温度的影响,这就需要控制其他因素保持不变。(2)下表是利用控制变量法测得的氯化钠、硝酸钾在不同温度时的溶解度,请根据表格内容及实验现象回答下列问题。
①从上表可知,两种物质的溶解度受温度变化影响较大的是________。②20 ℃时,将等质量的NaCl、KNO 3 分别放入盛有100 g水的两个烧杯中,充分溶解后如图K-9-6中(Ⅰ)所示,升温到50 ℃时如图(Ⅱ)所示。试判断:50 ℃时甲烧杯中的溶液一定是___________(填“饱和溶液”“不饱和溶液”或“不能确定”)。
图K-9-6
一、单选题
1、C 2、D3、C4、C 5、B 6、B7、C 8、D9、A 10、C
二、填空题
11.A;小于
12.NH4Cl;36.0;0~20;12.8
13.(1)﹥
(2)加水(或升高温度)
(3)不饱和;=
(4)5%
三、解答题
14.(1)现象1:烧杯底部有硝酸钾晶体析出;原因:硝酸钾溶解度随温度降低而减小;(2)现象2:木块会下沉一些;原因:降温后,饱和硝酸钾溶液会有晶体析出,溶液的密度减少,由浮力公式可知V排增大.
四、综合题
15.(1)C2H5OH
(2)温度
16、(1)③ (2)①硝酸钾(或KNO 3 ) ②不饱和溶液
(1)测定“某物质在不同温度下的溶解度”,研究的是溶质最多被溶解的质量受温度的影响。(2)①根据表格中的数据可知:KNO 3 的溶解度受温度的影响较大;②根据20 ℃时KNO 3 和NaCl的溶解度和图(Ⅰ)可知,甲烧杯中为KNO 3 的饱和溶液,乙烧杯中的NaCl完全溶解,说明图(Ⅰ)中NaCl、KNO 3 的质量小于或等于 36 g,且50 ℃时KNO 3 的溶解度为85.5 g,所以将温度从20 ℃升高到50 ℃时,甲烧杯中的溶液一定是不饱和溶液。
(
…………○…………外…………○…………装…………○…………订…………○…………线…………○…………
) (
※※请※※不※※要※※在※※装※※订※※线※※内※※答※※题※※
) (
…………○…………内…………○…………装…………○…………订…………○…………线…………○…………
)
