第五单元 初识酸和碱检测题-2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案)
文档属性
| 名称 | 第五单元 初识酸和碱检测题-2021-2022学年九年级化学沪教版(上海)第二学期(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 104.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-23 22:24:54 | ||
图片预览

文档简介
第5章《初识酸和碱》检测题
一、单选题
1.下列物质分别属于单质、混合物、化合物的是
A.水、石灰石、氢氧化钠
B.氧气、空气、二氧化碳
C.稀盐酸、五氧化二磷、氮气
D.氨水、高锰酸钾、铁
2.分析和推理是化学学习常用的方法,以下推理正确的是
A.厨房洗涤剂对油污有乳化作用,则汽油除油污利用的也是乳化作用
B.化合物是由不同种元素组成的纯净物,则只含一种元素的物质一定不是化合物
C.溶液具有均一性和稳定性,则均一性和稳定性的液体一定是溶液
D.活泼金属与酸反应能产生气体,则能与酸反应产生气体的一定是活泼金属
3.稀盐酸是化学实验中常用的试剂,但下列实验中,不宜使用稀盐酸的是
A.除去氯化钠溶液中的碳酸钠 B.除去铜粉中混有的铁粉
C.除去熟石灰中的石灰石 D.除去铁丝上的铁锈
4.因胃酸过多引起的胃病可用抗酸剂治疗。下列常用抗酸剂中,属于氧化物的是
A.MgO B.CaCO3 C.NaHCO3 D.Al(OH)3
5.下列关于物质用途的叙述错误的是
A.稀硫酸可用于除铁锈
B.氢氧化钙用于改良酸性土壤
C.氧气可用作燃料
D.明矾用于处理水中微小悬浮物
6.下列关于硫酸的认识,正确的是
A.组成:硫酸溶液中H+和SO的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用CaCl2处理后直接排放
7.下列有关实验现象描述正确的是
A.硫在氧气中燃烧发出淡蓝色火焰
B.打开浓盐酸试剂瓶瓶塞,瓶口有白雾产生
C.把CO2气体通入氢氧化钠溶液,溶液变浑浊
D.铁在空气中剧烈燃烧,火星四射,生成黑色固体
8.下列药品需要密封保存的原因,解释错误的是( )
A.浓盐酸—— 防止挥发 B.氢氧化钠溶液 ——防止与二氧化碳反应
C.浓硫酸 ——防止吸水 D.生石灰 —— 防止与氧气反应
9.逻辑推理是化学学习中常用的思维方法。下列推理正确的是
A.化合物是由不同元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物
B.有机物中一定含碳元素,所以含碳元素的化合物一定是有机物
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属
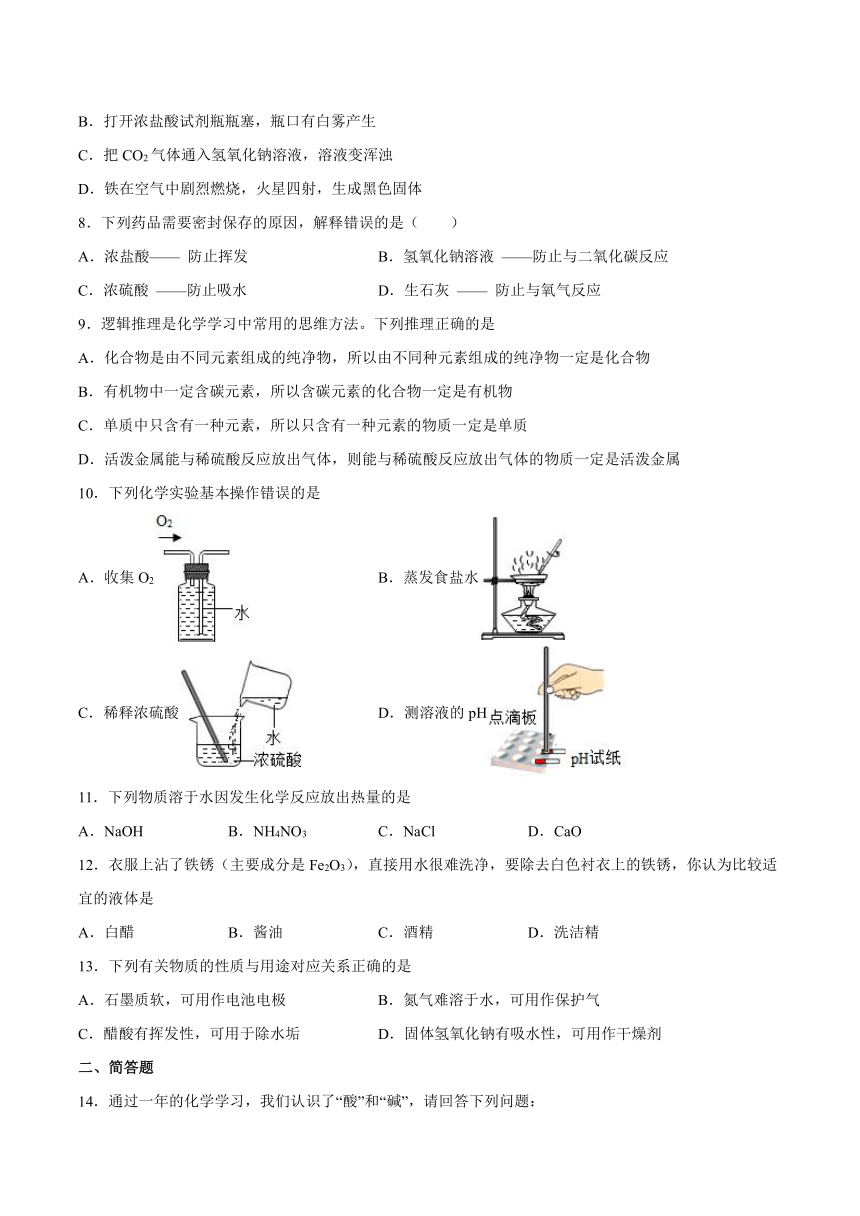
10.下列化学实验基本操作错误的是
A.收集O2 B.蒸发食盐水
C.稀释浓硫酸 D.测溶液的pH
11.下列物质溶于水因发生化学反应放出热量的是
A.NaOH B.NH4NO3 C.NaCl D.CaO
12.衣服上沾了铁锈(主要成分是Fe2O3),直接用水很难洗净,要除去白色衬衣上的铁锈,你认为比较适宜的液体是
A.白醋 B.酱油 C.酒精 D.洗洁精
13.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用作电池电极 B.氮气难溶于水,可用作保护气
C.醋酸有挥发性,可用于除水垢 D.固体氢氧化钠有吸水性,可用作干燥剂
二、简答题
14.通过一年的化学学习,我们认识了“酸”和“碱”,请回答下列问题:
(1)常见的酸有硫酸、盐酸等,在它们的水溶液里由于存在有相同的________离子(填符号),因此,它们有很多相似的化学性质,如:_______________________________、_______________________________________________________……等(写二条即可)。
(2)碱有氢氧化钠、氢氧化钙等,氢氧化钠可作某些气体的干燥剂,如:干燥___________
等气体,氢氧化钙可由生石灰与水反应制得,化学方程式为:__________________________。
(3)酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用,如硫酸厂的污水中含有硫酸等杂质,可用熟石灰进行处理,反应的化学方程式为:_____________________________。
(4)5·12汶川大地震灾害发生后,为了灾区人民群众的饮用水安全,卫生防疫部门要经常对灾区水源进行监测,获得可靠的科学依据。若现有一瓶水样,要获取它的酸碱度,应如何操作:_____________________________________________________________________________________________________________________________________________。
三、推断题
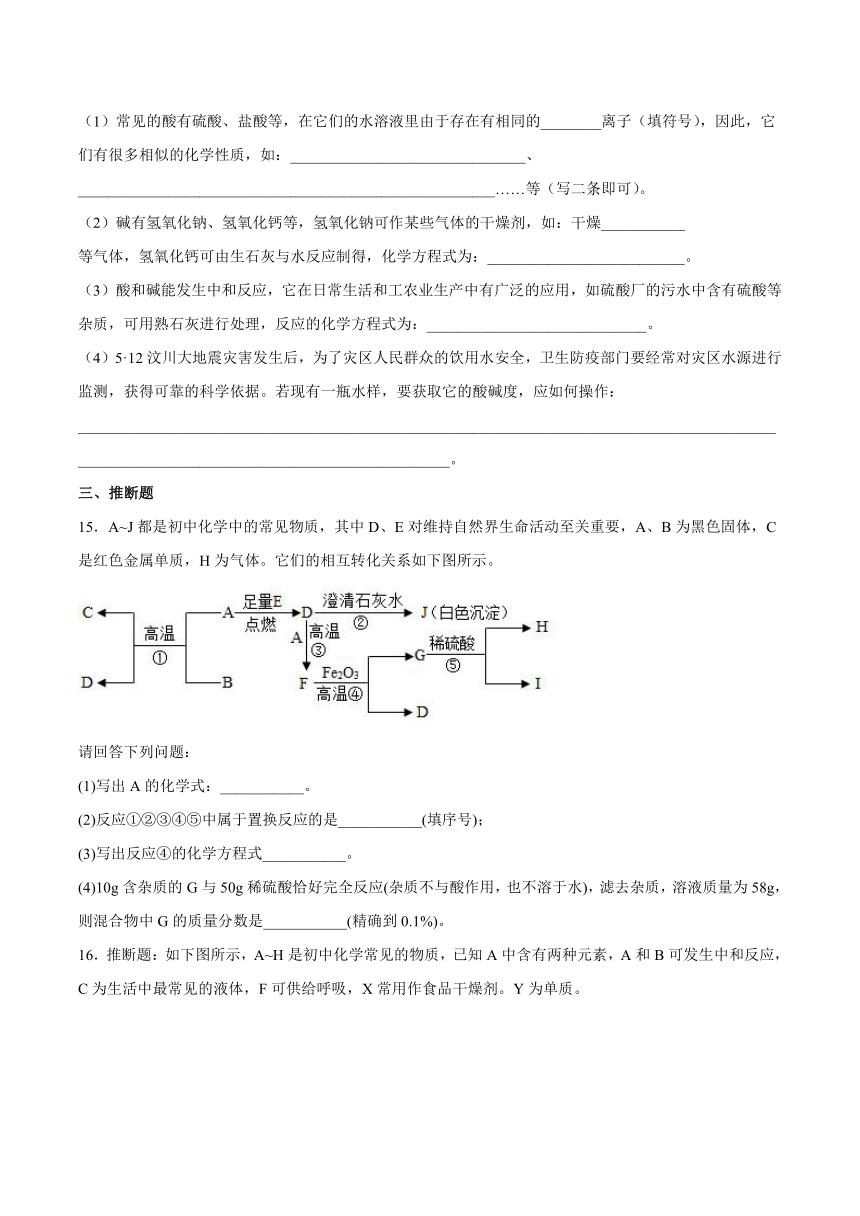
15.A~J都是初中化学中的常见物质,其中D、E对维持自然界生命活动至关重要,A、B为黑色固体,C是红色金属单质,H为气体。它们的相互转化关系如下图所示。
请回答下列问题:
(1)写出A的化学式:___________。
(2)反应①②③④⑤中属于置换反应的是___________(填序号);
(3)写出反应④的化学方程式___________。
(4)10g含杂质的G与50g稀硫酸恰好完全反应(杂质不与酸作用,也不溶于水),滤去杂质,溶液质量为58g,则混合物中G的质量分数是___________(精确到0.1%)。
16.推断题:如下图所示,A~H是初中化学常见的物质,已知A中含有两种元素,A和B可发生中和反应,C为生活中最常见的液体,F可供给呼吸,X常用作食品干燥剂。Y为单质。
请根据图示回答下列问题:
(1)H的化学式为______。
(2)反应②的基本类型为______。
(3)A和B反应的化学方程式为_________。
(4)写出物质B的一种用途_________。
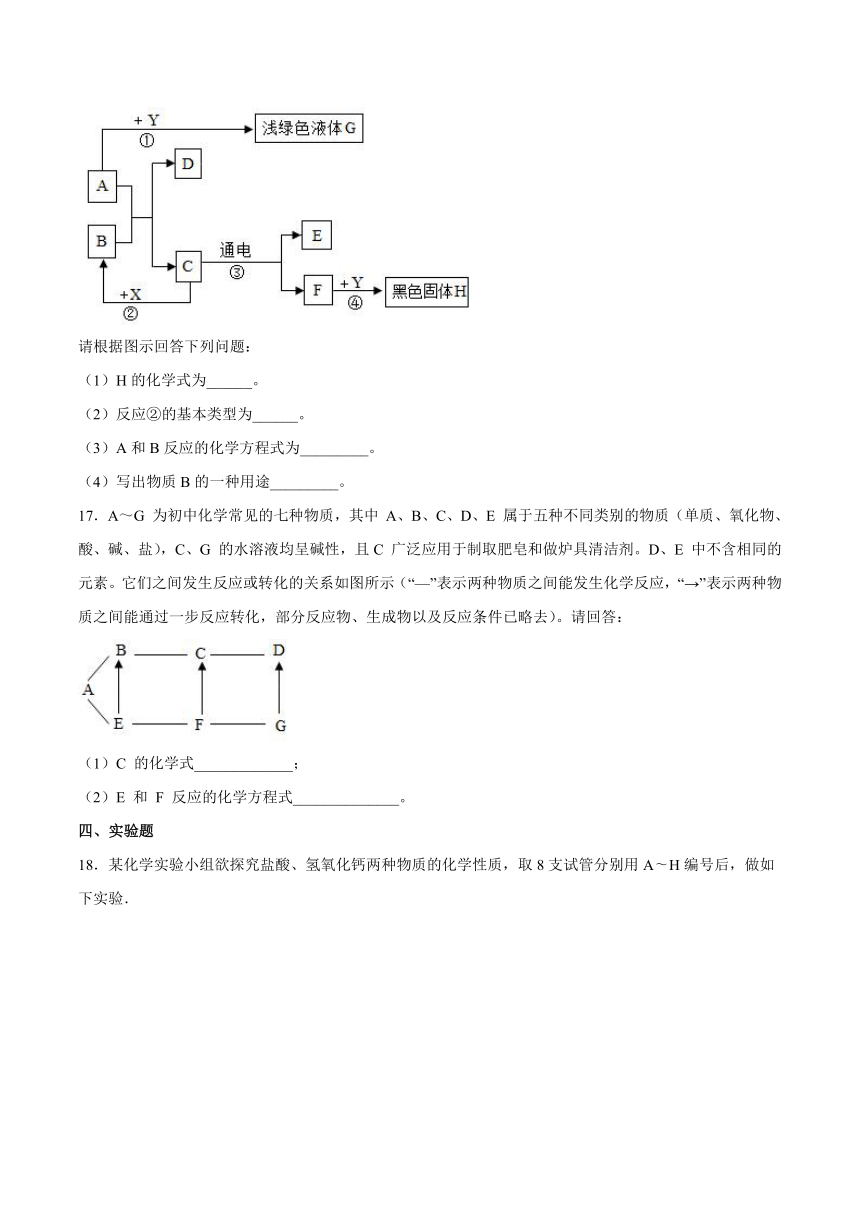
17.A~G 为初中化学常见的七种物质,其中 A、B、C、D、E 属于五种不同类别的物质(单质、氧化物、酸、碱、盐),C、G 的水溶液均呈碱性,且C 广泛应用于制取肥皂和做炉具清洁剂。D、E 中不含相同的元素。它们之间发生反应或转化的关系如图所示(“—”表示两种物质之间能发生化学反应,“→”表示两种物质之间能通过一步反应转化,部分反应物、生成物以及反应条件已略去)。请回答:
(1)C 的化学式_____________;
(2)E 和 F 反应的化学方程式______________。
四、实验题
18.某化学实验小组欲探究盐酸、氢氧化钙两种物质的化学性质,取8支试管分别用A H编号后,做如下实验.
(1)实验中观察到有气泡出现的试管是________,有沉淀生成的试管是________.
(2)写出实验中无明显现象产生的试管中发生反应的化学方程式:________.
(3)实验后某试管中为红色溶液,当向其中加入过量的________后,溶液变为蓝色.由此推断,该试管中最初盛有的物质是________.
(4)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现,则该滤液中的溶质是________.
(5)第二组E、F、G试管实验完成后,将反应后的液体都到入同一只大烧杯中,发现有白色沉淀生成,溶液呈红色.为此得出溶液中一定不含有的溶质是________(填写化学式,下同),一定含有的溶质是________.
(6)通过上述实验,可归纳出盐酸的化学性质有________.
19.CO2对人类的的生命活动非常重要 我们可以从多角度认识二氧化碳
(1)正常雨水的pH<7,是因为雨水降落过程中遇到了空气中的二氧化碳,与二氧化碳反应,生成_____(写该物质名称)使雨水呈酸性
(2)在下图中,用大理石和盐酸制取纯净 干燥的二氧化碳,并用排空气法收集CO2 (碳酸氢钠可以与盐酸反应生成二氧化碳)仪器的连接顺序为a接d,e接b,c接_____(选f或g) 装置B中所装的试剂是_____(填名称),仪器①的名称_____,向装置E中逐滴加入氢氧化钠溶液,实验现象为_____
(3)二氧化碳是一种重要的化工原料
a、在纳米纤维催化剂条件下,二氧化碳和氢气反应制得液体燃料甲醇(CH3OH)并生成水 反应的方程式为_____;
b、在高温 高压条件下,二氧化碳和NH3反应制得重要肥料尿素[CO(NH2)2]并生成水 该反应方程式为_____
五、计算题
20.为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量,从而计算出样品中碳酸钙的质量分数。为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
①按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57 g;
②在广口瓶中加入碳酸钙样品,称得装置和药品的总质量为574.57 g;
③旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
④反应结束后,称得装置及装置内所有物质的总质量为570.57 g。
请根据上述实验回答下列问题∶
(1)该方案测得样品中碳酸钙的质量分数是____________(写出解题过程,计算结果精确到0.1%)?
(2)该实验中用稀盐酸与碳酸钙样品反应,而不用浓盐酸与碳酸钙样品反应,其原因是________________。若实验中不用无水氯化钙干燥,则测得样品中碳酸钙的质量分数与上述实验计算结果相比__________(选填“偏小”或“不变”或“偏大”)。
21.某实验小组同学从碳酸钙、碳酸钠和氯化钠的固体混合物中提取氯化钠,实验操作的一部分流程如下图。请根据图中所提供的数据,回答下列问题:
(1)本实验生成二氧化碳的质量是______g,原固体混合物中碳酸钠的质量是______g。
(2)本实验最终所得不饱和溶液的溶质质量分数是多少?
参考答案:
1.B 2.B 3.C 4.A 5.C 6.C 7.B 8.D 9.A 10.C 11.D 12.A 13.D
14. H+ 能使紫色石蕊试液变红,使无色酚酞试液不变色;能与碱发生中和反应;能与较活泼金属反应 能与碱发生中和反应 H2(O2) CaO+H2O=Ca(OH)2 H2SO4+Ca(OH)2=CaSO4+2H2O 取待测水样,滴到pH试纸上,把pH试纸显示的颜色与标准比色卡比较,读出pH
15. C ①⑤ 83.0%
16. 化合反应 改良酸性士壤(合理即可)
17. NaOH 2HCl+Ca(OH)2=CaCl2+2H2O
18. B D G H NaOH溶液 紫色石蕊溶液 NaOH和Na2CO3 HCl NaCl 和NaOH 与酸碱指示剂反应、与活泼金属反应、与某些金属氧化物反应、与碱反应、与某些盐反应
19. 碳酸 f 浓硫酸 分液漏斗 气球胀大
20.(1)样品的质量为574.57 g-564.57 g=10 g,生成二氧化碳的质量为574.57 g-570.57 g=4 g
解:设参加反应的碳酸钙的质量为x
x≈9.09 g
所以碳酸钙样品中碳酸钙的质量分数为×100%=90.9%
答:样品中碳酸钙的质量分数是90.9%
(2)浓盐酸具有挥发性,会带来测量误差
(3)偏大
21.解:生成二氧化碳质量为20g-5.6g+90g+100g-200g=4.4g
设碳酸钠质量为x,生成氯化钠质量为y
答:(1)4.4;10.6
(2)所得溶液的溶质质量分数为7.75%。
一、单选题
1.下列物质分别属于单质、混合物、化合物的是
A.水、石灰石、氢氧化钠
B.氧气、空气、二氧化碳
C.稀盐酸、五氧化二磷、氮气
D.氨水、高锰酸钾、铁
2.分析和推理是化学学习常用的方法,以下推理正确的是
A.厨房洗涤剂对油污有乳化作用,则汽油除油污利用的也是乳化作用
B.化合物是由不同种元素组成的纯净物,则只含一种元素的物质一定不是化合物
C.溶液具有均一性和稳定性,则均一性和稳定性的液体一定是溶液
D.活泼金属与酸反应能产生气体,则能与酸反应产生气体的一定是活泼金属
3.稀盐酸是化学实验中常用的试剂,但下列实验中,不宜使用稀盐酸的是
A.除去氯化钠溶液中的碳酸钠 B.除去铜粉中混有的铁粉
C.除去熟石灰中的石灰石 D.除去铁丝上的铁锈
4.因胃酸过多引起的胃病可用抗酸剂治疗。下列常用抗酸剂中,属于氧化物的是
A.MgO B.CaCO3 C.NaHCO3 D.Al(OH)3
5.下列关于物质用途的叙述错误的是
A.稀硫酸可用于除铁锈
B.氢氧化钙用于改良酸性土壤
C.氧气可用作燃料
D.明矾用于处理水中微小悬浮物
6.下列关于硫酸的认识,正确的是
A.组成:硫酸溶液中H+和SO的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用CaCl2处理后直接排放
7.下列有关实验现象描述正确的是
A.硫在氧气中燃烧发出淡蓝色火焰
B.打开浓盐酸试剂瓶瓶塞,瓶口有白雾产生
C.把CO2气体通入氢氧化钠溶液,溶液变浑浊
D.铁在空气中剧烈燃烧,火星四射,生成黑色固体
8.下列药品需要密封保存的原因,解释错误的是( )
A.浓盐酸—— 防止挥发 B.氢氧化钠溶液 ——防止与二氧化碳反应
C.浓硫酸 ——防止吸水 D.生石灰 —— 防止与氧气反应
9.逻辑推理是化学学习中常用的思维方法。下列推理正确的是
A.化合物是由不同元素组成的纯净物,所以由不同种元素组成的纯净物一定是化合物
B.有机物中一定含碳元素,所以含碳元素的化合物一定是有机物
C.单质中只含有一种元素,所以只含有一种元素的物质一定是单质
D.活泼金属能与稀硫酸反应放出气体,则能与稀硫酸反应放出气体的物质一定是活泼金属
10.下列化学实验基本操作错误的是
A.收集O2 B.蒸发食盐水
C.稀释浓硫酸 D.测溶液的pH
11.下列物质溶于水因发生化学反应放出热量的是
A.NaOH B.NH4NO3 C.NaCl D.CaO
12.衣服上沾了铁锈(主要成分是Fe2O3),直接用水很难洗净,要除去白色衬衣上的铁锈,你认为比较适宜的液体是
A.白醋 B.酱油 C.酒精 D.洗洁精
13.下列有关物质的性质与用途对应关系正确的是
A.石墨质软,可用作电池电极 B.氮气难溶于水,可用作保护气
C.醋酸有挥发性,可用于除水垢 D.固体氢氧化钠有吸水性,可用作干燥剂
二、简答题
14.通过一年的化学学习,我们认识了“酸”和“碱”,请回答下列问题:
(1)常见的酸有硫酸、盐酸等,在它们的水溶液里由于存在有相同的________离子(填符号),因此,它们有很多相似的化学性质,如:_______________________________、_______________________________________________________……等(写二条即可)。
(2)碱有氢氧化钠、氢氧化钙等,氢氧化钠可作某些气体的干燥剂,如:干燥___________
等气体,氢氧化钙可由生石灰与水反应制得,化学方程式为:__________________________。
(3)酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用,如硫酸厂的污水中含有硫酸等杂质,可用熟石灰进行处理,反应的化学方程式为:_____________________________。
(4)5·12汶川大地震灾害发生后,为了灾区人民群众的饮用水安全,卫生防疫部门要经常对灾区水源进行监测,获得可靠的科学依据。若现有一瓶水样,要获取它的酸碱度,应如何操作:_____________________________________________________________________________________________________________________________________________。
三、推断题
15.A~J都是初中化学中的常见物质,其中D、E对维持自然界生命活动至关重要,A、B为黑色固体,C是红色金属单质,H为气体。它们的相互转化关系如下图所示。
请回答下列问题:
(1)写出A的化学式:___________。
(2)反应①②③④⑤中属于置换反应的是___________(填序号);
(3)写出反应④的化学方程式___________。
(4)10g含杂质的G与50g稀硫酸恰好完全反应(杂质不与酸作用,也不溶于水),滤去杂质,溶液质量为58g,则混合物中G的质量分数是___________(精确到0.1%)。
16.推断题:如下图所示,A~H是初中化学常见的物质,已知A中含有两种元素,A和B可发生中和反应,C为生活中最常见的液体,F可供给呼吸,X常用作食品干燥剂。Y为单质。
请根据图示回答下列问题:
(1)H的化学式为______。
(2)反应②的基本类型为______。
(3)A和B反应的化学方程式为_________。
(4)写出物质B的一种用途_________。
17.A~G 为初中化学常见的七种物质,其中 A、B、C、D、E 属于五种不同类别的物质(单质、氧化物、酸、碱、盐),C、G 的水溶液均呈碱性,且C 广泛应用于制取肥皂和做炉具清洁剂。D、E 中不含相同的元素。它们之间发生反应或转化的关系如图所示(“—”表示两种物质之间能发生化学反应,“→”表示两种物质之间能通过一步反应转化,部分反应物、生成物以及反应条件已略去)。请回答:
(1)C 的化学式_____________;
(2)E 和 F 反应的化学方程式______________。
四、实验题
18.某化学实验小组欲探究盐酸、氢氧化钙两种物质的化学性质,取8支试管分别用A H编号后,做如下实验.
(1)实验中观察到有气泡出现的试管是________,有沉淀生成的试管是________.
(2)写出实验中无明显现象产生的试管中发生反应的化学方程式:________.
(3)实验后某试管中为红色溶液,当向其中加入过量的________后,溶液变为蓝色.由此推断,该试管中最初盛有的物质是________.
(4)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现,则该滤液中的溶质是________.
(5)第二组E、F、G试管实验完成后,将反应后的液体都到入同一只大烧杯中,发现有白色沉淀生成,溶液呈红色.为此得出溶液中一定不含有的溶质是________(填写化学式,下同),一定含有的溶质是________.
(6)通过上述实验,可归纳出盐酸的化学性质有________.
19.CO2对人类的的生命活动非常重要 我们可以从多角度认识二氧化碳
(1)正常雨水的pH<7,是因为雨水降落过程中遇到了空气中的二氧化碳,与二氧化碳反应,生成_____(写该物质名称)使雨水呈酸性
(2)在下图中,用大理石和盐酸制取纯净 干燥的二氧化碳,并用排空气法收集CO2 (碳酸氢钠可以与盐酸反应生成二氧化碳)仪器的连接顺序为a接d,e接b,c接_____(选f或g) 装置B中所装的试剂是_____(填名称),仪器①的名称_____,向装置E中逐滴加入氢氧化钠溶液,实验现象为_____
(3)二氧化碳是一种重要的化工原料
a、在纳米纤维催化剂条件下,二氧化碳和氢气反应制得液体燃料甲醇(CH3OH)并生成水 反应的方程式为_____;
b、在高温 高压条件下,二氧化碳和NH3反应制得重要肥料尿素[CO(NH2)2]并生成水 该反应方程式为_____
五、计算题
20.为测定某市售碳酸钙药品中碳酸钙的质量分数(杂质为SiO2,与稀盐酸不反应),某同学的方法是:将样品与稀盐酸反应,测定反应后生成的CO2质量,再根据CO2的质量求出样品中碳酸钙的质量,从而计算出样品中碳酸钙的质量分数。为测定生成CO2的质量,他设计了如下实验方案(已知:无水氯化钙是常见的干燥剂):
①按图组装好装置,检查装置气密性后,在分液漏斗中加入过量稀盐酸,并在干燥管中加入适量无水氯化钙样品,称得装置和药品的总质量为564.57 g;
②在广口瓶中加入碳酸钙样品,称得装置和药品的总质量为574.57 g;
③旋紧橡皮塞,打开分液漏斗旋塞,向广口瓶中滴加稀盐酸,使样品与稀盐酸完全反应;
④反应结束后,称得装置及装置内所有物质的总质量为570.57 g。
请根据上述实验回答下列问题∶
(1)该方案测得样品中碳酸钙的质量分数是____________(写出解题过程,计算结果精确到0.1%)?
(2)该实验中用稀盐酸与碳酸钙样品反应,而不用浓盐酸与碳酸钙样品反应,其原因是________________。若实验中不用无水氯化钙干燥,则测得样品中碳酸钙的质量分数与上述实验计算结果相比__________(选填“偏小”或“不变”或“偏大”)。
21.某实验小组同学从碳酸钙、碳酸钠和氯化钠的固体混合物中提取氯化钠,实验操作的一部分流程如下图。请根据图中所提供的数据,回答下列问题:
(1)本实验生成二氧化碳的质量是______g,原固体混合物中碳酸钠的质量是______g。
(2)本实验最终所得不饱和溶液的溶质质量分数是多少?
参考答案:
1.B 2.B 3.C 4.A 5.C 6.C 7.B 8.D 9.A 10.C 11.D 12.A 13.D
14. H+ 能使紫色石蕊试液变红,使无色酚酞试液不变色;能与碱发生中和反应;能与较活泼金属反应 能与碱发生中和反应 H2(O2) CaO+H2O=Ca(OH)2 H2SO4+Ca(OH)2=CaSO4+2H2O 取待测水样,滴到pH试纸上,把pH试纸显示的颜色与标准比色卡比较,读出pH
15. C ①⑤ 83.0%
16. 化合反应 改良酸性士壤(合理即可)
17. NaOH 2HCl+Ca(OH)2=CaCl2+2H2O
18. B D G H NaOH溶液 紫色石蕊溶液 NaOH和Na2CO3 HCl NaCl 和NaOH 与酸碱指示剂反应、与活泼金属反应、与某些金属氧化物反应、与碱反应、与某些盐反应
19. 碳酸 f 浓硫酸 分液漏斗 气球胀大
20.(1)样品的质量为574.57 g-564.57 g=10 g,生成二氧化碳的质量为574.57 g-570.57 g=4 g
解:设参加反应的碳酸钙的质量为x
x≈9.09 g
所以碳酸钙样品中碳酸钙的质量分数为×100%=90.9%
答:样品中碳酸钙的质量分数是90.9%
(2)浓盐酸具有挥发性,会带来测量误差
(3)偏大
21.解:生成二氧化碳质量为20g-5.6g+90g+100g-200g=4.4g
设碳酸钠质量为x,生成氯化钠质量为y
答:(1)4.4;10.6
(2)所得溶液的溶质质量分数为7.75%。
