第9章溶液检测题-2021-2022学年九年级化学京改版(2013)下册(word版有答案)
文档属性
| 名称 | 第9章溶液检测题-2021-2022学年九年级化学京改版(2013)下册(word版有答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 140.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-23 23:02:30 | ||
图片预览


文档简介
第9章《溶液》检测题
一、单选题
1.如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
A.砂糖水颜色很深 B.砂糖水味道很甜
C.砂糖溶解得很快 D.砂糖固体有剩余
2.进行“一定溶质质量分数的氯化钠溶液的配制”实验活动常出现以下错误操作,其中不影响所配溶液浓度的是( )
A.氯化钠放在右盘 B.氯化钠洒出
C.俯视读数 D.配好的溶液装瓶时溅出
3.如图是甲、乙两种固体物质的溶解度曲线。下列叙述错误的是( )
A.t2℃时,甲、乙两种固体物质的饱和溶液中溶质的质量分数相等
B.加入乙物质或蒸发溶剂能使乙的不饱和溶液变成饱和溶液
C.相同质量的甲、乙饱和溶液分别从t2℃降温到t1℃,析出固体的质量甲<乙
D.t3℃时,将75g甲的饱和溶液与25g水混合后所得溶液中溶质的质量分数为25%
4.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是
①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
A.①② B.①③ C.②④ D.③④
5.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
6.氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。
其中措施正确的是
A.①②④ B.①③④ C.①③⑤ D.①②⑤
7.下列物质分别加入适量水中,充分搅拌,能够得到溶液的是
A.蔗糖 B.花生油 C.面粉 D.冰块
8.如图是利用海水提取粗盐的过程(温度不变),有关说法正确的是
A.氯化钠在海水中以分子的形式存在 B.①为蒸发池,②为结晶池
C.①中氧化钠的质量分数逐渐减小 D.母液是氯化钠的不饱和溶液
9.实验室用氯化钠配制50g质量分数为6%的氯化钠溶液。下列说法中不正确的是( )
A.所需氯化钠的质量为3g
B.氯化钠放在托盘天平的左盘称量
C.俯视量筒读数会使所配溶液偏稀
D.所需玻璃仪器有烧杯、玻璃棒、量筒等
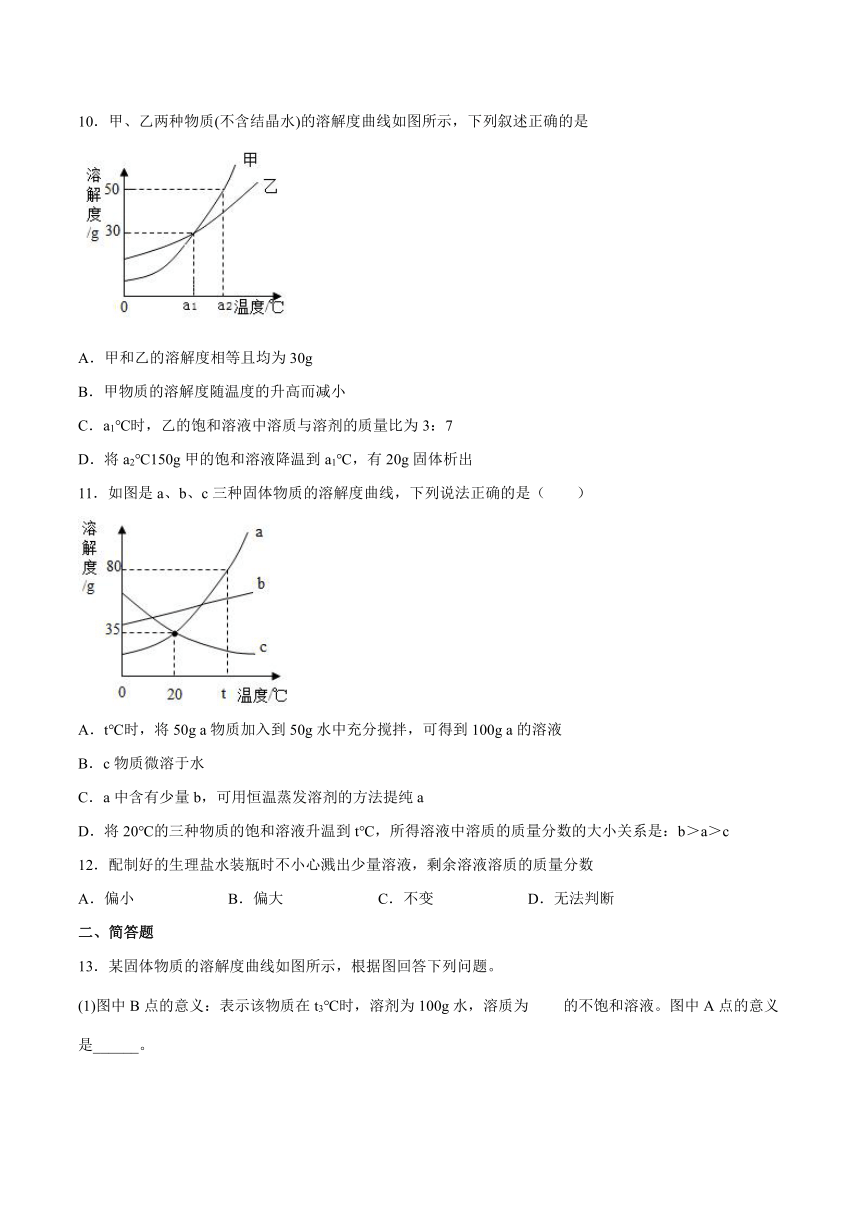
10.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
11.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t℃时,将50g a物质加入到50g水中充分搅拌,可得到100g a的溶液
B.c物质微溶于水
C.a中含有少量b,可用恒温蒸发溶剂的方法提纯a
D.将20℃的三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a>c
12.配制好的生理盐水装瓶时不小心溅出少量溶液,剩余溶液溶质的质量分数
A.偏小 B.偏大 C.不变 D.无法判断
二、简答题
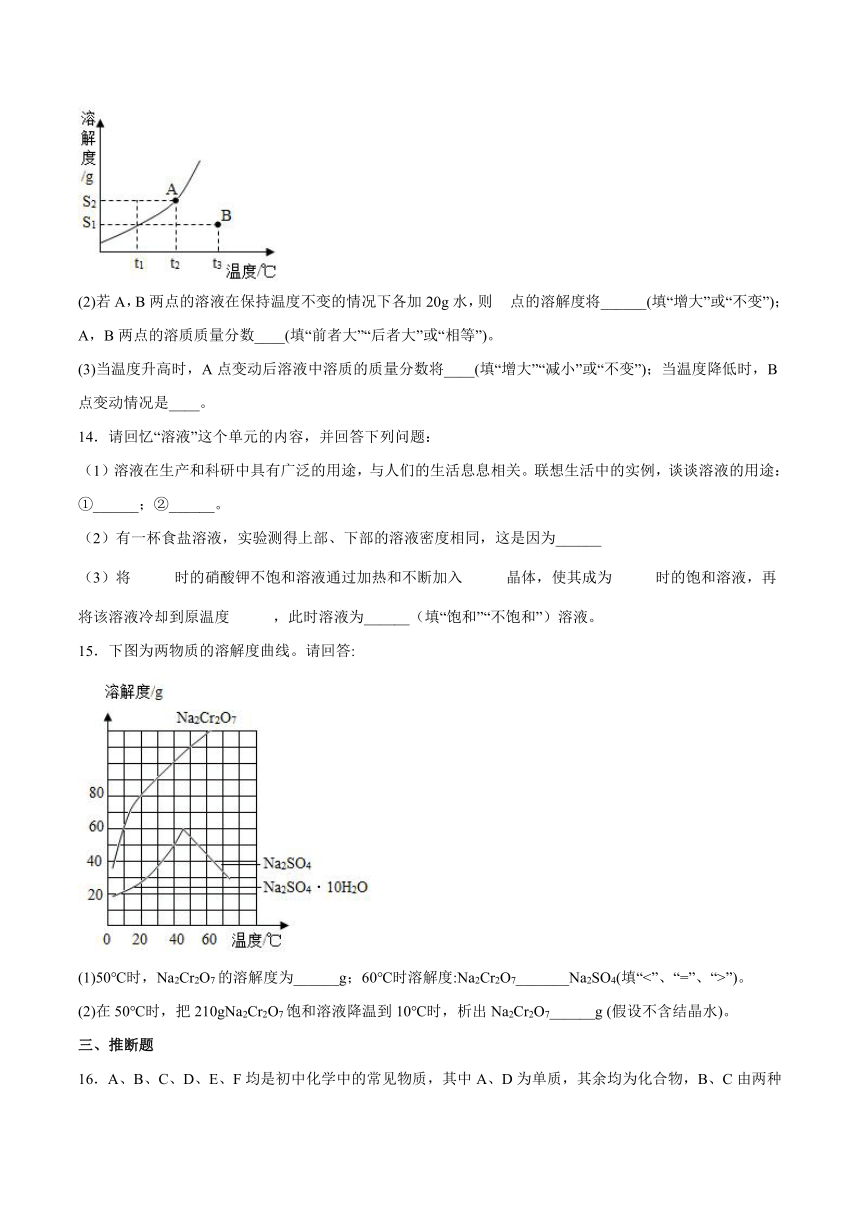
13.某固体物质的溶解度曲线如图所示,根据图回答下列问题。
(1)图中B点的意义:表示该物质在t3℃时,溶剂为100g水,溶质为的不饱和溶液。图中A点的意义是______。
(2)若A,B两点的溶液在保持温度不变的情况下各加20g水,则点的溶解度将______(填“增大”或“不变”);A,B两点的溶质质量分数____(填“前者大”“后者大”或“相等”)。
(3)当温度升高时,A点变动后溶液中溶质的质量分数将____(填“增大”“减小”或“不变”);当温度降低时,B点变动情况是____。
14.请回忆“溶液”这个单元的内容,并回答下列问题:
(1)溶液在生产和科研中具有广泛的用途,与人们的生活息息相关。联想生活中的实例,谈谈溶液的用途:①______;②______。
(2)有一杯食盐溶液,实验测得上部、下部的溶液密度相同,这是因为______
(3)将时的硝酸钾不饱和溶液通过加热和不断加入晶体,使其成为时的饱和溶液,再将该溶液冷却到原温度,此时溶液为______(填“饱和”“不饱和”)溶液。
15.下图为两物质的溶解度曲线。请回答:
(1)50℃时,Na2Cr2O7的溶解度为______g;60℃时溶解度:Na2Cr2O7_______Na2SO4(填“<”、“=”、“>”)。
(2)在50℃时,把210gNa2Cr2O7饱和溶液降温到10℃时,析出Na2Cr2O7______g (假设不含结晶水)。
三、推断题
16.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)A在D中完全燃烧和不完全燃烧时,生成不同的气体。B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是_____(用化学式表示)
(2)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。则E的化学式可能为_____,产生此现象的原因是_____________。
四、实验题
17.配制50g溶质质量分数为5%的氯化钠溶液,如图是某同学配制溶液的过程:
(1)写出标号①的仪器名称______,一般用于______。
(2)E操作中应称取氯化钠的质量是______g,在转移过程中有少量的氯化钠洒落,若不考虑其他因素的影响,结果会使所得的溶质质量分数______,F操作的作用是______。用字母表示该同学正确操作的顺序是______。
(3)称量氯化钠时,若将氯化钠放在天平的右盘中,砝码放在天平的左盘中,在称量过程中使用了游码,则会使称取的质量______(填“大于”或“小于)配制溶液所需的质量。
(4)在量取水的体积时,小刚同学俯视读数,则所配制溶液中氯化钠的质量分数______(填“偏大”、“偏小”或“不变”)。
18.某同学配制60g溶质质量分数为5%的NaCl溶液,准备了下列实验用品。回答下列问题:
(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④___________(填步骤名称)。
(2)配制过程还缺少的一种玻璃仪器是___________(填名称)。
(3)计算所需NaCl的质量为___________g,称量时,NaCl应放在托盘天平的___________(填“左盘”、“右盘”)上。
(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用___________(填仪器名称)滴加蒸馏水至刻度线。下图该同学观察方式正确的是___________(填序号)。
(5)若用C观察方式量取水的体积,所配制溶液的溶质质量分数会___________(填“偏大”、“偏小”或“无影响”)。
五、计算题
19.将一定质量的大理石投入50g稀盐酸中,恰好完全发应,放出气体的质量与反应时间的关系如图所示,请回答下列问题:
(1)完全反应后生成二氧化碳气体的质量为___________g;
(2)所用盐酸溶液中溶质的质量分数?(写出计算过程,结果精确到0.1%)
20.过氧化氢不稳定会自然分解,久置的过氧化氢溶液的溶质质量分数会变小。某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质质量分数,进行了实验探究,测得的相关数据如图所示。
(1)根据质量守恒定律,反应生成氧气的质量为__________。
(2)计算该过氧化氢溶液中溶质质量分数。
参考答案:
1.D 2.D 3.C 4.A 5.D 6.D 7.A 8.B 9.C 10.D 11.D 12.C
13. 表示t2℃时,该物质的溶解度为S1(g) 不变 前者大 不变 水平左移至曲线后沿曲线下移
14. 许多化学反应在溶液中进行,可以加快反应速率 溶液对动植物和人的生理活动有很重要的意义(合理即可) 溶液具有均一性 饱和
15. 110 > 50
16. H2O2 NaOH或CaO E溶于水放热
17.(1) 量筒 量取液体体积
(2) 2.5 减小##偏小 搅拌加速固体溶解 DEBAFC
(3)小于
(4)偏大
18. 溶解 玻璃棒 3 左盘 胶头滴管 A 偏大
19.(1)2.2
(2)设参与反应的盐酸中溶质的质量为x
x=3.65g
所用盐酸溶液中溶质的质量分数=×100%=7.3%
答:所用盐酸溶液中溶质的质量分数为7.3%。
20.(1)0.8g
(2)5%
解:设过氧化氢溶液溶质质量分数为x。
x=5%
答:溶质质量分数5%。
一、单选题
1.如图,将红砂糖倒入一杯开水中,充分溶解。能作为判断砂糖水是饱和溶液的依据是( )
A.砂糖水颜色很深 B.砂糖水味道很甜
C.砂糖溶解得很快 D.砂糖固体有剩余
2.进行“一定溶质质量分数的氯化钠溶液的配制”实验活动常出现以下错误操作,其中不影响所配溶液浓度的是( )
A.氯化钠放在右盘 B.氯化钠洒出
C.俯视读数 D.配好的溶液装瓶时溅出
3.如图是甲、乙两种固体物质的溶解度曲线。下列叙述错误的是( )
A.t2℃时,甲、乙两种固体物质的饱和溶液中溶质的质量分数相等
B.加入乙物质或蒸发溶剂能使乙的不饱和溶液变成饱和溶液
C.相同质量的甲、乙饱和溶液分别从t2℃降温到t1℃,析出固体的质量甲<乙
D.t3℃时,将75g甲的饱和溶液与25g水混合后所得溶液中溶质的质量分数为25%
4.实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是
①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出;④将配制好的溶液装入试剂瓶中时有少量溅出。
A.①② B.①③ C.②④ D.③④
5.不同温度下KNO3的溶解度如下表所示。下列说法正确的是
温度/℃ 20 30 40
溶解度/g 31.6 45.8 63.9
A.20℃时,100gKNO3饱和溶液中溶质质量为31.6g
B.30℃时,100gKNO3饱和溶液的溶质质量分数为45.8%
C.30℃时,将50gKNO3放入100g水中得到150g溶液
D.40℃时,100g水最多溶解63.9gKNO3
6.氢氧化钙的溶解度随温度升高而减小。要想把一瓶接近饱和的石灰水变成饱和,具体措施有:①加入氢氧化钙;②升高温度;③降低温度;④加入水;⑤蒸发水。
其中措施正确的是
A.①②④ B.①③④ C.①③⑤ D.①②⑤
7.下列物质分别加入适量水中,充分搅拌,能够得到溶液的是
A.蔗糖 B.花生油 C.面粉 D.冰块
8.如图是利用海水提取粗盐的过程(温度不变),有关说法正确的是
A.氯化钠在海水中以分子的形式存在 B.①为蒸发池,②为结晶池
C.①中氧化钠的质量分数逐渐减小 D.母液是氯化钠的不饱和溶液
9.实验室用氯化钠配制50g质量分数为6%的氯化钠溶液。下列说法中不正确的是( )
A.所需氯化钠的质量为3g
B.氯化钠放在托盘天平的左盘称量
C.俯视量筒读数会使所配溶液偏稀
D.所需玻璃仪器有烧杯、玻璃棒、量筒等
10.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
11.如图是a、b、c三种固体物质的溶解度曲线,下列说法正确的是( )
A.t℃时,将50g a物质加入到50g水中充分搅拌,可得到100g a的溶液
B.c物质微溶于水
C.a中含有少量b,可用恒温蒸发溶剂的方法提纯a
D.将20℃的三种物质的饱和溶液升温到t℃,所得溶液中溶质的质量分数的大小关系是:b>a>c
12.配制好的生理盐水装瓶时不小心溅出少量溶液,剩余溶液溶质的质量分数
A.偏小 B.偏大 C.不变 D.无法判断
二、简答题
13.某固体物质的溶解度曲线如图所示,根据图回答下列问题。
(1)图中B点的意义:表示该物质在t3℃时,溶剂为100g水,溶质为的不饱和溶液。图中A点的意义是______。
(2)若A,B两点的溶液在保持温度不变的情况下各加20g水,则点的溶解度将______(填“增大”或“不变”);A,B两点的溶质质量分数____(填“前者大”“后者大”或“相等”)。
(3)当温度升高时,A点变动后溶液中溶质的质量分数将____(填“增大”“减小”或“不变”);当温度降低时,B点变动情况是____。
14.请回忆“溶液”这个单元的内容,并回答下列问题:
(1)溶液在生产和科研中具有广泛的用途,与人们的生活息息相关。联想生活中的实例,谈谈溶液的用途:①______;②______。
(2)有一杯食盐溶液,实验测得上部、下部的溶液密度相同,这是因为______
(3)将时的硝酸钾不饱和溶液通过加热和不断加入晶体,使其成为时的饱和溶液,再将该溶液冷却到原温度,此时溶液为______(填“饱和”“不饱和”)溶液。
15.下图为两物质的溶解度曲线。请回答:
(1)50℃时,Na2Cr2O7的溶解度为______g;60℃时溶解度:Na2Cr2O7_______Na2SO4(填“<”、“=”、“>”)。
(2)在50℃时,把210gNa2Cr2O7饱和溶液降温到10℃时,析出Na2Cr2O7______g (假设不含结晶水)。
三、推断题
16.A、B、C、D、E、F均是初中化学中的常见物质,其中A、D为单质,其余均为化合物,B、C由两种相同元素组成。
(1)A在D中完全燃烧和不完全燃烧时,生成不同的气体。B溶液在一定条件下可反应生成C和无色气体D,C和D都与生命活动息息相关。B溶液中的溶质是_____(用化学式表示)
(2)如图所示将固体E放入大烧杯中的水里,小烧杯中F的饱和溶液变浑浊。则E的化学式可能为_____,产生此现象的原因是_____________。
四、实验题
17.配制50g溶质质量分数为5%的氯化钠溶液,如图是某同学配制溶液的过程:
(1)写出标号①的仪器名称______,一般用于______。
(2)E操作中应称取氯化钠的质量是______g,在转移过程中有少量的氯化钠洒落,若不考虑其他因素的影响,结果会使所得的溶质质量分数______,F操作的作用是______。用字母表示该同学正确操作的顺序是______。
(3)称量氯化钠时,若将氯化钠放在天平的右盘中,砝码放在天平的左盘中,在称量过程中使用了游码,则会使称取的质量______(填“大于”或“小于)配制溶液所需的质量。
(4)在量取水的体积时,小刚同学俯视读数,则所配制溶液中氯化钠的质量分数______(填“偏大”、“偏小”或“不变”)。
18.某同学配制60g溶质质量分数为5%的NaCl溶液,准备了下列实验用品。回答下列问题:
(1)该同学按下列实验步骤进行:①计算,②称量,③量取,④___________(填步骤名称)。
(2)配制过程还缺少的一种玻璃仪器是___________(填名称)。
(3)计算所需NaCl的质量为___________g,称量时,NaCl应放在托盘天平的___________(填“左盘”、“右盘”)上。
(4)量取蒸馏水操作如下:将蒸馏水注入量筒,待液面接近量取体积对应刻度线时,改用___________(填仪器名称)滴加蒸馏水至刻度线。下图该同学观察方式正确的是___________(填序号)。
(5)若用C观察方式量取水的体积,所配制溶液的溶质质量分数会___________(填“偏大”、“偏小”或“无影响”)。
五、计算题
19.将一定质量的大理石投入50g稀盐酸中,恰好完全发应,放出气体的质量与反应时间的关系如图所示,请回答下列问题:
(1)完全反应后生成二氧化碳气体的质量为___________g;
(2)所用盐酸溶液中溶质的质量分数?(写出计算过程,结果精确到0.1%)
20.过氧化氢不稳定会自然分解,久置的过氧化氢溶液的溶质质量分数会变小。某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质质量分数,进行了实验探究,测得的相关数据如图所示。
(1)根据质量守恒定律,反应生成氧气的质量为__________。
(2)计算该过氧化氢溶液中溶质质量分数。
参考答案:
1.D 2.D 3.C 4.A 5.D 6.D 7.A 8.B 9.C 10.D 11.D 12.C
13. 表示t2℃时,该物质的溶解度为S1(g) 不变 前者大 不变 水平左移至曲线后沿曲线下移
14. 许多化学反应在溶液中进行,可以加快反应速率 溶液对动植物和人的生理活动有很重要的意义(合理即可) 溶液具有均一性 饱和
15. 110 > 50
16. H2O2 NaOH或CaO E溶于水放热
17.(1) 量筒 量取液体体积
(2) 2.5 减小##偏小 搅拌加速固体溶解 DEBAFC
(3)小于
(4)偏大
18. 溶解 玻璃棒 3 左盘 胶头滴管 A 偏大
19.(1)2.2
(2)设参与反应的盐酸中溶质的质量为x
x=3.65g
所用盐酸溶液中溶质的质量分数=×100%=7.3%
答:所用盐酸溶液中溶质的质量分数为7.3%。
20.(1)0.8g
(2)5%
解:设过氧化氢溶液溶质质量分数为x。
x=5%
答:溶质质量分数5%。
