高中化学人教版(2019)必修第一册 2.3.3 物质的量在化学方程式计算中的应用 课件(22张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册 2.3.3 物质的量在化学方程式计算中的应用 课件(22张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 198.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 15:45:03 | ||
图片预览






文档简介
(共26张PPT)
三、物质的量在化学方程式计算中的应用
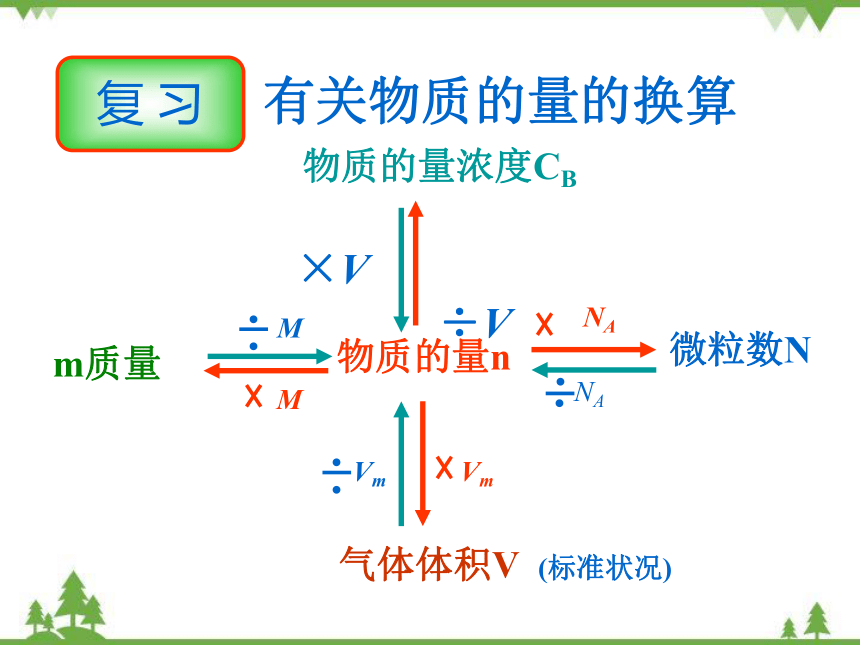
复 习
物质的量n
微粒数N
NA
.
.
NA
M
.
.
M
m质量
气体体积V (标准状况)
Vm
.
.
Vm
物质的量浓度CB
×V
÷V
有关物质的量的换算
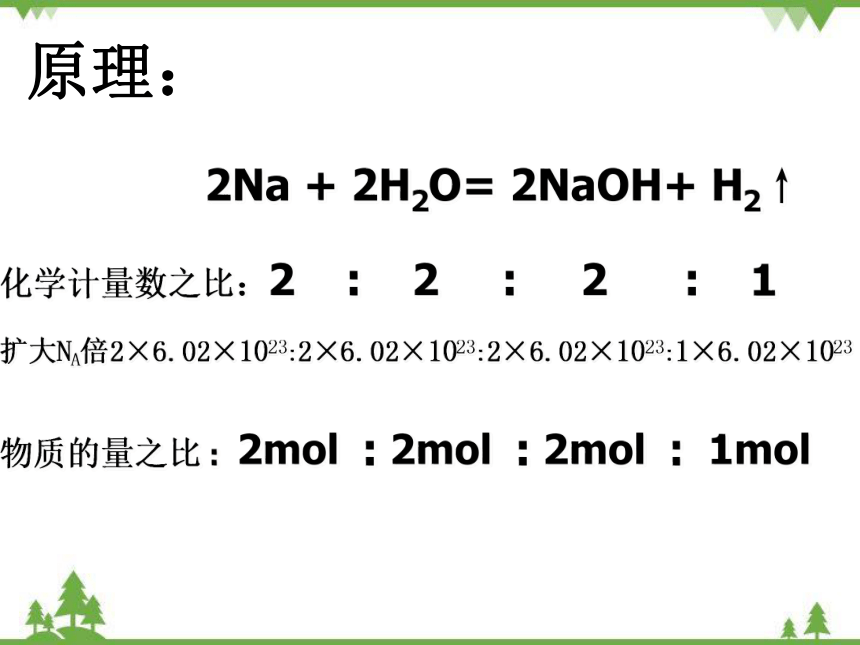
原理:
2Na + 2H2O= 2NaOH+ H2↑
化学计量数之比:2 : 2 : 2 : 1
扩大NA倍2×6.02×1023:2×6.02×1023:2×6.02×1023:1×6.02×1023
物质的量之比 : 2mol : 2mol : 2mol : 1mol
结论:化学方程式中各物质的化学计量数之比等于组成各物质的粒子数之比,也等于各物质的物质的量之比
例1
把6.5gZn放入足量的盐酸中,Zn完全反应。计算:
(2)、参加反应的HCl的物质的量;
(1)、6.5gZn的物质的量;
(3)、生成H2的体积(标准状况)。
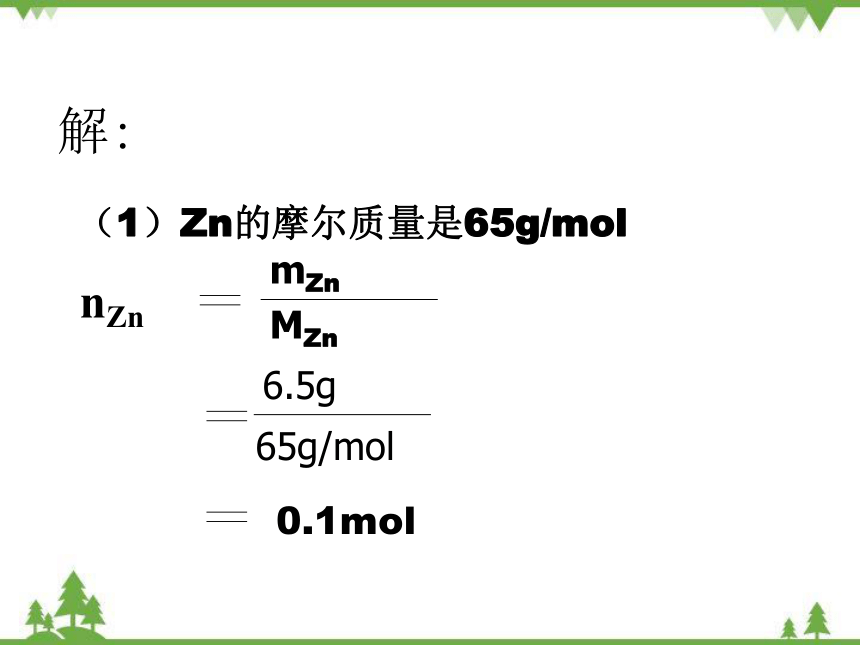
解:
mZn
MZn
nZn
6.5g
65g/mol
0.1mol
(1)Zn的摩尔质量是65g/mol
(2)设HCl的物质的量为nHCl
Zn + 2HCl =ZnCl2+H2↑
1
0.1mol nHCl
2
(3)设H2的物质的量为nH2
Zn + 2HCl =ZnCl2+H2↑
1
0.1mol nH2
1
VH2=nH2×Vm=0.1mol×22.4L/mol=2.24L
答:(1)6.5gZn的物质的量为0.1mol;
(2)参加反应的HCl的物质的量为 0.2mol;
(3)生成H2的体积(标准状况)为2.24L。
已知某物质(反应物或生成物)的物质的量,求其它物质(反应物或生成物)的物质的量。
归纳:
一般先根据计量系数比,先求出物质的量,再求质量,体积,浓度。
1、已知条件是什么;
解题思路:
2、要求的是什么?
3、应该找什么关系?
关于化学方程式的计算的基本步骤:
(1)设:设所求物质的物质的量为n;
(2)写:写出有关的化学方程式;
(3)找:找出相关物质的计量数之比对应计量数,找出相关物质的物质的量;
(4)列:将有关的四个量列出比例式;
(5)解:根据比例式求求出n,再求m,V或C;
(6)答:写出简明答案。
例2、把5.4gAl放入足量NaOH溶液中完全反应,计算生成氢气的体积(标准状况)。
解:设氢气的物质的量为nHCl
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2
3
0.2mol
nHCl
例3将一份CaCO3粉末放入500ml的盐酸中
,恰好完全反应,在标准状况下收集到
CO2气体的体积为22.4L,求:
(1)CaCO3的质量
(2)盐酸的物质的量浓度
解:(1)设CaCO3的物质的量为nCaCO3
1
1
nCaCO3
1mol
(2)设HCl的物质的量为nHCl
2
1
nHCl
1mol
例3.现有一种铜粉和铝粉的混合物样品。为测定该样品中铝的含量,称取5.0g此样品置于锥形瓶中,将100ml稀盐酸加入其中恰好完全反应,剩余固体2.3g。求:
(1)该混合物中铝的质量分数为多少?
(2)所用盐酸中溶质的物质的量浓度为多少?
解:(1)mAl = m总 - m剩
= 5.0g - 2.3g = 2.7g
(2)设HCl的物质的量为nHCl
2
6
0.1mol
nHCl
练一练
将30gMnO2的质量分数为76.6%软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应)。计算: (1)参加反应的浓盐酸的体积 (2)生成的Cl2的体积(标况下)
谢谢!再见!
三、物质的量在化学方程式计算中的应用
复 习
物质的量n
微粒数N
NA
.
.
NA
M
.
.
M
m质量
气体体积V (标准状况)
Vm
.
.
Vm
物质的量浓度CB
×V
÷V
有关物质的量的换算
原理:
2Na + 2H2O= 2NaOH+ H2↑
化学计量数之比:2 : 2 : 2 : 1
扩大NA倍2×6.02×1023:2×6.02×1023:2×6.02×1023:1×6.02×1023
物质的量之比 : 2mol : 2mol : 2mol : 1mol
结论:化学方程式中各物质的化学计量数之比等于组成各物质的粒子数之比,也等于各物质的物质的量之比
例1
把6.5gZn放入足量的盐酸中,Zn完全反应。计算:
(2)、参加反应的HCl的物质的量;
(1)、6.5gZn的物质的量;
(3)、生成H2的体积(标准状况)。
解:
mZn
MZn
nZn
6.5g
65g/mol
0.1mol
(1)Zn的摩尔质量是65g/mol
(2)设HCl的物质的量为nHCl
Zn + 2HCl =ZnCl2+H2↑
1
0.1mol nHCl
2
(3)设H2的物质的量为nH2
Zn + 2HCl =ZnCl2+H2↑
1
0.1mol nH2
1
VH2=nH2×Vm=0.1mol×22.4L/mol=2.24L
答:(1)6.5gZn的物质的量为0.1mol;
(2)参加反应的HCl的物质的量为 0.2mol;
(3)生成H2的体积(标准状况)为2.24L。
已知某物质(反应物或生成物)的物质的量,求其它物质(反应物或生成物)的物质的量。
归纳:
一般先根据计量系数比,先求出物质的量,再求质量,体积,浓度。
1、已知条件是什么;
解题思路:
2、要求的是什么?
3、应该找什么关系?
关于化学方程式的计算的基本步骤:
(1)设:设所求物质的物质的量为n;
(2)写:写出有关的化学方程式;
(3)找:找出相关物质的计量数之比对应计量数,找出相关物质的物质的量;
(4)列:将有关的四个量列出比例式;
(5)解:根据比例式求求出n,再求m,V或C;
(6)答:写出简明答案。
例2、把5.4gAl放入足量NaOH溶液中完全反应,计算生成氢气的体积(标准状况)。
解:设氢气的物质的量为nHCl
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2
3
0.2mol
nHCl
例3将一份CaCO3粉末放入500ml的盐酸中
,恰好完全反应,在标准状况下收集到
CO2气体的体积为22.4L,求:
(1)CaCO3的质量
(2)盐酸的物质的量浓度
解:(1)设CaCO3的物质的量为nCaCO3
1
1
nCaCO3
1mol
(2)设HCl的物质的量为nHCl
2
1
nHCl
1mol
例3.现有一种铜粉和铝粉的混合物样品。为测定该样品中铝的含量,称取5.0g此样品置于锥形瓶中,将100ml稀盐酸加入其中恰好完全反应,剩余固体2.3g。求:
(1)该混合物中铝的质量分数为多少?
(2)所用盐酸中溶质的物质的量浓度为多少?
解:(1)mAl = m总 - m剩
= 5.0g - 2.3g = 2.7g
(2)设HCl的物质的量为nHCl
2
6
0.1mol
nHCl
练一练
将30gMnO2的质量分数为76.6%软锰矿石与足量12mol/L浓盐酸完全反应(杂质不参加反应)。计算: (1)参加反应的浓盐酸的体积 (2)生成的Cl2的体积(标况下)
谢谢!再见!
