8.2金属的化学性质一课一练(word版有答案)
文档属性
| 名称 | 8.2金属的化学性质一课一练(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 168.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 11:00:28 | ||
图片预览




文档简介
8.2 金属的化学性质 一课一练
一、单选题
1.下列所示的四个图像,能正确反映对应变化关系的是( )
A.电解水
B.向两份完全相同的稀盐酸中分别加入足量的锌粉和铁粉
C.加热一定质量的氯酸钾和二氧化锰的混合物
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
2.下图所示反应,有关说法的错误的是
A.铝丝需要砂纸打磨
B.溶液由蓝色变为无色
C.金属活动性强弱:Al>Cu
D.反应的化学方程式为:Al+CuSO4=Cu+AlSO4
3.向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是( )
A. B. C. D.
4.将金属R放入稀硫酸中,没有气泡产生,放入硫酸铜溶液中,表面有红色物质析出。下列关于R的金属活动性判断不正确的是( )
A.R>Cu B.R>Fe C.Zn>R D.R>Ag
5.下列物质的转化中,不能由两种单质直接制得的是
A.H2→H2O B.Fe→FeCl2 C.P→P2O5 D.Al→Al2O3
6.下列不能与稀盐酸反应的金属是
A.Cu B.Zn C.Al D.Mg
7.已知化学反应:X+YSO4 = Y+XSO4,根据此反应信息判断正确的是( )
A.X一定是金属铁 B.Y一定是金属铜
C.X的金属活动性比Y强 D.Y的金属活动性比X强
8.为比较X、Y、Z三种金属活动性大小,进行如图所示的实验。下列实验结论正确的是( )
A.X>Y>Z
B.Z>Y>X
C.Y>X、Y>Z
D.X>Y、Z>Y
9.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是
比较硬度,硬度小的是“愚人金”
灼烧,表面变色的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A. B. C. D.
10.下列有关金属的说法错误的是
A.铜能导电 B.银能与稀盐酸反应
C.镁的活动性比铁强 D.铝具有良好的抗腐蚀性
11.在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。
物质 a b c d
反应前质量/g 5.6 10 0 20
反应后质量/g 0 16.4 15.2 x
下列说法正确的是A.x等于36
B.b可能是单质
C.该反应一定为置换反应
D.a与b的相对分子质量之比为7:8
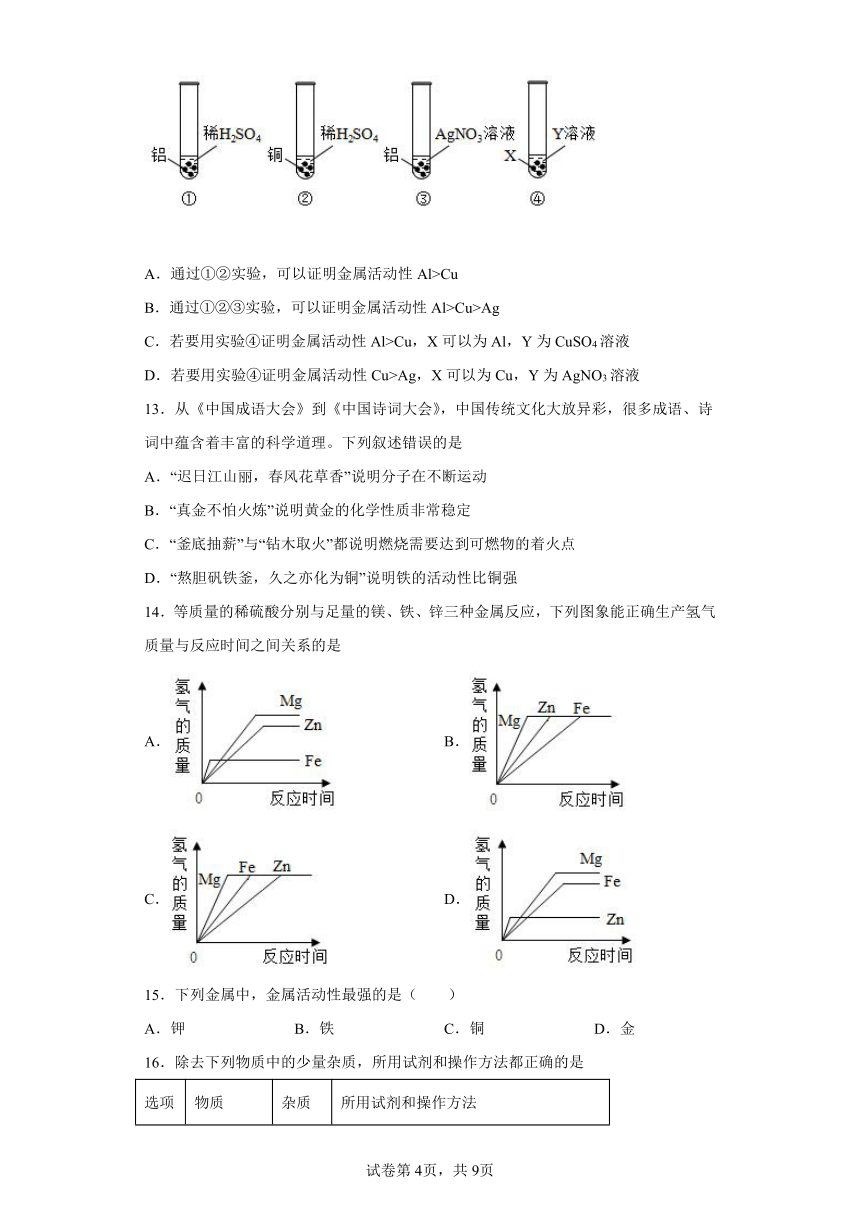
12.验证铝、铜、银的金属活动性强弱,小明设计了以下四组实验,下列说法不正确的是
A.通过①②实验,可以证明金属活动性Al>Cu
B.通过①②③实验,可以证明金属活动性Al>Cu>Ag
C.若要用实验④证明金属活动性Al>Cu,X可以为Al,Y为CuSO4溶液
D.若要用实验④证明金属活动性Cu>Ag,X可以为Cu,Y为AgNO3溶液
13.从《中国成语大会》到《中国诗词大会》,中国传统文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理。下列叙述错误的是
A.“迟日江山丽,春风花草香”说明分子在不断运动
B.“真金不怕火炼”说明黄金的化学性质非常稳定
C.“釜底抽薪”与“钻木取火”都说明燃烧需要达到可燃物的着火点
D.“熬胆矾铁釜,久之亦化为铜”说明铁的活动性比铜强
14.等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,下列图象能正确生产氢气质量与反应时间之间关系的是
A. B.
C. D.
15.下列金属中,金属活动性最强的是( )
A.钾 B.铁 C.铜 D.金
16.除去下列物质中的少量杂质,所用试剂和操作方法都正确的是
选项 物质 杂质 所用试剂和操作方法
A H2O NaCl 向水中加入活性炭吸附
B CO2 CO 点燃
C FeCl2溶液 CuCl2 加入足量的铁粉,充分搅拌后过滤
D CuO 木炭 隔绝空气加热至固体质量不再发生变化
A.A B.B C.C D.D
二、综合应用题
17.金属与我们生活关系密切。
(1)铁
①下列物品所使用的主要材料属于合金的是 ____ (填标号,下同)。
A.青花瓷瓶 B.橡胶充气艇 C.不锈钢锅
②生铁和钢是常用的合金,生铁的含碳量比钢的含碳量__________(填“高”或“低”)。 生铁冶炼的主要原理是利用一氧化碳与氧化铁反应,反应的化学方程式为__________________________________。
③生活中常用铁锅做炊具,利用了铁的___________性。
④颗粒大小达到纳米级的单质铁具有很强的反应活性,俗称纳米铁.在高温环境下,用H2和FeCl2反应,可以生成纳米铁和一种易溶于水显强酸性的气体,写出该反应的化学方程式____________________________________。
⑤铁制品锈蚀的过程,实际上是铁与空气中的________和________ 等发生化学反应的过程;回收废钢铁的目的是_______________________ (写一点)。
(2)铜
①黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明合金的硬度比组成中的纯金属要 _________ (填“大”、“小”)。
②黄铜渣中约含 Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。通过流程如下图的方法处理黄铜渣可得到硫酸锌(杂质不溶于水、不参与反应)。
资料:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2O
Ⅱ中生成金属单质的化学反应方程式为 _____________________________________ 。该流程最终得到的硫酸锌中锌元素质量 _____ (填“<”、“=”、“>”)黄铜中锌元素质量。
(3)铝
①铝块能制成铝箔是利用了铝的_________性。
②铝比铁活泼,但铝比铁耐腐蚀的原因是______________________________________。
③由铝粉与氧化铁组成的铝热剂在高温下反应,生成另一种氧化物和另一种金属单质,常用于焊接铁轨,试写出该反应的化学方程式:___________________。
(4)锌
锌等金属可以用于生产纽扣电池,下面是某常见纽扣电池中发生的反应:H2O+Zn+HgO=Zn(OH)2+Hg
①该反应后锌元素的化合价为___________。
②将该反应中的反应物进行简单分类,则下面横线上的物质是(填化学式):
纯净物:单质:_____________金属氧化物:_____________
③该电池中通常还加入石墨粉,是因为石墨具有良好的__________性。
④废旧电池不能随意丢弃,由于电池种类不同,应______________回收。
18.人类文明进步与金属材料发展关系十分密切。某课外兴趣小组探究金属的性质。
(1)用等质量相同表面积的镁条,等体积不同浓度的稀盐酸(盐酸浓度越大,密度越高),在一定条件下反应,实验结果如图所示:
①对比两曲线,a曲线所用盐酸浓度_______b曲线所用盐酸浓度(填“大于”或“小于”)。
②a、b对应实验产生的氢气质量相等,下列说法正确的是_______。
A 两实验镁条消耗的溶质质量相等
B a对应实验盐酸一定过量
C a对应实验达到的最高温度比b对应实验高
D 较长时间后,a、b曲线重合
(2)将10g含镁48%的镁铝合金(不含其他元素)粉末与稀硫酸反应完全。
①该合金中镁消耗硫酸的质量最多是多少 (写出计算过程)_______
②该合金与稀硫酸反应后生成氢气的质量最多是_______(计算结果保留2位小数)。
19.某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,工业流程如图:
(1)操作a的名称是______。
(2)金属A与废液发生反应的化学方程式为______。
(3)为了除去固体混合物中Fe粉,获得纯净的Cu粉,某同学设计了如图两个实验方案:
方案①中,由于______,可能导致Fe粉除不尽。
(4)为了准确测定Fe、Cu混合物中Cu的质量分数,某小组取样品20g,向其中加入100g足量的稀硫酸,充分反应后剩余混合物的总重量变为119.8g求:
①m=______g。
②样品中Cu的质量分数______(写出计算过程)。
20.为除去铜屑中的少量铁屑,某同学设计了如图两个实验方案:
(1)写出方案②中有关反应的化学方程式_______。
(2)以上两个实验方案中,你选择的是_______,理由是_______。
(3)两个方案中过滤需要的仪器是_______。
(4)现有100g铜屑,依照方案①进行实验,经处理得到干燥的固体100.8g。则铜屑中铜的质量分数为____。
(5)请思考更简单的方法_______。
21.某实验小组为了研究反应物的接触面积对反应速率的影响。实验装置如“题21-1图”所示,他们用等质量不同形状的金属锌(所用金属锌均不含任何杂质)和稀盐酸反应(见下表),实验中使用传感器装置测算生成氢气的体积,绘制氢气体积随时间变化的曲线如图所示。
实验编号 药品
I 6.5g锌块、7.3%的稀盐酸150g
II 6.5g锌粒、7.3%的稀盐酸150g
III 6.5g锌粉、7.3%的稀盐酸150g
(1)如图的曲线___________(填“甲”、“乙”或“丙”)代表的是实验III,从曲线甲、乙、丙得出探究结论是:_______________。
(2)实验前需要配制7.3%的稀盐酸150g,需要质量分数为36.5%的浓盐酸__________g。
(3)请计算以上任意一组实验中生成氢气的质量___________(写出具体计算过程)。
(4)分析上表数据,请在图中画出在6.5g锌中加入0~150g稀盐酸过程中,产生氢气质量对应的变化曲线图,并标注必要的数值。___________
22.分金属于机金属板中含有Fe、 Cu、 Au、 Ni(银银白色金属等金属,如图是某工厂回收部分金属的流程图。已知2Cu+O2+2H2SO42CuSO4+2H2O
(1)操作①的名称是_____。
(2)固体A的化学式为_____;滤液②中所含的金属阳离子为_____。
(3)写出滤液③和铁粉发生反应的一个化学方程式_____;该反应的基本类型为 _____反应。
(4) Cu、Fe、 Ni在溶液中的活动性由强到弱的顺序依次是_____。
(5)另有同学乙将一定质量的锌粒投入含有Cu(NO3)2 和Fe(NO3)3的混合溶液中,充分反应后过滤,若滤液中除了水之外,只含有一种物质,则滤渣中一定含有_____。
(6)铝合金广泛应用于生活中,兴趣小组同学称取20g铝合金粉末于烧杯中,将400g稀硫酸分四次加入(每次加入100g),充分反应,测得实验数据如下表所示:(假设该铝合金中只有铝能与稀硫酸反应,其他成分不与稀硫酸反应)则m=_____, 铝合金样品中铝的质量分数为_____。
实验 第一次 第二次 第三次 第四次
加入稀硫酸的质量(g) 100 100 100 100
烧杯中剩余物的质量(g) 119.2 218.4 318.0 m
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.B
5.B
6.A
7.C
8.A
9.D
10.B
11.B
12.B
13.C
14.B
15.A
16.C
17. C 高 3CO+Fe2O32Fe+3CO2 导热 H2+FeCl2Fe+2HCl 氧气 水 节约金属资源 大 CuSO4+Zn=ZnSO4+Cu > 延展 铝与氧气反应表面形成致密氧化膜 2Al+Fe2O3Al2O3+2Fe +2 Zn HgO 导电 分类
18. 大于 ACD 19.6g 0.98g
19.(1)过滤
(2)
(3)生成的铜覆盖在铁表面,阻止反应进行
(4) 0.2 解:设Fe的质量为x
答:样品中Cu的质量分数为72%。
20. Fe+H2SO4=FeSO4+H2↑ ② 便于观察是否除尽(合理即可) 漏斗、烧杯、玻璃棒、铁架台(带铁圈) 设铁质量为x,
,
x=5.6g,
则铜屑中铜的质量分数为: 用磁铁吸引
21. 甲 在其他条件相同时,固体颗粒越小,反应速率越快; 30 0.2g
22. 过滤 Cu、Fe Fe2+ Fe+CuSO4=FeSO4+Cu 置换 Fe>Ni>Cu Cu、Fe 418.0g 90%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列所示的四个图像,能正确反映对应变化关系的是( )
A.电解水
B.向两份完全相同的稀盐酸中分别加入足量的锌粉和铁粉
C.加热一定质量的氯酸钾和二氧化锰的混合物
D.相同温度下,用两份等质量、等浓度的过氧化氢溶液制氧气,其中一份加入少量MnO2
2.下图所示反应,有关说法的错误的是
A.铝丝需要砂纸打磨
B.溶液由蓝色变为无色
C.金属活动性强弱:Al>Cu
D.反应的化学方程式为:Al+CuSO4=Cu+AlSO4
3.向一定质量FeCl2和CuCl2的混和溶液中逐渐加入足量的锌粒,下列图象不能正确反映对应关系的是( )
A. B. C. D.
4.将金属R放入稀硫酸中,没有气泡产生,放入硫酸铜溶液中,表面有红色物质析出。下列关于R的金属活动性判断不正确的是( )
A.R>Cu B.R>Fe C.Zn>R D.R>Ag
5.下列物质的转化中,不能由两种单质直接制得的是
A.H2→H2O B.Fe→FeCl2 C.P→P2O5 D.Al→Al2O3
6.下列不能与稀盐酸反应的金属是
A.Cu B.Zn C.Al D.Mg
7.已知化学反应:X+YSO4 = Y+XSO4,根据此反应信息判断正确的是( )
A.X一定是金属铁 B.Y一定是金属铜
C.X的金属活动性比Y强 D.Y的金属活动性比X强
8.为比较X、Y、Z三种金属活动性大小,进行如图所示的实验。下列实验结论正确的是( )
A.X>Y>Z
B.Z>Y>X
C.Y>X、Y>Z
D.X>Y、Z>Y
9.“愚人金”实为铜锌合金,外观与黄金极为相似,常被不法商贩冒充黄金牟取暴利,下列关于鉴别“愚人金”与黄金的实验方案,合理的是
比较硬度,硬度小的是“愚人金”
灼烧,表面变色的是“愚人金”
浸没在稀硫酸中,表面有气泡产生的是“愚人金”
浸没在硫酸锌溶液中,表面附着白色物质的是“愚人金”
A. B. C. D.
10.下列有关金属的说法错误的是
A.铜能导电 B.银能与稀盐酸反应
C.镁的活动性比铁强 D.铝具有良好的抗腐蚀性
11.在一密闭容器中加入a、b、c、d四种物质,测得反应前后各物质的质量如下表。
物质 a b c d
反应前质量/g 5.6 10 0 20
反应后质量/g 0 16.4 15.2 x
下列说法正确的是A.x等于36
B.b可能是单质
C.该反应一定为置换反应
D.a与b的相对分子质量之比为7:8
12.验证铝、铜、银的金属活动性强弱,小明设计了以下四组实验,下列说法不正确的是
A.通过①②实验,可以证明金属活动性Al>Cu
B.通过①②③实验,可以证明金属活动性Al>Cu>Ag
C.若要用实验④证明金属活动性Al>Cu,X可以为Al,Y为CuSO4溶液
D.若要用实验④证明金属活动性Cu>Ag,X可以为Cu,Y为AgNO3溶液
13.从《中国成语大会》到《中国诗词大会》,中国传统文化大放异彩,很多成语、诗词中蕴含着丰富的科学道理。下列叙述错误的是
A.“迟日江山丽,春风花草香”说明分子在不断运动
B.“真金不怕火炼”说明黄金的化学性质非常稳定
C.“釜底抽薪”与“钻木取火”都说明燃烧需要达到可燃物的着火点
D.“熬胆矾铁釜,久之亦化为铜”说明铁的活动性比铜强
14.等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应,下列图象能正确生产氢气质量与反应时间之间关系的是
A. B.
C. D.
15.下列金属中,金属活动性最强的是( )
A.钾 B.铁 C.铜 D.金
16.除去下列物质中的少量杂质,所用试剂和操作方法都正确的是
选项 物质 杂质 所用试剂和操作方法
A H2O NaCl 向水中加入活性炭吸附
B CO2 CO 点燃
C FeCl2溶液 CuCl2 加入足量的铁粉,充分搅拌后过滤
D CuO 木炭 隔绝空气加热至固体质量不再发生变化
A.A B.B C.C D.D
二、综合应用题
17.金属与我们生活关系密切。
(1)铁
①下列物品所使用的主要材料属于合金的是 ____ (填标号,下同)。
A.青花瓷瓶 B.橡胶充气艇 C.不锈钢锅
②生铁和钢是常用的合金,生铁的含碳量比钢的含碳量__________(填“高”或“低”)。 生铁冶炼的主要原理是利用一氧化碳与氧化铁反应,反应的化学方程式为__________________________________。
③生活中常用铁锅做炊具,利用了铁的___________性。
④颗粒大小达到纳米级的单质铁具有很强的反应活性,俗称纳米铁.在高温环境下,用H2和FeCl2反应,可以生成纳米铁和一种易溶于水显强酸性的气体,写出该反应的化学方程式____________________________________。
⑤铁制品锈蚀的过程,实际上是铁与空气中的________和________ 等发生化学反应的过程;回收废钢铁的目的是_______________________ (写一点)。
(2)铜
①黄铜是铜锌合金,将纯铜片和黄铜片互相刻画(如图所示),纯铜片上留下明显的划痕,说明合金的硬度比组成中的纯金属要 _________ (填“大”、“小”)。
②黄铜渣中约含 Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质。通过流程如下图的方法处理黄铜渣可得到硫酸锌(杂质不溶于水、不参与反应)。
资料:ZnO+H2SO4═ZnSO4+H2O; CuO+H2SO4═CuSO4+H2O
Ⅱ中生成金属单质的化学反应方程式为 _____________________________________ 。该流程最终得到的硫酸锌中锌元素质量 _____ (填“<”、“=”、“>”)黄铜中锌元素质量。
(3)铝
①铝块能制成铝箔是利用了铝的_________性。
②铝比铁活泼,但铝比铁耐腐蚀的原因是______________________________________。
③由铝粉与氧化铁组成的铝热剂在高温下反应,生成另一种氧化物和另一种金属单质,常用于焊接铁轨,试写出该反应的化学方程式:___________________。
(4)锌
锌等金属可以用于生产纽扣电池,下面是某常见纽扣电池中发生的反应:H2O+Zn+HgO=Zn(OH)2+Hg
①该反应后锌元素的化合价为___________。
②将该反应中的反应物进行简单分类,则下面横线上的物质是(填化学式):
纯净物:单质:_____________金属氧化物:_____________
③该电池中通常还加入石墨粉,是因为石墨具有良好的__________性。
④废旧电池不能随意丢弃,由于电池种类不同,应______________回收。
18.人类文明进步与金属材料发展关系十分密切。某课外兴趣小组探究金属的性质。
(1)用等质量相同表面积的镁条,等体积不同浓度的稀盐酸(盐酸浓度越大,密度越高),在一定条件下反应,实验结果如图所示:
①对比两曲线,a曲线所用盐酸浓度_______b曲线所用盐酸浓度(填“大于”或“小于”)。
②a、b对应实验产生的氢气质量相等,下列说法正确的是_______。
A 两实验镁条消耗的溶质质量相等
B a对应实验盐酸一定过量
C a对应实验达到的最高温度比b对应实验高
D 较长时间后,a、b曲线重合
(2)将10g含镁48%的镁铝合金(不含其他元素)粉末与稀硫酸反应完全。
①该合金中镁消耗硫酸的质量最多是多少 (写出计算过程)_______
②该合金与稀硫酸反应后生成氢气的质量最多是_______(计算结果保留2位小数)。
19.某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,工业流程如图:
(1)操作a的名称是______。
(2)金属A与废液发生反应的化学方程式为______。
(3)为了除去固体混合物中Fe粉,获得纯净的Cu粉,某同学设计了如图两个实验方案:
方案①中,由于______,可能导致Fe粉除不尽。
(4)为了准确测定Fe、Cu混合物中Cu的质量分数,某小组取样品20g,向其中加入100g足量的稀硫酸,充分反应后剩余混合物的总重量变为119.8g求:
①m=______g。
②样品中Cu的质量分数______(写出计算过程)。
20.为除去铜屑中的少量铁屑,某同学设计了如图两个实验方案:
(1)写出方案②中有关反应的化学方程式_______。
(2)以上两个实验方案中,你选择的是_______,理由是_______。
(3)两个方案中过滤需要的仪器是_______。
(4)现有100g铜屑,依照方案①进行实验,经处理得到干燥的固体100.8g。则铜屑中铜的质量分数为____。
(5)请思考更简单的方法_______。
21.某实验小组为了研究反应物的接触面积对反应速率的影响。实验装置如“题21-1图”所示,他们用等质量不同形状的金属锌(所用金属锌均不含任何杂质)和稀盐酸反应(见下表),实验中使用传感器装置测算生成氢气的体积,绘制氢气体积随时间变化的曲线如图所示。
实验编号 药品
I 6.5g锌块、7.3%的稀盐酸150g
II 6.5g锌粒、7.3%的稀盐酸150g
III 6.5g锌粉、7.3%的稀盐酸150g
(1)如图的曲线___________(填“甲”、“乙”或“丙”)代表的是实验III,从曲线甲、乙、丙得出探究结论是:_______________。
(2)实验前需要配制7.3%的稀盐酸150g,需要质量分数为36.5%的浓盐酸__________g。
(3)请计算以上任意一组实验中生成氢气的质量___________(写出具体计算过程)。
(4)分析上表数据,请在图中画出在6.5g锌中加入0~150g稀盐酸过程中,产生氢气质量对应的变化曲线图,并标注必要的数值。___________
22.分金属于机金属板中含有Fe、 Cu、 Au、 Ni(银银白色金属等金属,如图是某工厂回收部分金属的流程图。已知2Cu+O2+2H2SO42CuSO4+2H2O
(1)操作①的名称是_____。
(2)固体A的化学式为_____;滤液②中所含的金属阳离子为_____。
(3)写出滤液③和铁粉发生反应的一个化学方程式_____;该反应的基本类型为 _____反应。
(4) Cu、Fe、 Ni在溶液中的活动性由强到弱的顺序依次是_____。
(5)另有同学乙将一定质量的锌粒投入含有Cu(NO3)2 和Fe(NO3)3的混合溶液中,充分反应后过滤,若滤液中除了水之外,只含有一种物质,则滤渣中一定含有_____。
(6)铝合金广泛应用于生活中,兴趣小组同学称取20g铝合金粉末于烧杯中,将400g稀硫酸分四次加入(每次加入100g),充分反应,测得实验数据如下表所示:(假设该铝合金中只有铝能与稀硫酸反应,其他成分不与稀硫酸反应)则m=_____, 铝合金样品中铝的质量分数为_____。
实验 第一次 第二次 第三次 第四次
加入稀硫酸的质量(g) 100 100 100 100
烧杯中剩余物的质量(g) 119.2 218.4 318.0 m
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.B
5.B
6.A
7.C
8.A
9.D
10.B
11.B
12.B
13.C
14.B
15.A
16.C
17. C 高 3CO+Fe2O32Fe+3CO2 导热 H2+FeCl2Fe+2HCl 氧气 水 节约金属资源 大 CuSO4+Zn=ZnSO4+Cu > 延展 铝与氧气反应表面形成致密氧化膜 2Al+Fe2O3Al2O3+2Fe +2 Zn HgO 导电 分类
18. 大于 ACD 19.6g 0.98g
19.(1)过滤
(2)
(3)生成的铜覆盖在铁表面,阻止反应进行
(4) 0.2 解:设Fe的质量为x
答:样品中Cu的质量分数为72%。
20. Fe+H2SO4=FeSO4+H2↑ ② 便于观察是否除尽(合理即可) 漏斗、烧杯、玻璃棒、铁架台(带铁圈) 设铁质量为x,
,
x=5.6g,
则铜屑中铜的质量分数为: 用磁铁吸引
21. 甲 在其他条件相同时,固体颗粒越小,反应速率越快; 30 0.2g
22. 过滤 Cu、Fe Fe2+ Fe+CuSO4=FeSO4+Cu 置换 Fe>Ni>Cu Cu、Fe 418.0g 90%
答案第1页,共2页
答案第1页,共2页
同课章节目录
