9.2溶解度一课一练(word版有答案)
文档属性
| 名称 | 9.2溶解度一课一练(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 179.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 11:09:01 | ||
图片预览



文档简介
9.2 溶解度 一课一练
一、单选题
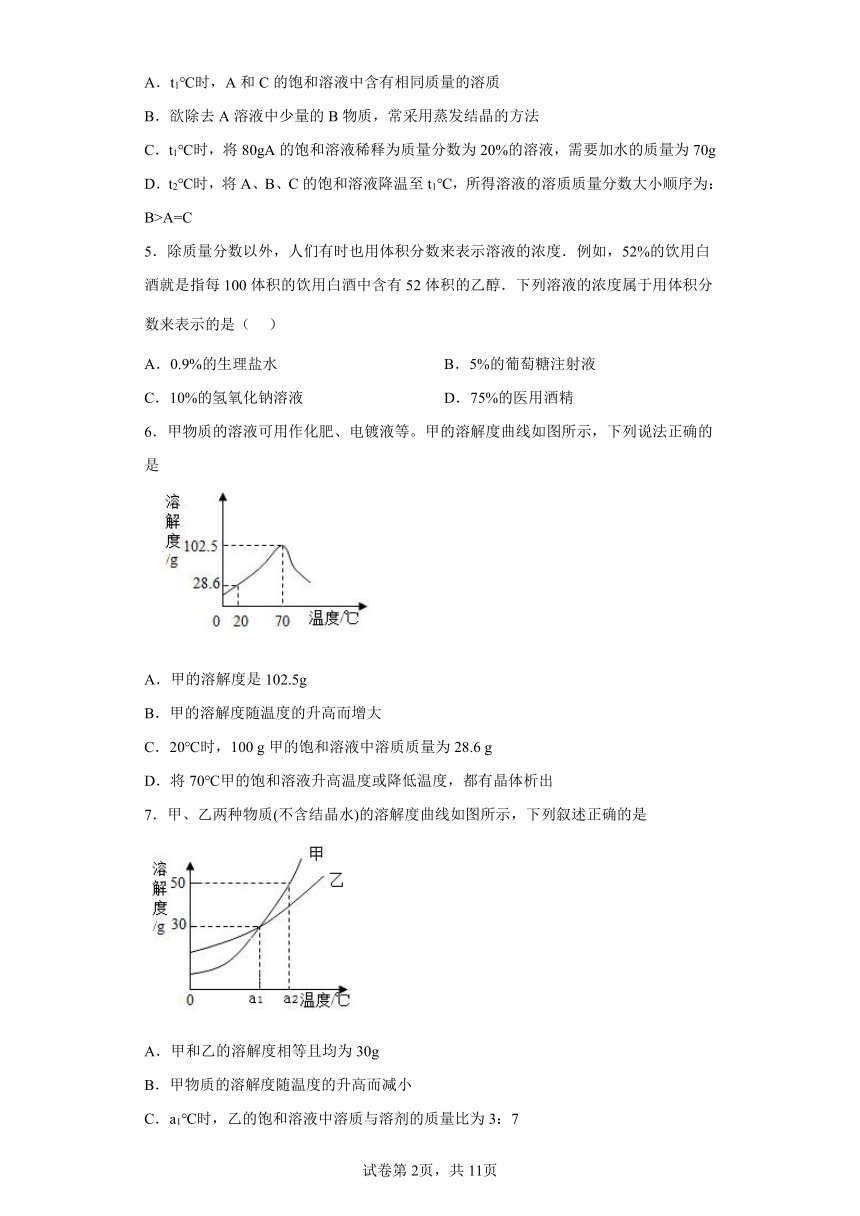
1.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是
A.t1 ℃时,甲的溶解度大于乙的溶解度
B.t2 ℃时,乙的饱和溶液升温或降温均会析出晶体
C.乙溶液从t3 ℃降温到t1 ℃,乙溶液中的溶质质量分数会发生改变
D.t3 ℃时,50 g水中加入40 g的甲物质充分溶解可得到90 g甲的饱和溶液
2.如图为a、b、c三种物质的溶解度曲线,等质量的a、b、c三种物质的饱和溶液温度由50℃降为30℃,析出晶体最多的是
A.a B.b C.c D.a和b
3.下列有关溶液说法正确的是
A.溶液都是均一、稳定的混合物 B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓 D.溶液的体积等于溶质的体积与溶剂的体积之和
4.下图是三种常见固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,A和C的饱和溶液中含有相同质量的溶质
B.欲除去A溶液中少量的B物质,常采用蒸发结晶的方法
C.t1℃时,将80gA的饱和溶液稀释为质量分数为20%的溶液,需要加水的质量为70g
D.t2℃时,将A、B、C的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为:B>A=C
5.除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
6.甲物质的溶液可用作化肥、电镀液等。甲的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100 g甲的饱和溶液中溶质质量为28.6 g
D.将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出
7.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
8.已知某物质在20℃ 和40℃ 时的溶解度分别为10g和40g。某温下,将5g该物质加到20g水中,下列有关叙述正确的是
A.20℃ 时,所得溶液的质量为25g
B.40℃ 时,所得溶液为饱和溶液
C.不管什么温度下,所得溶液的溶质质量分数均为20%
D.该物质的溶解度随温度的升高而增大
9.下列叙述错误的是
A.蔗糖溶解的过程就是在水分子作用下,蔗糖分子均匀分散到水分子中的过程
B.搅拌和升温能加快溶解,是因为加快了分子的运动速率
C.用汽油清洗衣服上的油污,是利用了乳化作用
D.室温下,向接近饱和的硝酸钾溶液中加入适量硝酸钾固体能形成硝酸钾饱和溶液
10.时,50g水中溶解某物质0.1045g即达到饱和,一般把这种物质划分为。
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
11.下列关于溶液的说法正确的是
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
12.下列关于溶液的说法,正确的是
A.水是最常用的溶剂
B.饱和溶液一定比不饱和溶液浓度大
C.澄清、透明的液体一定是溶液
D.饱和溶液一定不能再继续溶解溶质
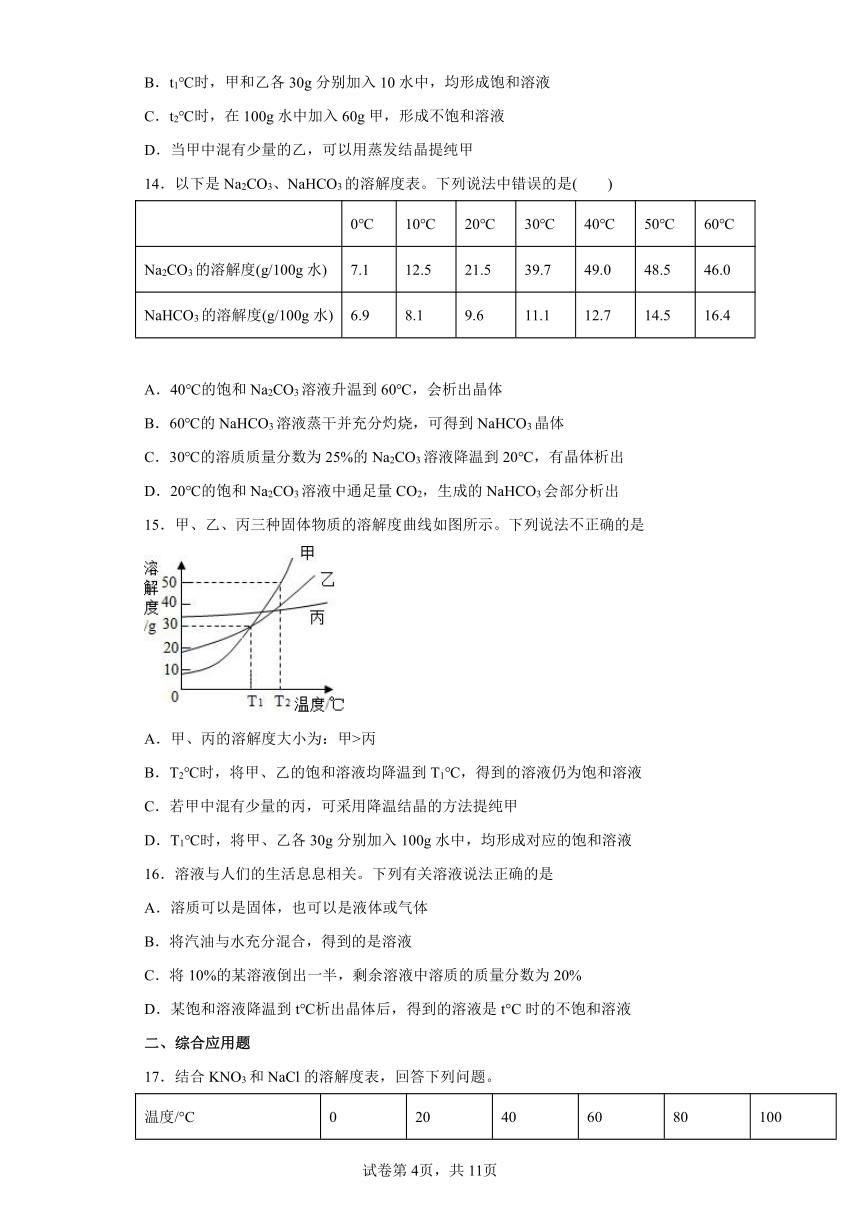
13.如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是( )
A.t1℃时甲、乙饱和溶液,升温到t2℃时仍为饱和溶液
B.t1℃时,甲和乙各30g分别加入10水中,均形成饱和溶液
C.t2℃时,在100g水中加入60g甲,形成不饱和溶液
D.当甲中混有少量的乙,可以用蒸发结晶提纯甲
14.以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃
Na2CO3的溶解度(g/100g水) 7.1 12.5 21.5 39.7 49.0 48.5 46.0
NaHCO3的溶解度(g/100g水) 6.9 8.1 9.6 11.1 12.7 14.5 16.4
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
15.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是
A.甲、丙的溶解度大小为:甲>丙
B.T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍为饱和溶液
C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲
D.T1℃时,将甲、乙各30g分别加入100g水中,均形成对应的饱和溶液
16.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
二、综合应用题
17.结合KNO3和NaCl的溶解度表,回答下列问题。
温度/°C 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)0°C时,KNO3溶解度是_____g
(2)根据NaCl的溶解度表可知,从海水中提取氯化钠,通常采用的结晶方法是____。
(3)在60°C时,将60gKNO3加入到50g水中充分溶解后所得溶液降温到40°C,对溶液的分析正确的是____。
A 降温前后溶液都是饱和溶液
B 溶液中溶质减少
C 溶液中溶质的质量分数不变
18.研究“水”可从多角度展开。
(1)水的电解
①宏观现象:按图1所示装置,通电一段时间后,试管A和B中产生气体的体积比约为_______,检验B中气体的现象是_____;
②微观分析:该反应中发生分解的微粒名称是_____;
③结论:水由氢氧元素组成。
(2)水的性质
将黄豆大小的金属钾放入盛有水的烧杯中,生成H2;在反应后的溶液中滴入酚酞试液,溶液变红。写出该反应的化学方程式_____
(3)水的用途
①碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是__;
②图2实验中,对水的主要作用分析不全面的是_____(填字母)
a. a图中的水便于观察烧瓶内气压变化
b. b图中的水提供热量
c. c图集气瓶中的水排尽空气且便于观察H2何时集满
d. d图中的水防止熔融物炸裂集气瓶
(4)水与溶液
根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题:
温度 0℃ 10℃ 20℃ 30℃ 40℃
氯化钠溶解度/g 35 35.5 36 36.5 37
碳酸钠溶解度/g 6 10 18 36.5 50
①30℃时,NaCl的溶解度是_____g。
②t2℃时,将40g Na2CO3固体加入50g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为___。
③若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是______(填“降温结晶”或“蒸发结晶”)
19.水和溶液在日常生活、科学研究中具有广泛的用途。
(1)生活中为了降低水的硬度并杀菌消毒,常用的方法是______。
(2)甲、乙两种物质(均不含结晶水)的溶解度曲线如图所示,请回答。
①t1℃时,在50g水中加入20g乙固体,充分搅拌后得到______(填“饱和或不饱和”)溶液。
②t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须恒温蒸发掉较多水的是______(填“甲”或“乙”)物质的饱和溶液。
③使甲物质的溶液状态发生如下改变,对应操作正确的是______。
A.a点→c点:加水 B.b点→c点:恒温蒸发
C.a点→b点:升温 D.c点→a点:降温、过滤
(3)生理盐水是医疗上常用的一种溶液,取出其中的任意一部分进行比较,发现它们的组成完全相同,说明溶液具有______性。
(4)实验室常用过氧化氢溶液制取氧气,若要制取6.4g氧气,则同时产生水的质量是多少?(写出计算过程)
20.CO2的捕集与资源化利用是化学研究的热点。
(1)控制 CO2的排放,是为了减缓______效应,加压水洗法可捕集 CO2,是 因为压强增大时 CO2在水中的溶解能力______(填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中的 CO2,该方法以 CaO 捕集 CO2,将所得产 物在高温下煅烧可重新获得 CaO 和 CO2,高温煅烧时反应的符号表达式 为______,生成的 CaO 疏松多孔,结构与活性炭相似,其在 捕集过程中对 CO2具有良好的______性。
(3)对 CO2气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过 程主要改变的是______。干冰能用于人工降雨,是因为______。
(4)CO2可用于食品保鲜,实验测得气体中 CO2的体积分数增加,其溶液的酸性 也随之增加,推测:
①气体中 CO2体积分数增大时,造成酸性增强的主要原因是溶液中______浓度 增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内 CO2气体含量的变化,举出一种可通 过颜色变化用于该智能化包装的物质______。
(5)为研究某公园中植物与大气间的碳交换,对该公园一年内每天的气温及光 合有效辐射进行测量,结果见图1 和图2。通过测量其一年内每天空气中 CO2含量等数据,分析所得碳交换的结果见图3。碳交换以每月每平方米植物吸收或 释放 CO2的质量表示,正值为净吸收 CO2,负值为净释放 CO2。
①由上图可推测,影响公园中植物与大气碳交换的因素有______。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天______的变化。
21.某化学小组从理论上初步探究“已知质量比的硝酸钾和氯化钠的混合物中提纯硝酸钾”.
【分析提纯方法】
表一:常温下(20℃)溶解度和溶解性的关系
溶解度S S≥10g 1g≤S<10g 0.01g≤S<1g S<0.01g
溶解性 易溶 可溶 微溶 难溶
表二:硝酸钾和氯化钠在不同温度时的溶解度
温度/℃ 0 20 40 60 80 100
溶解度/g KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)①常温下,KNO3和NaCl的溶解性均为______。
②根据表中数据,绘制KNO3的溶解度曲线_____.
③根据KNO3的溶解度曲线,获得KNO3在70℃时的溶解度约为 ______g.
(2)【设计提纯步骤】
①选取样品(95gKNO3和5gNaCl的混合物)
②配制80℃时KNO3的饱和溶液(加水约56.2mL,水的密度约为1g mL﹣1)
③降温至20℃
④得到晶体
【设计提纯方案】
为了证明④中得到的晶体为纯净的KNO3,该小组同学结合已有知识,从理论上初步设计了以下方案;(不考虑不同溶质对溶解度的相互影响及实验过程中水铬固体的损失等影响因素)
方案一 通过化学实验进行检验,取少量(4)中得到的晶体于试管中,加水配成溶液,滴加________,观察实验现象.
方案二 计算析出KNO3晶体的质量约为________g(精确到0.1g)与(4)中得到晶体的质量进行比较;
方案三________与95%进行比较;
方案四________.
22.化学通常是从宏观、微观两个方面来研究物质。
(1)下图是几种粒子结构示意图和周期表中的部分信息,则下列说法中正确的是( )
A、a、b粒子的化学性质相似,都是稳定结构
B、氯化钠是由c、d两种粒子构成的离子化合物
C、e的结构示意图中x=8,且该元素位于第四周期
D、氟的相对原子质量是19.00,且氟原子在化学反应中易失电子
(2)下图是某反应的微观示意图。下列说法正确的是( )
A、该反应中共有四种原子 B、A中氮元素的化合价为+3
C、这四种物质中有两种是氧化物 D、该反应中B和C的质量比为12∶7
(3)a.b.c三种物质的溶解度曲线如图所示。下列分析正确的是( )
A、t1℃时,a、c两种物质的饱和溶液中溶质的质量相等
B、t2℃时,把50g a放入50g水中能得到a的饱和溶液,其中溶质和溶液的质量比为1:3
C、将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是:b>c=a
D、将c的饱和溶液变成不饱和溶液,可采用升温的方法
(4)在和的混合溶液中,加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀无气体产生,则滤渣中一定含有的金属是_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.A
3.A
4.C
5.D
6.D
7.D
8.D
9.C
10.C
11.A
12.A
13.B
14.B
15.A
16.A
17. 13.3g 蒸发结晶 AB
18. 2:1 带火星的木条复燃 水分子 2K+2H2O=2KOH+H2↑ 加快反应速度(合理即可) ab 36.5 2:5 降温结晶
19.(1)加热煮沸
(2) 饱和 乙 BCD
(3)均一
(4)解:设同时产生水的质量是x
答:同时产生水的质量是7.2g。
20.(1) 温室 增大
(2)
吸附
(3) 分子间隔 干冰升华吸收热量
(4) H2CO3 石蕊试液
(5) 气温、光照强度 水分含量
21. 易溶 138 硝酸银 77.2 82% 利用20.2g与5g进行比较
22. C D B Ag
答案第1页,共2页
答案第1页,共2页
一、单选题
1.甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示。下列说法正确的是
A.t1 ℃时,甲的溶解度大于乙的溶解度
B.t2 ℃时,乙的饱和溶液升温或降温均会析出晶体
C.乙溶液从t3 ℃降温到t1 ℃,乙溶液中的溶质质量分数会发生改变
D.t3 ℃时,50 g水中加入40 g的甲物质充分溶解可得到90 g甲的饱和溶液
2.如图为a、b、c三种物质的溶解度曲线,等质量的a、b、c三种物质的饱和溶液温度由50℃降为30℃,析出晶体最多的是
A.a B.b C.c D.a和b
3.下列有关溶液说法正确的是
A.溶液都是均一、稳定的混合物 B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓 D.溶液的体积等于溶质的体积与溶剂的体积之和
4.下图是三种常见固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,A和C的饱和溶液中含有相同质量的溶质
B.欲除去A溶液中少量的B物质,常采用蒸发结晶的方法
C.t1℃时,将80gA的饱和溶液稀释为质量分数为20%的溶液,需要加水的质量为70g
D.t2℃时,将A、B、C的饱和溶液降温至t1℃,所得溶液的溶质质量分数大小顺序为:B>A=C
5.除质量分数以外,人们有时也用体积分数来表示溶液的浓度.例如,52%的饮用白酒就是指每100体积的饮用白酒中含有52体积的乙醇.下列溶液的浓度属于用体积分数来表示的是( )
A.0.9%的生理盐水 B.5%的葡萄糖注射液
C.10%的氢氧化钠溶液 D.75%的医用酒精
6.甲物质的溶液可用作化肥、电镀液等。甲的溶解度曲线如图所示,下列说法正确的是
A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100 g甲的饱和溶液中溶质质量为28.6 g
D.将70℃甲的饱和溶液升高温度或降低温度,都有晶体析出
7.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
8.已知某物质在20℃ 和40℃ 时的溶解度分别为10g和40g。某温下,将5g该物质加到20g水中,下列有关叙述正确的是
A.20℃ 时,所得溶液的质量为25g
B.40℃ 时,所得溶液为饱和溶液
C.不管什么温度下,所得溶液的溶质质量分数均为20%
D.该物质的溶解度随温度的升高而增大
9.下列叙述错误的是
A.蔗糖溶解的过程就是在水分子作用下,蔗糖分子均匀分散到水分子中的过程
B.搅拌和升温能加快溶解,是因为加快了分子的运动速率
C.用汽油清洗衣服上的油污,是利用了乳化作用
D.室温下,向接近饱和的硝酸钾溶液中加入适量硝酸钾固体能形成硝酸钾饱和溶液
10.时,50g水中溶解某物质0.1045g即达到饱和,一般把这种物质划分为。
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
11.下列关于溶液的说法正确的是
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
12.下列关于溶液的说法,正确的是
A.水是最常用的溶剂
B.饱和溶液一定比不饱和溶液浓度大
C.澄清、透明的液体一定是溶液
D.饱和溶液一定不能再继续溶解溶质
13.如图是甲、乙两种固体物质在水中的溶解度曲线。下列说法正确的是( )
A.t1℃时甲、乙饱和溶液,升温到t2℃时仍为饱和溶液
B.t1℃时,甲和乙各30g分别加入10水中,均形成饱和溶液
C.t2℃时,在100g水中加入60g甲,形成不饱和溶液
D.当甲中混有少量的乙,可以用蒸发结晶提纯甲
14.以下是Na2CO3、NaHCO3的溶解度表。下列说法中错误的是( )
0℃ 10℃ 20℃ 30℃ 40℃ 50℃ 60℃
Na2CO3的溶解度(g/100g水) 7.1 12.5 21.5 39.7 49.0 48.5 46.0
NaHCO3的溶解度(g/100g水) 6.9 8.1 9.6 11.1 12.7 14.5 16.4
A.40℃的饱和Na2CO3溶液升温到60℃,会析出晶体
B.60℃的NaHCO3溶液蒸干并充分灼烧,可得到NaHCO3晶体
C.30℃的溶质质量分数为25%的Na2CO3溶液降温到20℃,有晶体析出
D.20℃的饱和Na2CO3溶液中通足量CO2,生成的NaHCO3会部分析出
15.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是
A.甲、丙的溶解度大小为:甲>丙
B.T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍为饱和溶液
C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲
D.T1℃时,将甲、乙各30g分别加入100g水中,均形成对应的饱和溶液
16.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
二、综合应用题
17.结合KNO3和NaCl的溶解度表,回答下列问题。
温度/°C 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KNO3 13.3 31.6 63.9 110 169 246
(1)0°C时,KNO3溶解度是_____g
(2)根据NaCl的溶解度表可知,从海水中提取氯化钠,通常采用的结晶方法是____。
(3)在60°C时,将60gKNO3加入到50g水中充分溶解后所得溶液降温到40°C,对溶液的分析正确的是____。
A 降温前后溶液都是饱和溶液
B 溶液中溶质减少
C 溶液中溶质的质量分数不变
18.研究“水”可从多角度展开。
(1)水的电解
①宏观现象:按图1所示装置,通电一段时间后,试管A和B中产生气体的体积比约为_______,检验B中气体的现象是_____;
②微观分析:该反应中发生分解的微粒名称是_____;
③结论:水由氢氧元素组成。
(2)水的性质
将黄豆大小的金属钾放入盛有水的烧杯中,生成H2;在反应后的溶液中滴入酚酞试液,溶液变红。写出该反应的化学方程式_____
(3)水的用途
①碘与锌在常温下反应速度很慢,若滴入几滴水则反应剧烈,水在此的作用是__;
②图2实验中,对水的主要作用分析不全面的是_____(填字母)
a. a图中的水便于观察烧瓶内气压变化
b. b图中的水提供热量
c. c图集气瓶中的水排尽空气且便于观察H2何时集满
d. d图中的水防止熔融物炸裂集气瓶
(4)水与溶液
根据所给氯化钠和碳酸钠的溶解度及溶解度曲线的信息,回答下列问题:
温度 0℃ 10℃ 20℃ 30℃ 40℃
氯化钠溶解度/g 35 35.5 36 36.5 37
碳酸钠溶解度/g 6 10 18 36.5 50
①30℃时,NaCl的溶解度是_____g。
②t2℃时,将40g Na2CO3固体加入50g水中,充分溶解后所得Na2CO3溶液中溶质与溶剂的质量比为___。
③若Na2CO3中混有少量的NaCl,提纯Na2CO3应采取的方法是______(填“降温结晶”或“蒸发结晶”)
19.水和溶液在日常生活、科学研究中具有广泛的用途。
(1)生活中为了降低水的硬度并杀菌消毒,常用的方法是______。
(2)甲、乙两种物质(均不含结晶水)的溶解度曲线如图所示,请回答。
①t1℃时,在50g水中加入20g乙固体,充分搅拌后得到______(填“饱和或不饱和”)溶液。
②t2℃时,若从甲和乙两种物质的饱和溶液中析出等质量的固体,须恒温蒸发掉较多水的是______(填“甲”或“乙”)物质的饱和溶液。
③使甲物质的溶液状态发生如下改变,对应操作正确的是______。
A.a点→c点:加水 B.b点→c点:恒温蒸发
C.a点→b点:升温 D.c点→a点:降温、过滤
(3)生理盐水是医疗上常用的一种溶液,取出其中的任意一部分进行比较,发现它们的组成完全相同,说明溶液具有______性。
(4)实验室常用过氧化氢溶液制取氧气,若要制取6.4g氧气,则同时产生水的质量是多少?(写出计算过程)
20.CO2的捕集与资源化利用是化学研究的热点。
(1)控制 CO2的排放,是为了减缓______效应,加压水洗法可捕集 CO2,是 因为压强增大时 CO2在水中的溶解能力______(填“增大”“不变”或“减小”)。
(2)石灰石循环法可用于捕集烟气中的 CO2,该方法以 CaO 捕集 CO2,将所得产 物在高温下煅烧可重新获得 CaO 和 CO2,高温煅烧时反应的符号表达式 为______,生成的 CaO 疏松多孔,结构与活性炭相似,其在 捕集过程中对 CO2具有良好的______性。
(3)对 CO2气体加压,降温,可获得干冰,从构成物质的微粒视角分析,该过 程主要改变的是______。干冰能用于人工降雨,是因为______。
(4)CO2可用于食品保鲜,实验测得气体中 CO2的体积分数增加,其溶液的酸性 也随之增加,推测:
①气体中 CO2体积分数增大时,造成酸性增强的主要原因是溶液中______浓度 增大(填化学式)。
②智能化食品包装通过颜色变化显示包装内 CO2气体含量的变化,举出一种可通 过颜色变化用于该智能化包装的物质______。
(5)为研究某公园中植物与大气间的碳交换,对该公园一年内每天的气温及光 合有效辐射进行测量,结果见图1 和图2。通过测量其一年内每天空气中 CO2含量等数据,分析所得碳交换的结果见图3。碳交换以每月每平方米植物吸收或 释放 CO2的质量表示,正值为净吸收 CO2,负值为净释放 CO2。
①由上图可推测,影响公园中植物与大气碳交换的因素有______。
②为进一步研究环境因素对公园中植物与大气碳交换的影响,从光合作用的角度出发,还需测量的重要因素是其一年内每天______的变化。
21.某化学小组从理论上初步探究“已知质量比的硝酸钾和氯化钠的混合物中提纯硝酸钾”.
【分析提纯方法】
表一:常温下(20℃)溶解度和溶解性的关系
溶解度S S≥10g 1g≤S<10g 0.01g≤S<1g S<0.01g
溶解性 易溶 可溶 微溶 难溶
表二:硝酸钾和氯化钠在不同温度时的溶解度
温度/℃ 0 20 40 60 80 100
溶解度/g KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)①常温下,KNO3和NaCl的溶解性均为______。
②根据表中数据,绘制KNO3的溶解度曲线_____.
③根据KNO3的溶解度曲线,获得KNO3在70℃时的溶解度约为 ______g.
(2)【设计提纯步骤】
①选取样品(95gKNO3和5gNaCl的混合物)
②配制80℃时KNO3的饱和溶液(加水约56.2mL,水的密度约为1g mL﹣1)
③降温至20℃
④得到晶体
【设计提纯方案】
为了证明④中得到的晶体为纯净的KNO3,该小组同学结合已有知识,从理论上初步设计了以下方案;(不考虑不同溶质对溶解度的相互影响及实验过程中水铬固体的损失等影响因素)
方案一 通过化学实验进行检验,取少量(4)中得到的晶体于试管中,加水配成溶液,滴加________,观察实验现象.
方案二 计算析出KNO3晶体的质量约为________g(精确到0.1g)与(4)中得到晶体的质量进行比较;
方案三________与95%进行比较;
方案四________.
22.化学通常是从宏观、微观两个方面来研究物质。
(1)下图是几种粒子结构示意图和周期表中的部分信息,则下列说法中正确的是( )
A、a、b粒子的化学性质相似,都是稳定结构
B、氯化钠是由c、d两种粒子构成的离子化合物
C、e的结构示意图中x=8,且该元素位于第四周期
D、氟的相对原子质量是19.00,且氟原子在化学反应中易失电子
(2)下图是某反应的微观示意图。下列说法正确的是( )
A、该反应中共有四种原子 B、A中氮元素的化合价为+3
C、这四种物质中有两种是氧化物 D、该反应中B和C的质量比为12∶7
(3)a.b.c三种物质的溶解度曲线如图所示。下列分析正确的是( )
A、t1℃时,a、c两种物质的饱和溶液中溶质的质量相等
B、t2℃时,把50g a放入50g水中能得到a的饱和溶液,其中溶质和溶液的质量比为1:3
C、将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是:b>c=a
D、将c的饱和溶液变成不饱和溶液,可采用升温的方法
(4)在和的混合溶液中,加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀无气体产生,则滤渣中一定含有的金属是_______。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.A
3.A
4.C
5.D
6.D
7.D
8.D
9.C
10.C
11.A
12.A
13.B
14.B
15.A
16.A
17. 13.3g 蒸发结晶 AB
18. 2:1 带火星的木条复燃 水分子 2K+2H2O=2KOH+H2↑ 加快反应速度(合理即可) ab 36.5 2:5 降温结晶
19.(1)加热煮沸
(2) 饱和 乙 BCD
(3)均一
(4)解:设同时产生水的质量是x
答:同时产生水的质量是7.2g。
20.(1) 温室 增大
(2)
吸附
(3) 分子间隔 干冰升华吸收热量
(4) H2CO3 石蕊试液
(5) 气温、光照强度 水分含量
21. 易溶 138 硝酸银 77.2 82% 利用20.2g与5g进行比较
22. C D B Ag
答案第1页,共2页
答案第1页,共2页
同课章节目录
