9.3金属材料一课一练(word 含答案)
文档属性
| 名称 | 9.3金属材料一课一练(word 含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 181.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 00:00:00 | ||
图片预览




文档简介
9.3 金属材料 一课一练
一、单选题
1.实验室用密度为、质量分数为的浓硫酸和蒸馏水,配制 质量分数为的稀硫酸.需要用多少的量筒量取多少的浓硫酸?
A. B.
C. D.
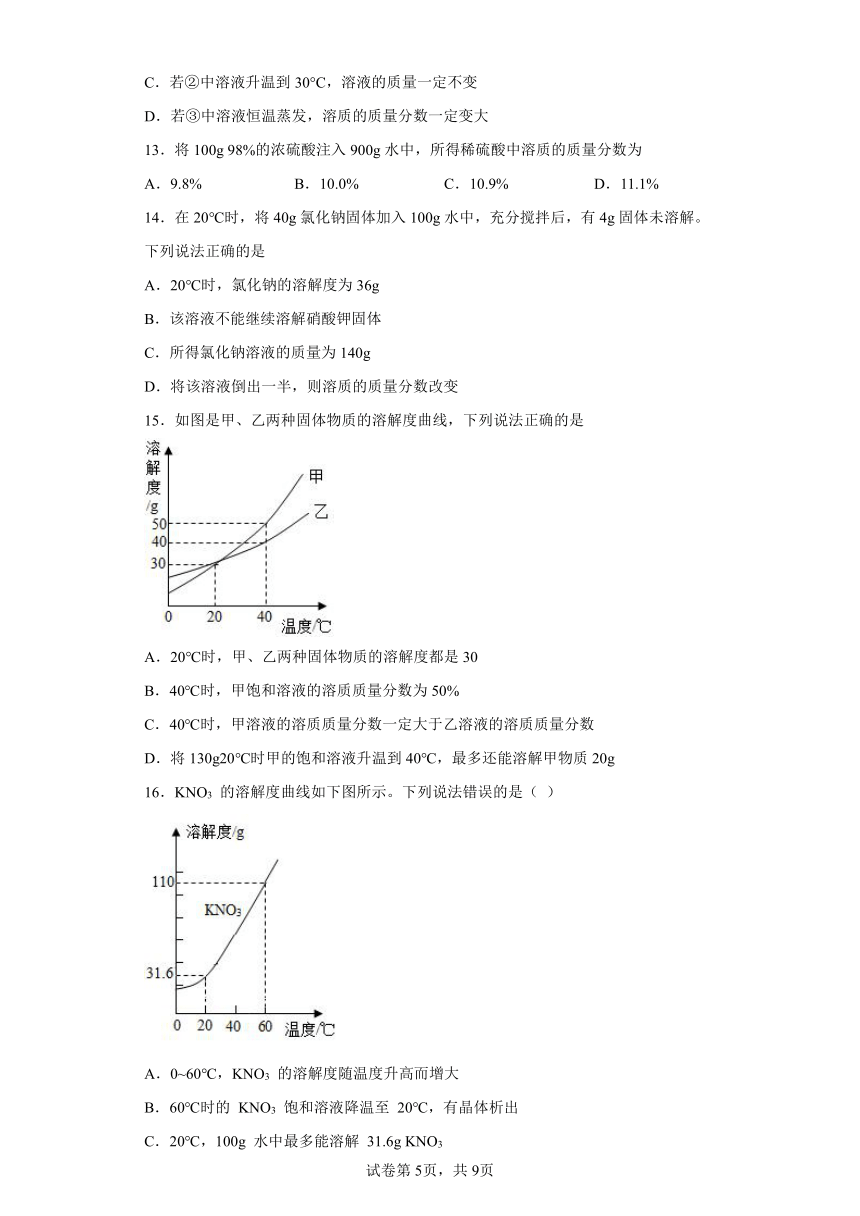
2.常温下,对100mL氯化钠的饱和溶液进行图示实验。下列分析错误的是
A.实验2后,甲中溶液为氯化钠的不饱和溶液
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲、乙中溶液的溶质质量分数不相等
D.实验1后的甲和实验2后的乙中溶液所含溶质质量相等
3.下列所示的图像与选项所描述的变化关系一致的是
A. 电解水实验中,产生的氢气和氧气的质量关系
B. 向一定量的过氧化氢溶液中加入二氧化锰
C. 在一定温度下,向饱和的KNO3溶液中加入KNO3固体
D. 分别向等质量的块状和粉末状大理石中加入过量的完全相同的稀盐酸
4.“一定溶质质量分数的氯化钠溶液的配制”实验中,下列有关操作正确的是
A.取用 B.滴加
C.读数 D.溶解
5.甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.两种物质的溶解度都随温度升高而增大
C.t1℃时,甲、乙两种物质的溶液中,溶质质量分数相等
D.t2℃时,甲饱和溶液溶质质量分数为50%
6.一定温度下,向图Ⅰ烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,判断一定正确的是
A.所得溶液是饱和溶液
B.溶质的质量分数变大
C.溶质的质量增加
D.氯化钾的溶解度变大
7.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
8.如图是A、B、C三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.A的溶解度大于B的溶解度
B.将50℃时A、B、C的饱和溶液降温至30℃,所得溶液的溶质质量分数:C>A=B
C.降温可以使接近饱和的C溶液变为饱和溶液
D.M点表示30℃时A、B两种物质的溶解度相同
9.下列关于溶液说法正确的是( )
A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液
B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制50gl6%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
10.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是
A.三种物质的溶解度大小关系为甲>乙>丙
B.t2℃时,将20g甲加入50g水中,得到70g溶液
C.t3℃时,用等质量的甲、乙、丙固体配成饱和溶液,需要水的质量大小关系是乙>甲>丙
D.将t2℃的三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数大小关系为乙>丙>甲
11.20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是
A.所得溶液可能都是饱和溶液
B.20℃时,乙溶液的溶质质量最小
C.溶液溶质的质量分数:甲>丙>乙
D.升高温度,溶液溶质的质量分数一定变大
12.现有编号为①、②、③的三个烧杯中均分别盛有100克水,20°C时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示,下列判断正确的是( )
A.①中所得溶液一定是不饱和溶液
B.②③中所得溶液溶质的质量分数相等
C.若②中溶液升温到30°C,溶液的质量一定不变
D.若③中溶液恒温蒸发,溶质的质量分数一定变大
13.将100g 98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为
A.9.8% B.10.0% C.10.9% D.11.1%
14.在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶质的质量分数改变
15.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.20℃时,甲、乙两种固体物质的溶解度都是30
B.40℃时,甲饱和溶液的溶质质量分数为50%
C.40℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数
D.将130g20℃时甲的饱和溶液升温到40℃,最多还能溶解甲物质20g
16.KNO3 的溶解度曲线如下图所示。下列说法错误的是( )
A.0~60℃,KNO3 的溶解度随温度升高而增大
B.60℃时的 KNO3 饱和溶液降温至 20℃,有晶体析出
C.20℃,100g 水中最多能溶解 31.6g KNO3
D.60℃时,可配制溶质质量分数为 60%的 KNO3 溶液
二、综合应用题
17.某NaCl固体中含有CaCl2杂质,分别取样进行实验。
(1)【测定杂质含量】取10.0 g样品溶于水,加入足量Na2CO3溶液与CaCl2完全反应,经相关操作后称量生成CaCO3沉淀1 g,计算样品中CaCl2的质量______。(根据化学方程式进行计算,写出计算过程)
(2)【提纯NaCl】取30.0 g 样品,依据两种物质的溶解度差异设计实验提纯NaCl,NaCl、CaCl2的部分溶解度数据见表。
温度(℃) 20 40 60 80 100
溶解度(g/100g水) NaCl 36.0 36.6 37.1 38.0 39.2
CaCl2 27.6 39.8 41.4 43.2 45.2
①由上表可知:80℃时,溶解度相对较大的物质是______。结合上表分析实验中,趁热过滤的原因是______。
②实验中,溶液A是NaCl 的______(选填“饱和”或“不饱和”)溶液;溶液B中溶质的阳离子是______。溶液B中CaCl2的质量分数______(选填“大于”“小于”或“等于”)溶液A中CaCl2 的质量分数。
18.如表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃),回答下列问题:
溶液中溶质的质量分数/% 4 12 16 24 28
硫酸溶液的密度/g·mL-1 1.02 1.08 1.11 1.17 1.20
氨水的密度/g·mL-1 0.98 0.95 0.94 0.91 0.90
(1)20℃时,随着溶液中溶质质量分数逐渐增大,氨水的密度逐渐_____(填“增大”、“减小”或“不变”)。
(2)取12%的硫酸溶液100mL,可配制成6%的硫酸溶液_____g。
(3)向100g24%的氨水中加入100g水,摇匀,所得溶液体积是_____mL(结果精确到0.1)。
(4)配制溶质质量分数4%的硫酸溶液50mL,需要溶质质量分数24%的硫酸溶液多少毫升?(写出计算过程,结果精确到0.1)
19.消毒剂在进行卫生防疫时发挥着重要的作用。
(1)国家卫健委向民众发布的防疫指南中明确指出75%的医用酒精可以杀灭新型冠状病毒。75%指的是酒精的体积分数,小华想把家里一瓶500mL95%的医用酒精配制成75%的医用酒精。
①计算:请你帮他算一下需要往其中加_____mL的水,(精确至0.1mL,忽略体积变化)
②量取:用量筒量取水时俯视读数,其余操作均正确,这样配得的酒精体积分数会_______(填“偏大”“偏小”或“无影响”)。
③混匀:用玻璃棒搅拌,使酒精溶液和水混合均匀。
(2)医疗上常用3%的过氧化氢溶液进行伤口消毒,消毒时常看到有气泡产生,产生这一现象的原因是________(用化学方程式表示)。
20.镁是重要的国防金属,充分利用海边的贝壳(主要成分是CaCO3)和卤水制取金属镁的流程图如下:
(1)步骤②的化学方程式为______,试剂X的名称是______。
(2)步骤⑤电解熔融状态的C得到金属镁的过程,是将______能转化为______能。
(3)某校学生在实验室中模拟步骤③的反应,将氯化镁和氯化钠的固体混合物样品20g,完全溶于113.7g水中,再将100g氢氧化钠溶液平均分四次加入其中,充分振荡,生成白色沉淀的质量与所加氢氧化钠溶液的质量关系如图所示。发生反应的化学方程式为:
请根据有关数据完成下列计算:
①M点对应的纵坐标应为______。
②恰好完全反应时,所得溶液的溶质质量分数?______(写出计算过程)。
21.金属和金属材料与生产生活和社会发展的关系非常密切。
(1)铁在潮湿的空气中易生锈的原因是___________。
(2)向硝酸银溶液中加入一定量的锌和铜的混合粉末,充分反应后过滤,滤液呈蓝色,则出的固体中一定含有___________;滤液中一定含有的金属离子是___________(写离子符号)。
(3)在实验室里,可以利用如右图装置制得铁。写出A装置玻璃管内反应的化学方程式___________。加热四氧化三铁之前,先通一会儿一氧化碳的目的是什么?___________从环保角度考虑,请写出一种尾气处理方法___________。
(4)实验室可用活泼金属与酸反应制取氢气,若用如图装置采用排水法收集H2,请将方框内的导管补画完整___________。
(5)某同学称取黄铜(铜锌合金)样品20g放入锥形瓶中,向其中加入100g稀硫酸恰好完全反应,测得反应后剩余物的质量为119.8g,请计算所用稀硫酸中溶质的质量分数__________。
22.实验室现有下列仪器及部分药品(药品自选),请回答下列问题:
(1)仪器⑧的名称为_______________。
(2)利用上述仪器可以制取二氧化碳,你选择的仪器是________(填序号),反应的化学方程式为_____。
(3)常温下进行如下图所示实验。A 中固体逐渐减 少,发生__________(选填“物理”或“化学”)变 化。C 中有气泡,溶液颜色____。
(4)有同学称取了一定质量的铜锌合金样品,加入 到盛有 146.0g 稀盐酸的烧杯中,发现两者恰好完全反应(杂质不参加反应),且反应后烧杯内物质总质 量减少了 0.3g,请问该稀盐酸中溶质的质量分数为多少?__________(写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.A
4.D
5.B
6.C
7.C
8.D
9.D
10.D
11.A
12.B
13.A
14.A
15.D
16.D
17. 取10.0 g样品溶于水,加入足量Na2CO3溶液与CaCl2完全反应,经相关操作后称量生成CaCO3沉淀1g,设样品中CaCl2的质量为x,则
解得x=1.11g; CaCl2 在较高的温度下氯化钙溶解度较大,趁热过滤保证氯化钙不析出,大部分氯化钠析出 不饱和 钙离子和钠离子 大于
18.(1)减小
(2)216
(3)210.5
(4)设需要溶质质量分数24%的硫酸溶液的质量为。
需要溶质质量分数24%的硫酸溶液的体积为:
答:需要溶质质量分数24%的硫酸溶液7.3mL。
19.(1) 133.3 偏大
(2)
20. 稀盐酸 电 化学 2.9g 解:设恰好完全反应时,生成氯化钠的质量为x,氯化镁的质量为y
x=17.55g
y=14.25g
恰好完全反应时,所得溶液的溶质质量分数为:
答:恰好完全反应时,所得溶液的溶质质量分数为11.65%。
21. 铁更容易与氧气、水分充分接触 银或Ag Zn2+和Cu2+ 排尽装置中的空气,防止发生爆炸 点燃或收集等 生成氢气的质量为
设生成0.2g氢气需要硫酸的质量为x
x=9.8g
则所用稀硫酸中溶质的质量分数为:
22. 长颈漏斗 ①②⑦⑧ CaCO3+2HCl=CaCl2+H2O+CO2↑ 物理 变红 7.5%
答案第1页,共2页
答案第1页,共2页
一、单选题
1.实验室用密度为、质量分数为的浓硫酸和蒸馏水,配制 质量分数为的稀硫酸.需要用多少的量筒量取多少的浓硫酸?
A. B.
C. D.
2.常温下,对100mL氯化钠的饱和溶液进行图示实验。下列分析错误的是
A.实验2后,甲中溶液为氯化钠的不饱和溶液
B.实验2后,乙中比甲中氯化钠的溶解度大
C.实验2后,甲、乙中溶液的溶质质量分数不相等
D.实验1后的甲和实验2后的乙中溶液所含溶质质量相等
3.下列所示的图像与选项所描述的变化关系一致的是
A. 电解水实验中,产生的氢气和氧气的质量关系
B. 向一定量的过氧化氢溶液中加入二氧化锰
C. 在一定温度下,向饱和的KNO3溶液中加入KNO3固体
D. 分别向等质量的块状和粉末状大理石中加入过量的完全相同的稀盐酸
4.“一定溶质质量分数的氯化钠溶液的配制”实验中,下列有关操作正确的是
A.取用 B.滴加
C.读数 D.溶解
5.甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( )
A.甲的溶解度大于乙的溶解度
B.两种物质的溶解度都随温度升高而增大
C.t1℃时,甲、乙两种物质的溶液中,溶质质量分数相等
D.t2℃时,甲饱和溶液溶质质量分数为50%
6.一定温度下,向图Ⅰ烧杯中加入一定量的水,如图Ⅱ所示,所得溶液与原溶液相比,判断一定正确的是
A.所得溶液是饱和溶液
B.溶质的质量分数变大
C.溶质的质量增加
D.氯化钾的溶解度变大
7.将20g质量分数为98%的浓硫酸稀释为25%的稀硫酸。下列说法中不正确的是
A.实验步骤:计算、量取、混匀、装瓶贴标签
B.实验仪器:量筒、胶头滴管、烧杯、玻璃棒、细口瓶
C.稀释浓硫酸时将水沿烧杯内壁慢慢注入浓硫酸中,并不断搅拌
D.浓硫酸不慎沾到皮肤上,应立即用大量水冲洗,再涂上3%~5%的碳酸氢钠溶液
8.如图是A、B、C三种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.A的溶解度大于B的溶解度
B.将50℃时A、B、C的饱和溶液降温至30℃,所得溶液的溶质质量分数:C>A=B
C.降温可以使接近饱和的C溶液变为饱和溶液
D.M点表示30℃时A、B两种物质的溶解度相同
9.下列关于溶液说法正确的是( )
A.将氯化钠和植物油放入水中,充分搅拌后都能形成溶液
B.把20%的蔗糖溶液均分成两份,每份溶液的溶质质量分数为10%
C.向20℃时的蔗糖饱和溶液中加入食盐,食盐不再溶解
D.配制50gl6%的氯化钠溶液一般经过计算、称量(或量取)、溶解、装瓶存放等步骤
10.如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线。下列说法正确的是
A.三种物质的溶解度大小关系为甲>乙>丙
B.t2℃时,将20g甲加入50g水中,得到70g溶液
C.t3℃时,用等质量的甲、乙、丙固体配成饱和溶液,需要水的质量大小关系是乙>甲>丙
D.将t2℃的三种物质的饱和溶液分别降温到t1℃,所得溶液的溶质质量分数大小关系为乙>丙>甲
11.20℃时,在各盛有100克水的烧杯中,分别加入10克甲、乙、丙三种纯净物(不含结晶水,不与水反应),充分溶解后,结果如图。下列说法正确的是
A.所得溶液可能都是饱和溶液
B.20℃时,乙溶液的溶质质量最小
C.溶液溶质的质量分数:甲>丙>乙
D.升高温度,溶液溶质的质量分数一定变大
12.现有编号为①、②、③的三个烧杯中均分别盛有100克水,20°C时向三个烧杯中分别加入36克、56克、76克的同种物质,充分溶解,实验结果如图所示,下列判断正确的是( )
A.①中所得溶液一定是不饱和溶液
B.②③中所得溶液溶质的质量分数相等
C.若②中溶液升温到30°C,溶液的质量一定不变
D.若③中溶液恒温蒸发,溶质的质量分数一定变大
13.将100g 98%的浓硫酸注入900g水中,所得稀硫酸中溶质的质量分数为
A.9.8% B.10.0% C.10.9% D.11.1%
14.在20℃时,将40g氯化钠固体加入100g水中,充分搅拌后,有4g固体未溶解。下列说法正确的是
A.20℃时,氯化钠的溶解度为36g
B.该溶液不能继续溶解硝酸钾固体
C.所得氯化钠溶液的质量为140g
D.将该溶液倒出一半,则溶质的质量分数改变
15.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.20℃时,甲、乙两种固体物质的溶解度都是30
B.40℃时,甲饱和溶液的溶质质量分数为50%
C.40℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数
D.将130g20℃时甲的饱和溶液升温到40℃,最多还能溶解甲物质20g
16.KNO3 的溶解度曲线如下图所示。下列说法错误的是( )
A.0~60℃,KNO3 的溶解度随温度升高而增大
B.60℃时的 KNO3 饱和溶液降温至 20℃,有晶体析出
C.20℃,100g 水中最多能溶解 31.6g KNO3
D.60℃时,可配制溶质质量分数为 60%的 KNO3 溶液
二、综合应用题
17.某NaCl固体中含有CaCl2杂质,分别取样进行实验。
(1)【测定杂质含量】取10.0 g样品溶于水,加入足量Na2CO3溶液与CaCl2完全反应,经相关操作后称量生成CaCO3沉淀1 g,计算样品中CaCl2的质量______。(根据化学方程式进行计算,写出计算过程)
(2)【提纯NaCl】取30.0 g 样品,依据两种物质的溶解度差异设计实验提纯NaCl,NaCl、CaCl2的部分溶解度数据见表。
温度(℃) 20 40 60 80 100
溶解度(g/100g水) NaCl 36.0 36.6 37.1 38.0 39.2
CaCl2 27.6 39.8 41.4 43.2 45.2
①由上表可知:80℃时,溶解度相对较大的物质是______。结合上表分析实验中,趁热过滤的原因是______。
②实验中,溶液A是NaCl 的______(选填“饱和”或“不饱和”)溶液;溶液B中溶质的阳离子是______。溶液B中CaCl2的质量分数______(选填“大于”“小于”或“等于”)溶液A中CaCl2 的质量分数。
18.如表是硫酸溶液和氨水的密度与其溶质的质量分数对照表(20℃),回答下列问题:
溶液中溶质的质量分数/% 4 12 16 24 28
硫酸溶液的密度/g·mL-1 1.02 1.08 1.11 1.17 1.20
氨水的密度/g·mL-1 0.98 0.95 0.94 0.91 0.90
(1)20℃时,随着溶液中溶质质量分数逐渐增大,氨水的密度逐渐_____(填“增大”、“减小”或“不变”)。
(2)取12%的硫酸溶液100mL,可配制成6%的硫酸溶液_____g。
(3)向100g24%的氨水中加入100g水,摇匀,所得溶液体积是_____mL(结果精确到0.1)。
(4)配制溶质质量分数4%的硫酸溶液50mL,需要溶质质量分数24%的硫酸溶液多少毫升?(写出计算过程,结果精确到0.1)
19.消毒剂在进行卫生防疫时发挥着重要的作用。
(1)国家卫健委向民众发布的防疫指南中明确指出75%的医用酒精可以杀灭新型冠状病毒。75%指的是酒精的体积分数,小华想把家里一瓶500mL95%的医用酒精配制成75%的医用酒精。
①计算:请你帮他算一下需要往其中加_____mL的水,(精确至0.1mL,忽略体积变化)
②量取:用量筒量取水时俯视读数,其余操作均正确,这样配得的酒精体积分数会_______(填“偏大”“偏小”或“无影响”)。
③混匀:用玻璃棒搅拌,使酒精溶液和水混合均匀。
(2)医疗上常用3%的过氧化氢溶液进行伤口消毒,消毒时常看到有气泡产生,产生这一现象的原因是________(用化学方程式表示)。
20.镁是重要的国防金属,充分利用海边的贝壳(主要成分是CaCO3)和卤水制取金属镁的流程图如下:
(1)步骤②的化学方程式为______,试剂X的名称是______。
(2)步骤⑤电解熔融状态的C得到金属镁的过程,是将______能转化为______能。
(3)某校学生在实验室中模拟步骤③的反应,将氯化镁和氯化钠的固体混合物样品20g,完全溶于113.7g水中,再将100g氢氧化钠溶液平均分四次加入其中,充分振荡,生成白色沉淀的质量与所加氢氧化钠溶液的质量关系如图所示。发生反应的化学方程式为:
请根据有关数据完成下列计算:
①M点对应的纵坐标应为______。
②恰好完全反应时,所得溶液的溶质质量分数?______(写出计算过程)。
21.金属和金属材料与生产生活和社会发展的关系非常密切。
(1)铁在潮湿的空气中易生锈的原因是___________。
(2)向硝酸银溶液中加入一定量的锌和铜的混合粉末,充分反应后过滤,滤液呈蓝色,则出的固体中一定含有___________;滤液中一定含有的金属离子是___________(写离子符号)。
(3)在实验室里,可以利用如右图装置制得铁。写出A装置玻璃管内反应的化学方程式___________。加热四氧化三铁之前,先通一会儿一氧化碳的目的是什么?___________从环保角度考虑,请写出一种尾气处理方法___________。
(4)实验室可用活泼金属与酸反应制取氢气,若用如图装置采用排水法收集H2,请将方框内的导管补画完整___________。
(5)某同学称取黄铜(铜锌合金)样品20g放入锥形瓶中,向其中加入100g稀硫酸恰好完全反应,测得反应后剩余物的质量为119.8g,请计算所用稀硫酸中溶质的质量分数__________。
22.实验室现有下列仪器及部分药品(药品自选),请回答下列问题:
(1)仪器⑧的名称为_______________。
(2)利用上述仪器可以制取二氧化碳,你选择的仪器是________(填序号),反应的化学方程式为_____。
(3)常温下进行如下图所示实验。A 中固体逐渐减 少,发生__________(选填“物理”或“化学”)变 化。C 中有气泡,溶液颜色____。
(4)有同学称取了一定质量的铜锌合金样品,加入 到盛有 146.0g 稀盐酸的烧杯中,发现两者恰好完全反应(杂质不参加反应),且反应后烧杯内物质总质 量减少了 0.3g,请问该稀盐酸中溶质的质量分数为多少?__________(写出计算过程)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
2.B
3.A
4.D
5.B
6.C
7.C
8.D
9.D
10.D
11.A
12.B
13.A
14.A
15.D
16.D
17. 取10.0 g样品溶于水,加入足量Na2CO3溶液与CaCl2完全反应,经相关操作后称量生成CaCO3沉淀1g,设样品中CaCl2的质量为x,则
解得x=1.11g; CaCl2 在较高的温度下氯化钙溶解度较大,趁热过滤保证氯化钙不析出,大部分氯化钠析出 不饱和 钙离子和钠离子 大于
18.(1)减小
(2)216
(3)210.5
(4)设需要溶质质量分数24%的硫酸溶液的质量为。
需要溶质质量分数24%的硫酸溶液的体积为:
答:需要溶质质量分数24%的硫酸溶液7.3mL。
19.(1) 133.3 偏大
(2)
20. 稀盐酸 电 化学 2.9g 解:设恰好完全反应时,生成氯化钠的质量为x,氯化镁的质量为y
x=17.55g
y=14.25g
恰好完全反应时,所得溶液的溶质质量分数为:
答:恰好完全反应时,所得溶液的溶质质量分数为11.65%。
21. 铁更容易与氧气、水分充分接触 银或Ag Zn2+和Cu2+ 排尽装置中的空气,防止发生爆炸 点燃或收集等 生成氢气的质量为
设生成0.2g氢气需要硫酸的质量为x
x=9.8g
则所用稀硫酸中溶质的质量分数为:
22. 长颈漏斗 ①②⑦⑧ CaCO3+2HCl=CaCl2+H2O+CO2↑ 物理 变红 7.5%
答案第1页,共2页
答案第1页,共2页
同课章节目录
