10.1常见的酸和碱一课一练(word版有答案)
文档属性
| 名称 | 10.1常见的酸和碱一课一练(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 124.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 00:00:00 | ||
图片预览




文档简介
10.1 常见的酸和碱 一课一练
一、单选题
1.生活中很多变化都伴随着热量变化,下列热量变化不是由化学变化引起的是
A.苹果腐烂发热 B.生石灰与水混合放热
C.灯管通电发热 D.暖宝宝贴(内含铁粉 活性炭 NaCl固体等)发热
2.氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者的溶液中均含有一种相同的粒子是
A.H+ B.OH- C.H2O D.H
3. 下列物质敞口放置在空气中一段时间后,质量会减少的是
A.浓硫酸 B.氯化钠 C.浓盐酸 D.烧碱
4.下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
5.中国丝绸有几千年的历史传承。古代染坊常用某种“碱剂”来处理丝绸,该“碱剂”可使丝绸颜色洁白、质感柔软,其主要成分是一种盐,这种“碱剂”可能是
A.食醋 B.烧碱 C.草木灰 D.生石灰
6.忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是
选项 问题 分析与设计
A 为何变质 2NaOH + CO2 = Na2CO3 + H2O
B 是否变质 取样,加入足量稀盐酸,观察是否产生气泡
C 是否全部变质 取样,加入足量氯化钙溶液,观察产生沉淀多少
D 如何除去杂质 取样,加入适量氢氧化钙溶液,过滤
A.A B.B C.C D.D
7.根据如图实验判断下列说法错误的是
A.浓盐酸有挥发性 B.分子在不断运动
C.B烧杯溶液的颜色会改变 D.B烧杯内发生了置换反应
8.用如图所示装置探究CO2能否与H2O反应。滴加盐酸,待试管乙中液体变红后,将其加热至沸腾,红色不褪去。下列说法正确的是
A.甲中逸出的气体只含CO2
B.乙中液体变红,证明CO2能与水反应
C.加热后红色不褪去,说明碳酸受热不分解
D.欲达到实验目的,可将盐酸改为稀硫酸
9.若利用碱的性质进行下列实验,不能达到相应目的的是
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
10.下列关于硫酸的认识,正确的是
A.组成:硫酸溶液中H+和SO的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用CaCl2处理后直接排放
11.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaOH溶液 B.NaCl溶液 C.KCl固体 D.硝酸银溶液
12.下列有关实验的描述错误的是
A.用肥皂水可区分硬水和蒸馏水
B.稀释浓硫酸时,应将水倒入浓硫酸中
C.用氢氧化钠溶液可以除去一氧化碳中混有的二氧化碳
D.蒸发结晶时,当蒸发皿中出现较多固体可停止加热
13.下列物质不能与NaOH溶液反应的是
A.二氧化碳 B.硝酸
C.硫酸铜 D.氢氧化铁
14.在Ca(OH)2的饱和溶液中加入下列物质,冷却至室温,溶液的pH没有改变的是
A.CO2 B.CaO C.Cu(NO3)2 D.HCl
15.下列溶液在空气中敞口放置后,溶液质量因发生化学反应而减小的是
A.石灰水 B.浓硫酸 C.浓盐酸 D.烧碱溶液
16.利用推理、归纳的方法得出以下结论,其中正确的是
A.金刚石、石墨是组成元素相同的单质,所以化学性质相似
B.氧化物中一定含有氧元素,所以含氧元素的化合物一定是氧化物
C.碱溶液pH>7,所以pH>7的溶液均为碱溶液
D.铁的金属活动性比铝弱,所以铁制品比铝制品更耐腐蚀
二、综合应用题
17.波尔多液是一种农业上常用的杀虫剂,它由硫酸铜、生石灰加水配制而成。
(1)硫酸铜所含阳离子的符号是_________,生石灰加水过程中会_________(填“放”或“吸”)热。
(2)波尔多液不能用铁质容器来配制的原因是(用化学方程式说明)____________。
(3)煅烧石灰石(主要成分CaCO3)可制得生石灰(CaO)。若要制取8.4t氧化钙,根据化学方程式计算需要加热分解碳酸钙的质量是多少_____?
18.请回答有关二氧化碳的问题:
(1)地球大气二氧化碳的含量增多,会产生温室效应,导致全球变暖,冰山融化,海平面上升。若继续增加二氧化碳含量,后果不堪设想。
①空气中二氧化碳的主要来源有 ____________ (写一点);
②自然界能消耗二氧化碳的主要途径是 ___________ ,该过程将 _________ 能转化为 _________ 能;
③“低碳生活”的基本理念是节约生活中所耗用的能源和材料,从而减少二氧化碳的排放量。下列做法不符合“低碳”理念的是 __________ ;
A 教科书循环使用
B 少用一次性塑料袋
C 多用一次性木筷
D 出门时随手关灯
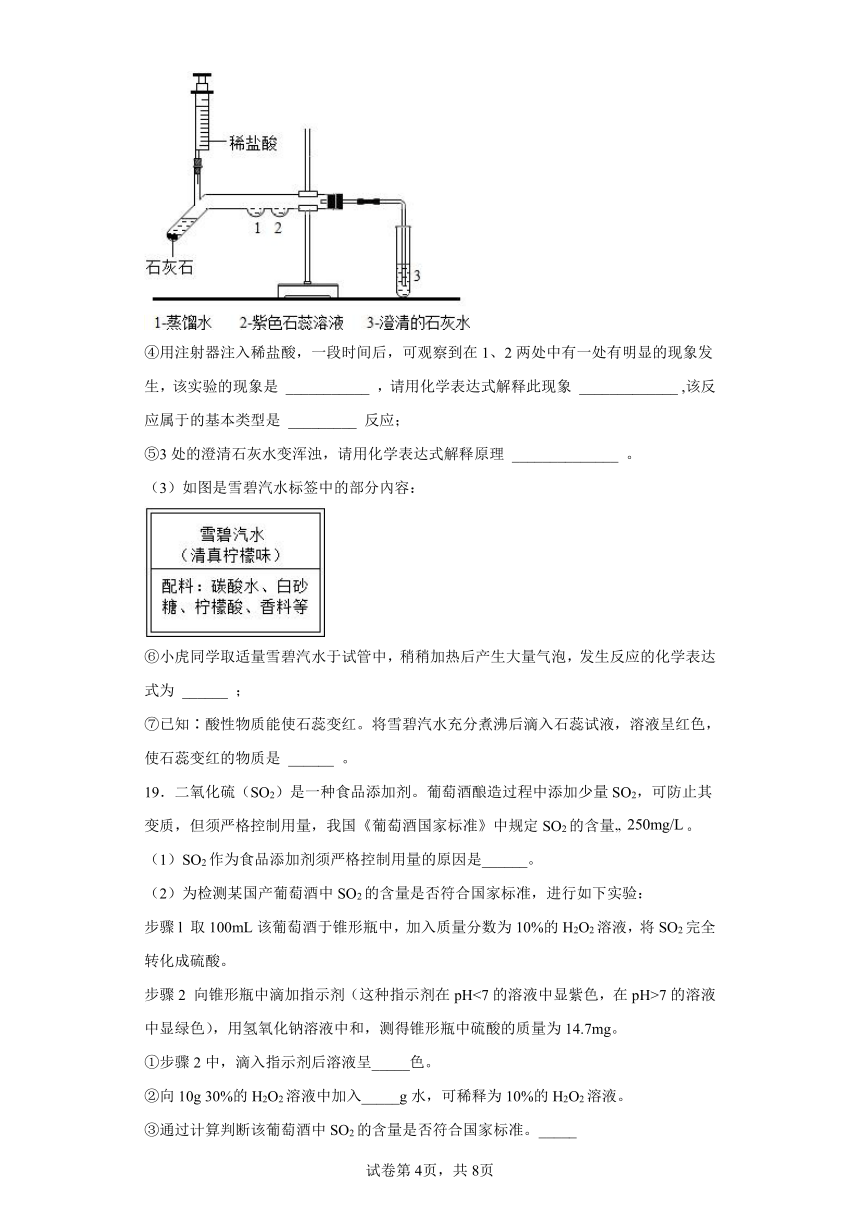
(2)为探究二氧化碳的性质,某同学设计如图实验:
④用注射器注入稀盐酸,一段时间后,可观察到在1、2两处中有一处有明显的现象发生,该实验的现象是 ___________ ,请用化学表达式解释此现象 _____________ ,该反应属于的基本类型是 _________ 反应;
⑤3处的澄清石灰水变浑浊,请用化学表达式解释原理 ______________ 。
(3)如图是雪碧汽水标签中的部分內容:
⑥小虎同学取适量雪碧汽水于试管中,稍稍加热后产生大量气泡,发生反应的化学表达式为 ______ ;
⑦已知∶酸性物质能使石蕊变红。将雪碧汽水充分煮沸后滴入石蕊试液,溶液呈红色,使石蕊变红的物质是 ______ 。
19.二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加少量SO2,可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量。
(1)SO2作为食品添加剂须严格控制用量的原因是______。
(2)为检测某国产葡萄酒中SO2的含量是否符合国家标准,进行如下实验:
步骤l 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(这种指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈_____色。
②向10g 30%的H2O2溶液中加入_____g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。_____
20.用某含有CO2、水蒸气的还原性气体(可能含有CO、H2中的一种或两种)经过如下图的装置来确定其成分及C装置中FexOy的化学式。(已知:无水硫酸铜粉末遇水变蓝)
(1)B装置的作用是_______,D装置的作用是_______;
(2)实验过程中观察到D中无明显变化,E中澄清石灰水变浑浊,则还原性气体是____,当C中的FexOy,完全反应后,测得E和F的总重量增加3.52g,C中剩余固体质量为3.36g,则FexOy的化学式为_______。若没有A装置,则测得的x和y的比值将_______(“偏大”、“偏小”或“不变”)。
21.铜及其化合物在生产、生活中都有广泛的应用。
一、铜的冶炼
资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石[主要成分是碱石碳酸铜Cu2(OH)2CO3],主要燃料是木炭,冶炼温度估计在1000℃左右。
资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”。“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜。
(1)关于“曾青”和孔雀石的说法中,正确的是 ___ 。
A 前者属于盐,后者的主要成分是碱 B 前者属于酸,后者的主要成分是碱
C 前者和后者的主要成分都属于氧化物 D 前者和后者的主要成分都属于盐
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有 __ 。
①Cu2(OH)2CO32CuO+CO2↑+H2O ②2CuO+C2Cu+CO2↑
③CuO+COCu+CO2 ④CO2+C2CO
A ①② B ①③ C ①②③ D ①②③④
(3)已知有元素化合价升高和降低的反应属于氧化还原反应。在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同) ____ ,不属于氧化还原反应的有 ____ 。
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式: ___ , ___ 。
二、铜及其化合物的应用
(5)碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等。碱式碳酸铜由Na2CO3 10H2O与CuSO4 5H2O反应制备,原理:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2Na2SO4+CO2↑。称取14.0gCuSO4 5H2O、16.0gNa2CO3 10H2O,用研钵分别研细后再混合研磨,立即发生反应,有“嗞嗞”声,而且混合物很快成为“黏胶状”。将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42﹣为止,取出沉淀,风干,得到蓝绿色晶体。
①混合物发生反应时有“嗞嗞”声的原因是 ___ 。
②撤离热源的目的是 ___ 。
组成测定:
有同学查阅资料发现用Cu(OH)2 CuCO3表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2 nCuCO3,不同来源的碱式碳酸铜的m、n值需要具体测定。热分解法测定碱式碳酸铜组成的实验装置如下图所示,通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值。
③三次平行实验测定结果如下表,则该样品中m:n= ___ ,若量气管中所盛液体是水,则该测定值比理论值 ___ (填“偏大”、“偏小”或“不变”)。(已知该状况下,二氧化碳密度为1.964g/L)
实验序号 样品质量/g CO2体积/mL (已折算成标准状况下)
1 0.542 44.82
2 0.542 44.80
3 0.542 44.78
22.某氢氧化钠样品放置于空气中,为测定其中碳酸钠的含量。设计如下三种实验方案。
【方案1】取一定量的样品,用以下装置测定样品中碳酸钠的含量(夹持装置已略去)
(1)有同学认为把分液漏斗中的稀硫酸换成稀盐酸,对实验结果没有影响。你是否赞同。(填“赞同”或“不赞同”)________,理由是_________。
(2)完成以下实验步骤:组装好实验装置,首先_________,再加入实验药品。打开K1、K2通一段时间氮气后,称量C装置的质量。接下来关闭K1,再打开分液漏斗活塞,加入稀硫酸,至不再产生气体,再打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是__________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见__________。
【方案2】用如图装置测定mg样品中氢氧化钠中碳酸钠的含量(部分夹持装置已略去)。
已知:本实验条件下,CO2密度为ρg/L
(4)虚线框处应选用_________(填“A”或“B”),较另外一套,它的优点是__________;__________。
(5)为测定生成气体的体积,量气装置中的X液体应选用_________。
(6)量气管在读数时,为了使测量数据更准确,读数时除了要视线要与凹液面的最低处相平、要等反应恢复到室温后才读数外,还需要注意;_________。
(7)若mg样品完全反应,测得生成气体的体积为VmL,则碳酸钠的质量分数是_________。(写出计算式即可,不用化简)。
【方案3】按以下步骤测定样品中碳酸钠的质量分数:
(8)步骤①反应的化学方程式为________。
(9)若在步骤中②未洗涤,测定结果将_________(填“偏高”、“偏低”或“无影响”),步骤②中洗涤沉淀的方法是__________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.C
4.C
5.C
6.C
7.D
8.D
9.C
10.C
11.B
12.B
13.D
14.B
15.A
16.A
17. Cu2+ 放 Fe+CuSO4=Cu+FeSO4
解:设若要制取8.4t氧化钙,需要加热分解碳酸钙的质量是x。
,x=15t
答:需要加热分解碳酸钙的质量为15t。
18. 化石燃料的燃烧 绿色植物光合作用 太阳 化学 C 2处紫色石蕊变红色 化合反应 柠檬酸
19. SO2有一定的毒性 紫 20 是
20.(1) 除去还原性气体中的水蒸气 验证C装置中是否有水生成(或检验还原性气体中是否含有氢气)
(2) CO Fe3O4 偏小
21. D D ③ ① Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O Fe +CuSO4=FeSO4+Cu 反应中有CO2气体生成 防止Cu2(OH)2CO3受热分解 3:2 偏大
22. 不赞同 稀盐酸有挥发性,挥发出的HCl会对实验结果有影响 检查装置气密性 排除空气中含有的二氧化碳气体对实验的影响,并将生成的二氧化碳气体排出使其完全被碱石灰吸收 装置C后加装一个盛有碱石灰的干燥管 B 平衡气压、便于液体顺利流下 消除由于稀硫酸的滴入,对气体体积造成的影响 饱和NaHCO3溶液 上下调节量气管,使量气管两侧液面相平 偏高 向过滤器中加蒸馏水至浸没沉淀,待水自然流尽后,重复2-3次
答案第1页,共2页
答案第1页,共2页
一、单选题
1.生活中很多变化都伴随着热量变化,下列热量变化不是由化学变化引起的是
A.苹果腐烂发热 B.生石灰与水混合放热
C.灯管通电发热 D.暖宝宝贴(内含铁粉 活性炭 NaCl固体等)发热
2.氢氧化钠溶液和氨水都能使酚酞溶液变红,其原因是二者的溶液中均含有一种相同的粒子是
A.H+ B.OH- C.H2O D.H
3. 下列物质敞口放置在空气中一段时间后,质量会减少的是
A.浓硫酸 B.氯化钠 C.浓盐酸 D.烧碱
4.下列物质存放在烧杯中一段时间后,质量变小且不变质的是( )
A.烧碱 B.浓硫酸 C.浓盐酸 D.生石灰
5.中国丝绸有几千年的历史传承。古代染坊常用某种“碱剂”来处理丝绸,该“碱剂”可使丝绸颜色洁白、质感柔软,其主要成分是一种盐,这种“碱剂”可能是
A.食醋 B.烧碱 C.草木灰 D.生石灰
6.忘盖瓶塞的氢氧化钠溶液可能变质。下表中分析与设计错误的是
选项 问题 分析与设计
A 为何变质 2NaOH + CO2 = Na2CO3 + H2O
B 是否变质 取样,加入足量稀盐酸,观察是否产生气泡
C 是否全部变质 取样,加入足量氯化钙溶液,观察产生沉淀多少
D 如何除去杂质 取样,加入适量氢氧化钙溶液,过滤
A.A B.B C.C D.D
7.根据如图实验判断下列说法错误的是
A.浓盐酸有挥发性 B.分子在不断运动
C.B烧杯溶液的颜色会改变 D.B烧杯内发生了置换反应
8.用如图所示装置探究CO2能否与H2O反应。滴加盐酸,待试管乙中液体变红后,将其加热至沸腾,红色不褪去。下列说法正确的是
A.甲中逸出的气体只含CO2
B.乙中液体变红,证明CO2能与水反应
C.加热后红色不褪去,说明碳酸受热不分解
D.欲达到实验目的,可将盐酸改为稀硫酸
9.若利用碱的性质进行下列实验,不能达到相应目的的是
A.分别加入少量Mg(OH)2固体,根据是否溶解,可鉴别稀盐酸和Na2CO3溶液
B.分别加入适量水溶解,根据温度是否明显升高,可鉴别NaOH固体和NaCl固体
C.分别加入Ba(OH)2溶液,根据是否产生沉淀,可鉴别MgCl2溶液和Na2SO4溶液
D.分别加入熟石灰粉末研磨,根据是否产生氨味,可鉴别(NH4)2SO4固体和K2SO4固体
10.下列关于硫酸的认识,正确的是
A.组成:硫酸溶液中H+和SO的数目相同
B.性质:能与CO2、SO3等非金属氧化物反应
C.用途:可用于实验室制备CuSO4等硫酸盐
D.生产:含硫酸废水用CaCl2处理后直接排放
11.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率,且不影响生成氢气的总量,可向盐酸中加入适量的( )
A.NaOH溶液 B.NaCl溶液 C.KCl固体 D.硝酸银溶液
12.下列有关实验的描述错误的是
A.用肥皂水可区分硬水和蒸馏水
B.稀释浓硫酸时,应将水倒入浓硫酸中
C.用氢氧化钠溶液可以除去一氧化碳中混有的二氧化碳
D.蒸发结晶时,当蒸发皿中出现较多固体可停止加热
13.下列物质不能与NaOH溶液反应的是
A.二氧化碳 B.硝酸
C.硫酸铜 D.氢氧化铁
14.在Ca(OH)2的饱和溶液中加入下列物质,冷却至室温,溶液的pH没有改变的是
A.CO2 B.CaO C.Cu(NO3)2 D.HCl
15.下列溶液在空气中敞口放置后,溶液质量因发生化学反应而减小的是
A.石灰水 B.浓硫酸 C.浓盐酸 D.烧碱溶液
16.利用推理、归纳的方法得出以下结论,其中正确的是
A.金刚石、石墨是组成元素相同的单质,所以化学性质相似
B.氧化物中一定含有氧元素,所以含氧元素的化合物一定是氧化物
C.碱溶液pH>7,所以pH>7的溶液均为碱溶液
D.铁的金属活动性比铝弱,所以铁制品比铝制品更耐腐蚀
二、综合应用题
17.波尔多液是一种农业上常用的杀虫剂,它由硫酸铜、生石灰加水配制而成。
(1)硫酸铜所含阳离子的符号是_________,生石灰加水过程中会_________(填“放”或“吸”)热。
(2)波尔多液不能用铁质容器来配制的原因是(用化学方程式说明)____________。
(3)煅烧石灰石(主要成分CaCO3)可制得生石灰(CaO)。若要制取8.4t氧化钙,根据化学方程式计算需要加热分解碳酸钙的质量是多少_____?
18.请回答有关二氧化碳的问题:
(1)地球大气二氧化碳的含量增多,会产生温室效应,导致全球变暖,冰山融化,海平面上升。若继续增加二氧化碳含量,后果不堪设想。
①空气中二氧化碳的主要来源有 ____________ (写一点);
②自然界能消耗二氧化碳的主要途径是 ___________ ,该过程将 _________ 能转化为 _________ 能;
③“低碳生活”的基本理念是节约生活中所耗用的能源和材料,从而减少二氧化碳的排放量。下列做法不符合“低碳”理念的是 __________ ;
A 教科书循环使用
B 少用一次性塑料袋
C 多用一次性木筷
D 出门时随手关灯
(2)为探究二氧化碳的性质,某同学设计如图实验:
④用注射器注入稀盐酸,一段时间后,可观察到在1、2两处中有一处有明显的现象发生,该实验的现象是 ___________ ,请用化学表达式解释此现象 _____________ ,该反应属于的基本类型是 _________ 反应;
⑤3处的澄清石灰水变浑浊,请用化学表达式解释原理 ______________ 。
(3)如图是雪碧汽水标签中的部分內容:
⑥小虎同学取适量雪碧汽水于试管中,稍稍加热后产生大量气泡,发生反应的化学表达式为 ______ ;
⑦已知∶酸性物质能使石蕊变红。将雪碧汽水充分煮沸后滴入石蕊试液,溶液呈红色,使石蕊变红的物质是 ______ 。
19.二氧化硫(SO2)是一种食品添加剂。葡萄酒酿造过程中添加少量SO2,可防止其变质,但须严格控制用量,我国《葡萄酒国家标准》中规定SO2的含量。
(1)SO2作为食品添加剂须严格控制用量的原因是______。
(2)为检测某国产葡萄酒中SO2的含量是否符合国家标准,进行如下实验:
步骤l 取100mL该葡萄酒于锥形瓶中,加入质量分数为10%的H2O2溶液,将SO2完全转化成硫酸。
步骤2 向锥形瓶中滴加指示剂(这种指示剂在pH<7的溶液中显紫色,在pH>7的溶液中显绿色),用氢氧化钠溶液中和,测得锥形瓶中硫酸的质量为14.7mg。
①步骤2中,滴入指示剂后溶液呈_____色。
②向10g 30%的H2O2溶液中加入_____g水,可稀释为10%的H2O2溶液。
③通过计算判断该葡萄酒中SO2的含量是否符合国家标准。_____
20.用某含有CO2、水蒸气的还原性气体(可能含有CO、H2中的一种或两种)经过如下图的装置来确定其成分及C装置中FexOy的化学式。(已知:无水硫酸铜粉末遇水变蓝)
(1)B装置的作用是_______,D装置的作用是_______;
(2)实验过程中观察到D中无明显变化,E中澄清石灰水变浑浊,则还原性气体是____,当C中的FexOy,完全反应后,测得E和F的总重量增加3.52g,C中剩余固体质量为3.36g,则FexOy的化学式为_______。若没有A装置,则测得的x和y的比值将_______(“偏大”、“偏小”或“不变”)。
21.铜及其化合物在生产、生活中都有广泛的应用。
一、铜的冶炼
资料一:考古工作者从安阳的商代铸铜遗址中,发现当时冶炼铜的主要矿物原料是孔雀石[主要成分是碱石碳酸铜Cu2(OH)2CO3],主要燃料是木炭,冶炼温度估计在1000℃左右。
资料二:西汉刘安著《淮南万毕术》中记载“曾青得铁则化为铜”。“曾青”可能是硫酸铜一类的物质,将孔雀石溶于硫酸中得此溶液,当把铁粉投入此溶液中即可得铜。
(1)关于“曾青”和孔雀石的说法中,正确的是 ___ 。
A 前者属于盐,后者的主要成分是碱 B 前者属于酸,后者的主要成分是碱
C 前者和后者的主要成分都属于氧化物 D 前者和后者的主要成分都属于盐
(2)以孔雀石为原料的冶炼过程中,用现代化学的观念审视,可能涉及的化学反应有 __ 。
①Cu2(OH)2CO32CuO+CO2↑+H2O ②2CuO+C2Cu+CO2↑
③CuO+COCu+CO2 ④CO2+C2CO
A ①② B ①③ C ①②③ D ①②③④
(3)已知有元素化合价升高和降低的反应属于氧化还原反应。在(2)的四个反应中,不属于四种基本反应类型的有(填序号,下同) ____ ,不属于氧化还原反应的有 ____ 。
(4)资料二中,假设溶解孔雀石的酸是稀硫酸,写出用此方法冶炼铜的化学方程式: ___ , ___ 。
二、铜及其化合物的应用
(5)碱式碳酸铜是一种具有广泛用途的化工产品,主要用于固体荧光粉激活剂和铜盐的制造等。碱式碳酸铜由Na2CO3 10H2O与CuSO4 5H2O反应制备,原理:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2Na2SO4+CO2↑。称取14.0gCuSO4 5H2O、16.0gNa2CO3 10H2O,用研钵分别研细后再混合研磨,立即发生反应,有“嗞嗞”声,而且混合物很快成为“黏胶状”。将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀生成,过滤,用水洗涤,至滤液中不含SO42﹣为止,取出沉淀,风干,得到蓝绿色晶体。
①混合物发生反应时有“嗞嗞”声的原因是 ___ 。
②撤离热源的目的是 ___ 。
组成测定:
有同学查阅资料发现用Cu(OH)2 CuCO3表示碱式碳酸铜是不准确的,较为准确、科学的表达式是mCu(OH)2 nCuCO3,不同来源的碱式碳酸铜的m、n值需要具体测定。热分解法测定碱式碳酸铜组成的实验装置如下图所示,通过测定碱式碳酸铜在灼热后所产生的气体体积,推导出碱式碳酸铜中碳酸铜和氢氧化铜的含量,即可求出m和n的比值。
③三次平行实验测定结果如下表,则该样品中m:n= ___ ,若量气管中所盛液体是水,则该测定值比理论值 ___ (填“偏大”、“偏小”或“不变”)。(已知该状况下,二氧化碳密度为1.964g/L)
实验序号 样品质量/g CO2体积/mL (已折算成标准状况下)
1 0.542 44.82
2 0.542 44.80
3 0.542 44.78
22.某氢氧化钠样品放置于空气中,为测定其中碳酸钠的含量。设计如下三种实验方案。
【方案1】取一定量的样品,用以下装置测定样品中碳酸钠的含量(夹持装置已略去)
(1)有同学认为把分液漏斗中的稀硫酸换成稀盐酸,对实验结果没有影响。你是否赞同。(填“赞同”或“不赞同”)________,理由是_________。
(2)完成以下实验步骤:组装好实验装置,首先_________,再加入实验药品。打开K1、K2通一段时间氮气后,称量C装置的质量。接下来关闭K1,再打开分液漏斗活塞,加入稀硫酸,至不再产生气体,再打开K1,通入氮气一段时间,测定C装置反应前后的质量变化。通入氮气的目的是__________。
(3)由于装置存在缺陷,导致测定结果偏高,请提出改进意见__________。
【方案2】用如图装置测定mg样品中氢氧化钠中碳酸钠的含量(部分夹持装置已略去)。
已知:本实验条件下,CO2密度为ρg/L
(4)虚线框处应选用_________(填“A”或“B”),较另外一套,它的优点是__________;__________。
(5)为测定生成气体的体积,量气装置中的X液体应选用_________。
(6)量气管在读数时,为了使测量数据更准确,读数时除了要视线要与凹液面的最低处相平、要等反应恢复到室温后才读数外,还需要注意;_________。
(7)若mg样品完全反应,测得生成气体的体积为VmL,则碳酸钠的质量分数是_________。(写出计算式即可,不用化简)。
【方案3】按以下步骤测定样品中碳酸钠的质量分数:
(8)步骤①反应的化学方程式为________。
(9)若在步骤中②未洗涤,测定结果将_________(填“偏高”、“偏低”或“无影响”),步骤②中洗涤沉淀的方法是__________。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.B
3.C
4.C
5.C
6.C
7.D
8.D
9.C
10.C
11.B
12.B
13.D
14.B
15.A
16.A
17. Cu2+ 放 Fe+CuSO4=Cu+FeSO4
解:设若要制取8.4t氧化钙,需要加热分解碳酸钙的质量是x。
,x=15t
答:需要加热分解碳酸钙的质量为15t。
18. 化石燃料的燃烧 绿色植物光合作用 太阳 化学 C 2处紫色石蕊变红色 化合反应 柠檬酸
19. SO2有一定的毒性 紫 20 是
20.(1) 除去还原性气体中的水蒸气 验证C装置中是否有水生成(或检验还原性气体中是否含有氢气)
(2) CO Fe3O4 偏小
21. D D ③ ① Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O Fe +CuSO4=FeSO4+Cu 反应中有CO2气体生成 防止Cu2(OH)2CO3受热分解 3:2 偏大
22. 不赞同 稀盐酸有挥发性,挥发出的HCl会对实验结果有影响 检查装置气密性 排除空气中含有的二氧化碳气体对实验的影响,并将生成的二氧化碳气体排出使其完全被碱石灰吸收 装置C后加装一个盛有碱石灰的干燥管 B 平衡气压、便于液体顺利流下 消除由于稀硫酸的滴入,对气体体积造成的影响 饱和NaHCO3溶液 上下调节量气管,使量气管两侧液面相平 偏高 向过滤器中加蒸馏水至浸没沉淀,待水自然流尽后,重复2-3次
答案第1页,共2页
答案第1页,共2页
同课章节目录
