9.2溶解度同步练习-2021-2022学年九年级化学人教版下册(word版 含答案)
文档属性
| 名称 | 9.2溶解度同步练习-2021-2022学年九年级化学人教版下册(word版 含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 160.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 17:17:26 | ||
图片预览



文档简介
9.2 溶解度 同步练习
一、单选题
1.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
2.下图是甲乙两种物质(不考虑结晶水)的溶解度曲线,下列说法正确的是
A.a1℃时,向甲的饱和溶液,加入25g甲,再升温至a ℃,烧杯底部有5g不溶物
B.a ℃,甲的饱和溶液可以配制成10%的甲溶液500g
C.a ℃甲的溶液中溶质和溶剂的质量比一定小于1:2
D.a ℃时,将等质量的甲乙两物质的饱和溶液降温至a1℃,所得溶液中溶质质量甲等于乙
3.关于饱和溶液的叙述正确的是( )
A.饱和溶液一定是浓溶液
B.增加溶质可使不饱和溶液变为饱和溶液
C.饱和溶液就是不能再溶解任何物质的溶液
D.同一物质的饱和溶液一定比不饱和溶液的浓度大
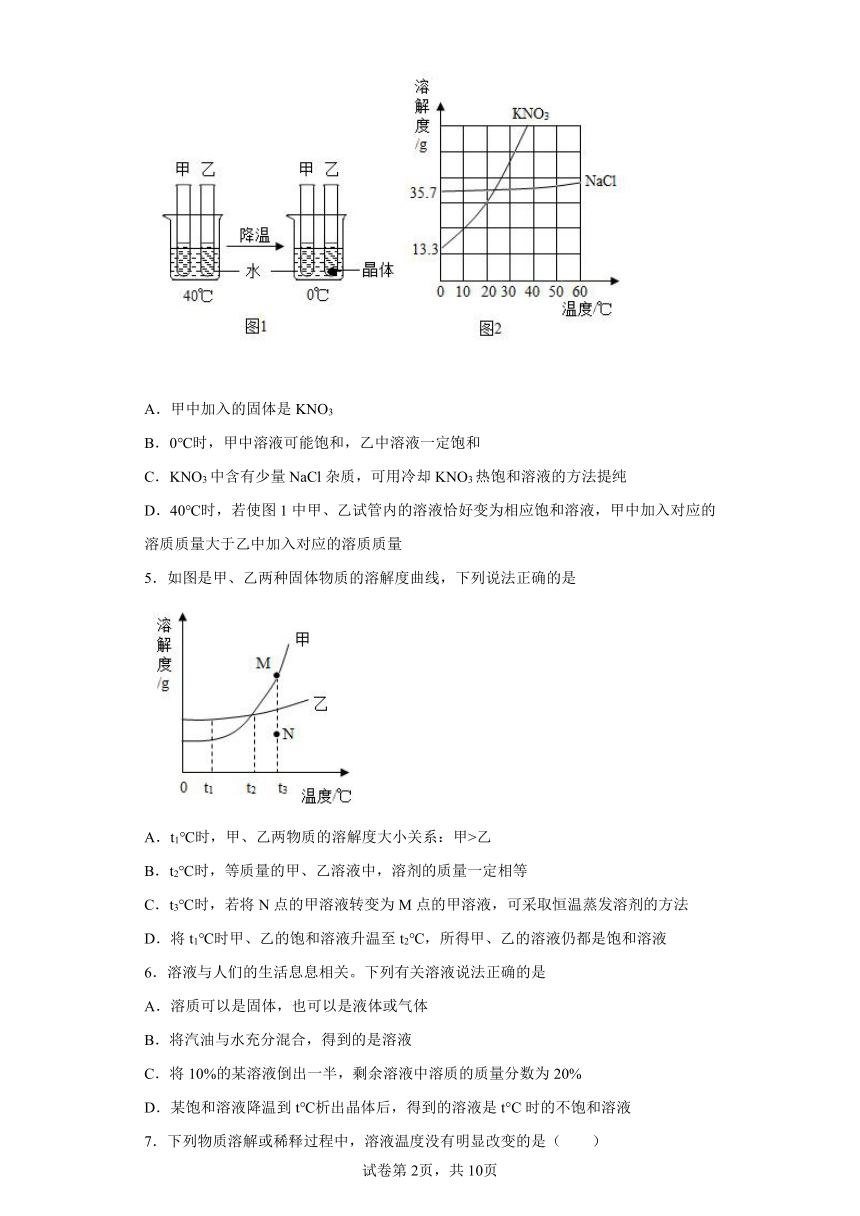
4.甲、乙试管中各盛有10.0g水,向其中一支中加入3.0gKNO3固体,另一支中加入3.0gNaCl固体,按图1进行实验(KNO3和NaCl的溶解度曲线如图2),下列说法正确的是
A.甲中加入的固体是KNO3
B.0℃时,甲中溶液可能饱和,乙中溶液一定饱和
C.KNO3中含有少量NaCl杂质,可用冷却KNO3热饱和溶液的方法提纯
D.40℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
5.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,甲、乙两物质的溶解度大小关系:甲>乙
B.t2℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C.t3℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.将t1℃时甲、乙的饱和溶液升温至t2℃,所得甲、乙的溶液仍都是饱和溶液
6.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
7.下列物质溶解或稀释过程中,溶液温度没有明显改变的是( )
A.NaOH B.NH4NO3 C.浓硫酸 D.NaCl
8.下列说法中,正确的是( )
A.在100 g水里,最多能溶解36 g食盐,所以食盐的溶解度为36 g
B.所有固体物质的溶解度都随着温度的升高而增大
C.有过剩溶质与溶液共存的溶液一定是该温度时的饱和溶液
D.20 ℃时100 g水里溶解了30 g硝酸钾,所以硝酸钾的溶解度是30 g
9.下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
10.下列关于溶液的说法正确的是
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
11.下列有关溶液说法正确的是
A.溶液都是均一、稳定的混合物 B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓 D.溶液的体积等于溶质的体积与溶剂的体积之和
12.下列说法错误的是
A.饱和溶液一定是浓溶液
B.糖水、汽水都是溶液
C.洗洁精去油污是因为洗洁精具有乳化功能
D.溶液都是均一、稳定的混合物
13.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
14.如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是
A.甲是易溶物质,乙是可溶物质
B.20℃时,等质量的甲、乙溶液中所含溶质的质量相等
C.从甲、乙溶液中获得甲、乙晶体都可采用蒸发溶剂的方法
D.40℃时,将20g甲加入50g水中,可得到70g溶液
15.溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是( )
A.升高温度溴酸银的溶解度增大
B.40 ℃时溴酸银易溶于水
C.90 ℃时溴酸银溶液的溶质质量分数一定小于1.3%
D.溴酸银可用降温结晶的方法从溶液中析出
16.能证实A物质的溶液在20°C时为饱和溶液的是( )
A.稍微降温,就有A晶体析出
B.蒸发掉10g水,有A晶体析出
C.加热到30°C时,再加A物质能继续溶解
D.20°C时,向溶液中加入少量的A晶体,溶液质量不变
二、综合应用题
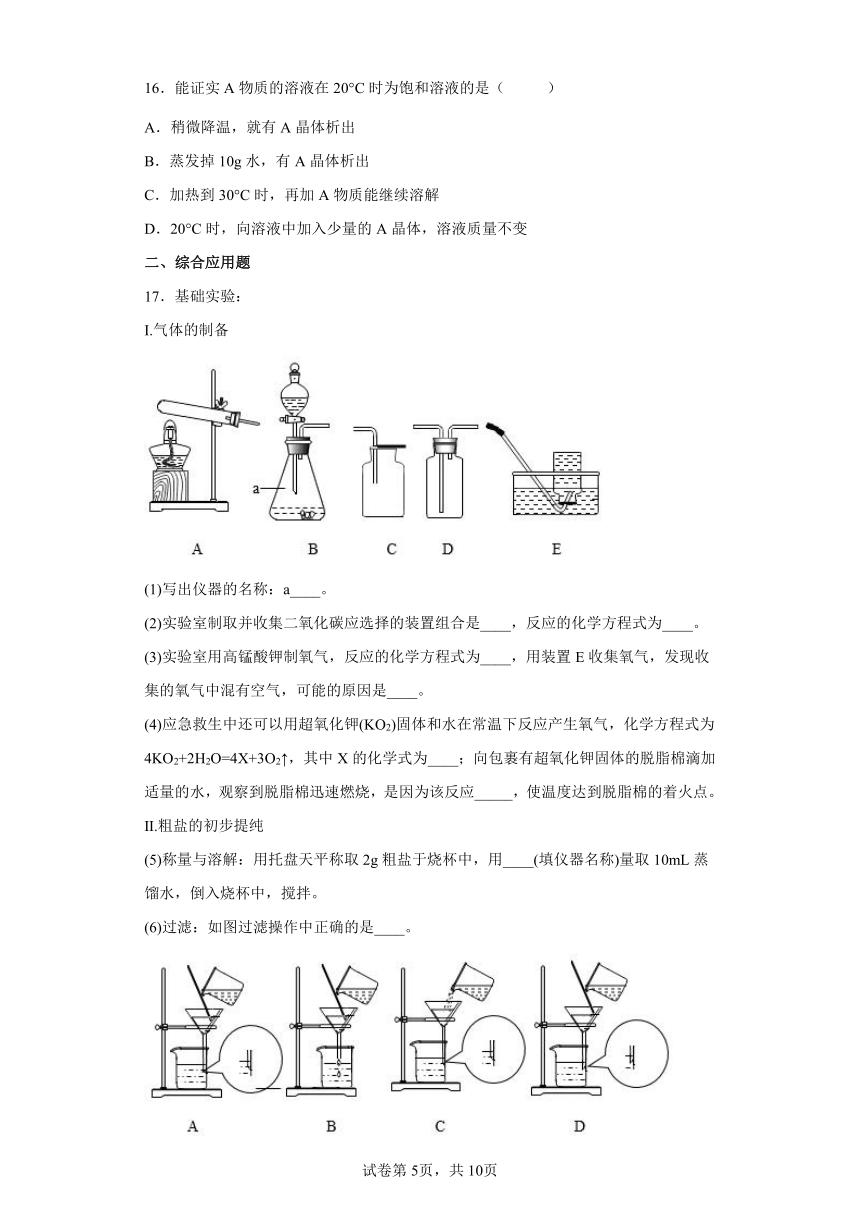
17.基础实验:
Ⅰ.气体的制备
(1)写出仪器的名称:a____。
(2)实验室制取并收集二氧化碳应选择的装置组合是____,反应的化学方程式为____。
(3)实验室用高锰酸钾制氧气,反应的化学方程式为____,用装置E收集氧气,发现收集的氧气中混有空气,可能的原因是____。
(4)应急救生中还可以用超氧化钾(KO2)固体和水在常温下反应产生氧气,化学方程式为4KO2+2H2O=4X+3O2↑,其中X的化学式为____;向包裹有超氧化钾固体的脱脂棉滴加适量的水,观察到脱脂棉迅速燃烧,是因为该反应_____,使温度达到脱脂棉的着火点。
Ⅱ.粗盐的初步提纯
(5)称量与溶解:用托盘天平称取2g粗盐于烧杯中,用____(填仪器名称)量取10mL蒸馏水,倒入烧杯中,搅拌。
(6)过滤:如图过滤操作中正确的是____。
(7)蒸发:当加热到蒸发皿中出现____时,停止加热,利用余热将滤液蒸干。
(8)转移称量:用玻璃棒将精盐转移到纸片上,称量质量,计算产率()。下列情况可能导致精盐产率偏低的是 。
A.溶解时加入的水过少 B.过滤时滤纸破损
C.蒸发时没有用玻璃棒搅拌导致滤液飞溅 D.所得精盐中含有少量水分
18.碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90% SrCO3,少量CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如图:
【查阅资料】
①不溶性碳酸盐高温下可以分解,生成金属氧化物和CO2气体。
② 可溶性碱(如KOH)中金属元素(K)形成的氧化物(K2O)才能与水反应生成对应的碱(KOH),反之,不溶性碱[如Cu(OH)2]中金属元素(Cu)形成的氧化物(CuO)不能与水反应。
③金属锶:化学性质非常活泼,可直接与水反应生成氢氧化锶和氢气。
④氢氧化锶在水中的溶解度数据如表:
温度/℃ 10 20 30 40 60 80 90 100
溶解度/(g/100g) 1.25 1.77 2.64 3.95 8.42 20.2 44.5 91.2
请回答以下问题:
(1)“粉碎”菱锶矿、焦炭混合的目的是______。标出碳酸锶(SrCO3)中锶的化合价为_____。
(2)“立窑煅烧”中碳酸锶和焦炭反应得到单质锶,请写出该反应的化学方程式______。
(3)“浸取”中用热水浸取而不用冷水的原因是________,滤渣1含有Ca(OH)2和_____。
(4)写出“除钡”环节中滤渣2的化学式_____。
(5)“结晶”采用的是_____结晶法,得到的“母液”一定是氢氧化锶的_____ (填“饱和”或“不饱和溶液”)。
(6)“沉锶”时发生的反应:Sr(OH)2+NH4HCO3=SrCO3↓+NH3·H2O+H2O,该反应需的温度需控制在65-80℃,其原因是_______。
(7)锶铁氧体是由锶和铁的氧化物组成的复合磁性材料。要制备某种锶铁氧体(化学式为SrO 6Fe2O3,相对分子质量为1064)5.32t,不考虑过程中的损失,理论上至少需要含SrCO3 80%的菱锶矿石多少t______?(写出计算过程)
19.假期生活丰富多彩,某校组织同学们夏令营活动。
(1)一路上各种鲜花盛开,果园里瓜果飘香,用分子观点解释闻到香气的原因____________________。
(2)野餐活动中若用漏勺捞煮好的方便面,与化学基本操作中的__________原理相似。同学们用洗涤剂清洗餐具上的油污,这是利用了洗涤剂的_______功能
(3)在野炊活动中用到的水来自一个大型水库,你认为水库的水属于_______(填“纯净物”或“混合物”)。如图是同学们自制的简易净水装置,净化水时,这是利用了活性炭的______作用,小明同学认为该水库的水是硬水,你认为可以用__________来鉴别,净化后的水你可以建议同学们通过_____的方法降低水的硬度
(4)“低碳生活,绿色出行”。学校建议同学们骑自行车出行。请回答下列问题
①图中所标示的各部件中,属于金属材料的是____________填序号)
②自行车车架一般用生铁制造,某些部件为不锈钢。工业上常以赤铁矿(主要成分为Fe2O3)为原料炼铁,请写出一氧化碳与氧化铁在高温下反应的化学方程式:________________。
③车架表面喷漆不仅美观,而且可有效防止其与__________________接触而生锈。防止公共自行车链条生锈的有效措施是_____________。
④自行车轮圈一般用铝合金制造,这是因为铝合金既轻便又耐用。铝制品比较耐腐蚀的原因是____________________。
⑤天气太热,建议同学们车胎气压不能太高试用。用分子、原子的相关知识解释_________________。有些同学带的碳酸饮料,其中溶有二氧化碳气体,当打开汽水瓶盖时,汽水会自动喷出来,原因是_________________有的同学们带了“摇摇冰”的罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动使它们混合,罐内饮料温度就会降低.这种固体物质可能是__________(填字母)
A.生石灰B.烧碱C.食盐D.硝酸铵
⑥为防止旅途中皮肤的以外擦伤感染,常备有碘酒,碘酒中的溶剂是________(写化学式)。
⑦同学们准备将垃圾分类处理,其中属于不可回收垃圾的是__________填字母)。
A.废纸 B.果皮 C. 饮料罐 D.废弃塑料
20.A、B、C三种固体物质(均不含结晶水)的溶解度曲线。
(1)A中混有少量的B是可用______方法提纯A。
(2)t2℃时,A物质的饱和溶液,为了进一步提高该溶液溶质质量分数,可进行的操作是______。
(3)对于溶解度曲线上的点p,以下描述一定正确的是______。
a. A、B、C溶液的溶质质量分数相同;
b.C的溶液100g有10g溶质;
c.B溶液处于不饱和状态;
d.A、C溶液质量相等
21.根据下面的溶解度表与溶解度曲线回答下列问题。
(1)B是________的溶解度曲线。
(2)40 ℃时,氯化钠的溶解度________(填“大于”“小于”或“等于”)硝酸钾的溶解度。
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是________。
(4)欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是________________。
(5)如图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是______(填字母)。
A.反应消耗水,氢氧化钙析出
B.反应放热,温度升高,氢氧化钙溶解度降低
C.生石灰与水反应生成的氢氧化钙不再溶解
22.水在生命活动、生产生活和科学实验等诸多领域起着十分重要的作用。
(1)在日常生活中,将硬水转化为软水常用的方法为 ________________ 。
(2)生理盐水中含氯化钠的质量分数为0.9%,现需要为病人输入500mL(密度为1g/mL)生理盐水,则能为病人提供的氯化钠质量为 ___________ g。
(3)在常温下水能与碳化钙(白色晶体,化学式为CaC2)发生剧烈反应,放出大量热,生成一种重要的化工原料R,反应原理可表示为CaC2+2H2O=Ca(OH)2+R,是推断R的化学式为 ______
(4)小明查阅数据得知A、B、C三种物质的溶解度曲线如图所示,据图回答:
①t2℃时,A物质的溶解度为 ________ g。
②当温度t的范围为0℃<t<t1℃时,A、B、C三种物质的溶解度由大到小的顺序为 ______
③现有t1℃时A物质的饱和溶液250g,其溶质质量分数为 ____________ 。
④下列叙述正确的是 ________ 。
A 升高温度可将A物质的饱和溶液变为不饱和溶液;
B 将t2℃时A、B两种物质的饱和溶液降温至t1℃,析出晶体的质量A>B
C 从C物质的溶液中获得晶体的方法可以采用降低温度的方法
D 在t1℃时,A、B均可配制成相同浓度的饱和溶液
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.C
5.C
6.A
7.D
8.C
9.C
10.A
11.A
12.A
13.D
14.C
15.B
16.D
17.(1)锥形瓶
(2) BD
(3) 未等导管口有连续均匀的气泡冒出就开始收集
(4) KOH 放热
(5)量筒
(6)A
(7)较多固体析出
(8)AC
18. 增大反应物的接触面积,使反应更快更充分 2C+SrCO3Sr+3CO↑ 增大氢氧化锶的溶解度 Mg(OH)2 BaSO4 降温 饱和 加快化学反应速率且防止NH4HCO3受热分解 解:化学反应前元素种类和质量守恒,设菱锶矿石的质量为x
答:需要菱锶矿石0.925t。
19. 分子不断运动 过滤 乳化 混合物 吸附 肥皂水 煮沸 序号为②③ 3CO+ Fe2O3 高温 2Fe + 3CO2 氧气(O2) 和水(H2O) 涂油 铝的表面有一层致密的氧化膜保护内部不被腐蚀 气体受热膨胀,分子间隔变大,导致爆胎 压强降低CO2溶解度变小 D C2H5OH B
20.(1)降温结晶
(2)升高温度同时加入A溶质
(3)c
21. NaCl 小于 (重)结晶 加KNO3 (固体)(或蒸发水分,或降低温度) B
22. 煮沸 4.5 C2H2 60 C>B>A 20% A
答案第1页,共2页
答案第1页,共2页
一、单选题
1.现有一接近饱和的溶液,下列方法中一定能使之成为饱和溶液的是 ( )
①蒸发溶剂,②增加溶质,③降低温度,④加热升温
A.只有①② B.只有②③ C.①②③ D.①②④
2.下图是甲乙两种物质(不考虑结晶水)的溶解度曲线,下列说法正确的是
A.a1℃时,向甲的饱和溶液,加入25g甲,再升温至a ℃,烧杯底部有5g不溶物
B.a ℃,甲的饱和溶液可以配制成10%的甲溶液500g
C.a ℃甲的溶液中溶质和溶剂的质量比一定小于1:2
D.a ℃时,将等质量的甲乙两物质的饱和溶液降温至a1℃,所得溶液中溶质质量甲等于乙
3.关于饱和溶液的叙述正确的是( )
A.饱和溶液一定是浓溶液
B.增加溶质可使不饱和溶液变为饱和溶液
C.饱和溶液就是不能再溶解任何物质的溶液
D.同一物质的饱和溶液一定比不饱和溶液的浓度大
4.甲、乙试管中各盛有10.0g水,向其中一支中加入3.0gKNO3固体,另一支中加入3.0gNaCl固体,按图1进行实验(KNO3和NaCl的溶解度曲线如图2),下列说法正确的是
A.甲中加入的固体是KNO3
B.0℃时,甲中溶液可能饱和,乙中溶液一定饱和
C.KNO3中含有少量NaCl杂质,可用冷却KNO3热饱和溶液的方法提纯
D.40℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
5.如图是甲、乙两种固体物质的溶解度曲线,下列说法正确的是
A.t1℃时,甲、乙两物质的溶解度大小关系:甲>乙
B.t2℃时,等质量的甲、乙溶液中,溶剂的质量一定相等
C.t3℃时,若将N点的甲溶液转变为M点的甲溶液,可采取恒温蒸发溶剂的方法
D.将t1℃时甲、乙的饱和溶液升温至t2℃,所得甲、乙的溶液仍都是饱和溶液
6.溶液与人们的生活息息相关。下列有关溶液说法正确的是
A.溶质可以是固体,也可以是液体或气体
B.将汽油与水充分混合,得到的是溶液
C.将10%的某溶液倒出一半,剩余溶液中溶质的质量分数为20%
D.某饱和溶液降温到t℃析出晶体后,得到的溶液是t°C时的不饱和溶液
7.下列物质溶解或稀释过程中,溶液温度没有明显改变的是( )
A.NaOH B.NH4NO3 C.浓硫酸 D.NaCl
8.下列说法中,正确的是( )
A.在100 g水里,最多能溶解36 g食盐,所以食盐的溶解度为36 g
B.所有固体物质的溶解度都随着温度的升高而增大
C.有过剩溶质与溶液共存的溶液一定是该温度时的饱和溶液
D.20 ℃时100 g水里溶解了30 g硝酸钾,所以硝酸钾的溶解度是30 g
9.下列说法正确的是( )
A.均一、稳定的液体都是溶液
B.溶质均以离子形式分散到溶剂中
C.同一温度下,硝酸钾的饱和溶液比不饱和溶液浓
D.饱和溶液析出晶体后溶质质量分数一定变小
10.下列关于溶液的说法正确的是
A.溶液一定是混合物
B.饱和溶液的浓度比不饱和溶液的浓度一定大
C.医用碘酒是碘的水溶液
D.添加溶质是不饱和溶液变成饱和溶液的唯一方法
11.下列有关溶液说法正确的是
A.溶液都是均一、稳定的混合物 B.形成溶液的溶质都是固体
C.所有饱和溶液都比不饱和溶液要浓 D.溶液的体积等于溶质的体积与溶剂的体积之和
12.下列说法错误的是
A.饱和溶液一定是浓溶液
B.糖水、汽水都是溶液
C.洗洁精去油污是因为洗洁精具有乳化功能
D.溶液都是均一、稳定的混合物
13.甲、乙两种物质(不含结晶水)的溶解度曲线如图所示,下列叙述正确的是
A.甲和乙的溶解度相等且均为30g
B.甲物质的溶解度随温度的升高而减小
C.a1℃时,乙的饱和溶液中溶质与溶剂的质量比为3:7
D.将a2℃150g甲的饱和溶液降温到a1℃,有20g固体析出
14.如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是
A.甲是易溶物质,乙是可溶物质
B.20℃时,等质量的甲、乙溶液中所含溶质的质量相等
C.从甲、乙溶液中获得甲、乙晶体都可采用蒸发溶剂的方法
D.40℃时,将20g甲加入50g水中,可得到70g溶液
15.溴酸银(AgBrO3)的溶解度随温度变化曲线如图所示,下列说法不正确的是( )
A.升高温度溴酸银的溶解度增大
B.40 ℃时溴酸银易溶于水
C.90 ℃时溴酸银溶液的溶质质量分数一定小于1.3%
D.溴酸银可用降温结晶的方法从溶液中析出
16.能证实A物质的溶液在20°C时为饱和溶液的是( )
A.稍微降温,就有A晶体析出
B.蒸发掉10g水,有A晶体析出
C.加热到30°C时,再加A物质能继续溶解
D.20°C时,向溶液中加入少量的A晶体,溶液质量不变
二、综合应用题
17.基础实验:
Ⅰ.气体的制备
(1)写出仪器的名称:a____。
(2)实验室制取并收集二氧化碳应选择的装置组合是____,反应的化学方程式为____。
(3)实验室用高锰酸钾制氧气,反应的化学方程式为____,用装置E收集氧气,发现收集的氧气中混有空气,可能的原因是____。
(4)应急救生中还可以用超氧化钾(KO2)固体和水在常温下反应产生氧气,化学方程式为4KO2+2H2O=4X+3O2↑,其中X的化学式为____;向包裹有超氧化钾固体的脱脂棉滴加适量的水,观察到脱脂棉迅速燃烧,是因为该反应_____,使温度达到脱脂棉的着火点。
Ⅱ.粗盐的初步提纯
(5)称量与溶解:用托盘天平称取2g粗盐于烧杯中,用____(填仪器名称)量取10mL蒸馏水,倒入烧杯中,搅拌。
(6)过滤:如图过滤操作中正确的是____。
(7)蒸发:当加热到蒸发皿中出现____时,停止加热,利用余热将滤液蒸干。
(8)转移称量:用玻璃棒将精盐转移到纸片上,称量质量,计算产率()。下列情况可能导致精盐产率偏低的是 。
A.溶解时加入的水过少 B.过滤时滤纸破损
C.蒸发时没有用玻璃棒搅拌导致滤液飞溅 D.所得精盐中含有少量水分
18.碳酸锶(SrCO3)是一种重要的工业原料,广泛用于生产锶铁氧体磁性材料。一种以菱锶矿(含80~90% SrCO3,少量CaCO3、BaCO3等)制备高纯碳酸锶的工艺流程如图:
【查阅资料】
①不溶性碳酸盐高温下可以分解,生成金属氧化物和CO2气体。
② 可溶性碱(如KOH)中金属元素(K)形成的氧化物(K2O)才能与水反应生成对应的碱(KOH),反之,不溶性碱[如Cu(OH)2]中金属元素(Cu)形成的氧化物(CuO)不能与水反应。
③金属锶:化学性质非常活泼,可直接与水反应生成氢氧化锶和氢气。
④氢氧化锶在水中的溶解度数据如表:
温度/℃ 10 20 30 40 60 80 90 100
溶解度/(g/100g) 1.25 1.77 2.64 3.95 8.42 20.2 44.5 91.2
请回答以下问题:
(1)“粉碎”菱锶矿、焦炭混合的目的是______。标出碳酸锶(SrCO3)中锶的化合价为_____。
(2)“立窑煅烧”中碳酸锶和焦炭反应得到单质锶,请写出该反应的化学方程式______。
(3)“浸取”中用热水浸取而不用冷水的原因是________,滤渣1含有Ca(OH)2和_____。
(4)写出“除钡”环节中滤渣2的化学式_____。
(5)“结晶”采用的是_____结晶法,得到的“母液”一定是氢氧化锶的_____ (填“饱和”或“不饱和溶液”)。
(6)“沉锶”时发生的反应:Sr(OH)2+NH4HCO3=SrCO3↓+NH3·H2O+H2O,该反应需的温度需控制在65-80℃,其原因是_______。
(7)锶铁氧体是由锶和铁的氧化物组成的复合磁性材料。要制备某种锶铁氧体(化学式为SrO 6Fe2O3,相对分子质量为1064)5.32t,不考虑过程中的损失,理论上至少需要含SrCO3 80%的菱锶矿石多少t______?(写出计算过程)
19.假期生活丰富多彩,某校组织同学们夏令营活动。
(1)一路上各种鲜花盛开,果园里瓜果飘香,用分子观点解释闻到香气的原因____________________。
(2)野餐活动中若用漏勺捞煮好的方便面,与化学基本操作中的__________原理相似。同学们用洗涤剂清洗餐具上的油污,这是利用了洗涤剂的_______功能
(3)在野炊活动中用到的水来自一个大型水库,你认为水库的水属于_______(填“纯净物”或“混合物”)。如图是同学们自制的简易净水装置,净化水时,这是利用了活性炭的______作用,小明同学认为该水库的水是硬水,你认为可以用__________来鉴别,净化后的水你可以建议同学们通过_____的方法降低水的硬度
(4)“低碳生活,绿色出行”。学校建议同学们骑自行车出行。请回答下列问题
①图中所标示的各部件中,属于金属材料的是____________填序号)
②自行车车架一般用生铁制造,某些部件为不锈钢。工业上常以赤铁矿(主要成分为Fe2O3)为原料炼铁,请写出一氧化碳与氧化铁在高温下反应的化学方程式:________________。
③车架表面喷漆不仅美观,而且可有效防止其与__________________接触而生锈。防止公共自行车链条生锈的有效措施是_____________。
④自行车轮圈一般用铝合金制造,这是因为铝合金既轻便又耐用。铝制品比较耐腐蚀的原因是____________________。
⑤天气太热,建议同学们车胎气压不能太高试用。用分子、原子的相关知识解释_________________。有些同学带的碳酸饮料,其中溶有二氧化碳气体,当打开汽水瓶盖时,汽水会自动喷出来,原因是_________________有的同学们带了“摇摇冰”的罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动使它们混合,罐内饮料温度就会降低.这种固体物质可能是__________(填字母)
A.生石灰B.烧碱C.食盐D.硝酸铵
⑥为防止旅途中皮肤的以外擦伤感染,常备有碘酒,碘酒中的溶剂是________(写化学式)。
⑦同学们准备将垃圾分类处理,其中属于不可回收垃圾的是__________填字母)。
A.废纸 B.果皮 C. 饮料罐 D.废弃塑料
20.A、B、C三种固体物质(均不含结晶水)的溶解度曲线。
(1)A中混有少量的B是可用______方法提纯A。
(2)t2℃时,A物质的饱和溶液,为了进一步提高该溶液溶质质量分数,可进行的操作是______。
(3)对于溶解度曲线上的点p,以下描述一定正确的是______。
a. A、B、C溶液的溶质质量分数相同;
b.C的溶液100g有10g溶质;
c.B溶液处于不饱和状态;
d.A、C溶液质量相等
21.根据下面的溶解度表与溶解度曲线回答下列问题。
(1)B是________的溶解度曲线。
(2)40 ℃时,氯化钠的溶解度________(填“大于”“小于”或“等于”)硝酸钾的溶解度。
(3)硝酸钾中混有少量的氯化钠,想要得到纯净的硝酸钾的方法是________。
(4)欲使硝酸钾的不饱和溶液转化为饱和溶液,可以采取的方法之一是________________。
(5)如图所示,烧杯A中是饱和的氢氧化钙溶液,向烧杯B中加入生石灰后,烧杯A中变浑浊,可能的原因是______(填字母)。
A.反应消耗水,氢氧化钙析出
B.反应放热,温度升高,氢氧化钙溶解度降低
C.生石灰与水反应生成的氢氧化钙不再溶解
22.水在生命活动、生产生活和科学实验等诸多领域起着十分重要的作用。
(1)在日常生活中,将硬水转化为软水常用的方法为 ________________ 。
(2)生理盐水中含氯化钠的质量分数为0.9%,现需要为病人输入500mL(密度为1g/mL)生理盐水,则能为病人提供的氯化钠质量为 ___________ g。
(3)在常温下水能与碳化钙(白色晶体,化学式为CaC2)发生剧烈反应,放出大量热,生成一种重要的化工原料R,反应原理可表示为CaC2+2H2O=Ca(OH)2+R,是推断R的化学式为 ______
(4)小明查阅数据得知A、B、C三种物质的溶解度曲线如图所示,据图回答:
①t2℃时,A物质的溶解度为 ________ g。
②当温度t的范围为0℃<t<t1℃时,A、B、C三种物质的溶解度由大到小的顺序为 ______
③现有t1℃时A物质的饱和溶液250g,其溶质质量分数为 ____________ 。
④下列叙述正确的是 ________ 。
A 升高温度可将A物质的饱和溶液变为不饱和溶液;
B 将t2℃时A、B两种物质的饱和溶液降温至t1℃,析出晶体的质量A>B
C 从C物质的溶液中获得晶体的方法可以采用降低温度的方法
D 在t1℃时,A、B均可配制成相同浓度的饱和溶液
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
2.B
3.B
4.C
5.C
6.A
7.D
8.C
9.C
10.A
11.A
12.A
13.D
14.C
15.B
16.D
17.(1)锥形瓶
(2) BD
(3) 未等导管口有连续均匀的气泡冒出就开始收集
(4) KOH 放热
(5)量筒
(6)A
(7)较多固体析出
(8)AC
18. 增大反应物的接触面积,使反应更快更充分 2C+SrCO3Sr+3CO↑ 增大氢氧化锶的溶解度 Mg(OH)2 BaSO4 降温 饱和 加快化学反应速率且防止NH4HCO3受热分解 解:化学反应前元素种类和质量守恒,设菱锶矿石的质量为x
答:需要菱锶矿石0.925t。
19. 分子不断运动 过滤 乳化 混合物 吸附 肥皂水 煮沸 序号为②③ 3CO+ Fe2O3 高温 2Fe + 3CO2 氧气(O2) 和水(H2O) 涂油 铝的表面有一层致密的氧化膜保护内部不被腐蚀 气体受热膨胀,分子间隔变大,导致爆胎 压强降低CO2溶解度变小 D C2H5OH B
20.(1)降温结晶
(2)升高温度同时加入A溶质
(3)c
21. NaCl 小于 (重)结晶 加KNO3 (固体)(或蒸发水分,或降低温度) B
22. 煮沸 4.5 C2H2 60 C>B>A 20% A
答案第1页,共2页
答案第1页,共2页
同课章节目录
