第五单元定量研究化学反应达标检测卷--2021-2022学年九年级化学鲁教版上册(word版 含答案)
文档属性
| 名称 | 第五单元定量研究化学反应达标检测卷--2021-2022学年九年级化学鲁教版上册(word版 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 351.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 00:00:00 | ||
图片预览


文档简介
第五单元达标检测卷
(100分,60分钟)
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 S—32
一、选择题(每小题3分,共30分)
1.硝酸铅[Pb(NO3)2]受热分解的化学方程式为2Pb(NO3)22PbO+4X↑+O2↑,则X的化学式为( )
A.NO B.N2 C.NO2 D.N2O5
2.下列化学方程式中书写正确的是( )
A.Mg+O2MgO2 B.H2O2H2↑+O2↑
C.4P+5O22P2O5 D.4Fe+3O22Fe2O3
3.铜在空气中锈蚀会生成铜绿[主要成分为Cu2(OH)2CO3],Cu2(OH)2CO3加热分解后不可能生成的物质是( )
A.CuO B.H2O C.SO2 D.CO2
4.下列对质量守恒定律的理解,正确的是( )
A.将5 g铁和5 g铜混合后物质的总质量为10 g,遵守质量守恒定律
B.5 g硫和5 g氧气恰好完全反应,生成二氧化硫10 g
C.化学反应前后分子的总数一定不发生变化
D.纸张燃烧后质量减少,不遵循质量守恒定律
5.宏观、微观、符号相结合是化学学科特有的思维方式,下图是某反应的微观示意图,有关说法正确的是( )
A.物质甲和乙均由氧、氢两种元素组成
B.物质丙中碳、氧两种元素的质量比为3:4
C.物质丁由两个原子构成
D.该反应前后分子和原子的种类、个数都没有发生变化
6.已知某密闭容器中,12 g A加热完全分解产生B和C,其中B的质量为2 g,同时C又能部分分解产生0.1 g D和7.9 g E,则最终该密闭容器中B和C的质量比为( )
A.1:1 B.1:2 C.1:4 D.1:5
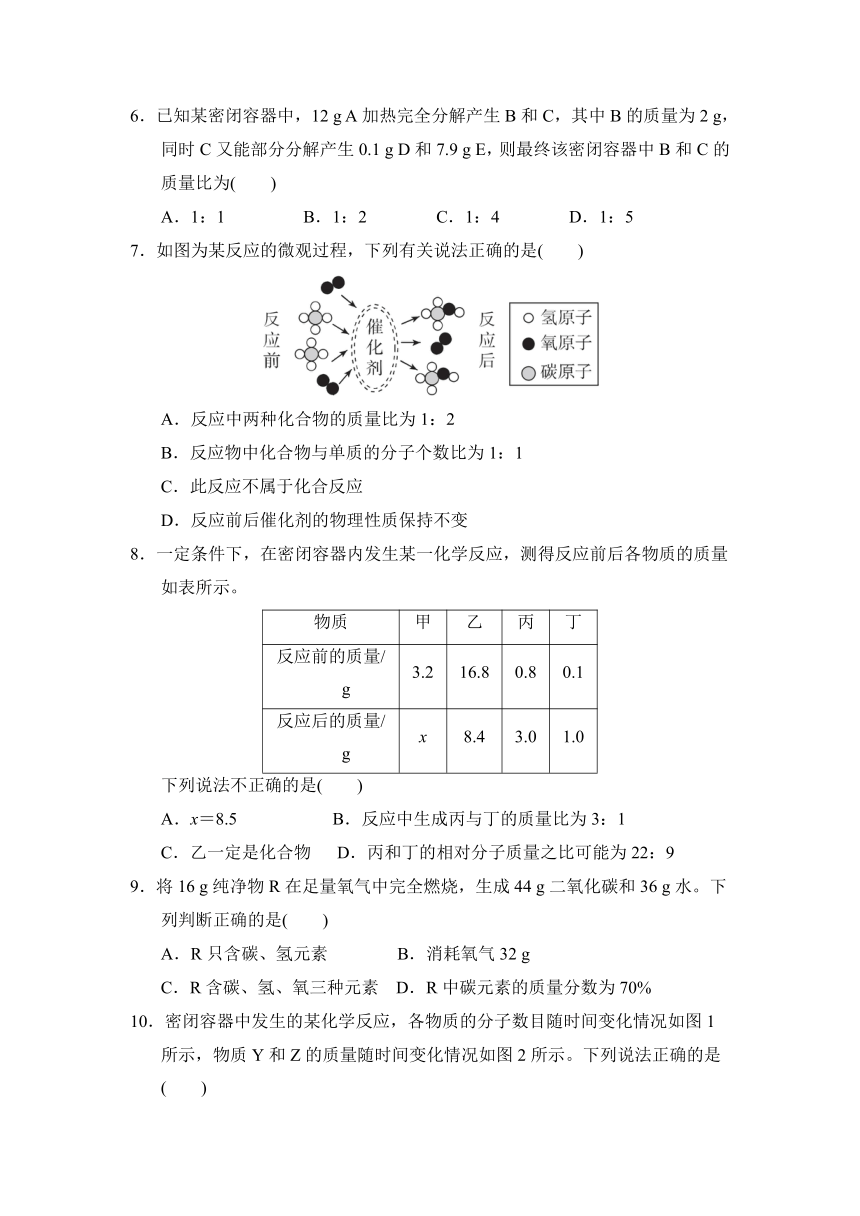
7.如图为某反应的微观过程,下列有关说法正确的是( )
A.反应中两种化合物的质量比为1:2
B.反应物中化合物与单质的分子个数比为1:1
C.此反应不属于化合反应
D.反应前后催化剂的物理性质保持不变
8.一定条件下,在密闭容器内发生某一化学反应,测得反应前后各物质的质量如表所示。
物质 甲 乙 丙 丁
反应前的质量/ g 3.2 16.8 0.8 0.1
反应后的质量/ g x 8.4 3.0 1.0
下列说法不正确的是( )
A.x=8.5 B.反应中生成丙与丁的质量比为3:1
C.乙一定是化合物 D.丙和丁的相对分子质量之比可能为22:9
9.将16 g纯净物R在足量氧气中完全燃烧,生成44 g二氧化碳和36 g水。下列判断正确的是( )
A.R只含碳、氢元素 B.消耗氧气32 g
C.R含碳、氢、氧三种元素 D.R中碳元素的质量分数为70%
10.密闭容器中发生的某化学反应,各物质的分子数目随时间变化情况如图1所示,物质Y和Z的质量随时间变化情况如图2所示。下列说法正确的是( )
A.该反应前后分子总数保持不变
B.参加反应的X与Y的质量比为2:7
C.该反应的化学方程式可表示为2X+Y===Z
D.若Z的相对分子质量为17,则Y的相对分子质量为28
二、填空题(46分)
11.(4分)对知识的归纳与整理是学习自然科学的重要方法。现有如下三个化学反应:
①S+O2SO2 ②2CO+O22CO2
③3Fe+2O2Fe3O4
(1)通过比较可发现它们有许多相似之处。
其一,从基本反应类型看,都是化合反应;
其二,__________________________________________________________。
(2)请再写出符合上述两点要求的一个化学方程式:___________________________________________________________。
12.(6分)新型材料的研制与应用推动了现代高新技术的发展。氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大,熔点高,化学性质稳定。工业上制得氮化硅的化学反应方程式为aSi+bN2Si3N4,则a、b的数值分别为a=________,b=________。
13.(8分)以柴油为燃料的汽车加装尿素箱可使尾气排放达“国四”标准,其工作原理如下。
(1)将尿素溶液均匀喷入热的尾气中,并释放出氨气,其反应方程式为CO(NH2)2+X===CO2+2NH3,则X的化学式为________。
(2)在催化剂的作用下,氨气使尾气中的氮氧化物快速转化成无害的氮气和水蒸气,水蒸气可吸收尾气中的烟尘,减少PM2.5排放。请写出氨气和N2O反应的化学方程式:______________________________。
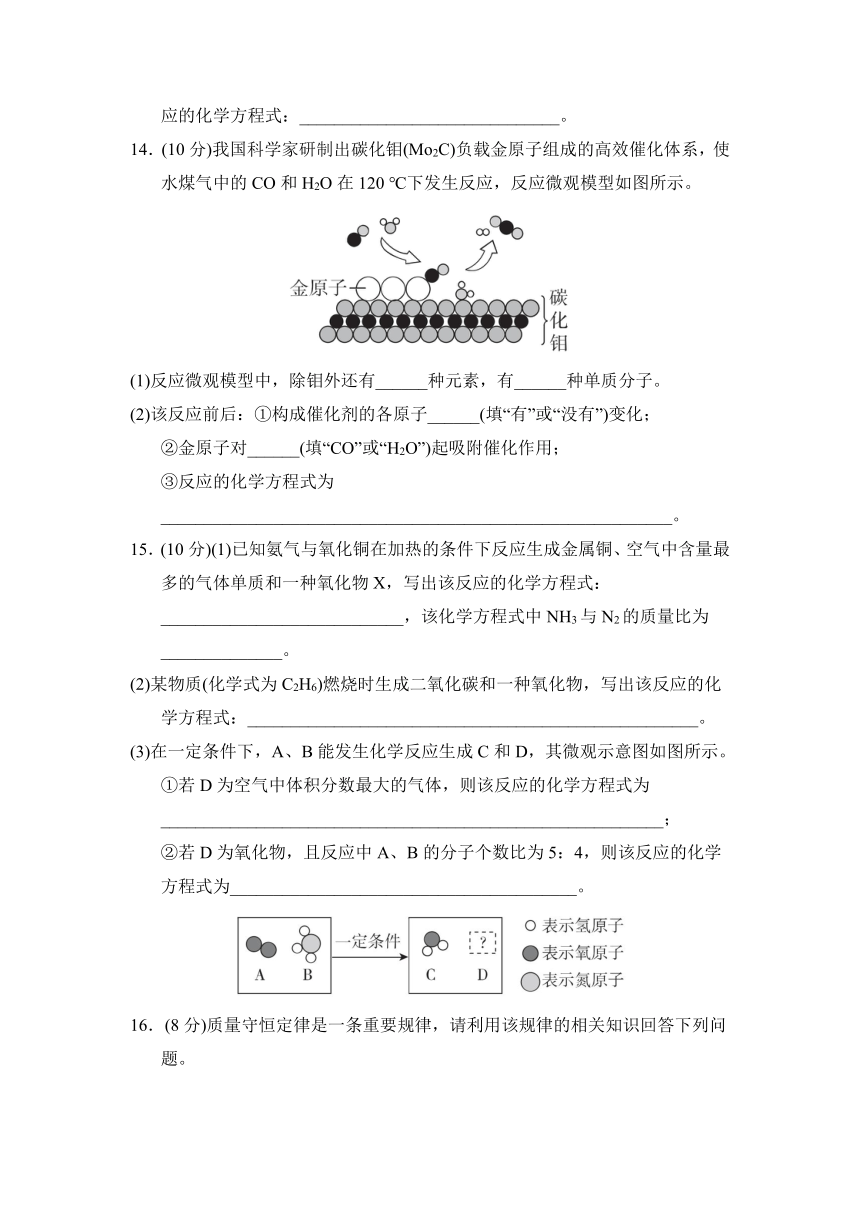
14.(10分)我国科学家研制出碳化钼(Mo2C)负载金原子组成的高效催化体系,使水煤气中的CO和H2O在120 ℃下发生反应,反应微观模型如图所示。
(1)反应微观模型中,除钼外还有______种元素,有______种单质分子。
(2)该反应前后:①构成催化剂的各原子______(填“有”或“没有”)变化;
②金原子对______(填“CO”或“H2O”)起吸附催化作用;
③反应的化学方程式为___________________________________________________________。
15.(10分)(1)已知氨气与氧化铜在加热的条件下反应生成金属铜、空气中含量最多的气体单质和一种氧化物X,写出该反应的化学方程式:____________________________,该化学方程式中NH3与N2的质量比为______________。
(2)某物质(化学式为C2H6)燃烧时生成二氧化碳和一种氧化物,写出该反应的化学方程式:____________________________________________________。
(3)在一定条件下,A、B能发生化学反应生成C和D,其微观示意图如图所示。
①若D为空气中体积分数最大的气体,则该反应的化学方程式为__________________________________________________________;
②若D为氧化物,且反应中A、B的分子个数比为5:4,则该反应的化学方程式为________________________________________。
16.(8分)质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题。
(1)化学反应前后肯定没有变化的是________(填字母序号)。
①原子数目 ②分子数目 ③元素种类 ④物质种类 ⑤原子种类 ⑥物质的总质量
A.①④⑥ B.①③⑤⑥ C.①②⑥ D.②③⑤
(2)镁条在空气中完全燃烧后生成氧化镁(只考虑氧气参加反应,下同),化学方程式为____________________________________________________,若固体质量变化用图甲表示,则m2与m1之差表示____________________的质量。
(3)实验过程中,镁条点燃后实验现象如图乙所示,镁条完全燃烧后,称量得知石棉网上留下的固体质量比反应前镁条还轻,其原因可能是_____________________________________________________________。
三、探究实验题(16分)
17.某课外兴趣小组的同学设计了如图所示实验来验证质量守恒定律。
(1)图1实验中,发生反应的化学方程式为________________________________,图1实验过程中小气球的变化现象为______________________。
(2)已知碳酸钠粉末能和稀盐酸反应生成氯化钠、水和二氧化碳,图2实验________(填“能”或“不能”)验证质量守恒定律,原因是_____________________________________________________________。
(3)请从微观的角度解释反应前后质量相等的原因:________________________________________________________________________________________________________。
(4)将图2装置改成图3装置(气密性良好),将充分反应后的锥形瓶放回左盘,发现指针没有停在刻度盘中央,而是________(填“偏右”或“偏左”),你认为可能的原因是________________________________________________________________________________________________________________。
四、计算题(8分)
18.侯德榜成功研制了“侯氏制碱法”,打破了西方发达国家对我国制碱技术的封锁,为世界制碱工业做出了杰出贡献。某工厂为了测定用“侯氏制碱法”制得的碳酸钠样品中碳酸钠的质量分数,工厂技术员完成了如图所示的测定工作(不考虑其他因素对测定结果的影响,反应的化学方程式为2HCl+Na2CO3===2NaCl+H2O+CO2↑),请根据图中数据计算样品中碳酸钠的质量分数。(计算结果精确到0.1%)
答案
一、1.C 2.C
3.C 点拨:Cu2(OH)2CO3中含有铜、氧、氢、碳四种元素,由反应前后元素种类不变可知,可能生成CuO、H2O、CO2,不可能生成二氧化硫。故选C。
4.B 5.B 6.A
7.A 点拨:由微观反应示意图可知,该反应的化学方程式为2CH4+O22CH3OH。反应中两种化合物——甲烷和CH3OH的质量比为(16×2):(32×2)=1:2,A正确;反应物中化合物与单质的分子个数比为2:1,B错误;该反应是由两种物质反应生成另一种新物质,属于化合反应,C错误;在化学反应前后,催化剂的质量与化学性质没有改变,而物理性质可能改变,D错误。
8.B 点拨:x=3.2+16.8+0.8+0.1-1.0-3.0-8.4=8.5,A正确;反应中生成丙与丁的质量比为(3.0-0.8):(1.0-0.1)=22:9,B不正确;反应后乙质量减小,是反应物,甲、丙、丁反应后质量都增大,都是生成物,即乙分解生成甲、丙、丁,因此乙一定是化合物,C正确;若反应中丙、丁的化学计量数之比是1:1,则丙和丁的相对分子质量之比为22:9,D正确。
9.A 点拨:44 g CO2中含有碳元素的质量为44 g××100%=12 g,36 g水中含有氢元素的质量为36 g××100%=4 g,12 g+4 g=16 g,恰好等于纯净物R的质量,则该物质中一定含有碳、氢两种元素,一定不含氧元素,A正确;由质量守恒定律知,消耗氧气的质量为44 g+36 g-16 g=64 g,B错误;根据A选项的分析,该物质中一定含有碳、氢两种元素,一定不含氧元素,C错误;R中碳元素的质量分数为×100%=75%,D错误。
10.D 点拨:由图知,反应的化学方程式为3X+Y===2Z,故A、C错误;参加反应的Z、Y的质量比为17:14,若Z的相对分子质量为17,则Y的相对分子质量为28,D正确。
二、11.(1)从反应条件看都需要点燃(或从反应物上看都是物质与氧气反应,从化学反应的能量变化看都是放热反应等,合理即可)
(2)4P + 5O22P2O5(或C+O2CO2,合理即可)
12.3;2
13.(1)H2O (2)2NH3+3N2O3H2O+4N2
14.(1)4;1 (2)①没有 ②CO ③CO+H2OCO2+H2
15.(1)2NH3+3CuO3Cu+N2+3H2O;17:14
(2)2C2H6+7O24CO2+6H2O
(3)①4NH3+3O22N2+6H2O
②4NH3+5O26H2O+4NO
16.(1)B (2)2Mg+O22MgO;参加反应的氧气
(3)部分生成物逸散到空气中去了
三、17.(1)4P+5O22P2O5;先胀大后变瘪
(2)不能;反应生成的二氧化碳逸出
(3)化学反应前后原子的种类、数目和质量没有发生改变
(4)偏右;气球膨胀,所受浮力增大
四、18.解:生成二氧化碳的质量为378.5 g-376.3 g=2.2 g。
设参加反应的碳酸钠的质量为x。
2HCl+Na2CO3===2NaCl+H2O+CO2↑
106 44
x 2.2 g
=
x=5.3 g
所以样品中Na2CO3的质量分数是×100%≈96.4%
答:样品中纯碱的质量分数是96.4%。
(100分,60分钟)
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 S—32
一、选择题(每小题3分,共30分)
1.硝酸铅[Pb(NO3)2]受热分解的化学方程式为2Pb(NO3)22PbO+4X↑+O2↑,则X的化学式为( )
A.NO B.N2 C.NO2 D.N2O5
2.下列化学方程式中书写正确的是( )
A.Mg+O2MgO2 B.H2O2H2↑+O2↑
C.4P+5O22P2O5 D.4Fe+3O22Fe2O3
3.铜在空气中锈蚀会生成铜绿[主要成分为Cu2(OH)2CO3],Cu2(OH)2CO3加热分解后不可能生成的物质是( )
A.CuO B.H2O C.SO2 D.CO2
4.下列对质量守恒定律的理解,正确的是( )
A.将5 g铁和5 g铜混合后物质的总质量为10 g,遵守质量守恒定律
B.5 g硫和5 g氧气恰好完全反应,生成二氧化硫10 g
C.化学反应前后分子的总数一定不发生变化
D.纸张燃烧后质量减少,不遵循质量守恒定律
5.宏观、微观、符号相结合是化学学科特有的思维方式,下图是某反应的微观示意图,有关说法正确的是( )
A.物质甲和乙均由氧、氢两种元素组成
B.物质丙中碳、氧两种元素的质量比为3:4
C.物质丁由两个原子构成
D.该反应前后分子和原子的种类、个数都没有发生变化
6.已知某密闭容器中,12 g A加热完全分解产生B和C,其中B的质量为2 g,同时C又能部分分解产生0.1 g D和7.9 g E,则最终该密闭容器中B和C的质量比为( )
A.1:1 B.1:2 C.1:4 D.1:5
7.如图为某反应的微观过程,下列有关说法正确的是( )
A.反应中两种化合物的质量比为1:2
B.反应物中化合物与单质的分子个数比为1:1
C.此反应不属于化合反应
D.反应前后催化剂的物理性质保持不变
8.一定条件下,在密闭容器内发生某一化学反应,测得反应前后各物质的质量如表所示。
物质 甲 乙 丙 丁
反应前的质量/ g 3.2 16.8 0.8 0.1
反应后的质量/ g x 8.4 3.0 1.0
下列说法不正确的是( )
A.x=8.5 B.反应中生成丙与丁的质量比为3:1
C.乙一定是化合物 D.丙和丁的相对分子质量之比可能为22:9
9.将16 g纯净物R在足量氧气中完全燃烧,生成44 g二氧化碳和36 g水。下列判断正确的是( )
A.R只含碳、氢元素 B.消耗氧气32 g
C.R含碳、氢、氧三种元素 D.R中碳元素的质量分数为70%
10.密闭容器中发生的某化学反应,各物质的分子数目随时间变化情况如图1所示,物质Y和Z的质量随时间变化情况如图2所示。下列说法正确的是( )
A.该反应前后分子总数保持不变
B.参加反应的X与Y的质量比为2:7
C.该反应的化学方程式可表示为2X+Y===Z
D.若Z的相对分子质量为17,则Y的相对分子质量为28
二、填空题(46分)
11.(4分)对知识的归纳与整理是学习自然科学的重要方法。现有如下三个化学反应:
①S+O2SO2 ②2CO+O22CO2
③3Fe+2O2Fe3O4
(1)通过比较可发现它们有许多相似之处。
其一,从基本反应类型看,都是化合反应;
其二,__________________________________________________________。
(2)请再写出符合上述两点要求的一个化学方程式:___________________________________________________________。
12.(6分)新型材料的研制与应用推动了现代高新技术的发展。氮化硅(Si3N4)是一种高温陶瓷材料,它的硬度大,熔点高,化学性质稳定。工业上制得氮化硅的化学反应方程式为aSi+bN2Si3N4,则a、b的数值分别为a=________,b=________。
13.(8分)以柴油为燃料的汽车加装尿素箱可使尾气排放达“国四”标准,其工作原理如下。
(1)将尿素溶液均匀喷入热的尾气中,并释放出氨气,其反应方程式为CO(NH2)2+X===CO2+2NH3,则X的化学式为________。
(2)在催化剂的作用下,氨气使尾气中的氮氧化物快速转化成无害的氮气和水蒸气,水蒸气可吸收尾气中的烟尘,减少PM2.5排放。请写出氨气和N2O反应的化学方程式:______________________________。
14.(10分)我国科学家研制出碳化钼(Mo2C)负载金原子组成的高效催化体系,使水煤气中的CO和H2O在120 ℃下发生反应,反应微观模型如图所示。
(1)反应微观模型中,除钼外还有______种元素,有______种单质分子。
(2)该反应前后:①构成催化剂的各原子______(填“有”或“没有”)变化;
②金原子对______(填“CO”或“H2O”)起吸附催化作用;
③反应的化学方程式为___________________________________________________________。
15.(10分)(1)已知氨气与氧化铜在加热的条件下反应生成金属铜、空气中含量最多的气体单质和一种氧化物X,写出该反应的化学方程式:____________________________,该化学方程式中NH3与N2的质量比为______________。
(2)某物质(化学式为C2H6)燃烧时生成二氧化碳和一种氧化物,写出该反应的化学方程式:____________________________________________________。
(3)在一定条件下,A、B能发生化学反应生成C和D,其微观示意图如图所示。
①若D为空气中体积分数最大的气体,则该反应的化学方程式为__________________________________________________________;
②若D为氧化物,且反应中A、B的分子个数比为5:4,则该反应的化学方程式为________________________________________。
16.(8分)质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题。
(1)化学反应前后肯定没有变化的是________(填字母序号)。
①原子数目 ②分子数目 ③元素种类 ④物质种类 ⑤原子种类 ⑥物质的总质量
A.①④⑥ B.①③⑤⑥ C.①②⑥ D.②③⑤
(2)镁条在空气中完全燃烧后生成氧化镁(只考虑氧气参加反应,下同),化学方程式为____________________________________________________,若固体质量变化用图甲表示,则m2与m1之差表示____________________的质量。
(3)实验过程中,镁条点燃后实验现象如图乙所示,镁条完全燃烧后,称量得知石棉网上留下的固体质量比反应前镁条还轻,其原因可能是_____________________________________________________________。
三、探究实验题(16分)
17.某课外兴趣小组的同学设计了如图所示实验来验证质量守恒定律。
(1)图1实验中,发生反应的化学方程式为________________________________,图1实验过程中小气球的变化现象为______________________。
(2)已知碳酸钠粉末能和稀盐酸反应生成氯化钠、水和二氧化碳,图2实验________(填“能”或“不能”)验证质量守恒定律,原因是_____________________________________________________________。
(3)请从微观的角度解释反应前后质量相等的原因:________________________________________________________________________________________________________。
(4)将图2装置改成图3装置(气密性良好),将充分反应后的锥形瓶放回左盘,发现指针没有停在刻度盘中央,而是________(填“偏右”或“偏左”),你认为可能的原因是________________________________________________________________________________________________________________。
四、计算题(8分)
18.侯德榜成功研制了“侯氏制碱法”,打破了西方发达国家对我国制碱技术的封锁,为世界制碱工业做出了杰出贡献。某工厂为了测定用“侯氏制碱法”制得的碳酸钠样品中碳酸钠的质量分数,工厂技术员完成了如图所示的测定工作(不考虑其他因素对测定结果的影响,反应的化学方程式为2HCl+Na2CO3===2NaCl+H2O+CO2↑),请根据图中数据计算样品中碳酸钠的质量分数。(计算结果精确到0.1%)
答案
一、1.C 2.C
3.C 点拨:Cu2(OH)2CO3中含有铜、氧、氢、碳四种元素,由反应前后元素种类不变可知,可能生成CuO、H2O、CO2,不可能生成二氧化硫。故选C。
4.B 5.B 6.A
7.A 点拨:由微观反应示意图可知,该反应的化学方程式为2CH4+O22CH3OH。反应中两种化合物——甲烷和CH3OH的质量比为(16×2):(32×2)=1:2,A正确;反应物中化合物与单质的分子个数比为2:1,B错误;该反应是由两种物质反应生成另一种新物质,属于化合反应,C错误;在化学反应前后,催化剂的质量与化学性质没有改变,而物理性质可能改变,D错误。
8.B 点拨:x=3.2+16.8+0.8+0.1-1.0-3.0-8.4=8.5,A正确;反应中生成丙与丁的质量比为(3.0-0.8):(1.0-0.1)=22:9,B不正确;反应后乙质量减小,是反应物,甲、丙、丁反应后质量都增大,都是生成物,即乙分解生成甲、丙、丁,因此乙一定是化合物,C正确;若反应中丙、丁的化学计量数之比是1:1,则丙和丁的相对分子质量之比为22:9,D正确。
9.A 点拨:44 g CO2中含有碳元素的质量为44 g××100%=12 g,36 g水中含有氢元素的质量为36 g××100%=4 g,12 g+4 g=16 g,恰好等于纯净物R的质量,则该物质中一定含有碳、氢两种元素,一定不含氧元素,A正确;由质量守恒定律知,消耗氧气的质量为44 g+36 g-16 g=64 g,B错误;根据A选项的分析,该物质中一定含有碳、氢两种元素,一定不含氧元素,C错误;R中碳元素的质量分数为×100%=75%,D错误。
10.D 点拨:由图知,反应的化学方程式为3X+Y===2Z,故A、C错误;参加反应的Z、Y的质量比为17:14,若Z的相对分子质量为17,则Y的相对分子质量为28,D正确。
二、11.(1)从反应条件看都需要点燃(或从反应物上看都是物质与氧气反应,从化学反应的能量变化看都是放热反应等,合理即可)
(2)4P + 5O22P2O5(或C+O2CO2,合理即可)
12.3;2
13.(1)H2O (2)2NH3+3N2O3H2O+4N2
14.(1)4;1 (2)①没有 ②CO ③CO+H2OCO2+H2
15.(1)2NH3+3CuO3Cu+N2+3H2O;17:14
(2)2C2H6+7O24CO2+6H2O
(3)①4NH3+3O22N2+6H2O
②4NH3+5O26H2O+4NO
16.(1)B (2)2Mg+O22MgO;参加反应的氧气
(3)部分生成物逸散到空气中去了
三、17.(1)4P+5O22P2O5;先胀大后变瘪
(2)不能;反应生成的二氧化碳逸出
(3)化学反应前后原子的种类、数目和质量没有发生改变
(4)偏右;气球膨胀,所受浮力增大
四、18.解:生成二氧化碳的质量为378.5 g-376.3 g=2.2 g。
设参加反应的碳酸钠的质量为x。
2HCl+Na2CO3===2NaCl+H2O+CO2↑
106 44
x 2.2 g
=
x=5.3 g
所以样品中Na2CO3的质量分数是×100%≈96.4%
答:样品中纯碱的质量分数是96.4%。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
