9.1认识溶液综合训练—2021~2022学年九年级化学京改版(2013)下册(word版 含解析)
文档属性
| 名称 | 9.1认识溶液综合训练—2021~2022学年九年级化学京改版(2013)下册(word版 含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 130.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-03-24 17:38:48 | ||
图片预览

文档简介
9.1 认识溶液
一、选择题(共16题)
1.下列有关溶液的说法正确的是( )
A.溶液一定是无色、透明的混合物 B.无色澄清液体一定是溶液
C.只有固体能作溶质 D.溶液的各部分性质均相同
2.下列物质能溶于水形成溶液的是( )
A.酒精 B.豆油 C.沙子 D.碘
3.下列几种溶液中,溶剂相同的是( )
①碘酒 ②糖水 ③70%的酒精 ④稀硫酸
A.①③
B.②④
C.①②③
D.②③④
4.某初三年级的同学正在筹备毕业晚会,预定有以下饮料,其中不属于溶液的是
A.啤酒 B.酸奶 C.矿泉水 D.可口可乐
5.下列清洗方法中,利用乳化原理的是
A.用自来水洗手 B.用汽油溶解油污
C.用洗涤剂清洗餐具 D.用盐酸清除试剂瓶壁上的碳酸钙
6.以下物质不属于溶液的是( )
A.食盐水 B.医用酒精 C.冰水混合物 D.碘酒
7.把少量下列物质分别放入水中,充分搅拌,可以得到溶液
A.汽油 B.面粉 C.蔗糖 D.牛奶
8.下列关于溶液说法不正确的是
A.溶质可以是气体、液体也可以是固体 B.最常见的溶剂是水
C.溶液的体积等于溶质与溶液的体积之和 D.溶液的质量等于溶质的质量与溶剂的质量之和
9.市场上有一种俗称“摇摇冰”的罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动使它们混合,罐内饮料温度就会降低。这种固体物质可能是
A.蔗糖 B.氢氧化钠 C.硝酸铵 D.氯化钠
10.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是
A.花生油 B.面粉 C.汽油 D.酒精
11.欲使80g10%的食盐溶液变成20%,可采用的方法是( )
A.将溶剂蒸发掉36g B.将溶剂蒸发掉40g
C.加入80g10%的食盐溶液 D.加入8g食盐
12.下面利用化学知识对有关事实的解释,其中正确的是
A.活性炭净水 降低水中Ca2+、Mg2+含量
B.水可以灭火 降低可燃物的着火点
C.洗涤剂能洗去衣服油污 洗涤剂能乳化油污
D.氯化钠溶解于水后“消失”不见了 氯化钠分子是不断运动的
13.下列实验设计能达到实验目的的是
选项 A B C D
实验设计
实验目的 用硝酸钾和水验证质量守恒定律 探究蜡烛中是否含有碳元素 探究碘的溶解性是否与溶剂种类有关 探究二氧化碳能否与水反应
A.A B.B C.C D.D
14.某同学配制氯化钠溶液的溶质质量分数偏小,可能的原因是( )
A.天平平衡后,砝码放左盘,氯化钠放右盘,游码在零处
B.溶解时烧杯内壁有水珠
C.装瓶时有少量溶液洒出
D.用生锈砝码称量
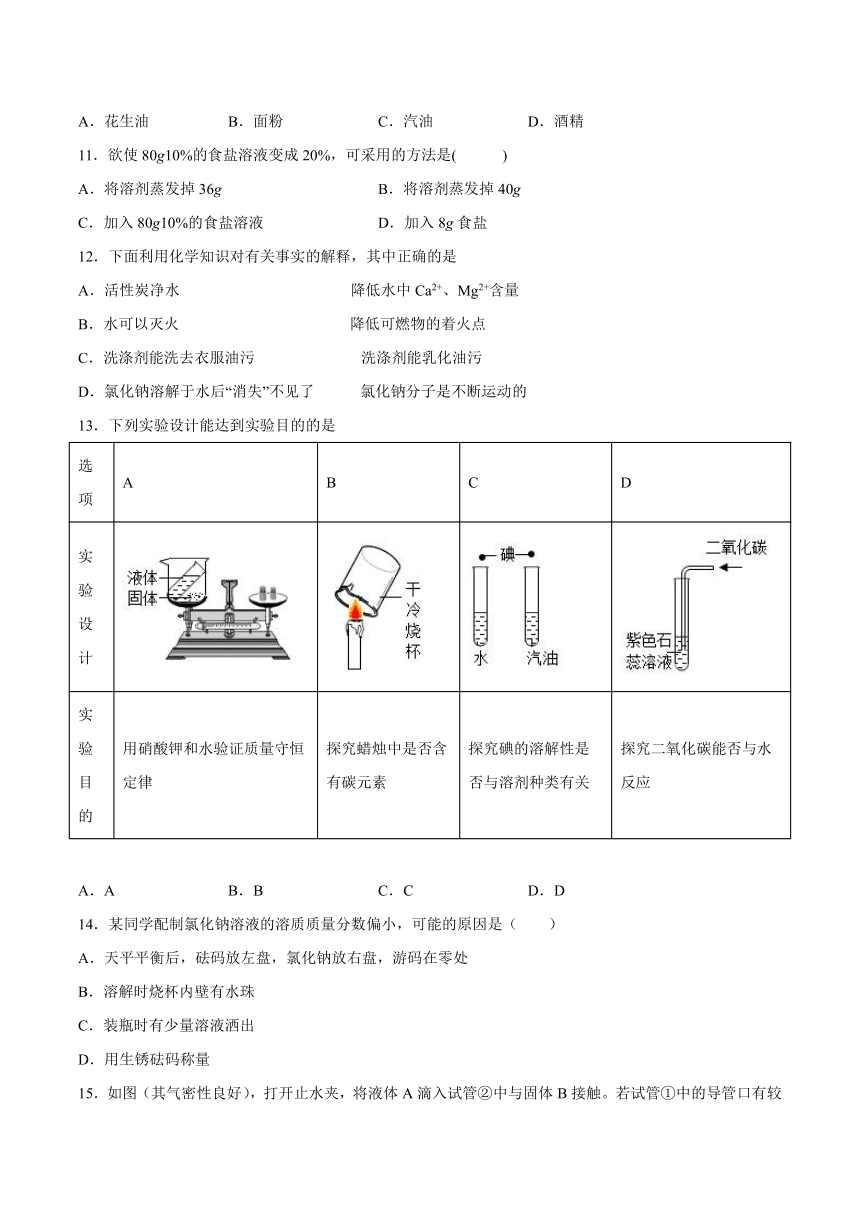
15.如图(其气密性良好),打开止水夹,将液体A滴入试管②中与固体B接触。若试管①中的导管口有较多气泡产生,则液体A和固体B的组合可能是
A.氯化钠和水 B.硝酸铵和水 C.氢氧化钠和水 D.铜和稀硫酸
16.物质的鉴别是重要的实验技能,下列实验方案正确的是
选项 实验目的 实验方案
A 鉴别AgNO3 和Na2SO4 固体 取样,加水溶解,滴加 BaCl2 溶液,观察是否有白色沉淀
B 鉴别NH4Cl 和尿素 取样,加入熟石灰粉末、研磨、闻气味
C 鉴别蔗糖和食盐 分别取样加水溶解,观察溶液颜色
D 鉴别CuO 粉末和木炭粉 观察颜色
A.A B.B C.C D.D
二、综合题(共6题)
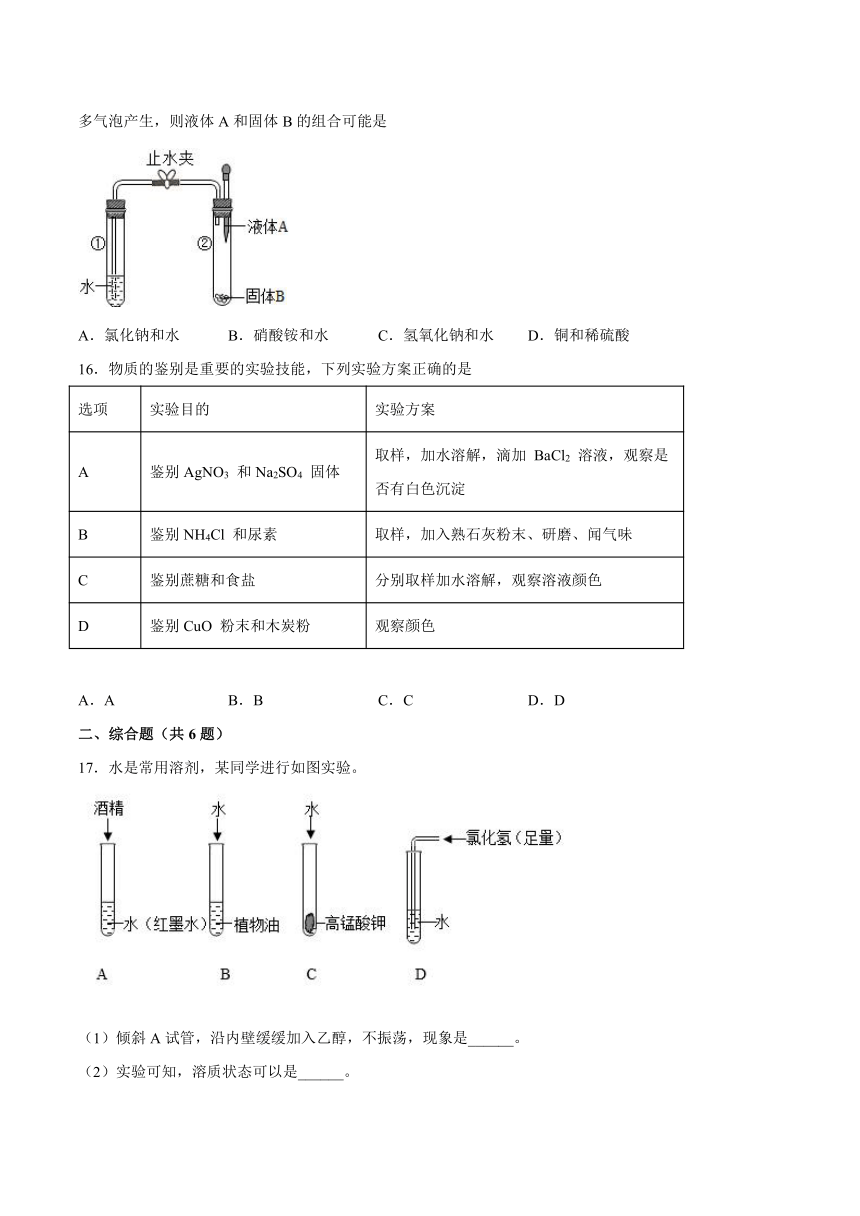
17.水是常用溶剂,某同学进行如图实验。
(1)倾斜A试管,沿内壁缓缓加入乙醇,不振荡,现象是______。
(2)实验可知,溶质状态可以是______。
(3)实验结束后,用洗涤剂洗净B试管,原理是______。
(4)C、D试管的废液倒入废液缸中产生了黄绿色气体,查阅资料可知: ,X的化学式为______。
(5)询问老师得知用可处理Cl2,根据化学方程式计算,处理0.142gCl2至少需NaOH的质量是多少______?
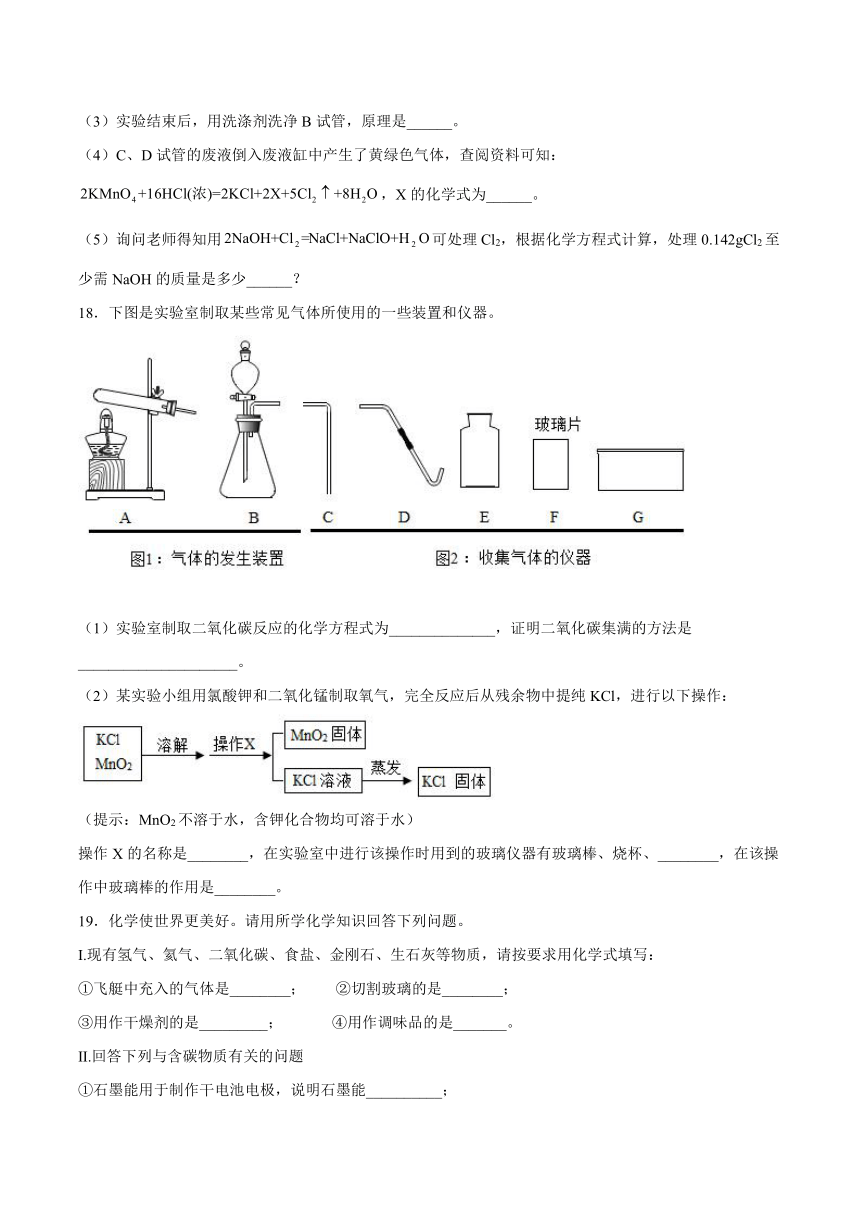
18.下图是实验室制取某些常见气体所使用的一些装置和仪器。
(1)实验室制取二氧化碳反应的化学方程式为______________,证明二氧化碳集满的方法是_____________________。
(2)某实验小组用氯酸钾和二氧化锰制取氧气,完全反应后从残余物中提纯KCl,进行以下操作:
(提示:MnO2不溶于水,含钾化合物均可溶于水)
操作X的名称是________,在实验室中进行该操作时用到的玻璃仪器有玻璃棒、烧杯、________,在该操作中玻璃棒的作用是________。
19.化学使世界更美好。请用所学化学知识回答下列问题。
Ⅰ.现有氢气、氦气、二氧化碳、食盐、金刚石、生石灰等物质,请按要求用化学式填写:
①飞艇中充入的气体是________; ②切割玻璃的是________;
③用作干燥剂的是_________; ④用作调味品的是_______。
Ⅱ.回答下列与含碳物质有关的问题
①石墨能用于制作干电池电极,说明石墨能__________;
②制糖工业中利用活性炭的__________性脱色制白糖;
③CO2通入汽水中可制作碳酸饮料,反应的化学方程式______________;
④炼铁时发生反应:,其中____做还原剂;
⑤在2Mg+CO22MgO+C中,反应前后碳元素的存在形态由_____(填编号)。
A.游离态到化合态 B. 化合态到游离态
Ⅲ. 某病人注射用的生理盐水(含0.85~0.90%的氯化钠)中添加了适量的葡萄糖(C6H12O6)以补充能量。该注射液中的溶质为_____;葡萄糖分子中碳,氢,氧元素的质量之比是______;1个葡萄糖分子中共含___________个原子;葡萄糖中质量分数最高是____元素;1mol 该葡萄糖中约含有___________个葡萄糖分子;
20.牙膏中常用的摩擦剂有碳酸钙粉末。用含碳酸钙90%的石灰石作为原料,制得碳酸钙粉末(杂质不参与反应),生产流程如下:
① 氧化钙的俗名是 _______ 。
② 石灰乳属于 __________ 。
A.悬浊液 B.乳浊液 C.溶液
③ 步骤II包含的操作名称是 ______________ 。
④ 请写出上述流程中发生化合反应的化学方程式 ___________________ 。
⑤ 理论上得到碳酸钙质量 ______ (选填“>”“<”或“=”)石灰石中碳酸钙的质量。
⑥ 上述过程中如产生9mol二氧化碳,则消耗该石灰石的质量为多少g? __________ (根据化学方程式列式计算)
21.用下图所示装置验证CO2能与NaOH溶液发生化学反应。推注射器活塞向充满CO2的集气瓶中注入过量的20% NaOH溶液,振荡集气瓶后打开止水夹(已知:Na2CO3 + CaCl2 = 2NaCl + CaCO3↓)。
(1)打开止水夹后观察到的现象是_____。
(2)反应后将集气瓶中的混合物过滤,所得滤液中除CaCl2外,还存在的溶质有_____。
22.有限的元素可组成种类繁多的物质。依据表中的元素回答下列问题。
元素名称 氢 碳 氧 氯 钙 铁
元素符号 H C O Cl Ca Fe
(1)若某种物质常用作食品干燥剂,该物质的俗称是______。
(2)在我们目前所学知识范围内,若两种氧化物发生还原反应,则这两种氧化物的化学式是________。
(3)二氧化碳是一种宝贵资源,在高温高压下,它和一种密度最小的气体反应会生成水,同时还得到一种气体(该气体为天然气中最主要的成分),试写出该反应的方程式________。
(4)甲、乙、丙、丁、戊是初中化学常见的物质,其中丁是大理石的主要成分,乙的固体俗称干冰,它们之间部分转化关系如图所示。(“→”表示某种物质经一步反应可转化成另一种物质,“一”表示两种物质能发生化学反应)关于上述的反应,有如下说法,其中正确的是 。
A.丙和戊的反应放热 B.甲乙丙三物质一定含有相同元素
C.甲可能具有可燃性 D.丁→乙和丁→戊的反应基本类型一定相同
试卷第1页,共3页
参考答案:
1.D
【详解】
A、溶液不一定是无色的,如硫酸铜溶液是蓝色的,错误;B、无色澄清液体不一定是溶液,如水是无色澄清液体,不是溶液;错误;C、溶质可以是固体,也可以是液体和气体,如水可以溶解蔗糖和食盐,也可以溶解酒精、二氧化碳等,错误;D、溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,各部分性质均相同;正确。故选D。
2.A
【详解】
A、酒精能与水以任意比例混溶,能形成均一、稳定的溶液,符合题意;
B、豆油不溶于水,只能以小液滴的形成悬浮于液体里,形成乳浊液,不符合题意;
C、沙子不溶于水,只能以固体小颗粒的形式悬浮于液体里,形成悬浊液,不符合题意;
D、碘不溶于水,只能以固体小颗粒的形式悬浮于液体里,形成悬浊液,不符合题意。
故选A。
3.D
【详解】
①碘酒中碘是溶质,酒精是溶剂;②糖水中糖是溶质,水是溶剂;③70%的酒精中溶质是酒精,溶剂是水;④稀硫酸中溶质是硫酸,溶剂是水。
4.B
【详解】
A、啤酒是在水中溶解了酒精等多种物质,长期放置不会分层,符合溶液的特点,选项A不符合题意。
B、酸奶属于混合物,但长期放置会分层。即它不具有均一、稳定的特点。不属于溶液,选项B符合题意。
C、矿泉水是由一些可溶解的矿物质溶解于水形成的,符合溶液的特点,选项C不符合题意。
D、可口可乐是由一些可溶解于水的色素、糖类等物质溶解于水形成的混合物,符合溶液的特点,选项D不符合题意。
故选:B。
5.C
【详解】
试题分析:用洗涤剂清洗餐具,能有效的去除污渍,是利用洗涤剂的乳化功能,用汽油溶解油污是利用二者互相溶解形成溶液,然后便于清洗,用盐酸清除试剂瓶壁上的碳酸钙是利用二者的反应,去掉了碳酸钙。故选C.
6.C
【详解】
A、食盐水是均一、稳定的混合物,属于溶液,故不符合题意;
B、医用酒精是均一、稳定的混合物,属于溶液,故不符合题意;
C、冰水混合物是由水一种物质组成,属于纯净物,不是溶液,故符合题意;
D、碘酒是均一、稳定的混合物,属于溶液,故不符合题意。
故选C。
7.C
【详解】
A. 汽油以油滴的形式分散在水中,形成的是乳浊液,不符合题意;
B. 面粉以固体颗粒分散在水中,形成的是悬浊液,不符合题意;
C. 蔗糖以分子形式分散在水分子,形成的是均一、稳定的溶液,符合题意;
D. 牛奶不是均一稳定的混合物,不是溶液,不符合题意。故选C。
8.C
【详解】
A、溶质可以是气体、液体也可以是固体,正确;B、最常见的溶剂是水,正确;C、由于微粒间存在间隔,体积之间不能相加减,错误;D、溶液的质量等于溶质的质量与溶剂的质量之和,正确。故选C。
9.C
【详解】
A、蔗糖溶于水后温度几乎不变,选项错误;B、氢氧化钠溶于水时放出大量的热量,温度升高,选项错误;C、硝酸铵溶于水时吸收大量热量,可以使罐内饮料温度明显降低,选项正确;D、氯化钠溶于水时无明显的吸热放热现象,选项错误。故本题选C。
10.D
【详解】
A、花生油不溶于水,放入水中,充分搅拌,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项错误。
B、面粉不溶于水,放入水中,充分搅拌,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项错误。
C、汽油不溶于水,放入水中,充分搅拌,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项错误。
D、酒精易溶于水,放入水中,充分搅拌,形成均一、稳定的混合物,能够形成溶液,故选项正确。
故选:D。
11.B
【详解】
A、溶质质量是80g×10%=8g,溶剂蒸发掉36g后溶液质量是80g-36g=44g,所以溶质质量分数是:×100%=18.2%,不符合题意;B、溶质质量是80g×10%=8g,溶剂蒸发掉40g后溶液质量是80g-40g=40g,所以溶质质量分数是:×100%=20%,符合题意;C、质量分数相同的溶液混合后,质量分数不变,不符合题意;D、溶质质量是80g×10%+8g=16g,加入8g食盐后溶液质量是80g+8g=88g,所以溶质质量分数是:×100%=18.2%,不符合题意。故选B。
12.C
【详解】
A、活性炭具有疏松多孔的结构,能把杂质和色素等吸附在表面,活性炭起吸附作用,活性炭不能吸附水中Ca2+、Mg2+含量,故无法降低水中Ca2+、Mg2+含量,此选项错误;
B、水能灭火,利用的是水汽化吸热,使温度降到着火点以下,而不是降低可燃物的着火点,此选项错误;
C、洗涤剂清洗油污,利用其乳化作用,洗涤剂能将油污在水中分散成细小的液滴,不聚成较大的油珠,从而随水流走,此选项正确;
D、氯化钠溶解于水后“消失”不见了,是因为钠离子和氯离子是在不断的运动的,运动到水分子中间去了,此选项错误。
故选C。
13.C
【详解】
A、硝酸钾不与水反应,不能用来验证质量守恒定律,故A错误;
B、在燃着的蜡烛上方罩一个干冷烧杯,有水雾出现,说明蜡烛燃烧生成了水,说明蜡烛中含有氢元素,故B错误;
C、图中溶剂种类不同,其它因素相同,可以探究碘的溶解性是否与溶剂种类有关,故C正确;
D、将二氧化碳通入紫色石蕊试液中,溶液变红,不能说明二氧化碳与水发生了反应,还应设计对照实验证明二氧化碳不能使紫色石蕊试液变红,故D错误。
故选C。
14.B
【详解】
A、天平平衡后,砝码放左盘,氯化钠放右盘,游码在零处,不影响实际所取的溶质的质量,溶质质量分数不变,故选项A错误。
B、溶解时烧杯内壁有水珠,会造成实际所取的水的体积偏大,则使溶质质量分数偏小,故选项B正确。
C、装瓶时有少量溶液洒出,有液体溅出,溶液具有均一性,溶质质量分数不变,故选项C错误。
D、用生锈砝码称量,会造成实际所取的溶质的质量偏大,则使溶质质量分数偏大,故选项D错误。
故选B。
15.C
【详解】
A、氯化钠和水不反应,且氯化钠溶于水没有明显吸热或放热的现象,故无法观察到有明显现象,A不符合题意;
B、硝酸铵和水不反应,且硝酸铵溶于水会吸热,导致装置内气压减小,会导致②中气压减小,①中试管内的水会进入导管中,观察到导管中液面升高,B不符合题意;
C、氢氧化钠和水不反应,但氢氧化钠溶于水会放热,导致装置内气压增大,会导致②中气压增大,有气体进入①中,可以观察到①中的导管口有较多气泡产生,C符合题意;
D、铜的金属活动性顺序在H之后,不能和稀硫酸反应,且不溶于稀硫酸和水,故无法观察到有明显现象,D不符合题意;
故选C。
16.B
【详解】
A、硝酸银和氯化钡生成氯化银沉淀,硫酸钠和氯化钡生成硫酸钡沉淀,现象相同,不能鉴别,错误;
B、铵态氮肥和碱性物质反应生成有刺激性气味的气体氨气,尿素不含铵根离子,氯化铵含有铵根离子,取样,加入熟石灰粉末、研磨、闻气味,可以鉴别,正确;
C、蔗糖和食盐溶于水都得到无色溶液,不能鉴别,错误;
D、CuO 粉末和木炭粉都是黑色固体,不能鉴别,错误。
故选B。
17. 一开始,液体分层,上层为无色,下层为红色,过一段时间后,溶液变为均匀的红色 气态、液态、固态 乳化作用 MnCl2 解:设至少需要氢氧化钠的质量是x
x=0.16g
答:至少需要氢氧化钠的质量是0.16g。
【详解】
(1)倾斜A试管,沿内壁缓缓加入乙醇,不振荡,乙醇的密度比水小,故一开始,液体分层,上层为无色,下层为红色,乙醇能与水以任意比例互溶,由于分子在不断运动,一定时间后,乙醇溶于水,形成均一、稳定的混合物,故最后溶液变为均匀的红色,故现象为:一开始,液体分层,上层为无色,下层为红色,过一段时间后,溶液变为均匀的红色;
(2)酒精溶于水,溶质是酒精,酒精是液态,高锰酸钾溶于水,溶质是高锰酸钾,高锰酸钾是固态,氯化氢溶于水,溶质是氯化氢,氯化氢是气态,故溶质状态可以是:气态、液态、固态;
(3)用洗涤剂清洗B试管,是因为洗涤剂中含有乳化剂,具有乳化作用,能将油污乳化为细小油滴,随水冲走,故填:乳化作用;
(4)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含K、Mn、O、H、Cl的个数分别是2、2、8、16、16,生成物中含K、Mn、O、H、Cl的个数分别是2、0、8、16、12,故生成物中还应含2个Mn、4个Cl,故X的化学式为:MnCl2;
(5)见答案。
18. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 用燃着的木条放在集器瓶口,木条熄灭,证明集满。 过滤 漏斗 引流
【详解】
(1)实验室常用大理石主要成分是碳酸钙与稀盐酸反应制取二氧化碳,产物是氯化钙、水和二氧化碳,该反应的化学方程式CaCO3 + 2HCl = CaCl2 + H2O + CO2↑,二氧化碳具有不支持燃烧,也不能燃烧的性质,常用燃着的小木条检验二氧化碳气体是否收集满,用燃着的木条放在集器瓶口,木条熄灭,证明集满;
(2)操作X实验固液分离,是过滤,过滤需要用到玻璃仪器有烧杯、玻璃棒和漏斗,其中玻璃棒的作用是引流,防止液体洒出。
19. He C CaO NaCl 导电 吸附 略 CO B 氯化钠 葡萄糖 6:1:8 24 O 6.02 1023
【详解】
Ⅰ、①氦气的密度小且化学性质不活泼,不易的发生爆炸,故常用来充灌载人飞艇,化学式为:He;②金刚石用于切割玻璃,化学式为:C;③生石灰能与水反应生成氢氧化钙,可做干燥剂,化学式为:CaO;④食盐是常用的调味品,化学式为:NaCl;Ⅱ、①石墨能用于制作干电池电极,说明石墨具有导电性;②制糖工业中利用活性炭的吸附性脱色制白糖;③CO2通入汽水中可制作碳酸饮料,反应的化学方程式CO2+H2O=H2CO3;④炼铁时发生反应:3CO+Fe2O32Fe+3CO2,其中一氧化碳得到氧,发生了氧化反应,具有还原性;⑤在2Mg+CO22MgO+C中,碳元素由化合物转化为了单质,所以反应前后碳元素的存在形态由化合态到游离态;Ⅲ、该注射液中含有氯化钠和葡萄糖两种溶质;由葡萄糖的化学式可知,一个葡萄糖分子中含有6个碳原子、12个氢原子和6个氧原子,共24个原子;原子的物质的量之比为C:H:O=1:2:1;葡萄糖是由碳、氢、氧三种元素组成的,碳、氢、氧三种元素的质量比为:(12×6):(1×12):(16×6)=6:1:8,可见其中氧元素的质量分数最高;1mol 该葡萄糖中约含有6.02 1023个葡萄糖分子。
20. 生石灰 A 过滤 CaO+H2OCa(OH)2 = 解:设消耗的CaCO3的物质的量为xmol
CaCO3 CaO + CO2↑ (1分)
1 1
x 9
(1分)
x=9 (1分)
9mol×100g/mol= 900g (1分)
900/90%=1000g (1分)
答:消耗该石灰石的质量为1000g。
【详解】
①根据氧化钙的俗名是生石灰解答;
②根据悬浊液和乳浊液的定义进行分析回答;
③过滤是将不溶于液体的固体分离出来的一种方法;
④根据氧化钙与水反应,生成氢氧化钙解答;
⑤根据质量守恒定律化学反应前后元素的种类不变解答;
⑥根据二氧化碳的质量利用反应的化学方程式求出碳酸钙的质量.
解:①氧化钙的俗名是生石灰;
②固体小颗粒和液体形成的不均一、不稳定的混合物就叫悬浊液,液体与液体形成的不均一、不稳定的混合物就叫乳浊液,本题中是固体小颗粒和液体形成的故为悬浊液;
③过滤是把不溶于溶液的固体和液体分开的一种分离混合物的方法,“反应池”中的混合物分离出生成的碳酸钙固体,可用过滤的方法;
④氧化钙与水反应,生成氢氧化钙,发生化合反应的化学方程式为:CaO+H2O═Ca(OH)2;
⑤根据质量守恒定律化学反应前后元素的种类不变,理论上得到碳酸钙质量等于石灰石中碳酸钙的质量;
⑥设消耗的CaCO3的物质的量为xmol
CaCO3 CaO+CO2↑
1 1
x 9mol
x=9mol
9mol×100g/mol=900g
=1000g
答案:
①生石灰;
②A;
③过滤;
④CaO+H2O═Ca(OH)2;
⑤=;
⑥消耗该石灰石的质量为1000g.
21. B中溶液倒吸进入A中,且出现浑浊 NaCl、NaOH
【详解】
(1)推注射器活塞向充满CO2的集气瓶中注入过量20%的NaOH溶液,二氧化碳和氢氧化钠反应生成碳酸钠和水,导致左边集气瓶中的气压减小,打开止水夹后,氯化钙溶液流入左边集气瓶中,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,因此观察到的现象是:氯化钙溶液流入左边集气瓶中,并且溶液变浑浊;(2)反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有过量的氢氧化钠和反应生成的氯化钠,化学式为:NaOH、 NaCl。
22.(1)生石灰
(2)CO、Fe2O3
(3)
(4)AC
【分析】
(1)
氧化钙能与水反应生成氢氧化钙,可用作食品干燥剂,氧化钙俗称生石灰;
(2)
一氧化碳是由C、O元素组成的化合物,属于氧化物,氧化铁是由Fe、O元素组成的化合物,属于氧化物,一氧化碳能与氧化铁在高温下反应生成铁和二氧化碳,可以发生还原反应,化学式为:CO、Fe2O3;
(3)
密度最小的气体是氢气,天然气中最主要的成分是甲烷,二氧化碳和氢气在高温高压下反应生成水和甲烷,该反应的化学方程式为:;
(4)
甲、乙、丙、丁、戊是初中化学常见的物质,其中丁是大理石的主要成分,可推出丁为碳酸钙,乙的固体俗称干冰,可推出乙为二氧化碳,乙能转化为丙,丁能转化为丙,可推出丙为水,丁能转化为戊,丙能与戊反应,可推出戊为氧化钙,甲能转化为乙和丙,甲可能是氧气,也可能是甲烷、也可能是氧化铜等,代入验证,符合题意。
A、丙和戊反应为氧化钙和水反应生成氢氧化钙,放出大量的热,符合题意;
B、甲可能为甲烷、氧气氧化铜等,乙为二氧化碳,丙为水,故甲、乙、丙三种物质中不一定含有相同元素,不符合题意;
C、甲可能是甲烷,甲烷具有可燃性,符合题意;
D、丁→戊的反应为碳酸钙高温煅烧生成氧化钙和二氧化碳,该反应符合“一变多”的特点,属于分解反应,丁→乙的反应可以是碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应,故反应的基本类型不一定相同,不符合题意。
故选AC。
答案第1页,共2页
一、选择题(共16题)
1.下列有关溶液的说法正确的是( )
A.溶液一定是无色、透明的混合物 B.无色澄清液体一定是溶液
C.只有固体能作溶质 D.溶液的各部分性质均相同
2.下列物质能溶于水形成溶液的是( )
A.酒精 B.豆油 C.沙子 D.碘
3.下列几种溶液中,溶剂相同的是( )
①碘酒 ②糖水 ③70%的酒精 ④稀硫酸
A.①③
B.②④
C.①②③
D.②③④
4.某初三年级的同学正在筹备毕业晚会,预定有以下饮料,其中不属于溶液的是
A.啤酒 B.酸奶 C.矿泉水 D.可口可乐
5.下列清洗方法中,利用乳化原理的是
A.用自来水洗手 B.用汽油溶解油污
C.用洗涤剂清洗餐具 D.用盐酸清除试剂瓶壁上的碳酸钙
6.以下物质不属于溶液的是( )
A.食盐水 B.医用酒精 C.冰水混合物 D.碘酒
7.把少量下列物质分别放入水中,充分搅拌,可以得到溶液
A.汽油 B.面粉 C.蔗糖 D.牛奶
8.下列关于溶液说法不正确的是
A.溶质可以是气体、液体也可以是固体 B.最常见的溶剂是水
C.溶液的体积等于溶质与溶液的体积之和 D.溶液的质量等于溶质的质量与溶剂的质量之和
9.市场上有一种俗称“摇摇冰”的罐装饮料,在饮料罐的夹层中分别装入一种固体物质和水,饮用前摇动使它们混合,罐内饮料温度就会降低。这种固体物质可能是
A.蔗糖 B.氢氧化钠 C.硝酸铵 D.氯化钠
10.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是
A.花生油 B.面粉 C.汽油 D.酒精
11.欲使80g10%的食盐溶液变成20%,可采用的方法是( )
A.将溶剂蒸发掉36g B.将溶剂蒸发掉40g
C.加入80g10%的食盐溶液 D.加入8g食盐
12.下面利用化学知识对有关事实的解释,其中正确的是
A.活性炭净水 降低水中Ca2+、Mg2+含量
B.水可以灭火 降低可燃物的着火点
C.洗涤剂能洗去衣服油污 洗涤剂能乳化油污
D.氯化钠溶解于水后“消失”不见了 氯化钠分子是不断运动的
13.下列实验设计能达到实验目的的是
选项 A B C D
实验设计
实验目的 用硝酸钾和水验证质量守恒定律 探究蜡烛中是否含有碳元素 探究碘的溶解性是否与溶剂种类有关 探究二氧化碳能否与水反应
A.A B.B C.C D.D
14.某同学配制氯化钠溶液的溶质质量分数偏小,可能的原因是( )
A.天平平衡后,砝码放左盘,氯化钠放右盘,游码在零处
B.溶解时烧杯内壁有水珠
C.装瓶时有少量溶液洒出
D.用生锈砝码称量
15.如图(其气密性良好),打开止水夹,将液体A滴入试管②中与固体B接触。若试管①中的导管口有较多气泡产生,则液体A和固体B的组合可能是
A.氯化钠和水 B.硝酸铵和水 C.氢氧化钠和水 D.铜和稀硫酸
16.物质的鉴别是重要的实验技能,下列实验方案正确的是
选项 实验目的 实验方案
A 鉴别AgNO3 和Na2SO4 固体 取样,加水溶解,滴加 BaCl2 溶液,观察是否有白色沉淀
B 鉴别NH4Cl 和尿素 取样,加入熟石灰粉末、研磨、闻气味
C 鉴别蔗糖和食盐 分别取样加水溶解,观察溶液颜色
D 鉴别CuO 粉末和木炭粉 观察颜色
A.A B.B C.C D.D
二、综合题(共6题)
17.水是常用溶剂,某同学进行如图实验。
(1)倾斜A试管,沿内壁缓缓加入乙醇,不振荡,现象是______。
(2)实验可知,溶质状态可以是______。
(3)实验结束后,用洗涤剂洗净B试管,原理是______。
(4)C、D试管的废液倒入废液缸中产生了黄绿色气体,查阅资料可知: ,X的化学式为______。
(5)询问老师得知用可处理Cl2,根据化学方程式计算,处理0.142gCl2至少需NaOH的质量是多少______?
18.下图是实验室制取某些常见气体所使用的一些装置和仪器。
(1)实验室制取二氧化碳反应的化学方程式为______________,证明二氧化碳集满的方法是_____________________。
(2)某实验小组用氯酸钾和二氧化锰制取氧气,完全反应后从残余物中提纯KCl,进行以下操作:
(提示:MnO2不溶于水,含钾化合物均可溶于水)
操作X的名称是________,在实验室中进行该操作时用到的玻璃仪器有玻璃棒、烧杯、________,在该操作中玻璃棒的作用是________。
19.化学使世界更美好。请用所学化学知识回答下列问题。
Ⅰ.现有氢气、氦气、二氧化碳、食盐、金刚石、生石灰等物质,请按要求用化学式填写:
①飞艇中充入的气体是________; ②切割玻璃的是________;
③用作干燥剂的是_________; ④用作调味品的是_______。
Ⅱ.回答下列与含碳物质有关的问题
①石墨能用于制作干电池电极,说明石墨能__________;
②制糖工业中利用活性炭的__________性脱色制白糖;
③CO2通入汽水中可制作碳酸饮料,反应的化学方程式______________;
④炼铁时发生反应:,其中____做还原剂;
⑤在2Mg+CO22MgO+C中,反应前后碳元素的存在形态由_____(填编号)。
A.游离态到化合态 B. 化合态到游离态
Ⅲ. 某病人注射用的生理盐水(含0.85~0.90%的氯化钠)中添加了适量的葡萄糖(C6H12O6)以补充能量。该注射液中的溶质为_____;葡萄糖分子中碳,氢,氧元素的质量之比是______;1个葡萄糖分子中共含___________个原子;葡萄糖中质量分数最高是____元素;1mol 该葡萄糖中约含有___________个葡萄糖分子;
20.牙膏中常用的摩擦剂有碳酸钙粉末。用含碳酸钙90%的石灰石作为原料,制得碳酸钙粉末(杂质不参与反应),生产流程如下:
① 氧化钙的俗名是 _______ 。
② 石灰乳属于 __________ 。
A.悬浊液 B.乳浊液 C.溶液
③ 步骤II包含的操作名称是 ______________ 。
④ 请写出上述流程中发生化合反应的化学方程式 ___________________ 。
⑤ 理论上得到碳酸钙质量 ______ (选填“>”“<”或“=”)石灰石中碳酸钙的质量。
⑥ 上述过程中如产生9mol二氧化碳,则消耗该石灰石的质量为多少g? __________ (根据化学方程式列式计算)
21.用下图所示装置验证CO2能与NaOH溶液发生化学反应。推注射器活塞向充满CO2的集气瓶中注入过量的20% NaOH溶液,振荡集气瓶后打开止水夹(已知:Na2CO3 + CaCl2 = 2NaCl + CaCO3↓)。
(1)打开止水夹后观察到的现象是_____。
(2)反应后将集气瓶中的混合物过滤,所得滤液中除CaCl2外,还存在的溶质有_____。
22.有限的元素可组成种类繁多的物质。依据表中的元素回答下列问题。
元素名称 氢 碳 氧 氯 钙 铁
元素符号 H C O Cl Ca Fe
(1)若某种物质常用作食品干燥剂,该物质的俗称是______。
(2)在我们目前所学知识范围内,若两种氧化物发生还原反应,则这两种氧化物的化学式是________。
(3)二氧化碳是一种宝贵资源,在高温高压下,它和一种密度最小的气体反应会生成水,同时还得到一种气体(该气体为天然气中最主要的成分),试写出该反应的方程式________。
(4)甲、乙、丙、丁、戊是初中化学常见的物质,其中丁是大理石的主要成分,乙的固体俗称干冰,它们之间部分转化关系如图所示。(“→”表示某种物质经一步反应可转化成另一种物质,“一”表示两种物质能发生化学反应)关于上述的反应,有如下说法,其中正确的是 。
A.丙和戊的反应放热 B.甲乙丙三物质一定含有相同元素
C.甲可能具有可燃性 D.丁→乙和丁→戊的反应基本类型一定相同
试卷第1页,共3页
参考答案:
1.D
【详解】
A、溶液不一定是无色的,如硫酸铜溶液是蓝色的,错误;B、无色澄清液体不一定是溶液,如水是无色澄清液体,不是溶液;错误;C、溶质可以是固体,也可以是液体和气体,如水可以溶解蔗糖和食盐,也可以溶解酒精、二氧化碳等,错误;D、溶液是均一、稳定的混合物;溶液的本质特征是均一性、稳定性,各部分性质均相同;正确。故选D。
2.A
【详解】
A、酒精能与水以任意比例混溶,能形成均一、稳定的溶液,符合题意;
B、豆油不溶于水,只能以小液滴的形成悬浮于液体里,形成乳浊液,不符合题意;
C、沙子不溶于水,只能以固体小颗粒的形式悬浮于液体里,形成悬浊液,不符合题意;
D、碘不溶于水,只能以固体小颗粒的形式悬浮于液体里,形成悬浊液,不符合题意。
故选A。
3.D
【详解】
①碘酒中碘是溶质,酒精是溶剂;②糖水中糖是溶质,水是溶剂;③70%的酒精中溶质是酒精,溶剂是水;④稀硫酸中溶质是硫酸,溶剂是水。
4.B
【详解】
A、啤酒是在水中溶解了酒精等多种物质,长期放置不会分层,符合溶液的特点,选项A不符合题意。
B、酸奶属于混合物,但长期放置会分层。即它不具有均一、稳定的特点。不属于溶液,选项B符合题意。
C、矿泉水是由一些可溶解的矿物质溶解于水形成的,符合溶液的特点,选项C不符合题意。
D、可口可乐是由一些可溶解于水的色素、糖类等物质溶解于水形成的混合物,符合溶液的特点,选项D不符合题意。
故选:B。
5.C
【详解】
试题分析:用洗涤剂清洗餐具,能有效的去除污渍,是利用洗涤剂的乳化功能,用汽油溶解油污是利用二者互相溶解形成溶液,然后便于清洗,用盐酸清除试剂瓶壁上的碳酸钙是利用二者的反应,去掉了碳酸钙。故选C.
6.C
【详解】
A、食盐水是均一、稳定的混合物,属于溶液,故不符合题意;
B、医用酒精是均一、稳定的混合物,属于溶液,故不符合题意;
C、冰水混合物是由水一种物质组成,属于纯净物,不是溶液,故符合题意;
D、碘酒是均一、稳定的混合物,属于溶液,故不符合题意。
故选C。
7.C
【详解】
A. 汽油以油滴的形式分散在水中,形成的是乳浊液,不符合题意;
B. 面粉以固体颗粒分散在水中,形成的是悬浊液,不符合题意;
C. 蔗糖以分子形式分散在水分子,形成的是均一、稳定的溶液,符合题意;
D. 牛奶不是均一稳定的混合物,不是溶液,不符合题意。故选C。
8.C
【详解】
A、溶质可以是气体、液体也可以是固体,正确;B、最常见的溶剂是水,正确;C、由于微粒间存在间隔,体积之间不能相加减,错误;D、溶液的质量等于溶质的质量与溶剂的质量之和,正确。故选C。
9.C
【详解】
A、蔗糖溶于水后温度几乎不变,选项错误;B、氢氧化钠溶于水时放出大量的热量,温度升高,选项错误;C、硝酸铵溶于水时吸收大量热量,可以使罐内饮料温度明显降低,选项正确;D、氯化钠溶于水时无明显的吸热放热现象,选项错误。故本题选C。
10.D
【详解】
A、花生油不溶于水,放入水中,充分搅拌,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项错误。
B、面粉不溶于水,放入水中,充分搅拌,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项错误。
C、汽油不溶于水,放入水中,充分搅拌,不能和水形成均一、稳定的混合物,即不能够形成溶液,故选项错误。
D、酒精易溶于水,放入水中,充分搅拌,形成均一、稳定的混合物,能够形成溶液,故选项正确。
故选:D。
11.B
【详解】
A、溶质质量是80g×10%=8g,溶剂蒸发掉36g后溶液质量是80g-36g=44g,所以溶质质量分数是:×100%=18.2%,不符合题意;B、溶质质量是80g×10%=8g,溶剂蒸发掉40g后溶液质量是80g-40g=40g,所以溶质质量分数是:×100%=20%,符合题意;C、质量分数相同的溶液混合后,质量分数不变,不符合题意;D、溶质质量是80g×10%+8g=16g,加入8g食盐后溶液质量是80g+8g=88g,所以溶质质量分数是:×100%=18.2%,不符合题意。故选B。
12.C
【详解】
A、活性炭具有疏松多孔的结构,能把杂质和色素等吸附在表面,活性炭起吸附作用,活性炭不能吸附水中Ca2+、Mg2+含量,故无法降低水中Ca2+、Mg2+含量,此选项错误;
B、水能灭火,利用的是水汽化吸热,使温度降到着火点以下,而不是降低可燃物的着火点,此选项错误;
C、洗涤剂清洗油污,利用其乳化作用,洗涤剂能将油污在水中分散成细小的液滴,不聚成较大的油珠,从而随水流走,此选项正确;
D、氯化钠溶解于水后“消失”不见了,是因为钠离子和氯离子是在不断的运动的,运动到水分子中间去了,此选项错误。
故选C。
13.C
【详解】
A、硝酸钾不与水反应,不能用来验证质量守恒定律,故A错误;
B、在燃着的蜡烛上方罩一个干冷烧杯,有水雾出现,说明蜡烛燃烧生成了水,说明蜡烛中含有氢元素,故B错误;
C、图中溶剂种类不同,其它因素相同,可以探究碘的溶解性是否与溶剂种类有关,故C正确;
D、将二氧化碳通入紫色石蕊试液中,溶液变红,不能说明二氧化碳与水发生了反应,还应设计对照实验证明二氧化碳不能使紫色石蕊试液变红,故D错误。
故选C。
14.B
【详解】
A、天平平衡后,砝码放左盘,氯化钠放右盘,游码在零处,不影响实际所取的溶质的质量,溶质质量分数不变,故选项A错误。
B、溶解时烧杯内壁有水珠,会造成实际所取的水的体积偏大,则使溶质质量分数偏小,故选项B正确。
C、装瓶时有少量溶液洒出,有液体溅出,溶液具有均一性,溶质质量分数不变,故选项C错误。
D、用生锈砝码称量,会造成实际所取的溶质的质量偏大,则使溶质质量分数偏大,故选项D错误。
故选B。
15.C
【详解】
A、氯化钠和水不反应,且氯化钠溶于水没有明显吸热或放热的现象,故无法观察到有明显现象,A不符合题意;
B、硝酸铵和水不反应,且硝酸铵溶于水会吸热,导致装置内气压减小,会导致②中气压减小,①中试管内的水会进入导管中,观察到导管中液面升高,B不符合题意;
C、氢氧化钠和水不反应,但氢氧化钠溶于水会放热,导致装置内气压增大,会导致②中气压增大,有气体进入①中,可以观察到①中的导管口有较多气泡产生,C符合题意;
D、铜的金属活动性顺序在H之后,不能和稀硫酸反应,且不溶于稀硫酸和水,故无法观察到有明显现象,D不符合题意;
故选C。
16.B
【详解】
A、硝酸银和氯化钡生成氯化银沉淀,硫酸钠和氯化钡生成硫酸钡沉淀,现象相同,不能鉴别,错误;
B、铵态氮肥和碱性物质反应生成有刺激性气味的气体氨气,尿素不含铵根离子,氯化铵含有铵根离子,取样,加入熟石灰粉末、研磨、闻气味,可以鉴别,正确;
C、蔗糖和食盐溶于水都得到无色溶液,不能鉴别,错误;
D、CuO 粉末和木炭粉都是黑色固体,不能鉴别,错误。
故选B。
17. 一开始,液体分层,上层为无色,下层为红色,过一段时间后,溶液变为均匀的红色 气态、液态、固态 乳化作用 MnCl2 解:设至少需要氢氧化钠的质量是x
x=0.16g
答:至少需要氢氧化钠的质量是0.16g。
【详解】
(1)倾斜A试管,沿内壁缓缓加入乙醇,不振荡,乙醇的密度比水小,故一开始,液体分层,上层为无色,下层为红色,乙醇能与水以任意比例互溶,由于分子在不断运动,一定时间后,乙醇溶于水,形成均一、稳定的混合物,故最后溶液变为均匀的红色,故现象为:一开始,液体分层,上层为无色,下层为红色,过一段时间后,溶液变为均匀的红色;
(2)酒精溶于水,溶质是酒精,酒精是液态,高锰酸钾溶于水,溶质是高锰酸钾,高锰酸钾是固态,氯化氢溶于水,溶质是氯化氢,氯化氢是气态,故溶质状态可以是:气态、液态、固态;
(3)用洗涤剂清洗B试管,是因为洗涤剂中含有乳化剂,具有乳化作用,能将油污乳化为细小油滴,随水冲走,故填:乳化作用;
(4)根据质量守恒定律,化学反应前后,原子的种类和数目不变,反应物中含K、Mn、O、H、Cl的个数分别是2、2、8、16、16,生成物中含K、Mn、O、H、Cl的个数分别是2、0、8、16、12,故生成物中还应含2个Mn、4个Cl,故X的化学式为:MnCl2;
(5)见答案。
18. CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ 用燃着的木条放在集器瓶口,木条熄灭,证明集满。 过滤 漏斗 引流
【详解】
(1)实验室常用大理石主要成分是碳酸钙与稀盐酸反应制取二氧化碳,产物是氯化钙、水和二氧化碳,该反应的化学方程式CaCO3 + 2HCl = CaCl2 + H2O + CO2↑,二氧化碳具有不支持燃烧,也不能燃烧的性质,常用燃着的小木条检验二氧化碳气体是否收集满,用燃着的木条放在集器瓶口,木条熄灭,证明集满;
(2)操作X实验固液分离,是过滤,过滤需要用到玻璃仪器有烧杯、玻璃棒和漏斗,其中玻璃棒的作用是引流,防止液体洒出。
19. He C CaO NaCl 导电 吸附 略 CO B 氯化钠 葡萄糖 6:1:8 24 O 6.02 1023
【详解】
Ⅰ、①氦气的密度小且化学性质不活泼,不易的发生爆炸,故常用来充灌载人飞艇,化学式为:He;②金刚石用于切割玻璃,化学式为:C;③生石灰能与水反应生成氢氧化钙,可做干燥剂,化学式为:CaO;④食盐是常用的调味品,化学式为:NaCl;Ⅱ、①石墨能用于制作干电池电极,说明石墨具有导电性;②制糖工业中利用活性炭的吸附性脱色制白糖;③CO2通入汽水中可制作碳酸饮料,反应的化学方程式CO2+H2O=H2CO3;④炼铁时发生反应:3CO+Fe2O32Fe+3CO2,其中一氧化碳得到氧,发生了氧化反应,具有还原性;⑤在2Mg+CO22MgO+C中,碳元素由化合物转化为了单质,所以反应前后碳元素的存在形态由化合态到游离态;Ⅲ、该注射液中含有氯化钠和葡萄糖两种溶质;由葡萄糖的化学式可知,一个葡萄糖分子中含有6个碳原子、12个氢原子和6个氧原子,共24个原子;原子的物质的量之比为C:H:O=1:2:1;葡萄糖是由碳、氢、氧三种元素组成的,碳、氢、氧三种元素的质量比为:(12×6):(1×12):(16×6)=6:1:8,可见其中氧元素的质量分数最高;1mol 该葡萄糖中约含有6.02 1023个葡萄糖分子。
20. 生石灰 A 过滤 CaO+H2OCa(OH)2 = 解:设消耗的CaCO3的物质的量为xmol
CaCO3 CaO + CO2↑ (1分)
1 1
x 9
(1分)
x=9 (1分)
9mol×100g/mol= 900g (1分)
900/90%=1000g (1分)
答:消耗该石灰石的质量为1000g。
【详解】
①根据氧化钙的俗名是生石灰解答;
②根据悬浊液和乳浊液的定义进行分析回答;
③过滤是将不溶于液体的固体分离出来的一种方法;
④根据氧化钙与水反应,生成氢氧化钙解答;
⑤根据质量守恒定律化学反应前后元素的种类不变解答;
⑥根据二氧化碳的质量利用反应的化学方程式求出碳酸钙的质量.
解:①氧化钙的俗名是生石灰;
②固体小颗粒和液体形成的不均一、不稳定的混合物就叫悬浊液,液体与液体形成的不均一、不稳定的混合物就叫乳浊液,本题中是固体小颗粒和液体形成的故为悬浊液;
③过滤是把不溶于溶液的固体和液体分开的一种分离混合物的方法,“反应池”中的混合物分离出生成的碳酸钙固体,可用过滤的方法;
④氧化钙与水反应,生成氢氧化钙,发生化合反应的化学方程式为:CaO+H2O═Ca(OH)2;
⑤根据质量守恒定律化学反应前后元素的种类不变,理论上得到碳酸钙质量等于石灰石中碳酸钙的质量;
⑥设消耗的CaCO3的物质的量为xmol
CaCO3 CaO+CO2↑
1 1
x 9mol
x=9mol
9mol×100g/mol=900g
=1000g
答案:
①生石灰;
②A;
③过滤;
④CaO+H2O═Ca(OH)2;
⑤=;
⑥消耗该石灰石的质量为1000g.
21. B中溶液倒吸进入A中,且出现浑浊 NaCl、NaOH
【详解】
(1)推注射器活塞向充满CO2的集气瓶中注入过量20%的NaOH溶液,二氧化碳和氢氧化钠反应生成碳酸钠和水,导致左边集气瓶中的气压减小,打开止水夹后,氯化钙溶液流入左边集气瓶中,氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,因此观察到的现象是:氯化钙溶液流入左边集气瓶中,并且溶液变浑浊;(2)反应后将集气瓶中混合物过滤,所得溶液中除CaCl2外,还存在的溶质有过量的氢氧化钠和反应生成的氯化钠,化学式为:NaOH、 NaCl。
22.(1)生石灰
(2)CO、Fe2O3
(3)
(4)AC
【分析】
(1)
氧化钙能与水反应生成氢氧化钙,可用作食品干燥剂,氧化钙俗称生石灰;
(2)
一氧化碳是由C、O元素组成的化合物,属于氧化物,氧化铁是由Fe、O元素组成的化合物,属于氧化物,一氧化碳能与氧化铁在高温下反应生成铁和二氧化碳,可以发生还原反应,化学式为:CO、Fe2O3;
(3)
密度最小的气体是氢气,天然气中最主要的成分是甲烷,二氧化碳和氢气在高温高压下反应生成水和甲烷,该反应的化学方程式为:;
(4)
甲、乙、丙、丁、戊是初中化学常见的物质,其中丁是大理石的主要成分,可推出丁为碳酸钙,乙的固体俗称干冰,可推出乙为二氧化碳,乙能转化为丙,丁能转化为丙,可推出丙为水,丁能转化为戊,丙能与戊反应,可推出戊为氧化钙,甲能转化为乙和丙,甲可能是氧气,也可能是甲烷、也可能是氧化铜等,代入验证,符合题意。
A、丙和戊反应为氧化钙和水反应生成氢氧化钙,放出大量的热,符合题意;
B、甲可能为甲烷、氧气氧化铜等,乙为二氧化碳,丙为水,故甲、乙、丙三种物质中不一定含有相同元素,不符合题意;
C、甲可能是甲烷,甲烷具有可燃性,符合题意;
D、丁→戊的反应为碳酸钙高温煅烧生成氧化钙和二氧化碳,该反应符合“一变多”的特点,属于分解反应,丁→乙的反应可以是碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,该反应符合“两种化合物互相交换成分生成另外两种化合物”的反应,属于复分解反应,故反应的基本类型不一定相同,不符合题意。
故选AC。
答案第1页,共2页
